转录空间克隆网站
空间克隆网站 时间:2021-04-20 阅读:()
Hereditas(Beijing)2017年12月,39(12):1122―1137www.
chinagene.
cn特邀综述收稿日期:20171027;修回日期:20171116基金项目:国家自然科学基金项目(编号:31571208),安徽省自然科学基金项目(编号:1608085MH212)和安徽大学大学生科研训练计划项目(编号:J10118520418)资助[SupportedbytheNationalNaturalScienceFoundationofChina(No.
31571208),theNaturalScienceFoundationofAnhuiProvince(No.
1608085MH212),andAnhuiUniversityUndergraduateStudentTrainingGrant(No.
J10118520418)]作者简介:岳敏,本科,专业方向:生物科学.
E-mail:yuemin_ahu@163.
com通讯作者:秦曦明,博士,教授,博士生导师,研究方向:生物钟分子组分的功能及其相互作用参与生物钟调控的分子机制.
E-mail:qin.
ximing@ahu.
edu.
cnDOI:10.
16288/j.
yczz.
17-350网络出版时间:2017/11/1619:01:54URI:http://kns.
cnki.
net/kcms/detail/11.
1913.
R.
20171116.
1901.
003.
html秦曦明教授,2010年从美国Vanderbilt大学获得博士学位,现任职于安徽大学健康科学研究院.
课题组主要研究方向是生物钟(近日节律)的分子与结构基础、生物钟组分的功能和生物钟调节健康的靶点分子的研究.
曾经利用蓝绿细菌作为模式生物,阐述核心振荡器和次级振荡器之间的联系与相互作用,并提出真核生物可能存在不依赖转录翻译环路的核心分子振荡器的假设.
通过研究生物钟蛋白分子的相互作用,解析生物钟如何维持稳定的相关机制.
相关的研究成果发表在Nature、ProcNatlAcadSciUSA、PLoSBiology、CurrentBiology、JBiolRhythms等学术期刊上.
目前主持国家自然科学基金面上项目与安徽省自然科学基金项目.
哺乳动物生物钟的遗传和表观遗传研究进展岳敏1,2,杨禹1,郭改丽1,秦曦明11.
安徽大学健康科学研究院,合肥230601;2.
安徽大学生命科学学院,合肥230601摘要:生物钟对生物机体的生存与环境适应具有着重要意义,其相关研究近年来受到人们的广泛关注.
生物钟的重要性质之一是内源节律的周期性,当前的研究认为这种周期性是由生物钟相关基因转录翻译的多反馈环路构成核心机制调控着近似24h的节律振荡.
哺乳动物的生物钟系统存在一个多层次的结构,包括位于视交叉上核的主时钟和外周器官和组织的子时钟.
虽然主时钟和子时钟存在的组织不同,但是参与调节生物钟的分子机制是一致的.
近年来,通过正向、反向遗传学方法和表观遗传学的研究方法,对生物钟的分子机制的解析和认知愈发深入.
本文在简单回顾生物钟基因发现历史的基础上,重点从遗传学和表观遗传学两个方面,从振荡周期的角度,对哺乳动物生物钟分子机制的研究进展进行了综述性介绍,以期为靶向调节生物钟来改善机体的稳态系统的研究提供参考,同时希望能促进时间生物学领域与更多其他领域形成交叉研究.
关键词:生物钟;近日节律;生物钟基因;转录翻译反馈环路;顺式作用元件;转录因子;表观遗传学第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1123GeneticandepigeneticregulationsofmammaliancircadianrhythmsMinYue1,2,YuYang1,GailiGuo1,XimingQin11.
InstituteofHealthSciences,AnhuiUniversity,Hefei230601,China;2.
SchoolofLifeSciences,AnhuiUniversity,Hefei230601,ChinaAbstract:Thecircadianclocksarevitaltomanyorganismsfortheirsurvivalandadaptiontothesurroundingenviron-ment.
Moreandmorepeopleareinterestedinthecircadianclockandrelatedresearches.
Oneofthekeycharacteristicsofthisendogenousclockisitsperiodicity.
Mechanismsunderlyingthemammaliancircadianrhythmswith~24hperiodicityinvolveinterlockedtranscriptionalandtranslationalfeedbackloops.
Thecircadianclocksysteminmammalsconsistsofhierarchicalstructures,withthesuprachiasmaticnucleus(SCN)asthecentralpacemakerandperipheraloscillatorsinotherorgans.
Inspiteofthecentralandperipheraloscillators,themolecularmechanismsarethesamewithintheSCNandperi-pheralorgans.
Inthepastdecades,majorachievementsareaccomplishedbyusingforwardandreversegenetics,aswellasepigeneticapproaches.
Inthisreview,werecapitulatethehistoryofhowclock-relatedgeneswereidentified,andsummarizethemainachievementsingeneticsandepigeneticstounderstandthemolecularunderpinnings.
Wehopeitcanofferbasicknowledgeforfurtherresearches,areferenceforexperimentaldesignsaimingtoadjustorganisms'homeostasisbymod-ulatingtheclock,andprovideafoundationtobuildinterdisciplinaryresearchnetworks.
Keywords:Circadianclock;circadianrhythm;clockgenes;transcriptionalandtranslationalfeedbackloop;cis-regulatingelements;transcriptionfactors;epigenetics地球生物在漫长的演化历史中,为了适应环境的周期性变化,其生理活动形成了各种不同时间尺度的生物节律,例如近年节律、季节节律、近月节律、近日节律和超日节律.
其中,产生近日节律(circadianrhythms,指其周期接近地球自转一圈所需的时间24h)的运行机制就是人们通常所说的生物钟.
生物钟是生物机体内源自主产生的一种调控系统,周期约为24h,由能够进行自我维持的振荡器组成[1].
不同物种的生物钟周期存在一定的差异,介于20~28h之间.
健康人群的内源生物钟平均周期通常会比24h多出11±16min,但在外界环境的同步化过程中每天会被调整为24h[2].
因此,生物钟的基本性质除了内源性和周期性之外,保持和外界同步也是生物钟的另一个重要特性.
生物钟的同步化(synchronization)是指外界环境对机体生物钟节律重置的过程,类似于人们对钟表的校时.
同步化不仅是指机体生物钟的周期与地球的自转周期保持一致,更重要的是,机体生物钟的时相(phase)与外界时间信号的时相间存在一个稳定的相位关系[3,4].
一个与外界时间信号保持同步的生物钟能够促进生物机体形成生存优势,提高机体适应环境的能力,这已经在蓝绿细菌和小鼠中被证实[5,6].
生物钟是被人们熟知的生物节律之一.
在过去的几十年中,从生物钟相关基因的发现、克隆,到提出精确的分子机制阐述节律振荡的发生,再到从组织水平发现外周组织拥有独立的自主振荡现象,人们在生物钟研究领域取得一系列的突破性成果[7~9].
从细菌到昆虫再到高等动物,近似于24h的周期行为被广泛发现,并通过正向遗传学操作鉴定出各个物种的生物钟基因.
在机体水平上,哺乳动物的生物钟系统是一个多层次结构,由主时钟和位于外周组织的子时钟构成,其中的主时钟位于下丘脑中的视交叉上核(suprachiasmaticnucleus,SCN).
外界环境中对哺乳动物影响最大的是光照信息,首先它通过视网膜被传递到SCN这个主时钟,经过处理和整合后,再通过激素和自主神经系统将环境信息传递到外周组织的子时钟[10].
在哺乳动物中,生物钟节律振荡被发现几乎存在于全身所有细胞和组织中,并参与优化调节组织或器官的生理活动[9,11].
哺乳动物的不同组织和器官虽然存在很大的功能差异性,但是参与调节生理活动的生物钟的分子机制却是一致的.
当前时间生物学领域普遍认同的分子机制是生物钟基因转录与翻译水平的多反馈环来产生并维持节律振荡的理论[8,12].
本文将对哺乳动1124Hereditas(Beijing)2017第39卷物生物钟产生的分子基础,从遗传学和表观遗传学两个方面展开综述性的介绍,主要内容包括重要生物钟基因的发现、转录翻译反馈环路的调控模型的确立、生物钟通路中主要的顺式作用元件、生物钟振荡节律循环中的分子相互作用及此过程中的主要表观遗传修饰等相关研究进展.
1遗传学研究发现的主要生物钟基因研究生物钟及其参与环境适应性的学科被称为时间生物学.
早在1960年,美国冷泉港定量生物学研讨会"生物钟专场",学科奠基人ColinPittendrigh和JürgenAschoff在大会做重要报告并出版论文,标志该学科的创立[13,14].
此后,人们对生物钟展开了更为大量的科学研究,研究的对象从植物、果蝇(Drosophilamelanogaster),逐渐扩展到高等动物及人类.
随着现代遗传学的建立,一批生物钟基因得到鉴定,促进了人们对生物钟振荡的理解.
早期的分子研究是在果蝇中展开,发现了许多重要的生物钟基因,这为哺乳动物的研究打下了坚实的基础.
20世纪70年代,SeymourBenzer和他的博士后RonaldKonopka通过化学诱变筛选的正向遗传学方法,得到第一个生物钟基因突变的动物——昼夜活动节律变长(29h)、变短(19h)或者节律消失的果蝇;这些突变体被命名为周期基因突变体[15].
20世纪80年代,MichaelRosbash、JeffreyHall和MichaelYoung(三人共享2017年诺贝尔生理学或医学奖)克隆得到果蝇的"周期基因"—Period,并且发现Period的转录产物呈现近似24h的节律变化[16,17].
随后的研究过程中,果蝇的另一个生物钟基因Timeless被克隆出来,并且发现其蛋白产物(TIM)和周期蛋白(PER)相互作用生成二聚体,而且会抑制Period基因的转录过程[18~20].
之后,Rosbash和Hall继续通过化学诱变筛选及相关的生物化学方法,发现了Clock基因的果蝇突变体,突变体的Period和Timeless的转录水平显著下降[21];同时也发现了Cycle基因的突变体,表现出与Clock突变体相似的表型,并且CYC蛋白(Cycle基因编码)与CLK蛋白(Clock基因编码)形成异二聚体[22].
与此同时,Young也利用了化学突变鉴定出新的生物钟表型突变的果蝇,命名为Double-time突变体;Double-time是哺乳动物酪蛋白激酶家族的同源基因,并且DOUBLETIME蛋白控制PER蛋白的稳定性[23].
综上所述,三位诺贝尔奖获得者的工作在果蝇中初步确立了由转录翻译反馈环路构成的生物钟调控的分子作用模型.
90年代中,JosephTakahashi的课题组在小鼠(Musmusculus)中应用化学诱变筛选,同样通过正向遗传学方法,发现了第一个哺乳动物的生物钟基因—'钟基因'(Clock),突变的小鼠的昼夜活动节律变长[24].
之后,其他参与调控小鼠生物钟的基因相继被发现:通过蛋白相互作用的方法筛选到Bmal1基因,其产物(BMAL1)与钟基因的蛋白产物(CLOCK)相互作用生成异二聚体[25,26];果蝇周期基因在哺乳动物中的同源基因Per1、Per2和Per3[27~31];与周期蛋白相互作用的隐花色素的基因Cry1(cryptochrome的简写)和Cry2[32,33];负责磷酸化周期蛋白(PER),及隐花色素蛋白(CRY)的酪蛋白激酶的基因Csnk1e[34];介导PER和CRY蛋白磷酸化后进入蛋白酶体降解途径的Btrc(编码E3连接酶BTRCP)和Fbxl3/Fbxl21(编码E3连接酶FBXL3/FBXL21)[35~37].
以上基因及其转录翻译产物构成生物钟的核心分子环路,同时参与调控生物钟辅助振荡环路的更多基因也被发现,例如维甲酸受体相关孤儿受体基因Ror-α、Ror-β和Rev-erb.
其中,Ror-α和Ror-β的蛋白产物(分别是ROR-A和ROR-B)参与Bmal1转录的正调节[38],而Rev-erb的蛋白产物(REV-ERB)抑制Bmal1的转录[39].
此外,表达DBP蛋白的基因不仅是一个受生物钟控制表达的基因,其蛋白产物也参与对核心生物钟基因Bmal1和Cry的转录调控,更在生物钟下游参与多种代谢酶的昼夜节律调控[40,41].
人类的基因组存在着与小鼠完全同源的生物钟基因.
2生物钟振荡的转录翻译反馈分子模型在果蝇中发现Period基因及其转录翻译产物存在24h的振荡规律后,Rosbash和他的同事们提出了一个反馈抑制环路的分子模型,用以解释生物钟振荡的产生[42].
此时的反馈抑制环路模型相对简单,仅仅包括Period的转录翻译产物对其自身的反馈抑制(图1A).
随着更多的时钟基因被发现,尤其是在哺乳动物中发现了多个果蝇时钟基因的同源基因,这一分子模型逐渐发展成为较为复杂的多重反馈环第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1125图1哺乳动物生物钟的分子模型Fig.
1ThemolecularmodelofthecircadianclockinmammalsA:原始的转录翻译反馈抑制环路,由Rosbash提出[42].
该简单模型仅仅由当时发现的Period基因及其转录翻译产物PER蛋白组成,其他的细节在当时都不清楚.
B:当前生物钟的分子模型是一个包括转录调控和转录后调控的转录翻译多反馈环路.
这个多反馈环路中的核心部分,BMAL1和CLOCK蛋白形成异二聚体,结合在启动子上游含有E-box的DNA区域,激活下游基因的转录,其中包括Per、Cry、Rev-erb、Dbp和其他的钟控基因(Ccg).
Per和Cry基因的蛋白产物PER和CRY会形成复合物,回到细胞核抑制BMAL1/CLOCK复合物的激活功能.
PER和CRY蛋白的降解受到酪蛋白激酶和E3连接酶(B-TRCP,FBXL21和FBXL3)的调控.
这个多反馈环路中的稳定环路中,Bmal1基因受到孤核受体REV-ERB的负调节和ROR的正调节.
其中,编码ROR的基因Ror的表达被DBP激活.
路构成的生物钟分子模型[43].
在机体水平上,哺乳动物的生物钟系统由几乎全身所有细胞的细胞时钟构成.
一系列的切除和移植手术的实验揭示在下丘脑中存在一个首要调节时钟(主时钟),它存在的核团正好位于视神经交叉的上部,因此被命名为视交叉上核[44,45].
不同的研究小组将金黄仓鼠(Mesocricetusauratus)的SCN去除,观察到动物活动的昼夜节律变得杂乱无章,然后将其他仓鼠的SCN移植到切除SCN的仓鼠脑中,节律又得到恢复,并且受体动物表现出的节律周期和SCN供体动物一致[46,47].
SCN对于节律性的荷尔蒙分泌和活动至关重要,是多层次结构的生物钟系统的核心指导者.
虽然生物钟基1126Hereditas(Beijing)2017第39卷因的表达存在部分的组织特异性,全身所有组织(生殖系统除外)的细胞时钟的基础分子模型是一致的.
生物钟基因组织特异性表达的范例之一便是Clock和Npas2(是Clock的同源基因),其中Clock基因的存在对于外周器官的生物钟振荡是必需的[48,49].
当前的研究表明,哺乳动物包括人类的生物钟的分子模型是一个包括转录调控和转录后调控的转录翻译多反馈环路(图1B),较之前已经更加丰富和完善.
前面提到的生物钟分子组分,Clock、Bmal1、Per1、Per2、Cry1、Cry2、Csnk1e、Ror-α、Ror-β、Rev-erbα、Fbxl3和Fbxl21等基因和它们的蛋白产物相互作用,组成多反馈环,传导信号到基因组,然后进行转录和翻译后调控,产生一个完整的近日节律周期[8].
这个分子模型的核心是转录翻译负反馈环路,由正调控元件BMAL1及CLOCK和负调控元件PER1/2及CRY1/2组成.
在细胞水平上,当一天开始的时候,Per和Cry基因的转录水平很低,然后BMAL1/CLOCK复合物激活了Per和Cry基因上游的E-box元件序列(下文有详细介绍),正向调节基因转录,在前半天这两个基因的转录水平到达峰值[50].
在细胞质中经过翻译后,PER和CRY蛋白形成同二聚体或者异二聚体,并最终迁移进入细胞核[51].
在细胞核内,PER和CRY蛋白聚合物抑制BMAL1/CLOCK复合物的激活功能,也包括Per和Cry基因自身转录的抑制[52].
由于蛋白的不稳定性和转录活动的抑制,PER和CRY的蛋白水平在下半天达到峰值,然后越来越少.
与此同时,由于负调控元件PER和CRY的减少,BMAL1/CLOCK复合物的激活功能在夜间又开始慢慢变强.
这样,在经历了大约一天的周期后,开始了一个新的转录循环.
正调控元件BMAL1及CLOCK,和负调控元件PER1/2及CRY1/2还参与对钟控基因(clockcontrolledgenes,指生物钟调控的基因)的昼夜调控,而这些钟控基因在不同的外周组织中表达有所不同[53~55].
除了这个核心的负反馈环路外,孤核受体(orphannuclearreceptor)家族成员ROR-A/B和REV-ERBα/β会形成另一个环路,调控重要的正调控元件Bmal1基因的转录.
ROR-A/B结合到Bmal1启动子区上游的ROR作用元件(RORE元件,下文有详细介绍)正向激活转录,而REV-ERBα/β则会竞争结合到同一位点抑制转录的发生[38,39].
这个环路又被称为"稳定环路",其结果是Bmal1的转录在一天中的后半天达到峰值,与Per、Cry的转录产物相反(图1).
转录后调控在生物钟基因以及钟控基因的近日节律的维持过程中发挥重要作用.
转录后修饰控制蛋白的降解,尤其是负调控元件PER和CRY蛋白的降解对于一个完整的生物钟周期是不可或缺的.
有多个转录后修饰会影响PER和CRY蛋白的稳定性,从而调节它们对BMAL1/CLOCK复合物的抑制作用.
研究最多的就是它们的磷酸化和去磷酸化过程,一方面磷酸化的过程会影响到PER和CRY蛋白的细胞定位[56,57],另一方面磷酸化会介导PER和CRY蛋白被泛素化降解途径的E3连接酶识别,进入降解途径[35,37].
研究发现,磷酸化PER和CRY蛋白的激酶包括CK1δ、CK1ε、CK2、AMPK和GSK-3β[34,58~61].
PER和CRY蛋白被泛素化后降解的过程,会加速或者减缓生物钟的运行,调节近日节律的周期.
其他的转录后修饰对于生物钟的调节也很重要,例如RNA水平的修饰调节,蛋白的糖基化,蛋白的乙酰化等[62,63].
下面将重点介绍近日节律产生过程中转录激活和抑制过程的分子机制,包括生物钟调控过程中主要的顺式作用元件,生物钟节律振荡过程中转录水平上的分子相互作用,以及节律过程中的表观遗传修饰等.
3生物钟调控网络中的顺式作用元件生物钟基因及其转录翻译产物组成的多反馈环,是哺乳动物生物钟分子调控的基础.
因此在转录过程中,不可或缺地会发生对启动子区域的DNA顺式作用元件的调节.
已有的研究表明,DNA顺式作用元件,如E-box、RORE、D-box等,在生物钟的网络调控和对下游钟控基因的调节过程具有着重要的调控功能(图2).
3.
1E-box元件自从1985年在免疫球蛋白的重链基因的启动子区域,E-box作为一个调控元件被发现后,人们发现它能够广泛地参与大量基因的表达调控[64].
这些基因有的几乎没有什么关联,如肌动蛋白基因(Actin)、鸟氨酸脱羧酶基因(Odc1)、前胸腺素基因第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1127图2生物钟调控网络中的顺式作用元件Fig.
2Cis-regulatingmotifsthatbindclocktranscriptionfactorsA:E-box元件,包含一段由具有bHLH(碱性螺旋环螺旋)结构域的转录因子所识别的核心序列:CANNTG,能被生物钟节律振荡中的正调节因子BMAL1、CLOCK和NPAS2蛋白特异性结合.
B:RORE元件,是由一段(G/A)GGTCA核心序列加上一段AT富集的前导序列构成,能被转录激活因子ROR、转录抑制因子REV-ERBα和REV-ERBβ特异性结合.
C:D-box元件,是两段GTAA(C/T)一个正向和一个反向组成的9~10个碱基的回文序列,在特定的相位被DBP、E4BP4、HLF和TEF等富含脯氨酸和酸性氨基酸的碱性亮氨酸(PAR-bZIP)转录因子家族的蛋白特异性结合.
(Ptma)、赖氨加压素基因(Avp)、生长因子-β基因(Tgfb)、乳腺癌基因2(Brca2)、细胞周期蛋白B1基因(Ccnb1)、血型糖蛋白-B基因(Gypb)以及肌球蛋白基因(Myo)等[65].
E-box作用元件包含了一段由具有bHLH(碱性螺旋环螺旋)结构域的转录因子所识别的核心序列CANNTG.
E-box依赖的调控途径具有复杂的多样性,人们根据已有的E-box对可能具有的反式作用因子展开了大量研究.
毫无意外,研究人员发现了大量可以识别E-box的转录调控因子,而这些转录调控因子均通过bHLH结构域与启动子或者其他蛋白相互作用.
以其中的一小部分举例,这些结合E-box的转录因子包括MYC、ARNT、MAX、MYOD、MAD、USF、TFE3、TAL1等,以及生物钟节律振荡中的正调节因子BMAL1、CLOCK和NPAS2[65].
研究发现,E-box侧翼的各种序列通过改变DNA的构象能够使E-box特异性去识别哺乳动物蛋白质组中含有bHLH结构域的不同蛋白[66].
在果蝇中发现了周期基因Period后,人们在对Period的研究分析过程中,很快发现了E-box顺式元件参与生物钟基因的转录调控[67].
之后,在哺乳动物中的研究进一步证实E-box与生物钟的调控存在紧密的关联[68].
作为参与生物钟调控的E-box元件,其具有的一个最重要的特征即是能够特异性招募BMAL1/CLOCK复合物.
更为重要的是,人们发现如果两个E-box在间隔6~7个碱基重复出现的情况下,BMAL1/CLOCK复合物对这部分的E-box具有更强的亲和力,并且由于这种协同作用,可以使BMAL1/CLOCK复合物更容易招募到其他转录元件[69].
经过比较Rev-erbα基因座上转录因子BMAL1的结合数量和RNA的表达量,发现并不是所有的E-box元件都结合了BMAL1,这表明BMAL1对增强子的结合可能受到一些表观遗传修饰或者其他转录因子的影响.
其他的研究发现BMAL1/CLOCK复合物结合的靶基因的生物钟表达存在不同的相位[70],更加表明在对E-box的结合的调控过程中存在表观遗传机制参与的高阶调控,或者其他的转录因子,例如MYC、ARNT、MAX等参与这个过程[71].
虽然一些含有bHLH的转录因子和BMAL1在对E-box的偏好性上有着微小的差异,但是这些转录因子还是可能会占用到BMAL1结合位点,特别是由于一些疾病导致这些bHLH蛋白表达异常时,错误结合率会有所增加[72,73].
例如,含有bHLH结构域致癌因子MYC能够通过结合E-box直接激活许多生物钟转录抑制因子的表达,包括了Rev-erbα和Rev-erbβ,从而干扰了BMAL1主导的生物钟基因转录本和生物钟蛋白的周期节律振荡和葡萄糖昼夜代谢振荡.
经染色质免疫共沉淀(chromatinimmuno-precipitation,ChIP)分析发现转录激活因子USF1与Dbp、Per1和Per2的增强子区域结合,证明USF1也可以通过结合E-box元件进行转录水平的调控.
而且通过突变Usf1启动子导致的USF1表达上调可以恢复CLOCK突变小鼠昼夜节律相关的表型的实1128Hereditas(Beijing)2017第39卷验,进一步证明USF1通过E-box参与转录调控[73].
3.
2RORE和RevDR2元件RORE元件是由一段(G/A)GGTCA核心序列加上一段AT富集的前导序列构成,最早是在参与维甲酸相关的孤核受体家族成员ROR激活调控通路中作为高特异的结合位点而被发现的[74,75].
之后,又发现了在ROR激活调控中与其结合的2个成员,它们是来自核受体超家族的REV-ERBα和REV-ERBβ[76,77].
REV-ERBα既可以单体形式结合在RORE上,也能形成同二聚体结合到具有间隔2个碱基的RORE串联序列(这个作用元件被称为DevDR2)的基因上,参与对基因的转录抑制调控.
起初,人们认为仅有REV-ERBα负调控Bmal1基因的转录[39],但是很快就发现仅有RORE存在的增强子也能够驱动荧光素酶报告基因(启动子驱动萤火虫荧光素酶报告基因,可用来检测启动子的转录状态)的生物钟振荡表达[78].
这表明,RORE作用元件不仅有转录抑制的负调节元件REV-ERBα,还存在它的正向调节元件.
很快,人们就确认已知的RORE正调节因子ROR参与对Bmal1的转录激活,而且发现Ror-α的mRNA在SCN组织中振荡表达,而Ror-γ的mRNA在肝脏组织中振荡表达[38].
不论是将Ror基因家族或是Rev-erb基因家族进行全身敲除,还是进行组织特异性敲除,都会导致各种组织中生物钟振荡的紊乱或是振荡的相位迁移.
因此,ROR蛋白和REV-ERB蛋白被证实是以昼夜振荡的方式分别与RORE元件和Rev-DR2元件结合,共同增强了核心生物钟蛋白(BMAL1、NPAS2和CRY1等)的生物钟节律性表达的稳定性.
作为核受体的家族成员,虽然ROR的天然配体仍然存在争议,但似乎固醇可以激活ROR[79].
此外,ROR似乎可以一直保持活性状态(即其不依赖配体就处于激活状态),或者其持续的活性是由于ROR一直与天然配体结合.
有研究表明,氧合甾醇是高亲和性的ROR-C激动剂[80],而7位氧合的甾醇作为ROR-A和ROR-C的反向激动剂发挥作用[79].
还有许多其他天然物质结合ROR被报道,其中包括全反式视黄酸能够以高亲和力结合ROR-B和ROR-C,但是不与ROR-A结合[81].
脂代谢产物对生物钟的影响可能是下一步的研究方向.
3.
3D-box元件D-box元件是指各种碱性亮氨酸拉链(bZIP)家族成员结合的顺式元件,是两段GTAA(C/T)一个正向和一个反向组成的9~10个碱基的回文序列.
D-box元件在特定的相位能被DBP、E4BP4、HLF和TEF等富含脯氨酸和酸性氨基酸的碱性亮氨酸(PAR-bZIP)转录因子家族的蛋白所结合.
虽然BMAL1/CLOCK通过调控Dbp、Hlf和Tef启动子区域的E-box元件,使它们的表达呈现出节律振荡,并且这3个转录激活因子具有很高的序列相似性,在功能上也存在着冗余性.
但有趣的是,对于这3个基因同时进行全身敲除既不会影响个体行为昼夜节律性的表现,也不会影响生物钟基因的表达[82].
因而推测,DBP、HLF和TEF更有可能对生物钟下游的输出基因而不是核心基因进行调控.
与DBP、HLF和TEF这3个转录激活因子相比,被REV-ERBα通过RevDR2元件调控的转录抑制因子E4BP4正好在与DBP等因子相反的相位进行表达.
被REV-ERBα抑制的基因通过D-box元件,同样成为E4BP4的靶标[83].
因此,E4BP4被认为调控了一条与DBP、HLF和TEF调控的截然不同的生物钟下游输出途径,并且它借由D-box促进了目标基因转录"开"与"关"两种状态的切换.
4转录过程中的分子间相互作用哺乳动物的生物钟基因被发现以后,人们注意到一个事实,就是正调控因子BMAL1和CLOCK的蛋白上有PAS(Per-Arnt-Sim)结构域,负调控因子PER蛋白上有同样的PAS结构域.
和果蝇中的CYC与CLK类似,BMAL1和CLOCK(或者NPAS2)的PAS结构域形成异二聚体结构,结合到钟控基因的启动子附近的E-box区启动转录[84,85].
下面将介绍一个完整的生物钟振荡过程中转录水平上的分子相互作用,包括蛋白-蛋白相互作用和转录因子顺式元件的相互作用.
BMAL1/CLOCK复合物结合到启动子附近的增强子上之后,除了CLOCK本身具有一定的组蛋白乙酰化酶功能外,BMAL1的C端柔性区负责招募第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1129转录共激活因子CBP/p300,启动转录[86].
CBP/p300不仅可以作为蛋白相互作用的支架招募包含转录聚合酶在内的转录复合物,还具有乙酰转移酶活性.
另外,BMAL1/CLOCK复合物类似于转录活动的开拓者,可以使结合的靶基因上的核小体有节律性的脱离染色质,而染色质这种有节律性的松散(开放转录)可以促进像HNF4、HNF6、CEBPA、STAT5以及REV-ERB等转录因子装载到DNA之上[87].
这种协同作用的结合方式有效增强了转录起始的速率,从而提高转录活性.
在生物钟的多反馈环通路中,ROR作为结合在RORE元件上的正向激活因子,对靶基因的调节常常是通过与其他转录激活或者转录抑制因子的竞争发挥作用.
在肝脏中,ROR-A有节律地结合在RORE上,但是肝脏中Rorα的蛋白表达量很高且几乎没有振荡变化,那么猜测ROR-A节律性地结合在DNA上是由于主要在白天表达的REV-ERB蛋白与ROR-A竞争结合RORE元件[88].
事实证明,REV-ERB在RORE上结合的相位与ROR-A相反.
当ROR结合到DNA上,会招募转录共激活因子来调节靶基因的转录表达.
在转录抑制的过程中,有报道在E-box元件附近,PER蛋白会形成分子量很大的复合物,其中包含数十个以上的蛋白,包括生物钟蛋白BMAL1、CLOCK、CRY1/2和CK1δ/ε,以及其他的转录抑制蛋白因子如PSF、SIN3和HDAC[89].
这个转录抑制复合物构成一个PER-SIN-HDAC分子轴,使组蛋白3和组蛋白4去乙酰化,从而抑制BMAL1/CLOCK复合物的转录活性.
另外,还有研究发现,PER蛋白可以与BMAL1/CLOCK复合物结合,使BMAL1脱离E-box元件区域,从而终结了BMAL1/CLOCK复合物的转录活性[90].
相对于PER蛋白的抑制效果,CRY蛋白的抑制能力更强,其中CRY1的抑制主要发生在生物钟振荡的起始期[70],而CRY2的抑制是通过和PER蛋白的协同作用而发生的.
CRY1和CBP/p300竞争结合到BMAL1的C端柔性区,从而解除BMAL1对CBP/p300的招募[86].
BMAL1的C端片断(末尾的43个氨基酸)对于结合CRY1,以及维持正常的生物钟振荡周期是必需的[91].
如果在细胞内将BMAL1的C端结构域上的L606/L607突变为丙氨酸,那么BMAL1不仅与CRY1的相互作用消失,细胞的生物钟振荡也失去了节律[86].
除了蛋白蛋白相互作用引起生物钟周期的转录抑制外,转录因子间的相互竞争也会抑制BMAL1/CLOCK复合物对E-box的结合,如转录抑制作用因子DEC1和DEC2以及转录激活因子USF1会与BMAL1/CLOCK发生竞争[92].
同样,由于存在竞争结合顺式作用元件的情况,不具有节律振荡的转录因子也会影响生物钟基因的表达,比如MYC会与BMAL1/CLOCK发生竞争[72],ARNT也会发生同样的情况[71].
因此,在许多疾病(癌症以及代谢类疾病等)个体中,生物钟功能紊乱的现象很普遍.
5转录激活/抑制过程中的表观遗传修饰在细胞中,DNA在组蛋白八聚体周围缠绕约1.
65圈形成核小体,并进一步凝缩成染色质.
转录过程中,转录复合物需要结合到DNA上,而凝缩的染色质会在空间上阻碍转录复合物的结合,但是核小体的修饰可以松散或者打开核小体的结构.
因此核小体的修饰会影响转录状态,从而调节基因的表达[93].
组蛋白H3K4(组蛋白H3上第4位的赖氨酸)的甲基化与常染色质(euchromatin)相关,如H3K4me1(H3K4发生1个甲基修饰)常位于增强子元件附近,而H3K4me3(H3K4发生3个甲基修饰)则出现在活性转录起始位点附近[94].
H3K9(组蛋白H3上第9位的赖氨酸)的甲基化促进异染色质(heterochromatin)的形成并抑制转录,而H3K9ac(H3K9发生乙酰化修饰)则是常染色质的标记及与转录状态的激活相关,并且H3K27ac是转录活跃的增强子标记.
此外,组蛋白变体H2A.
Z会出现在转录起始位点和增强子附近,从而减弱DNA与核小体的结合[95].
除组蛋白的修饰外,DNA甲基化等表观遗传学修饰,不依赖于DNA序列的改变而引起的可遗传的基因表达和细胞表型的变化.
越来越多的实验证据表明生物钟振荡过程中,基因表达与染色质的表观遗传学修饰密切相关(图3).
例如,增强子的活性标志物H3K27ac和H3K9ac,都被证实存在昼夜节律性,且与生物钟基因的表达有正相关的关系[95~97].
REV-ERBα通过将共抑制复合物NCoR和/或SMRT募集到RORE元件来抑制转录.
NCoR和/或SMRT复合物的稳定成员HDAC31130Hereditas(Beijing)2017第39卷(组蛋白去乙酰化酶)能使RORE元件附近的组蛋白节律性的脱乙酰化,从而赋予表观基因组层面上的生物钟基因调控.
E-box附近的H3K9呈现出昼夜节律的甲基化修饰,而且小鼠肝脏中H3K9的甲基化与乙酰化在相反的相位发生[89,96].
在Per1和Per2基因的启动子上最早发现了组蛋白修饰参与昼夜节律调控[98].
Per1和Per2基因启动子上的组蛋白H3K9节律性乙酰化,并且其乙酰化的节律与两个基因的转录活性是一致的[98].
图3所示,生物钟振荡的转录开始阶段,BMAL1/CLOCK复合物招募组蛋白乙酰化酶p300/CBP,使E-box附近组蛋白乙酰化,从而使得染色质松散有助于基因的转录激活过程[96,99].
有报道称CLOCK自身具有乙酰转移酶(HAT)活性,可以将组蛋白H3K9和H3K14(组蛋白H3的第14位赖氨酸)进行乙酰化修饰,且BMAL1与CLOCK的结合能增强其酶活性[100].
组蛋白的乙酰化水平由组蛋白去乙酰化酶HDAC和组蛋白乙酰转移酶HAT调节.
长寿因子(sirtuins,SIRT1)是一类参与核心生物钟的HDAC,其辅因子NAD+在许多生理系统中处于严格的昼夜节律调控下,其表达受CLOCK、BMAL1和PER2调控[101].
受到BMAL1/CLOCK调控的目的基因Nampt节律性表达,使得NAD+的水平呈现出节律振荡,使得SIRT1的活性呈现节律振荡,而SIRT1的活性增高时就会反过来抑制BMAL1/CLOCK复合物的转录激活作用[102,103].
H3K4甲基化通常与转录激活基因和增强子附近同一核小体中的赖氨酸残基的乙酰化同时发生,在生物钟的遗传机制中也不例外.
H3K4me3是活性基因启动子上的普遍标志,其水平在生物钟基因转录起始位点(transcriptionstartsites,TSSs)附近呈现节律振荡[104,105].
转移酶MLL家族的成员参与H3K4节律性的三甲基化[106~108].
其中MLL1与CLOCK转录激活域(Δ19突变体)相互作用,这对CLOCK招募到DNA上至关重要.
此外,MLL1的甲基化活性也由乙酰化和去乙酰化调控,其中去乙酰化由SIRT1节律性调控.
相关的甲基转移酶MLL3也表现出节律性振荡,同时也与H3K4em3有关,但是MLL3并不是凭借BMAL1或是CLOCK招募至DNA上[106].
CLOCK和BMAL1还与特异性组蛋白脱甲基酶JARID1A及LSD1相互作用以促进BMAL1/CLOCK招募到Per启动子上以增强其转录[109,110].
在E-box附近单泛素化的组蛋白H2B(H2Bub)的水平也出现节律振荡[111].
在转录激活的后期,DDB1-CUL4介导的H2Bub积累,通过招募PER-CRY复合体到与E-box结合的BMAL1/CLOCK来启动抑制过程[111].
目前,推测还有几种蛋白可能结合或读取H2B单泛素化的核小体,可能存在于PER-CRY抑制复合物中,但是迄今为止并没有确定.
在激活到抑制的过程中,随着PER和CRY的积累并转移到细胞核,BMAL1/CLOCK复合体与PER-CRY复合体相互作用.
由CRY和PER介导的转录抑制的主要机制是直接招募包含HDAC1和HDAC2的Sin3复合物和Mi-2-核小体重塑去乙酰化酶(NuRD)转录共抑制复合物,使附近的组蛋白脱乙酰化[112].
BMAL1/CLOCK也能够招募核心蛋白复合体2(PRC2),使目的基因的组蛋白H3K27被三甲基化后抑制该基因的表达[113,114].
在抑制过程中,由SUV3甲基转移酶介导E-box附近的H3K9二甲基化.
甲基化的H3K9(在转录激活期间,此赖氨酸被乙酰化),成为异染色质蛋白1α(HP1α)的结合位点,并在生物钟基因转录的抑制阶段介导异染色质节律性的形成[115,116].
有趣的是,在CRY-PER降解后,时钟基因仍然受到很强的抑制作用[70,88],由此可见,H3K9me和HP1可以作为钟表基因表达的表观遗传学沉默子,直到BMAL1/CLOCK重新激活并开始下一轮循环[89].
该机制还暗示了在BMAL1/CLOCK结合之前或之后H3K9活跃的昼夜节律去甲基化,但是潜在的机制仍然未知.
DNA的甲基化由DNA甲基转移酶催化,是一种被广泛研究的表观遗传修饰,在基因调控中具有复杂的作用.
在哺乳动物中,它主要发生在胞嘧啶鸟嘌呤(CpG)二核苷酸中的胞嘧啶上,在分化过程中组织特异性的基因组DNA甲基化模式对建立细胞识别方面发挥着重要的作用.
在小鼠的肝脏和脑中,DNA甲基转移酶节律性的表达[117],并且也有证据表明在LINE-1元件上呈现出昼夜节律的DNA甲基化[118].
经典的E-box元件CACGTG中心含有可被甲基化的CpG部分,并且CpG的甲基化会改变某些bHLH蛋白的结合[119],但是并不清楚E-box的甲基化是否会影响BMAL1/CLOCK的结合.
第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1131图3生物钟振荡周期中的表观遗传修饰Fig.
3Epigeneticmodificationinthecycleofcircadianclock生物钟振荡的转录激活阶段,BMAL1/CLOCK二聚体与E-box结合并招募CBP和p300,它们的组蛋白乙酰化酶活性能够使附近的组蛋白乙酰化,包括H3K9ac、H3K14ac及H3K27ac.
还有组蛋白甲基转移酶系MLL家族,能够特异性的使H3K4甲基化.
不同的是,增强子上的活性标记为H3K4me1,而启动子上的活性标记为H3K4me3,同时还有H2A.
Z突变体随着BMAL1/CLOCK与E-box的结合而替换H2A.
BMAL1和CLOCK还与特异性组蛋白脱甲基酶JARID1A及LSD1相互作用,BMAL1/CLOCK与酶相互作用介导的一系列组蛋白修饰,促使核小体松散离开DNA,从而促进转录.
在转录激活后期,DDB1-CUL4介导的H2Bub在E-box附近积累,通过招募PER-CRY复合体到与E-box结合的BMAL1/CLOCK来启动抑制过程.
BMAL1/ClOCK也能够招募核心蛋白复合体2(PRC2),使目的基因的组蛋白H3K27被三甲基化后抑制该基因的表达.
在转录抑制阶段,由CRY和PER介导的转录抑制的主要机制是直接招募包含HDAC1和HDAC2的Sin3复合物和Mi-2-核小体重塑去乙酰化酶(NuRD)转录共抑制复合物,使附近的组蛋白脱乙酰化,同时还有由SUV3甲基转移酶介导E-box附近的H3K9二甲基化,而H3K9me2为异染色质蛋白HP1α的结合位点,能促使染色质进一步凝缩成为异染色质,从而使转录沉默,直到BMAL1/CLOCK重新激活并开始下一轮循环.
1132Hereditas(Beijing)2017第39卷6结语与展望从果蝇的正向遗传学研究发现第一个高等动物生物钟开始,本文简单介绍了高等动物生物钟基因的历史发现,并主要从转录翻译的反馈环路角度综述了哺乳动物生物钟的遗传学和表观遗传学研究进展.
这些研究进展从分子水平解释了内源性的生物钟的周期性的发生.
尽管在其他的模式生物中存在一个不依赖于转录和翻译的反馈环路的基础生物钟[120],但转录翻译反馈环路仍然构成了高等生物的生物钟基础.
在过去的几十年中,从正向遗传学的表型鉴定到反向遗传学对分子组分研究的深入发展,为深刻理解生物钟提供了大量的实验数据和理论.
近年来,一系列的研究发现表明生物钟紊乱会招致严重的健康后果,包括心血管疾病、肥胖、精神类疾病.
生物钟几乎存在所有的物种内,能帮助这些物种有效地预测环境,适应环境.
果蝇生物钟基因的克隆与分子机制获得2017诺贝尔生理学及医学奖之后,将会有更多的科研工作者关注和深入生物钟系统的研究,尤其是生物钟及其调控的周期节律紊乱与人类健康相关课题的研究将会是热点科学问题.
因此,从分子生物钟、遗传学、及表观遗传学多个层次解释生物钟的作用机理,将会为人们彻底理解生物钟与其他生物学领域的相关性打下扎实基础,并推动时间生物学和其他学科的交叉研究.
参考文献(References):[1]DunlapJC,LorosJJ,DeCourseyPJ.
Chronobiology:BiologicalTimekeeping.
Sunderland:SinauerAsso-ciates,Inc.
Publishers,2004.
[DOI][2]CzeislerCA,DuffyJF,ShanahanTL,BrownEN,Mit-chellJF,RimmerDW,RondaJM,SilvaEJ,AllanJS,EmensJS,DijkDJ,KronauerRE.
Stability,precision,andnear-24-hourperiodofthehumancircadianpace-maker.
Science,1999,284(5423):2177–2181.
[DOI][3]DuffyJF,WrightKPJr.
Entrainmentofthehumancir-cadiansystembylight.
JBiolRhythms,2005,20(4):326–338.
[DOI][4]QinXM,GuoJH.
Synchronizationofthemammaliancentralandperipheralcircadianclocks.
ChinSciBull,2017,62(25):2849–2856.
秦曦明,郭金虎.
哺乳动物生物钟同步化的研究进展.
科学通报,2017,62(25):2849–2856.
[DOI][5]OuyangY,AnderssonCR,KondoT,GoldenSS,John-sonCH.
Resonatingcircadianclocksenhancefitnessincyanobacteria.
ProcNatlAcadSciUSA,1998,95(15):8660–8664.
[DOI][6]SpoelstraK,WikelskiM,DaanS,LoudonASI,HauM.
Naturalselectionagainstacircadianclockgenemuta-tioninmice.
ProcNatlAcadSciUSA,2016,113(3):686–691.
[DOI][7]TakahashiJS.
Molecularcomponentsofthecircadianclockinmammals.
DiabetesObesMetab,2015,17Suppl1:6–11.
[DOI][8]TakahashiJS.
Transcriptionalarchitectureofthemam-maliancircadianclock.
NatRevGenet,2017,18(3):164–179.
[DOI][9]SchiblerU,GoticI,SainiC,GosP,CurieT,Emme-neggerY,SinturelF,GosselinP,GerberA,Fleury-OlelaF,RandoG,DemarqueM,FrankenP.
Clock-Talk:Inte-ractionsbetweencentralandperipheralcircadianoscil-latorsinmammals.
ColdSpringHarbSympQuantBiol,2015,80:223–232.
[DOI][10]BuijsRM,HermesMHLJ,KalsbeekA.
Thesupra-chiasmaticnucleus—paraventricularnucleusinterac-tions:abridgetotheneuroendocrineandautonomicnervoussystem.
ProgBrainRes,1998,119:365–382.
[DOI][11]BalsalobreA,DamiolaF,SchiblerU.
Aserumshockinducescircadiangeneexpressioninmammaliantissueculturecells.
Cell,1998,93(6):929–937.
[DOI][12]AnY,XuY.
Themechanismofmammaliancircadianrhythms.
ChinBullLifeSci,2015,27(11):1372–1379.
安扬,徐璎.
哺乳动物昼夜节律机制研究进展.
生命科学,2015,27(11):1372–1379.
[DOI][13]PittendrighCS.
Circadianrhythmsandthecircadianorganizationoflivingsystems.
ColdSpringHarbSympQuantBiol,1960,25:159–184.
[DOI][14]AschoffJ.
Exogenousandendogenouscomponentsincircadianrhythms.
ColdSpringHarbSympQuantBiol,1960,25:11–28.
[DOI][15]KonopkaRJ,BenzerS.
ClockmutantsofDrosophilamelanogaster.
ProcNatlAcadSciUSA,1971,68(9):2112–2116.
[DOI][16]ReddyP,ZehringWA,WheelerDA,PirrottaV,HadfieldC,HallJC,RosbashM.
Molecularanalysisofthepe-riodlocusinDrosophilamelanogasterandidentificationofatranscriptinvolvedinbiologicalrhythms.
Cell,1984,38(3):701–710.
[DOI]第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1133[17]BargielloTA,JacksonFR,YoungMW.
RestorationofcircadianbehaviouralrhythmsbygenetransferinDro-sophila.
Nature,1984,312(5996):752–754.
[DOI][18]SehgalA,PriceJL,ManB,YoungMW.
Lossofcirca-dianbehavioralrhythmsandperRNAoscillationsintheDrosophilamutanttimeless.
Science,1994,263(5153):1603–1606.
[DOI][19]MyersMP,Wager-SmithK,WesleyCS,YoungMW,SehgalA.
PositionalcloningandsequenceanalysisoftheDrosophilaclockgene,timeless.
Science,1995,270(5237):805–808.
[DOI][20]GekakisN,SaezL,Delahaye-BrownAM,MyersMP,SehgalA,YoungMW,WeitzCJ.
IsolationoftimelessbyPERproteininteraction:defectiveinteractionbetweentimelessproteinandlong-periodmutantPERL.
Science,1995,270(5237):811–815.
[DOI][21]AlladaR,WhiteNE,SoWV,HallJC,RosbashM.
AmutantDrosophilahomologofmammalianClockdis-ruptscircadianrhythmsandtranscriptionofperiodandtimeless.
Cell,1998,93(5):791–804.
[DOI][22]RutilaJE,SuriV,LeM,SoWV,RosbashM,HallJC.
CYCLEisasecondbHLH-PASclockproteinessentialforcircadianrhythmicityandtranscriptionofDroso-philaperiodandtimeless.
Cell,1998,93(5):805–814.
[DOI][23]PriceJL,BlauJ,RothenfluhA,AbodeelyM,KlossB,YoungMW.
double-timeisanovelDrosophilaclockgenethatregulatesPERIODproteinaccumulation.
Cell,1998,94(1):83–95.
[DOI][24]VitaternaMH,KingDP,ChangAM,KornhauserJM,LowreyPL,McDonaldJD,DoveWF,PintoLH,TurekFW,TakahashiJS.
Mutagenesisandmappingofamousegene,Clock,essentialforcircadianbehavior.
Science,1994,264(5159):719–725.
[DOI][25]GekakisN,StaknisD,NguyenHB,DavisFC,Wils-bacherLD,KingDP,TakahashiJS,WeitzCJ.
RoleoftheCLOCKproteininthemammaliancircadianme-chanism.
Science,1998,280(5369):1564–1569.
[DOI][26]BungerMK,WilsbacherLD,MoranSM,ClendeninC,RadcliffeLA,HogeneschJB,SimonMC,TakahashiJS,BradfieldCA.
Mop3isanessentialcomponentofthemastercircadianpacemakerinmammals.
Cell,2000,103(7):1009–1017.
[DOI][27]TeiH,OkamuraH,ShigeyoshiY,FukuharaC,OzawaR,HiroseM,SakakiY.
Circadianoscillationofamamma-lianhomologueoftheDrosophilaperiodgene.
Nature,1997,389(6650):512–516.
[DOI][28]SunZS,AlbrechtU,ZhuchenkoO,BaileyJ,EicheleG,LeeCC.
RIGUI,aputativemammalianorthologoftheDrosophilaperiodgene.
Cell,1997,90(6):1003–1011.
[DOI][29]AlbrechtU,SunZS,EicheleG,LeeCC.
Adifferentialresponseoftwoputativemammaliancircadianregulators,mper1andmper2,tolight.
Cell,1997,91(7):1055–1064.
[DOI][30]ShearmanLP,ZylkaMJ,WeaverDR,KolakowskiLFJr,ReppertSM.
Twoperiodhomologs:circadianexpres-sionandphoticregulationinthesuprachiasmaticnuclei.
Neuron,1997,19(6):1261–1269.
[DOI][31]TakumiT,TaguchiK,MiyakeS,SakakidaY,TakashimaN,MatsubaraC,MaebayashiY,OkumuraK,TakekidaS,YamamotoS,YagitaK,YanL,YoungMW,OkamuraH.
Alight-independentoscillatorygenemPer3inmouseSCNandOVLT.
EMBOJ,1998,17(16):4753–4759.
[DOI][32]vanderHorstGT,MuijtjensM,KobayashiK,TakanoR,KannoS,TakaoM,deWitJ,VerkerkA,EkerAP,vanLeenenD,BuijsR,BootsmaD,HoeijmakersJH,YasuiA.
MammalianCry1andCry2areessentialformain-tenanceofcircadianrhythms.
Nature,1999,398(6728):627–630.
[DOI][33]VitaternaMH,SelbyCP,TodoT,NiwaH,ThompsonC,FruechteEM,HitomiK,ThresherRJ,IshikawaT,MiyazakiJ,TakahashiJS,SancarA.
Differentialregu-lationofmammalianperiodgenesandcircadianrhyth-micitybycryptochromes1and2.
ProcNatlAcadSciUSA,1999,96(21):12114–12119.
[DOI][34]LowreyPL,ShimomuraK,AntochMP,YamazakiS,ZemenidesPD,RalphMR,MenakerM,TakahashiJS.
Positionalsynteniccloningandfunctionalcharacteriza-tionofthemammaliancircadianmutationtau.
Science,2000,288(5465):483–491.
[DOI][35]SiepkaSM,YooSH,ParkJ,SongWM,KumarV,HuYN,LeeC,TakahashiJS.
CircadianmutantOvertimerevealsF-boxproteinFBXL3regulationofCryptoch-romeandPeriodgeneexpression.
Cell,2007,129(5):1011–1023.
[DOI][36]HiranoA,YumimotoK,TsunematsuR,MatsumotoM,OyamaM,Kozuka-HataH,NakagawaT,Lanjakornsi-ripanD,NakayamaKI,FukadaY.
FBXL21regulatesoscillationofthecircadianclockthroughubiquitinationandstabilizationofcryptochromes.
Cell,2013,152(5):1106–1118.
[DOI][37]ShiroganeT,JinJP,AngXL,HarperJW.
SCFβ-TRCP1134Hereditas(Beijing)2017第39卷controlsclock-dependenttranscriptionviacaseinkinase1-dependentdegradationofthemammalianperiod-1(Per1)proteinm.
JBiolChem,2005,280(29):26863–26872.
[DOI][38]SatoTK,PandaS,MiragliaLJ,ReyesTM,RudicRD,McNamaraP,NaikKA,FitzGeraldGA,KaySA,Ho-geneschJB.
AfunctionalgenomicsstrategyrevealsRoraasacomponentofthemammaliancircadianclock.
Neu-ron,2004,43(4):527–537.
[DOI][39]PreitnerN,DamiolaF,Lopez-MolinaL,ZakanyJ,Du-bouleD,AlbrechtU,SchiblerU.
TheorphannuclearreceptorREV-ERBαcontrolscircadiantranscriptionwithinthepositivelimbofthemammaliancircadianoscillator.
Cell,2002,110(2):251–260.
[DOI][40]YamaguchiS,MitsuiS,YanL,YagitaK,MiyakeS,OkamuraH.
RoleofDBPinthecircadianoscillatorymechanism.
MolCellBiol,2000,20(13):4773–4781.
[DOI][41]OishiK,MiyazakiK,KadotaK,KikunoR,NagaseT,AtsumiGI,OhkuraN,AzamaT,MesakiM,YukimasaS,KobayashiH,IitakaC,UmeharaT,HorikoshiM,KudoT,ShimizuY,YanoM,MondenM,MachidaK,MatsudaJ,HorieS,TodoT,IshidaN.
Genome-wideexpressionanalysisofmouseliverrevealsCLOCK-regulatedcir-cadianoutputgenes.
JBiolChem,2003,278(42):41519–41527.
[DOI][42]HardinPE,HallJC,RosbashM.
FeedbackoftheDro-sophilaperiodgeneproductoncircadiancyclingofitsmessengerRNAlevels.
Nature,1990,343(6258):536–540.
[DOI][43]PandaS,AntochMP,MillerBH,SuAI,SchookAB,StraumeM,SchultzPG,KaySA,TakahashiJS,Hoge-neschJB.
Coordinatedtranscriptionofkeypathwaysinthemousebythecircadianclock.
Cell,2002,109(3):307–320.
[DOI][44]MoskoSS,MooreRY.
Neonatalsuprachiasmaticnuc-leuslesions:effectsonthedevelopmentofcircadianrhythmsintherat.
BrainRes,1979,164(1–2):17–38.
[DOI][45]KafkaMS,MarangosPJ,MooreRY.
Suprachiasmaticnucleusablationabolishescircadianrhythmsinratbrainneurotransmitterreceptors.
BrainRes,1985,327(1–2):344–347.
[DOI][46]RalphMR,FosterRG,DavisFC,MenakerM.
Trans-plantedsuprachiasmaticnucleusdeterminescircadianperiod.
Science,1990,247(4945):975–978.
[DOI][47]SujinoM,MasumotoKH,YamaguchiS,VanDerHorstGTJ,OkamuraH,InouyeSIT.
Suprachiasmaticnucleusgraftsrestorecircadianbehavioralrhythmsofgeneti-callyarrhythmicmice.
CurrBiol,2003,13(8):664–668.
[DOI][48]DeBruyneJP,WeaverDR,ReppertSM.
CLOCKandNPAS2haveoverlappingrolesinthesuprachiasmaticcircadianclock.
NatNeurosci,2007,10(5):543–545.
[DOI][49]DeBruyneJP,WeaverDR,ReppertSM.
Peripheralcir-cadianoscillatorsrequireCLOCK.
CurrBiol,2007,17(14):R538–R539.
[DOI][50]KondratovRV,ChernovMV,KondratovaAA,Gorba-chevaVY,GudkovAV,AntochMP.
BMAL1-dependentcircadianoscillationofnuclearCLOCK:posttransla-tionaleventsinducedbydimerizationoftranscriptionalactivatorsofthemammalianclocksystem.
GenesDev,2003,17(15):1921–1932.
[DOI][51]LeeC,EtchegarayJP,CagampangFRA,LoudonASI,ReppertSM.
Posttranslationalmechanismsregulatethemammaliancircadianclock.
Cell,2001,107(7):855–867.
[DOI][52]ShearmanLP,SriramS,WeaverDR,MaywoodES,ChavesI,ZhengBH,KumeK,LeeCC,VanDerHorstGTJ,HastingsMH,ReppertSM.
Interactingmolecularloopsinthemammaliancircadianclock.
Science,2000,288(5468):1013–1019.
[DOI][53]MarchevaB,RamseyKM,BuhrED,KobayashiY,SuH,KoCH,IvanovaG,OmuraC,MoS,VitaternaMH,Lo-pezJP,PhilipsonLH,BradfieldCA,CrosbySD,JeBai-leyL,WangXZ,TakahashiJS,BassJ.
DisruptionoftheclockcomponentsCLOCKandBMAL1leadstohy-poinsulinaemiaanddiabetes.
Nature,2010,466(7306):627–631.
[DOI][54]JanichP,PascualG,Merlos-SuárezA,BatlleE,Rip-pergerJ,AlbrechtU,ChengHYM,ObrietanK,DiCroceL,BenitahSA.
Thecircadianmolecularclockcreatesepidermalstemcellheterogeneity.
Nature,2011,480(7376):209–214.
[DOI][55]NamD,YechoorVK,MaK.
Molecularclockintegra-tionofbrownadiposetissueformationandfunction.
Adipocyte,2015,5(2):243–250.
[DOI][56]VielhaberE,EideE,RiversA,GaoZH,VirshupDM.
NuclearentryofthecircadianregulatormPER1iscon-trolledbymammaliancaseinkinaseI.
MolCellBiol,2000,20(13):4888–4899.
[DOI][57]YagitaK,TamaniniF,YasudaM,HoeijmakersJHJ,VanDerHorstGTJ,OkamuraH.
Nucleocytoplasmicshut-tlingandmCRY-dependentinhibitionofubiquitylation第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1135ofthemPER2clockprotein.
EMBOJ,2002,21(6):1301–1314.
[DOI][58]YangY,XuTT,ZhangYF,QinXM.
MolecularbasisfortheregulationofthecircadianclockkinasesCK1δandCK1ε.
CellSignal,2017,31:58–65.
[DOI][59]TamaruT,HirayamaJ,IsojimaY,NagaiK,NoriokaS,TakamatsuK,Sassone-CorsiP.
CK2αphosphorylatesBMAL1toregulatethemammalianclock.
NatStructMolBiol,2009,16(4):446–448.
[DOI][60]LamiaKA,SachdevaUM,DiTacchioL,WilliamsEC,AlvarezJG,EganDF,VasquezDS,JuguilonH,PandaS,ShawRJ,ThompsonCB,EvansRM.
AMPKregulatesthecircadianclockbycryptochromephosphorylationanddegradation.
Science,2009,326(5951):437–440.
[DOI][61]SaharS,ZocchiL,KinoshitaC,BorrelliE,Sas-sone-CorsiP.
RegulationofBMAL1proteinstabilityandcircadianfunctionbyGSK3β-mediatedphosphory-lation.
PLoSOne,2010,5(1):e8561.
[DOI][62]YuB,WuT,NiYH,ZhouJL,ZhugeF,SunL,FuZW.
Posttranscriptionalandposttranslationalregulationofcircadianclock.
ChinBullLifeSci,2011,23(5):470–476.
俞波,吴涛,倪银华,周静露,诸葛芬,孙璐,傅正伟.
生物钟的转录后与翻译后水平调控进展.
生命科学,2011,23(5):470–476.
[DOI][63]KimEY,JeongEH,ParkS,JeongHJ,EderyI,ChoJW.
AroleforO-GlcNAcylationinsettingcircadianclockspeed.
GenesDev,2012,26(5):490–502.
[DOI][64]ChurchGM,EphrussiA,GilbertW,TonegawaS.
Cell-type-specificcontactstoimmunoglobulinenhanc-ersinnuclei.
Nature,1985,313(6005):798–801.
[DOI][65]MuozE,BrewerM,BalerR.
CircadiantranscriptionthinkingoutsidetheE-Box.
JBiolChem,2002,277(39):36009–36017.
[DOI][66]GordnR,ShenN,DrorI,ZhouTY,HortonJ,RohsR,BulykML.
GenomicregionsflankingE-boxbindingsitesinfluenceDNAbindingspecificityofbHLHtran-scriptionfactorsthroughDNAshape.
CellRep,2013,3(4):1093–1104.
[DOI][67]HaoH,AllenDL,HardinPE.
Acircadianenhancerme-diatesPER-dependentmRNAcyclinginDrosophilamelanogaster.
MolCellBiol,1997,17(7):3687–3693.
[DOI][68]HogeneschJB,GuYZ,JainS,BradfieldCA.
Theba-sic-helix–loop–helix-PASorphanMOP3formstran-scriptionallyactivecomplexeswithcircadianandhy-poxiafactors.
ProcNatlAcadSciUSA,1998,95(10):5474–5479.
[DOI][69]ReyG,CesbronF,RougemontJ,ReinkeH,BrunnerM,NaefF.
Genome-wideandphase-specificDNA-bindingrhythmsofBMAL1controlcircadianoutputfunctionsinmouseliver.
PLoSBiol,2011,9(2):e1000595.
[DOI][70]KoikeN,YooSH,HuangHC,KumarV,LeeC,KimTK,TakahashiJS.
Transcriptionalarchitectureandchroma-tinlandscapeofthecorecircadianclockinmammals.
Science,2012,338(6105):349–354.
[DOI][71]WuYL,TangDB,LiuN,XiongW,HuangHW,LiY,MaZX,ZhaoHJ,ChenPH,QiXB,ZhangEE.
Reci-procalregulationbetweenthecircadianclockandhy-poxiasignalingatthegenomelevelinmammals.
CellMetab,2017,25(1):73–85.
[DOI][72]AltmanBJ,HsiehAL,SenguptaA,KrishnanaiahSY,StineZE,WaltonZE,GouwAM,VenkataramanA,LiB,Goraksha-HicksP,DiskinSJ,BellovinDI,SimonMC,RathmellJC,LazarMA,MarisJM,FelsherDW,Hoge-neschJB,WeljieAM,DangCV.
MYCdisruptsthecir-cadianclockandmetabolismincancercells.
CellMetab,2015,22(6):1009–1019.
[DOI][73]ShimomuraK,KumarV,KoikeN,KimTK,ChongJ,BuhrED,WhiteleyAR,LowSS,OmuraC,FennerD,OwensJR,RichardsM,YooSH,HongHK,VitaternaMH,BassJ,PletcherMT,WiltshireT,HogeneschJ,LowreyPL,TakahashiJS.
Usf1,asuppressorofthecircadianClockmutant,revealsthenatureoftheDNA-bindingoftheCLOCK:BMAL1complexinmice.
eLife,2013,2:e00426.
[DOI][74]GiguèreV,TiniM,FlockG,OngE,EvansRM,Otula-kowskiG.
Isoform-specificamino-terminaldomainsdictateDNA-bindingpropertiesofRORα,anovelfam-ilyoforphanhormonenuclearreceptors.
GenesDev,1994,8(5):538–553.
[DOI][75]GiguèreV,McBroomLD,FlockG.
DeterminantsoftargetgenespecificityforRORα1:monomericDNAbindingbyanorphannuclearreceptor.
MolCellBiol,1995,15(5):2517–2526.
[DOI][76]HardingHP,LazarMA.
TheorphanreceptorRev-ErbAαactivatestranscriptionviaanovelresponseelement.
MolCellBiol,1993,13(5):3113–3121.
[DOI][77]BaesM,GulickT,ChoiHS,MartinoliMG,SimhaD,MooreDD.
Aneworphanmemberofthenuclearhor-monereceptorsuperfamilythatinteractswithasubsetofretinoicacidresponseelements.
MolCellBiol,1994,14(3):1544–1552.
[DOI][78]UedaHR,ChenWB,AdachiA,WakamatsuH,Hayashi1136Hereditas(Beijing)2017第39卷S,TakasugiT,NaganoM,NakahamaK,SuzukiY,Su-ganoS,IinoM,ShigeyoshiY,HashimotoS.
Atran-scriptionfactorresponseelementforgeneexpressionduringcircadiannight.
Nature,2002,418(6897):534–539.
[DOI][79]SoltLA,BurrisTP.
ActionofRORsandtheirligandsin(patho)physiology.
TrendsEndocrinolMetab,2012,23(12):619–627.
[DOI][80]ZhangY,LuoXY,WuDH,XuY.
RORnuclearrecep-tors:structures,relateddiseases,anddrugdiscovery.
ActaPharmacolSin,2015,36(1):71–87.
[DOI][81]Stehlin-GaonC,WillmannD,ZeyerD,SanglierS,VanDorsselaerA,RenaudJP,MorasD,SchüleR.
All-transretinoicacidisaligandfortheorphannuclearreceptorRORβ.
NatStructBiol,2003,10(10):820–825.
[DOI][82]GachonF.
PhysiologicalfunctionofPARbZipcircadianclock-controlledtranscriptionfactors.
AnnMed,2007,39(8):562–571.
[DOI][83]FangB,EverettLJ,JagerJ,BriggsE,ArmourSM,FengD,RoyA,Gerhart-HinesZ,SunZ,LazarMA.
Circa-dianenhancerscoordinatemultiplephasesofrhythmicgenetranscriptioninvivo.
Cell,2014,159(5):1140–1152.
[DOI][84]HuangZJ,EderyI,RosbashM.
PASisadimerizationdomaincommontoDrosophilaperiodandseveraltran-scriptionfactors.
Nature,1993,364(6434):259–262.
[DOI][85]HuangN,ChelliahY,ShanYL,TaylorCA,YooSH,PartchC,GreenCB,ZhangH,TakahashiJS.
CrystalstructureoftheheterodimericCLOCK:BMAL1tran-scriptionalactivatorcomplex.
Science,2012,337(6091):189–194.
[DOI][86]XuHY,GustafsonCL,SammonsPJ,KhanSK,ParsleyNC,RamanathanC,LeeHW,LiuAC,PartchCL.
Cryptochrome1regulatesthecircadianclockthroughdynamicinteractionswiththeBMAL1Cterminus.
NatStructMolBiol,2015,22(6):476–484.
[DOI][87]MenetJS,PescatoreS,RosbashM.
CLOCK:BMAL1isapioneer-liketranscriptionfactor.
GenesDev,2014,28(1):8–13.
[DOI][88]ZhangYX,FangB,EmmettMJ,DamleM,SunZ,FengD,ArmourSM,RemsbergJR,JagerJ,SoccioRE,StegerDJ,LazarMA.
Discretefunctionsofnuclearre-ceptorRev-erbαcouplemetabolismtotheclock.
Science,2015,348(6242):1488–1492.
[DOI][89]DuongHA,WeitzCJ.
Temporalorchestrationofrepres-sivechromatinmodifiersbycircadianclockPeriodcomplexes.
NatStructMolBiol,2014,21(2):126–132.
[DOI][90]YeR,SelbyCP,OzturkN,AnnayevY,SancarA.
Bio-chemicalanalysisofthecanonicalmodelforthemam-maliancircadianclock.
JBiolChem,2011,286(29):25891–25902.
[DOI][91]KiyoharaYB,TagaoS,TamaniniF,MoritaA,SugisawaY,YasudaM,YamanakaI,UedaHR,VanDerHorstGTJ,KondoT,YagitaK.
TheBMAL1Cterminusregu-latesthecircadiantranscriptionfeedbackloop.
ProcNatlAcadSciUSA,2006,103(26):10074–10079.
[DOI][92]HonmaS,KawamotoT,TakagiY,FujimotoK,SatoF,NoshiroM,KatoY,HonmaK.
Dec1andDec2arereg-ulatorsofthemammalianmolecularclock.
Nature,2002,419(6909):841–844.
[DOI][93]JenuweinT,AllisCD.
Translatingthehistonecode.
Science,2001,293(5532):1074–1080.
[DOI][94]SoshnevAA,JosefowiczSZ,AllisCD.
Greaterthanthesumofparts:complexityofthedynamicepigenome.
MolCell,2016,62(5):681–694.
[DOI][95]VollmersC,SchmitzRJ,NathansonJ,YeoG,EckerJR,PandaS.
Circadianoscillationsofprotein-codingandregulatoryRNAsinahighlydynamicmammalianliverepigenome.
CellMetab,2012,16(6):833–845.
[DOI][96]RippergerJA,SchiblerU.
RhythmicCLOCK-BMAL1bindingtomultipleE-boxmotifsdrivescircadianDbptranscriptionandchromatintransitions.
NatGenet,2006,38(3):369–374.
[DOI][97]FengD,LiuT,SunZ,BuggeA,MullicanSE,AlenghatT,LiuXS,LazarMA.
Acircadianrhythmorchestratedbyhistonedeacetylase3controlshepaticlipidmetabol-ism.
Science,2011,331(6022):1315–1319.
[DOI][98]EtchegarayJP,LeeC,WadePA,ReppertSM.
Rhythmichistoneacetylationunderliestranscriptioninthemam-maliancircadianclock.
Nature,2003,421(6919):177–182.
[DOI][99]LeeY,LeeJ,KwonI,NakajimaY,OhmiyaY,SonGH,LeeKH,KimK.
CoactivationoftheCLOCK-BMAL1complexbyCBPmediatesresettingofthecircadianclock.
JCellSci,2010,123(Pt20):3547–3557.
[DOI][100]NakahataY,KaluzovaM,GrimaldiB,SaharS,Hi-rayamaJ,ChenD,GuarenteLP,Sassone-CorsiP.
TheNAD+-dependentdeacetylaseSIRT1modulatesCLOCK-mediatedchromatinremodelingandcircadiancontrol.
Cell,2008,134(2):329–340.
[DOI][101]AsherG,GatfieldD,StratmannM,ReinkeH,DibnerC,KreppelF,MostoslavskyR,AltFW,SchiblerU.
SIRT1第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1137regulatescircadianclockgeneexpressionthroughPER2deacetylation.
Cell,2008,134(2):317–328.
[DOI][102]NakahataY,SaharS,AstaritaG,KaluzovaM,Sas-sone-CorsiP.
CircadiancontroloftheNAD+salvagepathwaybyCLOCK-SIRT1.
Science,2009,324(5927):654–657.
[DOI][103]RamseyKM,YoshinoJ,BraceCS,AbrassartD,Ko-bayashiY,MarchevaB,HongHK,ChongJLC,BuhrED,LeeC,TakahashiJS,ImaiSI,BassJ.
CircadianclockfeedbackcyclethroughNAMPT-mediatedNAD+biosynthesis.
Science,2009,324(5927):651–654.
[DOI][104]LeMartelotG,CanellaD,SymulL,MigliavaccaE,Gi-lardiF,LiechtiR,MartinO,HarshmanK,DelorenziM,DesvergneB,HerrW,DeplanckeB,SchiblerU,Rou-gemontJ,GuexN,HernandezN,NaefF,CycliXCon-sortium.
Genome-wideRNApolymeraseIIprofilesandRNAaccumulationrevealkineticsoftranscriptionandassociatedepigeneticchangesduringdiurnalcycles.
PLoSBiol,2012,10(11):e1001442.
[DOI][105]MalapeiraJ,KhaitovaLC,MasP.
OrderedchangesinhistonemodificationsatthecoreoftheArabidopsiscircadianclock.
ProcNatlAcadSciUSA,2012,109(52):21540–21545.
[DOI][106]ValekunjaUK,EdgarRS,OklejewiczM,VanDerHorstGTJ,O'NeillJS,TamaniniF,TurnerDJ,ReddyAB.
HistonemethyltransferaseMLL3contributestoge-nome-scalecircadiantranscription.
ProcNatlAcadSciUSA,2013,110(4):1554–1559.
[DOI][107]KatadaS,Sassone-CorsiP.
Thehistonemethyltransfe-raseMLL1permitstheoscillationofcircadiangeneex-pression.
NatStructMolBiol,2010,17(12):1414–1421.
[DOI][108]KimDH,RheeJC,YeoS,ShenRK,LeeSK,LeeJW,LeeS.
Crucialrolesofmixed-lineageleukemia3and4asepigeneticswitchesofthehepaticcircadianclockcontrollingbileacidhomeostasisinmice.
Hepatology,2015,61(3):1012–1023.
[DOI][109]DiTacchioL,LeHD,VollmersC,HatoriM,WitcherM,SecombeJ,PandaS.
HistonelysinedemethylaseJARID1aactivatesCLOCK-BMAL1andinfluencesthecircadianclock.
Science,2011,333(6051):1881–1885.
[DOI][110]NamHJ,BooK,KimD,HanDH,ChoeHK,KimCR,SunW,KimH,KimK,LeeH,MetzgerE,SchueleR,YooSH,TakahashiJS,ChoS,SonGH,BaekSH.
PhosphorylationofLSD1byPKCαiscrucialforcirca-dianrhythmicityandphaseresetting.
MolCell,2014,53(5):791–805.
[DOI][111]TamayoAG,DuongHA,RoblesMS,MannM,WeitzCJ.
HistonemonoubiquitinationbyClock-BMAL1complexmarksPer1andPer2genesforcircadianfeedback.
NatStructMolBiol,2015,22(10):759–766.
[DOI][112]KimJY,KwakPB,WeitzCJ.
SpecificityincircadianclockfeedbackfromtargetedreconstitutionoftheNuRDcorepressor.
MolCell,2014,56(6):738–748.
[DOI][113]EtchegarayJP,YangXM,DeBruyneJP,PetersAHFM,WeaverDR,JenuweinT,ReppertSM.
ThepolycombgroupproteinEZH2isrequiredformammaliancirca-dianclockfunction.
JBiolChem,2006,281(30):21209–21215.
[DOI][114]NguyenKD,FentressSJ,QiuYF,YunKR,CoxJS,ChawlaA.
CircadiangeneBmal1regulatesdiurnalos-cillationsofLy6Chiinflammatorymonocytes.
Science,2013,341(6153):1483–1488.
[DOI][115]BannisterAJ,ZegermanP,PartridgeJF,MiskaEA,ThomasJO,AllshireRC,KouzaridesT.
Selectiverec-ognitionofmethylatedlysine9onhistoneH3bytheHP1chromodomain.
Nature,2001,410(6824):120–124.
[DOI][116]LachnerM,O'CarrollD,ReaS,MechtlerK,JenuweinT.
MethylationofhistoneH3lysine9createsabindingsiteforHP1proteins.
Nature,2001,410(6824):116–120.
[DOI][117]MaekawaF,ShimbaS,TakumiS,SanoT,SuzukiT,BaoJH,OhwadaM,EharaT,OgawaY,NoharaK.
DiurnalexpressionofDnmt3bmRNAinmouseliverisregu-latedbyfeedingandhepaticclockwork.
Epigenetics,2012,7(9):1046–1056.
[DOI][118]XiaL,MaSH,ZhangY,WangT,ZhouMY,WangZQ,ZhangJF.
DailyvariationinglobalandlocalDNAme-thylationinmouselivers.
PLoSOne,2015,10(2):e0118101.
[DOI][119]HuSH,WanJ,SuYJ,SongQF,ZengYX,NguyenHN,ShinJ,CoxE,RhoHS,WoodardC,XiaSL,LiuS,LyuHB,MingGL,WadeH,SongHJ,QianJ,ZhuH.
DNAmethylationpresentsdistinctbindingsitesforhumantranscriptionfactors.
eLife,2013,2:e00726.
[DOI][120]NakajimaM,ImaiK,ItoH,NishiwakiT,MurayamaY,IwasakiH,OyamaT,KondoT.
Reconstitutionofcirca-dianoscillationofcyanobacterialKaiCphosphorylationinvitro.
Science,2005,308(5720):414–415.
[DOI](责任编委:何群)
chinagene.
cn特邀综述收稿日期:20171027;修回日期:20171116基金项目:国家自然科学基金项目(编号:31571208),安徽省自然科学基金项目(编号:1608085MH212)和安徽大学大学生科研训练计划项目(编号:J10118520418)资助[SupportedbytheNationalNaturalScienceFoundationofChina(No.
31571208),theNaturalScienceFoundationofAnhuiProvince(No.
1608085MH212),andAnhuiUniversityUndergraduateStudentTrainingGrant(No.
J10118520418)]作者简介:岳敏,本科,专业方向:生物科学.
E-mail:yuemin_ahu@163.
com通讯作者:秦曦明,博士,教授,博士生导师,研究方向:生物钟分子组分的功能及其相互作用参与生物钟调控的分子机制.
E-mail:qin.
ximing@ahu.
edu.
cnDOI:10.
16288/j.
yczz.
17-350网络出版时间:2017/11/1619:01:54URI:http://kns.
cnki.
net/kcms/detail/11.
1913.
R.
20171116.
1901.
003.
html秦曦明教授,2010年从美国Vanderbilt大学获得博士学位,现任职于安徽大学健康科学研究院.
课题组主要研究方向是生物钟(近日节律)的分子与结构基础、生物钟组分的功能和生物钟调节健康的靶点分子的研究.
曾经利用蓝绿细菌作为模式生物,阐述核心振荡器和次级振荡器之间的联系与相互作用,并提出真核生物可能存在不依赖转录翻译环路的核心分子振荡器的假设.
通过研究生物钟蛋白分子的相互作用,解析生物钟如何维持稳定的相关机制.
相关的研究成果发表在Nature、ProcNatlAcadSciUSA、PLoSBiology、CurrentBiology、JBiolRhythms等学术期刊上.
目前主持国家自然科学基金面上项目与安徽省自然科学基金项目.
哺乳动物生物钟的遗传和表观遗传研究进展岳敏1,2,杨禹1,郭改丽1,秦曦明11.
安徽大学健康科学研究院,合肥230601;2.
安徽大学生命科学学院,合肥230601摘要:生物钟对生物机体的生存与环境适应具有着重要意义,其相关研究近年来受到人们的广泛关注.
生物钟的重要性质之一是内源节律的周期性,当前的研究认为这种周期性是由生物钟相关基因转录翻译的多反馈环路构成核心机制调控着近似24h的节律振荡.
哺乳动物的生物钟系统存在一个多层次的结构,包括位于视交叉上核的主时钟和外周器官和组织的子时钟.
虽然主时钟和子时钟存在的组织不同,但是参与调节生物钟的分子机制是一致的.
近年来,通过正向、反向遗传学方法和表观遗传学的研究方法,对生物钟的分子机制的解析和认知愈发深入.
本文在简单回顾生物钟基因发现历史的基础上,重点从遗传学和表观遗传学两个方面,从振荡周期的角度,对哺乳动物生物钟分子机制的研究进展进行了综述性介绍,以期为靶向调节生物钟来改善机体的稳态系统的研究提供参考,同时希望能促进时间生物学领域与更多其他领域形成交叉研究.
关键词:生物钟;近日节律;生物钟基因;转录翻译反馈环路;顺式作用元件;转录因子;表观遗传学第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1123GeneticandepigeneticregulationsofmammaliancircadianrhythmsMinYue1,2,YuYang1,GailiGuo1,XimingQin11.
InstituteofHealthSciences,AnhuiUniversity,Hefei230601,China;2.
SchoolofLifeSciences,AnhuiUniversity,Hefei230601,ChinaAbstract:Thecircadianclocksarevitaltomanyorganismsfortheirsurvivalandadaptiontothesurroundingenviron-ment.
Moreandmorepeopleareinterestedinthecircadianclockandrelatedresearches.
Oneofthekeycharacteristicsofthisendogenousclockisitsperiodicity.
Mechanismsunderlyingthemammaliancircadianrhythmswith~24hperiodicityinvolveinterlockedtranscriptionalandtranslationalfeedbackloops.
Thecircadianclocksysteminmammalsconsistsofhierarchicalstructures,withthesuprachiasmaticnucleus(SCN)asthecentralpacemakerandperipheraloscillatorsinotherorgans.
Inspiteofthecentralandperipheraloscillators,themolecularmechanismsarethesamewithintheSCNandperi-pheralorgans.
Inthepastdecades,majorachievementsareaccomplishedbyusingforwardandreversegenetics,aswellasepigeneticapproaches.
Inthisreview,werecapitulatethehistoryofhowclock-relatedgeneswereidentified,andsummarizethemainachievementsingeneticsandepigeneticstounderstandthemolecularunderpinnings.
Wehopeitcanofferbasicknowledgeforfurtherresearches,areferenceforexperimentaldesignsaimingtoadjustorganisms'homeostasisbymod-ulatingtheclock,andprovideafoundationtobuildinterdisciplinaryresearchnetworks.
Keywords:Circadianclock;circadianrhythm;clockgenes;transcriptionalandtranslationalfeedbackloop;cis-regulatingelements;transcriptionfactors;epigenetics地球生物在漫长的演化历史中,为了适应环境的周期性变化,其生理活动形成了各种不同时间尺度的生物节律,例如近年节律、季节节律、近月节律、近日节律和超日节律.
其中,产生近日节律(circadianrhythms,指其周期接近地球自转一圈所需的时间24h)的运行机制就是人们通常所说的生物钟.
生物钟是生物机体内源自主产生的一种调控系统,周期约为24h,由能够进行自我维持的振荡器组成[1].
不同物种的生物钟周期存在一定的差异,介于20~28h之间.
健康人群的内源生物钟平均周期通常会比24h多出11±16min,但在外界环境的同步化过程中每天会被调整为24h[2].
因此,生物钟的基本性质除了内源性和周期性之外,保持和外界同步也是生物钟的另一个重要特性.
生物钟的同步化(synchronization)是指外界环境对机体生物钟节律重置的过程,类似于人们对钟表的校时.
同步化不仅是指机体生物钟的周期与地球的自转周期保持一致,更重要的是,机体生物钟的时相(phase)与外界时间信号的时相间存在一个稳定的相位关系[3,4].
一个与外界时间信号保持同步的生物钟能够促进生物机体形成生存优势,提高机体适应环境的能力,这已经在蓝绿细菌和小鼠中被证实[5,6].
生物钟是被人们熟知的生物节律之一.
在过去的几十年中,从生物钟相关基因的发现、克隆,到提出精确的分子机制阐述节律振荡的发生,再到从组织水平发现外周组织拥有独立的自主振荡现象,人们在生物钟研究领域取得一系列的突破性成果[7~9].
从细菌到昆虫再到高等动物,近似于24h的周期行为被广泛发现,并通过正向遗传学操作鉴定出各个物种的生物钟基因.
在机体水平上,哺乳动物的生物钟系统是一个多层次结构,由主时钟和位于外周组织的子时钟构成,其中的主时钟位于下丘脑中的视交叉上核(suprachiasmaticnucleus,SCN).
外界环境中对哺乳动物影响最大的是光照信息,首先它通过视网膜被传递到SCN这个主时钟,经过处理和整合后,再通过激素和自主神经系统将环境信息传递到外周组织的子时钟[10].
在哺乳动物中,生物钟节律振荡被发现几乎存在于全身所有细胞和组织中,并参与优化调节组织或器官的生理活动[9,11].
哺乳动物的不同组织和器官虽然存在很大的功能差异性,但是参与调节生理活动的生物钟的分子机制却是一致的.
当前时间生物学领域普遍认同的分子机制是生物钟基因转录与翻译水平的多反馈环来产生并维持节律振荡的理论[8,12].
本文将对哺乳动1124Hereditas(Beijing)2017第39卷物生物钟产生的分子基础,从遗传学和表观遗传学两个方面展开综述性的介绍,主要内容包括重要生物钟基因的发现、转录翻译反馈环路的调控模型的确立、生物钟通路中主要的顺式作用元件、生物钟振荡节律循环中的分子相互作用及此过程中的主要表观遗传修饰等相关研究进展.
1遗传学研究发现的主要生物钟基因研究生物钟及其参与环境适应性的学科被称为时间生物学.
早在1960年,美国冷泉港定量生物学研讨会"生物钟专场",学科奠基人ColinPittendrigh和JürgenAschoff在大会做重要报告并出版论文,标志该学科的创立[13,14].
此后,人们对生物钟展开了更为大量的科学研究,研究的对象从植物、果蝇(Drosophilamelanogaster),逐渐扩展到高等动物及人类.
随着现代遗传学的建立,一批生物钟基因得到鉴定,促进了人们对生物钟振荡的理解.
早期的分子研究是在果蝇中展开,发现了许多重要的生物钟基因,这为哺乳动物的研究打下了坚实的基础.
20世纪70年代,SeymourBenzer和他的博士后RonaldKonopka通过化学诱变筛选的正向遗传学方法,得到第一个生物钟基因突变的动物——昼夜活动节律变长(29h)、变短(19h)或者节律消失的果蝇;这些突变体被命名为周期基因突变体[15].
20世纪80年代,MichaelRosbash、JeffreyHall和MichaelYoung(三人共享2017年诺贝尔生理学或医学奖)克隆得到果蝇的"周期基因"—Period,并且发现Period的转录产物呈现近似24h的节律变化[16,17].
随后的研究过程中,果蝇的另一个生物钟基因Timeless被克隆出来,并且发现其蛋白产物(TIM)和周期蛋白(PER)相互作用生成二聚体,而且会抑制Period基因的转录过程[18~20].
之后,Rosbash和Hall继续通过化学诱变筛选及相关的生物化学方法,发现了Clock基因的果蝇突变体,突变体的Period和Timeless的转录水平显著下降[21];同时也发现了Cycle基因的突变体,表现出与Clock突变体相似的表型,并且CYC蛋白(Cycle基因编码)与CLK蛋白(Clock基因编码)形成异二聚体[22].
与此同时,Young也利用了化学突变鉴定出新的生物钟表型突变的果蝇,命名为Double-time突变体;Double-time是哺乳动物酪蛋白激酶家族的同源基因,并且DOUBLETIME蛋白控制PER蛋白的稳定性[23].
综上所述,三位诺贝尔奖获得者的工作在果蝇中初步确立了由转录翻译反馈环路构成的生物钟调控的分子作用模型.
90年代中,JosephTakahashi的课题组在小鼠(Musmusculus)中应用化学诱变筛选,同样通过正向遗传学方法,发现了第一个哺乳动物的生物钟基因—'钟基因'(Clock),突变的小鼠的昼夜活动节律变长[24].
之后,其他参与调控小鼠生物钟的基因相继被发现:通过蛋白相互作用的方法筛选到Bmal1基因,其产物(BMAL1)与钟基因的蛋白产物(CLOCK)相互作用生成异二聚体[25,26];果蝇周期基因在哺乳动物中的同源基因Per1、Per2和Per3[27~31];与周期蛋白相互作用的隐花色素的基因Cry1(cryptochrome的简写)和Cry2[32,33];负责磷酸化周期蛋白(PER),及隐花色素蛋白(CRY)的酪蛋白激酶的基因Csnk1e[34];介导PER和CRY蛋白磷酸化后进入蛋白酶体降解途径的Btrc(编码E3连接酶BTRCP)和Fbxl3/Fbxl21(编码E3连接酶FBXL3/FBXL21)[35~37].
以上基因及其转录翻译产物构成生物钟的核心分子环路,同时参与调控生物钟辅助振荡环路的更多基因也被发现,例如维甲酸受体相关孤儿受体基因Ror-α、Ror-β和Rev-erb.
其中,Ror-α和Ror-β的蛋白产物(分别是ROR-A和ROR-B)参与Bmal1转录的正调节[38],而Rev-erb的蛋白产物(REV-ERB)抑制Bmal1的转录[39].
此外,表达DBP蛋白的基因不仅是一个受生物钟控制表达的基因,其蛋白产物也参与对核心生物钟基因Bmal1和Cry的转录调控,更在生物钟下游参与多种代谢酶的昼夜节律调控[40,41].
人类的基因组存在着与小鼠完全同源的生物钟基因.
2生物钟振荡的转录翻译反馈分子模型在果蝇中发现Period基因及其转录翻译产物存在24h的振荡规律后,Rosbash和他的同事们提出了一个反馈抑制环路的分子模型,用以解释生物钟振荡的产生[42].
此时的反馈抑制环路模型相对简单,仅仅包括Period的转录翻译产物对其自身的反馈抑制(图1A).
随着更多的时钟基因被发现,尤其是在哺乳动物中发现了多个果蝇时钟基因的同源基因,这一分子模型逐渐发展成为较为复杂的多重反馈环第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1125图1哺乳动物生物钟的分子模型Fig.
1ThemolecularmodelofthecircadianclockinmammalsA:原始的转录翻译反馈抑制环路,由Rosbash提出[42].
该简单模型仅仅由当时发现的Period基因及其转录翻译产物PER蛋白组成,其他的细节在当时都不清楚.
B:当前生物钟的分子模型是一个包括转录调控和转录后调控的转录翻译多反馈环路.
这个多反馈环路中的核心部分,BMAL1和CLOCK蛋白形成异二聚体,结合在启动子上游含有E-box的DNA区域,激活下游基因的转录,其中包括Per、Cry、Rev-erb、Dbp和其他的钟控基因(Ccg).
Per和Cry基因的蛋白产物PER和CRY会形成复合物,回到细胞核抑制BMAL1/CLOCK复合物的激活功能.
PER和CRY蛋白的降解受到酪蛋白激酶和E3连接酶(B-TRCP,FBXL21和FBXL3)的调控.
这个多反馈环路中的稳定环路中,Bmal1基因受到孤核受体REV-ERB的负调节和ROR的正调节.
其中,编码ROR的基因Ror的表达被DBP激活.
路构成的生物钟分子模型[43].
在机体水平上,哺乳动物的生物钟系统由几乎全身所有细胞的细胞时钟构成.
一系列的切除和移植手术的实验揭示在下丘脑中存在一个首要调节时钟(主时钟),它存在的核团正好位于视神经交叉的上部,因此被命名为视交叉上核[44,45].
不同的研究小组将金黄仓鼠(Mesocricetusauratus)的SCN去除,观察到动物活动的昼夜节律变得杂乱无章,然后将其他仓鼠的SCN移植到切除SCN的仓鼠脑中,节律又得到恢复,并且受体动物表现出的节律周期和SCN供体动物一致[46,47].
SCN对于节律性的荷尔蒙分泌和活动至关重要,是多层次结构的生物钟系统的核心指导者.
虽然生物钟基1126Hereditas(Beijing)2017第39卷因的表达存在部分的组织特异性,全身所有组织(生殖系统除外)的细胞时钟的基础分子模型是一致的.
生物钟基因组织特异性表达的范例之一便是Clock和Npas2(是Clock的同源基因),其中Clock基因的存在对于外周器官的生物钟振荡是必需的[48,49].
当前的研究表明,哺乳动物包括人类的生物钟的分子模型是一个包括转录调控和转录后调控的转录翻译多反馈环路(图1B),较之前已经更加丰富和完善.
前面提到的生物钟分子组分,Clock、Bmal1、Per1、Per2、Cry1、Cry2、Csnk1e、Ror-α、Ror-β、Rev-erbα、Fbxl3和Fbxl21等基因和它们的蛋白产物相互作用,组成多反馈环,传导信号到基因组,然后进行转录和翻译后调控,产生一个完整的近日节律周期[8].
这个分子模型的核心是转录翻译负反馈环路,由正调控元件BMAL1及CLOCK和负调控元件PER1/2及CRY1/2组成.
在细胞水平上,当一天开始的时候,Per和Cry基因的转录水平很低,然后BMAL1/CLOCK复合物激活了Per和Cry基因上游的E-box元件序列(下文有详细介绍),正向调节基因转录,在前半天这两个基因的转录水平到达峰值[50].
在细胞质中经过翻译后,PER和CRY蛋白形成同二聚体或者异二聚体,并最终迁移进入细胞核[51].
在细胞核内,PER和CRY蛋白聚合物抑制BMAL1/CLOCK复合物的激活功能,也包括Per和Cry基因自身转录的抑制[52].
由于蛋白的不稳定性和转录活动的抑制,PER和CRY的蛋白水平在下半天达到峰值,然后越来越少.
与此同时,由于负调控元件PER和CRY的减少,BMAL1/CLOCK复合物的激活功能在夜间又开始慢慢变强.
这样,在经历了大约一天的周期后,开始了一个新的转录循环.
正调控元件BMAL1及CLOCK,和负调控元件PER1/2及CRY1/2还参与对钟控基因(clockcontrolledgenes,指生物钟调控的基因)的昼夜调控,而这些钟控基因在不同的外周组织中表达有所不同[53~55].
除了这个核心的负反馈环路外,孤核受体(orphannuclearreceptor)家族成员ROR-A/B和REV-ERBα/β会形成另一个环路,调控重要的正调控元件Bmal1基因的转录.
ROR-A/B结合到Bmal1启动子区上游的ROR作用元件(RORE元件,下文有详细介绍)正向激活转录,而REV-ERBα/β则会竞争结合到同一位点抑制转录的发生[38,39].
这个环路又被称为"稳定环路",其结果是Bmal1的转录在一天中的后半天达到峰值,与Per、Cry的转录产物相反(图1).
转录后调控在生物钟基因以及钟控基因的近日节律的维持过程中发挥重要作用.
转录后修饰控制蛋白的降解,尤其是负调控元件PER和CRY蛋白的降解对于一个完整的生物钟周期是不可或缺的.
有多个转录后修饰会影响PER和CRY蛋白的稳定性,从而调节它们对BMAL1/CLOCK复合物的抑制作用.
研究最多的就是它们的磷酸化和去磷酸化过程,一方面磷酸化的过程会影响到PER和CRY蛋白的细胞定位[56,57],另一方面磷酸化会介导PER和CRY蛋白被泛素化降解途径的E3连接酶识别,进入降解途径[35,37].
研究发现,磷酸化PER和CRY蛋白的激酶包括CK1δ、CK1ε、CK2、AMPK和GSK-3β[34,58~61].
PER和CRY蛋白被泛素化后降解的过程,会加速或者减缓生物钟的运行,调节近日节律的周期.
其他的转录后修饰对于生物钟的调节也很重要,例如RNA水平的修饰调节,蛋白的糖基化,蛋白的乙酰化等[62,63].
下面将重点介绍近日节律产生过程中转录激活和抑制过程的分子机制,包括生物钟调控过程中主要的顺式作用元件,生物钟节律振荡过程中转录水平上的分子相互作用,以及节律过程中的表观遗传修饰等.
3生物钟调控网络中的顺式作用元件生物钟基因及其转录翻译产物组成的多反馈环,是哺乳动物生物钟分子调控的基础.
因此在转录过程中,不可或缺地会发生对启动子区域的DNA顺式作用元件的调节.
已有的研究表明,DNA顺式作用元件,如E-box、RORE、D-box等,在生物钟的网络调控和对下游钟控基因的调节过程具有着重要的调控功能(图2).
3.
1E-box元件自从1985年在免疫球蛋白的重链基因的启动子区域,E-box作为一个调控元件被发现后,人们发现它能够广泛地参与大量基因的表达调控[64].
这些基因有的几乎没有什么关联,如肌动蛋白基因(Actin)、鸟氨酸脱羧酶基因(Odc1)、前胸腺素基因第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1127图2生物钟调控网络中的顺式作用元件Fig.
2Cis-regulatingmotifsthatbindclocktranscriptionfactorsA:E-box元件,包含一段由具有bHLH(碱性螺旋环螺旋)结构域的转录因子所识别的核心序列:CANNTG,能被生物钟节律振荡中的正调节因子BMAL1、CLOCK和NPAS2蛋白特异性结合.
B:RORE元件,是由一段(G/A)GGTCA核心序列加上一段AT富集的前导序列构成,能被转录激活因子ROR、转录抑制因子REV-ERBα和REV-ERBβ特异性结合.
C:D-box元件,是两段GTAA(C/T)一个正向和一个反向组成的9~10个碱基的回文序列,在特定的相位被DBP、E4BP4、HLF和TEF等富含脯氨酸和酸性氨基酸的碱性亮氨酸(PAR-bZIP)转录因子家族的蛋白特异性结合.
(Ptma)、赖氨加压素基因(Avp)、生长因子-β基因(Tgfb)、乳腺癌基因2(Brca2)、细胞周期蛋白B1基因(Ccnb1)、血型糖蛋白-B基因(Gypb)以及肌球蛋白基因(Myo)等[65].
E-box作用元件包含了一段由具有bHLH(碱性螺旋环螺旋)结构域的转录因子所识别的核心序列CANNTG.
E-box依赖的调控途径具有复杂的多样性,人们根据已有的E-box对可能具有的反式作用因子展开了大量研究.
毫无意外,研究人员发现了大量可以识别E-box的转录调控因子,而这些转录调控因子均通过bHLH结构域与启动子或者其他蛋白相互作用.
以其中的一小部分举例,这些结合E-box的转录因子包括MYC、ARNT、MAX、MYOD、MAD、USF、TFE3、TAL1等,以及生物钟节律振荡中的正调节因子BMAL1、CLOCK和NPAS2[65].
研究发现,E-box侧翼的各种序列通过改变DNA的构象能够使E-box特异性去识别哺乳动物蛋白质组中含有bHLH结构域的不同蛋白[66].
在果蝇中发现了周期基因Period后,人们在对Period的研究分析过程中,很快发现了E-box顺式元件参与生物钟基因的转录调控[67].
之后,在哺乳动物中的研究进一步证实E-box与生物钟的调控存在紧密的关联[68].
作为参与生物钟调控的E-box元件,其具有的一个最重要的特征即是能够特异性招募BMAL1/CLOCK复合物.
更为重要的是,人们发现如果两个E-box在间隔6~7个碱基重复出现的情况下,BMAL1/CLOCK复合物对这部分的E-box具有更强的亲和力,并且由于这种协同作用,可以使BMAL1/CLOCK复合物更容易招募到其他转录元件[69].
经过比较Rev-erbα基因座上转录因子BMAL1的结合数量和RNA的表达量,发现并不是所有的E-box元件都结合了BMAL1,这表明BMAL1对增强子的结合可能受到一些表观遗传修饰或者其他转录因子的影响.
其他的研究发现BMAL1/CLOCK复合物结合的靶基因的生物钟表达存在不同的相位[70],更加表明在对E-box的结合的调控过程中存在表观遗传机制参与的高阶调控,或者其他的转录因子,例如MYC、ARNT、MAX等参与这个过程[71].
虽然一些含有bHLH的转录因子和BMAL1在对E-box的偏好性上有着微小的差异,但是这些转录因子还是可能会占用到BMAL1结合位点,特别是由于一些疾病导致这些bHLH蛋白表达异常时,错误结合率会有所增加[72,73].
例如,含有bHLH结构域致癌因子MYC能够通过结合E-box直接激活许多生物钟转录抑制因子的表达,包括了Rev-erbα和Rev-erbβ,从而干扰了BMAL1主导的生物钟基因转录本和生物钟蛋白的周期节律振荡和葡萄糖昼夜代谢振荡.
经染色质免疫共沉淀(chromatinimmuno-precipitation,ChIP)分析发现转录激活因子USF1与Dbp、Per1和Per2的增强子区域结合,证明USF1也可以通过结合E-box元件进行转录水平的调控.
而且通过突变Usf1启动子导致的USF1表达上调可以恢复CLOCK突变小鼠昼夜节律相关的表型的实1128Hereditas(Beijing)2017第39卷验,进一步证明USF1通过E-box参与转录调控[73].
3.
2RORE和RevDR2元件RORE元件是由一段(G/A)GGTCA核心序列加上一段AT富集的前导序列构成,最早是在参与维甲酸相关的孤核受体家族成员ROR激活调控通路中作为高特异的结合位点而被发现的[74,75].
之后,又发现了在ROR激活调控中与其结合的2个成员,它们是来自核受体超家族的REV-ERBα和REV-ERBβ[76,77].
REV-ERBα既可以单体形式结合在RORE上,也能形成同二聚体结合到具有间隔2个碱基的RORE串联序列(这个作用元件被称为DevDR2)的基因上,参与对基因的转录抑制调控.
起初,人们认为仅有REV-ERBα负调控Bmal1基因的转录[39],但是很快就发现仅有RORE存在的增强子也能够驱动荧光素酶报告基因(启动子驱动萤火虫荧光素酶报告基因,可用来检测启动子的转录状态)的生物钟振荡表达[78].
这表明,RORE作用元件不仅有转录抑制的负调节元件REV-ERBα,还存在它的正向调节元件.
很快,人们就确认已知的RORE正调节因子ROR参与对Bmal1的转录激活,而且发现Ror-α的mRNA在SCN组织中振荡表达,而Ror-γ的mRNA在肝脏组织中振荡表达[38].
不论是将Ror基因家族或是Rev-erb基因家族进行全身敲除,还是进行组织特异性敲除,都会导致各种组织中生物钟振荡的紊乱或是振荡的相位迁移.
因此,ROR蛋白和REV-ERB蛋白被证实是以昼夜振荡的方式分别与RORE元件和Rev-DR2元件结合,共同增强了核心生物钟蛋白(BMAL1、NPAS2和CRY1等)的生物钟节律性表达的稳定性.
作为核受体的家族成员,虽然ROR的天然配体仍然存在争议,但似乎固醇可以激活ROR[79].
此外,ROR似乎可以一直保持活性状态(即其不依赖配体就处于激活状态),或者其持续的活性是由于ROR一直与天然配体结合.
有研究表明,氧合甾醇是高亲和性的ROR-C激动剂[80],而7位氧合的甾醇作为ROR-A和ROR-C的反向激动剂发挥作用[79].
还有许多其他天然物质结合ROR被报道,其中包括全反式视黄酸能够以高亲和力结合ROR-B和ROR-C,但是不与ROR-A结合[81].
脂代谢产物对生物钟的影响可能是下一步的研究方向.
3.
3D-box元件D-box元件是指各种碱性亮氨酸拉链(bZIP)家族成员结合的顺式元件,是两段GTAA(C/T)一个正向和一个反向组成的9~10个碱基的回文序列.
D-box元件在特定的相位能被DBP、E4BP4、HLF和TEF等富含脯氨酸和酸性氨基酸的碱性亮氨酸(PAR-bZIP)转录因子家族的蛋白所结合.
虽然BMAL1/CLOCK通过调控Dbp、Hlf和Tef启动子区域的E-box元件,使它们的表达呈现出节律振荡,并且这3个转录激活因子具有很高的序列相似性,在功能上也存在着冗余性.
但有趣的是,对于这3个基因同时进行全身敲除既不会影响个体行为昼夜节律性的表现,也不会影响生物钟基因的表达[82].
因而推测,DBP、HLF和TEF更有可能对生物钟下游的输出基因而不是核心基因进行调控.
与DBP、HLF和TEF这3个转录激活因子相比,被REV-ERBα通过RevDR2元件调控的转录抑制因子E4BP4正好在与DBP等因子相反的相位进行表达.
被REV-ERBα抑制的基因通过D-box元件,同样成为E4BP4的靶标[83].
因此,E4BP4被认为调控了一条与DBP、HLF和TEF调控的截然不同的生物钟下游输出途径,并且它借由D-box促进了目标基因转录"开"与"关"两种状态的切换.
4转录过程中的分子间相互作用哺乳动物的生物钟基因被发现以后,人们注意到一个事实,就是正调控因子BMAL1和CLOCK的蛋白上有PAS(Per-Arnt-Sim)结构域,负调控因子PER蛋白上有同样的PAS结构域.
和果蝇中的CYC与CLK类似,BMAL1和CLOCK(或者NPAS2)的PAS结构域形成异二聚体结构,结合到钟控基因的启动子附近的E-box区启动转录[84,85].
下面将介绍一个完整的生物钟振荡过程中转录水平上的分子相互作用,包括蛋白-蛋白相互作用和转录因子顺式元件的相互作用.
BMAL1/CLOCK复合物结合到启动子附近的增强子上之后,除了CLOCK本身具有一定的组蛋白乙酰化酶功能外,BMAL1的C端柔性区负责招募第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1129转录共激活因子CBP/p300,启动转录[86].
CBP/p300不仅可以作为蛋白相互作用的支架招募包含转录聚合酶在内的转录复合物,还具有乙酰转移酶活性.
另外,BMAL1/CLOCK复合物类似于转录活动的开拓者,可以使结合的靶基因上的核小体有节律性的脱离染色质,而染色质这种有节律性的松散(开放转录)可以促进像HNF4、HNF6、CEBPA、STAT5以及REV-ERB等转录因子装载到DNA之上[87].
这种协同作用的结合方式有效增强了转录起始的速率,从而提高转录活性.
在生物钟的多反馈环通路中,ROR作为结合在RORE元件上的正向激活因子,对靶基因的调节常常是通过与其他转录激活或者转录抑制因子的竞争发挥作用.
在肝脏中,ROR-A有节律地结合在RORE上,但是肝脏中Rorα的蛋白表达量很高且几乎没有振荡变化,那么猜测ROR-A节律性地结合在DNA上是由于主要在白天表达的REV-ERB蛋白与ROR-A竞争结合RORE元件[88].
事实证明,REV-ERB在RORE上结合的相位与ROR-A相反.
当ROR结合到DNA上,会招募转录共激活因子来调节靶基因的转录表达.
在转录抑制的过程中,有报道在E-box元件附近,PER蛋白会形成分子量很大的复合物,其中包含数十个以上的蛋白,包括生物钟蛋白BMAL1、CLOCK、CRY1/2和CK1δ/ε,以及其他的转录抑制蛋白因子如PSF、SIN3和HDAC[89].
这个转录抑制复合物构成一个PER-SIN-HDAC分子轴,使组蛋白3和组蛋白4去乙酰化,从而抑制BMAL1/CLOCK复合物的转录活性.
另外,还有研究发现,PER蛋白可以与BMAL1/CLOCK复合物结合,使BMAL1脱离E-box元件区域,从而终结了BMAL1/CLOCK复合物的转录活性[90].
相对于PER蛋白的抑制效果,CRY蛋白的抑制能力更强,其中CRY1的抑制主要发生在生物钟振荡的起始期[70],而CRY2的抑制是通过和PER蛋白的协同作用而发生的.
CRY1和CBP/p300竞争结合到BMAL1的C端柔性区,从而解除BMAL1对CBP/p300的招募[86].
BMAL1的C端片断(末尾的43个氨基酸)对于结合CRY1,以及维持正常的生物钟振荡周期是必需的[91].
如果在细胞内将BMAL1的C端结构域上的L606/L607突变为丙氨酸,那么BMAL1不仅与CRY1的相互作用消失,细胞的生物钟振荡也失去了节律[86].
除了蛋白蛋白相互作用引起生物钟周期的转录抑制外,转录因子间的相互竞争也会抑制BMAL1/CLOCK复合物对E-box的结合,如转录抑制作用因子DEC1和DEC2以及转录激活因子USF1会与BMAL1/CLOCK发生竞争[92].
同样,由于存在竞争结合顺式作用元件的情况,不具有节律振荡的转录因子也会影响生物钟基因的表达,比如MYC会与BMAL1/CLOCK发生竞争[72],ARNT也会发生同样的情况[71].
因此,在许多疾病(癌症以及代谢类疾病等)个体中,生物钟功能紊乱的现象很普遍.
5转录激活/抑制过程中的表观遗传修饰在细胞中,DNA在组蛋白八聚体周围缠绕约1.
65圈形成核小体,并进一步凝缩成染色质.
转录过程中,转录复合物需要结合到DNA上,而凝缩的染色质会在空间上阻碍转录复合物的结合,但是核小体的修饰可以松散或者打开核小体的结构.
因此核小体的修饰会影响转录状态,从而调节基因的表达[93].
组蛋白H3K4(组蛋白H3上第4位的赖氨酸)的甲基化与常染色质(euchromatin)相关,如H3K4me1(H3K4发生1个甲基修饰)常位于增强子元件附近,而H3K4me3(H3K4发生3个甲基修饰)则出现在活性转录起始位点附近[94].
H3K9(组蛋白H3上第9位的赖氨酸)的甲基化促进异染色质(heterochromatin)的形成并抑制转录,而H3K9ac(H3K9发生乙酰化修饰)则是常染色质的标记及与转录状态的激活相关,并且H3K27ac是转录活跃的增强子标记.
此外,组蛋白变体H2A.
Z会出现在转录起始位点和增强子附近,从而减弱DNA与核小体的结合[95].
除组蛋白的修饰外,DNA甲基化等表观遗传学修饰,不依赖于DNA序列的改变而引起的可遗传的基因表达和细胞表型的变化.
越来越多的实验证据表明生物钟振荡过程中,基因表达与染色质的表观遗传学修饰密切相关(图3).
例如,增强子的活性标志物H3K27ac和H3K9ac,都被证实存在昼夜节律性,且与生物钟基因的表达有正相关的关系[95~97].
REV-ERBα通过将共抑制复合物NCoR和/或SMRT募集到RORE元件来抑制转录.
NCoR和/或SMRT复合物的稳定成员HDAC31130Hereditas(Beijing)2017第39卷(组蛋白去乙酰化酶)能使RORE元件附近的组蛋白节律性的脱乙酰化,从而赋予表观基因组层面上的生物钟基因调控.
E-box附近的H3K9呈现出昼夜节律的甲基化修饰,而且小鼠肝脏中H3K9的甲基化与乙酰化在相反的相位发生[89,96].
在Per1和Per2基因的启动子上最早发现了组蛋白修饰参与昼夜节律调控[98].
Per1和Per2基因启动子上的组蛋白H3K9节律性乙酰化,并且其乙酰化的节律与两个基因的转录活性是一致的[98].
图3所示,生物钟振荡的转录开始阶段,BMAL1/CLOCK复合物招募组蛋白乙酰化酶p300/CBP,使E-box附近组蛋白乙酰化,从而使得染色质松散有助于基因的转录激活过程[96,99].
有报道称CLOCK自身具有乙酰转移酶(HAT)活性,可以将组蛋白H3K9和H3K14(组蛋白H3的第14位赖氨酸)进行乙酰化修饰,且BMAL1与CLOCK的结合能增强其酶活性[100].
组蛋白的乙酰化水平由组蛋白去乙酰化酶HDAC和组蛋白乙酰转移酶HAT调节.
长寿因子(sirtuins,SIRT1)是一类参与核心生物钟的HDAC,其辅因子NAD+在许多生理系统中处于严格的昼夜节律调控下,其表达受CLOCK、BMAL1和PER2调控[101].
受到BMAL1/CLOCK调控的目的基因Nampt节律性表达,使得NAD+的水平呈现出节律振荡,使得SIRT1的活性呈现节律振荡,而SIRT1的活性增高时就会反过来抑制BMAL1/CLOCK复合物的转录激活作用[102,103].
H3K4甲基化通常与转录激活基因和增强子附近同一核小体中的赖氨酸残基的乙酰化同时发生,在生物钟的遗传机制中也不例外.
H3K4me3是活性基因启动子上的普遍标志,其水平在生物钟基因转录起始位点(transcriptionstartsites,TSSs)附近呈现节律振荡[104,105].
转移酶MLL家族的成员参与H3K4节律性的三甲基化[106~108].
其中MLL1与CLOCK转录激活域(Δ19突变体)相互作用,这对CLOCK招募到DNA上至关重要.
此外,MLL1的甲基化活性也由乙酰化和去乙酰化调控,其中去乙酰化由SIRT1节律性调控.
相关的甲基转移酶MLL3也表现出节律性振荡,同时也与H3K4em3有关,但是MLL3并不是凭借BMAL1或是CLOCK招募至DNA上[106].
CLOCK和BMAL1还与特异性组蛋白脱甲基酶JARID1A及LSD1相互作用以促进BMAL1/CLOCK招募到Per启动子上以增强其转录[109,110].
在E-box附近单泛素化的组蛋白H2B(H2Bub)的水平也出现节律振荡[111].
在转录激活的后期,DDB1-CUL4介导的H2Bub积累,通过招募PER-CRY复合体到与E-box结合的BMAL1/CLOCK来启动抑制过程[111].
目前,推测还有几种蛋白可能结合或读取H2B单泛素化的核小体,可能存在于PER-CRY抑制复合物中,但是迄今为止并没有确定.
在激活到抑制的过程中,随着PER和CRY的积累并转移到细胞核,BMAL1/CLOCK复合体与PER-CRY复合体相互作用.
由CRY和PER介导的转录抑制的主要机制是直接招募包含HDAC1和HDAC2的Sin3复合物和Mi-2-核小体重塑去乙酰化酶(NuRD)转录共抑制复合物,使附近的组蛋白脱乙酰化[112].
BMAL1/CLOCK也能够招募核心蛋白复合体2(PRC2),使目的基因的组蛋白H3K27被三甲基化后抑制该基因的表达[113,114].
在抑制过程中,由SUV3甲基转移酶介导E-box附近的H3K9二甲基化.
甲基化的H3K9(在转录激活期间,此赖氨酸被乙酰化),成为异染色质蛋白1α(HP1α)的结合位点,并在生物钟基因转录的抑制阶段介导异染色质节律性的形成[115,116].
有趣的是,在CRY-PER降解后,时钟基因仍然受到很强的抑制作用[70,88],由此可见,H3K9me和HP1可以作为钟表基因表达的表观遗传学沉默子,直到BMAL1/CLOCK重新激活并开始下一轮循环[89].
该机制还暗示了在BMAL1/CLOCK结合之前或之后H3K9活跃的昼夜节律去甲基化,但是潜在的机制仍然未知.
DNA的甲基化由DNA甲基转移酶催化,是一种被广泛研究的表观遗传修饰,在基因调控中具有复杂的作用.
在哺乳动物中,它主要发生在胞嘧啶鸟嘌呤(CpG)二核苷酸中的胞嘧啶上,在分化过程中组织特异性的基因组DNA甲基化模式对建立细胞识别方面发挥着重要的作用.
在小鼠的肝脏和脑中,DNA甲基转移酶节律性的表达[117],并且也有证据表明在LINE-1元件上呈现出昼夜节律的DNA甲基化[118].
经典的E-box元件CACGTG中心含有可被甲基化的CpG部分,并且CpG的甲基化会改变某些bHLH蛋白的结合[119],但是并不清楚E-box的甲基化是否会影响BMAL1/CLOCK的结合.
第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1131图3生物钟振荡周期中的表观遗传修饰Fig.
3Epigeneticmodificationinthecycleofcircadianclock生物钟振荡的转录激活阶段,BMAL1/CLOCK二聚体与E-box结合并招募CBP和p300,它们的组蛋白乙酰化酶活性能够使附近的组蛋白乙酰化,包括H3K9ac、H3K14ac及H3K27ac.
还有组蛋白甲基转移酶系MLL家族,能够特异性的使H3K4甲基化.
不同的是,增强子上的活性标记为H3K4me1,而启动子上的活性标记为H3K4me3,同时还有H2A.
Z突变体随着BMAL1/CLOCK与E-box的结合而替换H2A.
BMAL1和CLOCK还与特异性组蛋白脱甲基酶JARID1A及LSD1相互作用,BMAL1/CLOCK与酶相互作用介导的一系列组蛋白修饰,促使核小体松散离开DNA,从而促进转录.
在转录激活后期,DDB1-CUL4介导的H2Bub在E-box附近积累,通过招募PER-CRY复合体到与E-box结合的BMAL1/CLOCK来启动抑制过程.
BMAL1/ClOCK也能够招募核心蛋白复合体2(PRC2),使目的基因的组蛋白H3K27被三甲基化后抑制该基因的表达.
在转录抑制阶段,由CRY和PER介导的转录抑制的主要机制是直接招募包含HDAC1和HDAC2的Sin3复合物和Mi-2-核小体重塑去乙酰化酶(NuRD)转录共抑制复合物,使附近的组蛋白脱乙酰化,同时还有由SUV3甲基转移酶介导E-box附近的H3K9二甲基化,而H3K9me2为异染色质蛋白HP1α的结合位点,能促使染色质进一步凝缩成为异染色质,从而使转录沉默,直到BMAL1/CLOCK重新激活并开始下一轮循环.
1132Hereditas(Beijing)2017第39卷6结语与展望从果蝇的正向遗传学研究发现第一个高等动物生物钟开始,本文简单介绍了高等动物生物钟基因的历史发现,并主要从转录翻译的反馈环路角度综述了哺乳动物生物钟的遗传学和表观遗传学研究进展.
这些研究进展从分子水平解释了内源性的生物钟的周期性的发生.
尽管在其他的模式生物中存在一个不依赖于转录和翻译的反馈环路的基础生物钟[120],但转录翻译反馈环路仍然构成了高等生物的生物钟基础.
在过去的几十年中,从正向遗传学的表型鉴定到反向遗传学对分子组分研究的深入发展,为深刻理解生物钟提供了大量的实验数据和理论.
近年来,一系列的研究发现表明生物钟紊乱会招致严重的健康后果,包括心血管疾病、肥胖、精神类疾病.
生物钟几乎存在所有的物种内,能帮助这些物种有效地预测环境,适应环境.
果蝇生物钟基因的克隆与分子机制获得2017诺贝尔生理学及医学奖之后,将会有更多的科研工作者关注和深入生物钟系统的研究,尤其是生物钟及其调控的周期节律紊乱与人类健康相关课题的研究将会是热点科学问题.
因此,从分子生物钟、遗传学、及表观遗传学多个层次解释生物钟的作用机理,将会为人们彻底理解生物钟与其他生物学领域的相关性打下扎实基础,并推动时间生物学和其他学科的交叉研究.
参考文献(References):[1]DunlapJC,LorosJJ,DeCourseyPJ.
Chronobiology:BiologicalTimekeeping.
Sunderland:SinauerAsso-ciates,Inc.
Publishers,2004.
[DOI][2]CzeislerCA,DuffyJF,ShanahanTL,BrownEN,Mit-chellJF,RimmerDW,RondaJM,SilvaEJ,AllanJS,EmensJS,DijkDJ,KronauerRE.
Stability,precision,andnear-24-hourperiodofthehumancircadianpace-maker.
Science,1999,284(5423):2177–2181.
[DOI][3]DuffyJF,WrightKPJr.
Entrainmentofthehumancir-cadiansystembylight.
JBiolRhythms,2005,20(4):326–338.
[DOI][4]QinXM,GuoJH.
Synchronizationofthemammaliancentralandperipheralcircadianclocks.
ChinSciBull,2017,62(25):2849–2856.
秦曦明,郭金虎.
哺乳动物生物钟同步化的研究进展.
科学通报,2017,62(25):2849–2856.
[DOI][5]OuyangY,AnderssonCR,KondoT,GoldenSS,John-sonCH.
Resonatingcircadianclocksenhancefitnessincyanobacteria.
ProcNatlAcadSciUSA,1998,95(15):8660–8664.
[DOI][6]SpoelstraK,WikelskiM,DaanS,LoudonASI,HauM.
Naturalselectionagainstacircadianclockgenemuta-tioninmice.
ProcNatlAcadSciUSA,2016,113(3):686–691.
[DOI][7]TakahashiJS.
Molecularcomponentsofthecircadianclockinmammals.
DiabetesObesMetab,2015,17Suppl1:6–11.
[DOI][8]TakahashiJS.
Transcriptionalarchitectureofthemam-maliancircadianclock.
NatRevGenet,2017,18(3):164–179.
[DOI][9]SchiblerU,GoticI,SainiC,GosP,CurieT,Emme-neggerY,SinturelF,GosselinP,GerberA,Fleury-OlelaF,RandoG,DemarqueM,FrankenP.
Clock-Talk:Inte-ractionsbetweencentralandperipheralcircadianoscil-latorsinmammals.
ColdSpringHarbSympQuantBiol,2015,80:223–232.
[DOI][10]BuijsRM,HermesMHLJ,KalsbeekA.
Thesupra-chiasmaticnucleus—paraventricularnucleusinterac-tions:abridgetotheneuroendocrineandautonomicnervoussystem.
ProgBrainRes,1998,119:365–382.
[DOI][11]BalsalobreA,DamiolaF,SchiblerU.
Aserumshockinducescircadiangeneexpressioninmammaliantissueculturecells.
Cell,1998,93(6):929–937.
[DOI][12]AnY,XuY.
Themechanismofmammaliancircadianrhythms.
ChinBullLifeSci,2015,27(11):1372–1379.
安扬,徐璎.
哺乳动物昼夜节律机制研究进展.
生命科学,2015,27(11):1372–1379.
[DOI][13]PittendrighCS.
Circadianrhythmsandthecircadianorganizationoflivingsystems.
ColdSpringHarbSympQuantBiol,1960,25:159–184.
[DOI][14]AschoffJ.
Exogenousandendogenouscomponentsincircadianrhythms.
ColdSpringHarbSympQuantBiol,1960,25:11–28.
[DOI][15]KonopkaRJ,BenzerS.
ClockmutantsofDrosophilamelanogaster.
ProcNatlAcadSciUSA,1971,68(9):2112–2116.
[DOI][16]ReddyP,ZehringWA,WheelerDA,PirrottaV,HadfieldC,HallJC,RosbashM.
Molecularanalysisofthepe-riodlocusinDrosophilamelanogasterandidentificationofatranscriptinvolvedinbiologicalrhythms.
Cell,1984,38(3):701–710.
[DOI]第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1133[17]BargielloTA,JacksonFR,YoungMW.
RestorationofcircadianbehaviouralrhythmsbygenetransferinDro-sophila.
Nature,1984,312(5996):752–754.
[DOI][18]SehgalA,PriceJL,ManB,YoungMW.
Lossofcirca-dianbehavioralrhythmsandperRNAoscillationsintheDrosophilamutanttimeless.
Science,1994,263(5153):1603–1606.
[DOI][19]MyersMP,Wager-SmithK,WesleyCS,YoungMW,SehgalA.
PositionalcloningandsequenceanalysisoftheDrosophilaclockgene,timeless.
Science,1995,270(5237):805–808.
[DOI][20]GekakisN,SaezL,Delahaye-BrownAM,MyersMP,SehgalA,YoungMW,WeitzCJ.
IsolationoftimelessbyPERproteininteraction:defectiveinteractionbetweentimelessproteinandlong-periodmutantPERL.
Science,1995,270(5237):811–815.
[DOI][21]AlladaR,WhiteNE,SoWV,HallJC,RosbashM.
AmutantDrosophilahomologofmammalianClockdis-ruptscircadianrhythmsandtranscriptionofperiodandtimeless.
Cell,1998,93(5):791–804.
[DOI][22]RutilaJE,SuriV,LeM,SoWV,RosbashM,HallJC.
CYCLEisasecondbHLH-PASclockproteinessentialforcircadianrhythmicityandtranscriptionofDroso-philaperiodandtimeless.
Cell,1998,93(5):805–814.
[DOI][23]PriceJL,BlauJ,RothenfluhA,AbodeelyM,KlossB,YoungMW.
double-timeisanovelDrosophilaclockgenethatregulatesPERIODproteinaccumulation.
Cell,1998,94(1):83–95.
[DOI][24]VitaternaMH,KingDP,ChangAM,KornhauserJM,LowreyPL,McDonaldJD,DoveWF,PintoLH,TurekFW,TakahashiJS.
Mutagenesisandmappingofamousegene,Clock,essentialforcircadianbehavior.
Science,1994,264(5159):719–725.
[DOI][25]GekakisN,StaknisD,NguyenHB,DavisFC,Wils-bacherLD,KingDP,TakahashiJS,WeitzCJ.
RoleoftheCLOCKproteininthemammaliancircadianme-chanism.
Science,1998,280(5369):1564–1569.
[DOI][26]BungerMK,WilsbacherLD,MoranSM,ClendeninC,RadcliffeLA,HogeneschJB,SimonMC,TakahashiJS,BradfieldCA.
Mop3isanessentialcomponentofthemastercircadianpacemakerinmammals.
Cell,2000,103(7):1009–1017.
[DOI][27]TeiH,OkamuraH,ShigeyoshiY,FukuharaC,OzawaR,HiroseM,SakakiY.
Circadianoscillationofamamma-lianhomologueoftheDrosophilaperiodgene.
Nature,1997,389(6650):512–516.
[DOI][28]SunZS,AlbrechtU,ZhuchenkoO,BaileyJ,EicheleG,LeeCC.
RIGUI,aputativemammalianorthologoftheDrosophilaperiodgene.
Cell,1997,90(6):1003–1011.
[DOI][29]AlbrechtU,SunZS,EicheleG,LeeCC.
Adifferentialresponseoftwoputativemammaliancircadianregulators,mper1andmper2,tolight.
Cell,1997,91(7):1055–1064.
[DOI][30]ShearmanLP,ZylkaMJ,WeaverDR,KolakowskiLFJr,ReppertSM.
Twoperiodhomologs:circadianexpres-sionandphoticregulationinthesuprachiasmaticnuclei.
Neuron,1997,19(6):1261–1269.
[DOI][31]TakumiT,TaguchiK,MiyakeS,SakakidaY,TakashimaN,MatsubaraC,MaebayashiY,OkumuraK,TakekidaS,YamamotoS,YagitaK,YanL,YoungMW,OkamuraH.
Alight-independentoscillatorygenemPer3inmouseSCNandOVLT.
EMBOJ,1998,17(16):4753–4759.
[DOI][32]vanderHorstGT,MuijtjensM,KobayashiK,TakanoR,KannoS,TakaoM,deWitJ,VerkerkA,EkerAP,vanLeenenD,BuijsR,BootsmaD,HoeijmakersJH,YasuiA.
MammalianCry1andCry2areessentialformain-tenanceofcircadianrhythms.
Nature,1999,398(6728):627–630.
[DOI][33]VitaternaMH,SelbyCP,TodoT,NiwaH,ThompsonC,FruechteEM,HitomiK,ThresherRJ,IshikawaT,MiyazakiJ,TakahashiJS,SancarA.
Differentialregu-lationofmammalianperiodgenesandcircadianrhyth-micitybycryptochromes1and2.
ProcNatlAcadSciUSA,1999,96(21):12114–12119.
[DOI][34]LowreyPL,ShimomuraK,AntochMP,YamazakiS,ZemenidesPD,RalphMR,MenakerM,TakahashiJS.
Positionalsynteniccloningandfunctionalcharacteriza-tionofthemammaliancircadianmutationtau.
Science,2000,288(5465):483–491.
[DOI][35]SiepkaSM,YooSH,ParkJ,SongWM,KumarV,HuYN,LeeC,TakahashiJS.
CircadianmutantOvertimerevealsF-boxproteinFBXL3regulationofCryptoch-romeandPeriodgeneexpression.
Cell,2007,129(5):1011–1023.
[DOI][36]HiranoA,YumimotoK,TsunematsuR,MatsumotoM,OyamaM,Kozuka-HataH,NakagawaT,Lanjakornsi-ripanD,NakayamaKI,FukadaY.
FBXL21regulatesoscillationofthecircadianclockthroughubiquitinationandstabilizationofcryptochromes.
Cell,2013,152(5):1106–1118.
[DOI][37]ShiroganeT,JinJP,AngXL,HarperJW.
SCFβ-TRCP1134Hereditas(Beijing)2017第39卷controlsclock-dependenttranscriptionviacaseinkinase1-dependentdegradationofthemammalianperiod-1(Per1)proteinm.
JBiolChem,2005,280(29):26863–26872.
[DOI][38]SatoTK,PandaS,MiragliaLJ,ReyesTM,RudicRD,McNamaraP,NaikKA,FitzGeraldGA,KaySA,Ho-geneschJB.
AfunctionalgenomicsstrategyrevealsRoraasacomponentofthemammaliancircadianclock.
Neu-ron,2004,43(4):527–537.
[DOI][39]PreitnerN,DamiolaF,Lopez-MolinaL,ZakanyJ,Du-bouleD,AlbrechtU,SchiblerU.
TheorphannuclearreceptorREV-ERBαcontrolscircadiantranscriptionwithinthepositivelimbofthemammaliancircadianoscillator.
Cell,2002,110(2):251–260.
[DOI][40]YamaguchiS,MitsuiS,YanL,YagitaK,MiyakeS,OkamuraH.
RoleofDBPinthecircadianoscillatorymechanism.
MolCellBiol,2000,20(13):4773–4781.
[DOI][41]OishiK,MiyazakiK,KadotaK,KikunoR,NagaseT,AtsumiGI,OhkuraN,AzamaT,MesakiM,YukimasaS,KobayashiH,IitakaC,UmeharaT,HorikoshiM,KudoT,ShimizuY,YanoM,MondenM,MachidaK,MatsudaJ,HorieS,TodoT,IshidaN.
Genome-wideexpressionanalysisofmouseliverrevealsCLOCK-regulatedcir-cadianoutputgenes.
JBiolChem,2003,278(42):41519–41527.
[DOI][42]HardinPE,HallJC,RosbashM.
FeedbackoftheDro-sophilaperiodgeneproductoncircadiancyclingofitsmessengerRNAlevels.
Nature,1990,343(6258):536–540.
[DOI][43]PandaS,AntochMP,MillerBH,SuAI,SchookAB,StraumeM,SchultzPG,KaySA,TakahashiJS,Hoge-neschJB.
Coordinatedtranscriptionofkeypathwaysinthemousebythecircadianclock.
Cell,2002,109(3):307–320.
[DOI][44]MoskoSS,MooreRY.
Neonatalsuprachiasmaticnuc-leuslesions:effectsonthedevelopmentofcircadianrhythmsintherat.
BrainRes,1979,164(1–2):17–38.
[DOI][45]KafkaMS,MarangosPJ,MooreRY.
Suprachiasmaticnucleusablationabolishescircadianrhythmsinratbrainneurotransmitterreceptors.
BrainRes,1985,327(1–2):344–347.
[DOI][46]RalphMR,FosterRG,DavisFC,MenakerM.
Trans-plantedsuprachiasmaticnucleusdeterminescircadianperiod.
Science,1990,247(4945):975–978.
[DOI][47]SujinoM,MasumotoKH,YamaguchiS,VanDerHorstGTJ,OkamuraH,InouyeSIT.
Suprachiasmaticnucleusgraftsrestorecircadianbehavioralrhythmsofgeneti-callyarrhythmicmice.
CurrBiol,2003,13(8):664–668.
[DOI][48]DeBruyneJP,WeaverDR,ReppertSM.
CLOCKandNPAS2haveoverlappingrolesinthesuprachiasmaticcircadianclock.
NatNeurosci,2007,10(5):543–545.
[DOI][49]DeBruyneJP,WeaverDR,ReppertSM.
Peripheralcir-cadianoscillatorsrequireCLOCK.
CurrBiol,2007,17(14):R538–R539.
[DOI][50]KondratovRV,ChernovMV,KondratovaAA,Gorba-chevaVY,GudkovAV,AntochMP.
BMAL1-dependentcircadianoscillationofnuclearCLOCK:posttransla-tionaleventsinducedbydimerizationoftranscriptionalactivatorsofthemammalianclocksystem.
GenesDev,2003,17(15):1921–1932.
[DOI][51]LeeC,EtchegarayJP,CagampangFRA,LoudonASI,ReppertSM.
Posttranslationalmechanismsregulatethemammaliancircadianclock.
Cell,2001,107(7):855–867.
[DOI][52]ShearmanLP,SriramS,WeaverDR,MaywoodES,ChavesI,ZhengBH,KumeK,LeeCC,VanDerHorstGTJ,HastingsMH,ReppertSM.
Interactingmolecularloopsinthemammaliancircadianclock.
Science,2000,288(5468):1013–1019.
[DOI][53]MarchevaB,RamseyKM,BuhrED,KobayashiY,SuH,KoCH,IvanovaG,OmuraC,MoS,VitaternaMH,Lo-pezJP,PhilipsonLH,BradfieldCA,CrosbySD,JeBai-leyL,WangXZ,TakahashiJS,BassJ.
DisruptionoftheclockcomponentsCLOCKandBMAL1leadstohy-poinsulinaemiaanddiabetes.
Nature,2010,466(7306):627–631.
[DOI][54]JanichP,PascualG,Merlos-SuárezA,BatlleE,Rip-pergerJ,AlbrechtU,ChengHYM,ObrietanK,DiCroceL,BenitahSA.
Thecircadianmolecularclockcreatesepidermalstemcellheterogeneity.
Nature,2011,480(7376):209–214.
[DOI][55]NamD,YechoorVK,MaK.
Molecularclockintegra-tionofbrownadiposetissueformationandfunction.
Adipocyte,2015,5(2):243–250.
[DOI][56]VielhaberE,EideE,RiversA,GaoZH,VirshupDM.
NuclearentryofthecircadianregulatormPER1iscon-trolledbymammaliancaseinkinaseI.
MolCellBiol,2000,20(13):4888–4899.
[DOI][57]YagitaK,TamaniniF,YasudaM,HoeijmakersJHJ,VanDerHorstGTJ,OkamuraH.
Nucleocytoplasmicshut-tlingandmCRY-dependentinhibitionofubiquitylation第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1135ofthemPER2clockprotein.
EMBOJ,2002,21(6):1301–1314.
[DOI][58]YangY,XuTT,ZhangYF,QinXM.
MolecularbasisfortheregulationofthecircadianclockkinasesCK1δandCK1ε.
CellSignal,2017,31:58–65.
[DOI][59]TamaruT,HirayamaJ,IsojimaY,NagaiK,NoriokaS,TakamatsuK,Sassone-CorsiP.
CK2αphosphorylatesBMAL1toregulatethemammalianclock.
NatStructMolBiol,2009,16(4):446–448.
[DOI][60]LamiaKA,SachdevaUM,DiTacchioL,WilliamsEC,AlvarezJG,EganDF,VasquezDS,JuguilonH,PandaS,ShawRJ,ThompsonCB,EvansRM.
AMPKregulatesthecircadianclockbycryptochromephosphorylationanddegradation.
Science,2009,326(5951):437–440.
[DOI][61]SaharS,ZocchiL,KinoshitaC,BorrelliE,Sas-sone-CorsiP.
RegulationofBMAL1proteinstabilityandcircadianfunctionbyGSK3β-mediatedphosphory-lation.
PLoSOne,2010,5(1):e8561.
[DOI][62]YuB,WuT,NiYH,ZhouJL,ZhugeF,SunL,FuZW.
Posttranscriptionalandposttranslationalregulationofcircadianclock.
ChinBullLifeSci,2011,23(5):470–476.
俞波,吴涛,倪银华,周静露,诸葛芬,孙璐,傅正伟.
生物钟的转录后与翻译后水平调控进展.
生命科学,2011,23(5):470–476.
[DOI][63]KimEY,JeongEH,ParkS,JeongHJ,EderyI,ChoJW.
AroleforO-GlcNAcylationinsettingcircadianclockspeed.
GenesDev,2012,26(5):490–502.
[DOI][64]ChurchGM,EphrussiA,GilbertW,TonegawaS.
Cell-type-specificcontactstoimmunoglobulinenhanc-ersinnuclei.
Nature,1985,313(6005):798–801.
[DOI][65]MuozE,BrewerM,BalerR.
CircadiantranscriptionthinkingoutsidetheE-Box.
JBiolChem,2002,277(39):36009–36017.
[DOI][66]GordnR,ShenN,DrorI,ZhouTY,HortonJ,RohsR,BulykML.
GenomicregionsflankingE-boxbindingsitesinfluenceDNAbindingspecificityofbHLHtran-scriptionfactorsthroughDNAshape.
CellRep,2013,3(4):1093–1104.
[DOI][67]HaoH,AllenDL,HardinPE.
Acircadianenhancerme-diatesPER-dependentmRNAcyclinginDrosophilamelanogaster.
MolCellBiol,1997,17(7):3687–3693.
[DOI][68]HogeneschJB,GuYZ,JainS,BradfieldCA.
Theba-sic-helix–loop–helix-PASorphanMOP3formstran-scriptionallyactivecomplexeswithcircadianandhy-poxiafactors.
ProcNatlAcadSciUSA,1998,95(10):5474–5479.
[DOI][69]ReyG,CesbronF,RougemontJ,ReinkeH,BrunnerM,NaefF.
Genome-wideandphase-specificDNA-bindingrhythmsofBMAL1controlcircadianoutputfunctionsinmouseliver.
PLoSBiol,2011,9(2):e1000595.
[DOI][70]KoikeN,YooSH,HuangHC,KumarV,LeeC,KimTK,TakahashiJS.
Transcriptionalarchitectureandchroma-tinlandscapeofthecorecircadianclockinmammals.
Science,2012,338(6105):349–354.
[DOI][71]WuYL,TangDB,LiuN,XiongW,HuangHW,LiY,MaZX,ZhaoHJ,ChenPH,QiXB,ZhangEE.
Reci-procalregulationbetweenthecircadianclockandhy-poxiasignalingatthegenomelevelinmammals.
CellMetab,2017,25(1):73–85.
[DOI][72]AltmanBJ,HsiehAL,SenguptaA,KrishnanaiahSY,StineZE,WaltonZE,GouwAM,VenkataramanA,LiB,Goraksha-HicksP,DiskinSJ,BellovinDI,SimonMC,RathmellJC,LazarMA,MarisJM,FelsherDW,Hoge-neschJB,WeljieAM,DangCV.
MYCdisruptsthecir-cadianclockandmetabolismincancercells.
CellMetab,2015,22(6):1009–1019.
[DOI][73]ShimomuraK,KumarV,KoikeN,KimTK,ChongJ,BuhrED,WhiteleyAR,LowSS,OmuraC,FennerD,OwensJR,RichardsM,YooSH,HongHK,VitaternaMH,BassJ,PletcherMT,WiltshireT,HogeneschJ,LowreyPL,TakahashiJS.
Usf1,asuppressorofthecircadianClockmutant,revealsthenatureoftheDNA-bindingoftheCLOCK:BMAL1complexinmice.
eLife,2013,2:e00426.
[DOI][74]GiguèreV,TiniM,FlockG,OngE,EvansRM,Otula-kowskiG.
Isoform-specificamino-terminaldomainsdictateDNA-bindingpropertiesofRORα,anovelfam-ilyoforphanhormonenuclearreceptors.
GenesDev,1994,8(5):538–553.
[DOI][75]GiguèreV,McBroomLD,FlockG.
DeterminantsoftargetgenespecificityforRORα1:monomericDNAbindingbyanorphannuclearreceptor.
MolCellBiol,1995,15(5):2517–2526.
[DOI][76]HardingHP,LazarMA.
TheorphanreceptorRev-ErbAαactivatestranscriptionviaanovelresponseelement.
MolCellBiol,1993,13(5):3113–3121.
[DOI][77]BaesM,GulickT,ChoiHS,MartinoliMG,SimhaD,MooreDD.
Aneworphanmemberofthenuclearhor-monereceptorsuperfamilythatinteractswithasubsetofretinoicacidresponseelements.
MolCellBiol,1994,14(3):1544–1552.
[DOI][78]UedaHR,ChenWB,AdachiA,WakamatsuH,Hayashi1136Hereditas(Beijing)2017第39卷S,TakasugiT,NaganoM,NakahamaK,SuzukiY,Su-ganoS,IinoM,ShigeyoshiY,HashimotoS.
Atran-scriptionfactorresponseelementforgeneexpressionduringcircadiannight.
Nature,2002,418(6897):534–539.
[DOI][79]SoltLA,BurrisTP.
ActionofRORsandtheirligandsin(patho)physiology.
TrendsEndocrinolMetab,2012,23(12):619–627.
[DOI][80]ZhangY,LuoXY,WuDH,XuY.
RORnuclearrecep-tors:structures,relateddiseases,anddrugdiscovery.
ActaPharmacolSin,2015,36(1):71–87.
[DOI][81]Stehlin-GaonC,WillmannD,ZeyerD,SanglierS,VanDorsselaerA,RenaudJP,MorasD,SchüleR.
All-transretinoicacidisaligandfortheorphannuclearreceptorRORβ.
NatStructBiol,2003,10(10):820–825.
[DOI][82]GachonF.
PhysiologicalfunctionofPARbZipcircadianclock-controlledtranscriptionfactors.
AnnMed,2007,39(8):562–571.
[DOI][83]FangB,EverettLJ,JagerJ,BriggsE,ArmourSM,FengD,RoyA,Gerhart-HinesZ,SunZ,LazarMA.
Circa-dianenhancerscoordinatemultiplephasesofrhythmicgenetranscriptioninvivo.
Cell,2014,159(5):1140–1152.
[DOI][84]HuangZJ,EderyI,RosbashM.
PASisadimerizationdomaincommontoDrosophilaperiodandseveraltran-scriptionfactors.
Nature,1993,364(6434):259–262.
[DOI][85]HuangN,ChelliahY,ShanYL,TaylorCA,YooSH,PartchC,GreenCB,ZhangH,TakahashiJS.
CrystalstructureoftheheterodimericCLOCK:BMAL1tran-scriptionalactivatorcomplex.
Science,2012,337(6091):189–194.
[DOI][86]XuHY,GustafsonCL,SammonsPJ,KhanSK,ParsleyNC,RamanathanC,LeeHW,LiuAC,PartchCL.
Cryptochrome1regulatesthecircadianclockthroughdynamicinteractionswiththeBMAL1Cterminus.
NatStructMolBiol,2015,22(6):476–484.
[DOI][87]MenetJS,PescatoreS,RosbashM.
CLOCK:BMAL1isapioneer-liketranscriptionfactor.
GenesDev,2014,28(1):8–13.
[DOI][88]ZhangYX,FangB,EmmettMJ,DamleM,SunZ,FengD,ArmourSM,RemsbergJR,JagerJ,SoccioRE,StegerDJ,LazarMA.
Discretefunctionsofnuclearre-ceptorRev-erbαcouplemetabolismtotheclock.
Science,2015,348(6242):1488–1492.
[DOI][89]DuongHA,WeitzCJ.
Temporalorchestrationofrepres-sivechromatinmodifiersbycircadianclockPeriodcomplexes.
NatStructMolBiol,2014,21(2):126–132.
[DOI][90]YeR,SelbyCP,OzturkN,AnnayevY,SancarA.
Bio-chemicalanalysisofthecanonicalmodelforthemam-maliancircadianclock.
JBiolChem,2011,286(29):25891–25902.
[DOI][91]KiyoharaYB,TagaoS,TamaniniF,MoritaA,SugisawaY,YasudaM,YamanakaI,UedaHR,VanDerHorstGTJ,KondoT,YagitaK.
TheBMAL1Cterminusregu-latesthecircadiantranscriptionfeedbackloop.
ProcNatlAcadSciUSA,2006,103(26):10074–10079.
[DOI][92]HonmaS,KawamotoT,TakagiY,FujimotoK,SatoF,NoshiroM,KatoY,HonmaK.
Dec1andDec2arereg-ulatorsofthemammalianmolecularclock.
Nature,2002,419(6909):841–844.
[DOI][93]JenuweinT,AllisCD.
Translatingthehistonecode.
Science,2001,293(5532):1074–1080.
[DOI][94]SoshnevAA,JosefowiczSZ,AllisCD.
Greaterthanthesumofparts:complexityofthedynamicepigenome.
MolCell,2016,62(5):681–694.
[DOI][95]VollmersC,SchmitzRJ,NathansonJ,YeoG,EckerJR,PandaS.
Circadianoscillationsofprotein-codingandregulatoryRNAsinahighlydynamicmammalianliverepigenome.
CellMetab,2012,16(6):833–845.
[DOI][96]RippergerJA,SchiblerU.
RhythmicCLOCK-BMAL1bindingtomultipleE-boxmotifsdrivescircadianDbptranscriptionandchromatintransitions.
NatGenet,2006,38(3):369–374.
[DOI][97]FengD,LiuT,SunZ,BuggeA,MullicanSE,AlenghatT,LiuXS,LazarMA.
Acircadianrhythmorchestratedbyhistonedeacetylase3controlshepaticlipidmetabol-ism.
Science,2011,331(6022):1315–1319.
[DOI][98]EtchegarayJP,LeeC,WadePA,ReppertSM.
Rhythmichistoneacetylationunderliestranscriptioninthemam-maliancircadianclock.
Nature,2003,421(6919):177–182.
[DOI][99]LeeY,LeeJ,KwonI,NakajimaY,OhmiyaY,SonGH,LeeKH,KimK.
CoactivationoftheCLOCK-BMAL1complexbyCBPmediatesresettingofthecircadianclock.
JCellSci,2010,123(Pt20):3547–3557.
[DOI][100]NakahataY,KaluzovaM,GrimaldiB,SaharS,Hi-rayamaJ,ChenD,GuarenteLP,Sassone-CorsiP.
TheNAD+-dependentdeacetylaseSIRT1modulatesCLOCK-mediatedchromatinremodelingandcircadiancontrol.
Cell,2008,134(2):329–340.
[DOI][101]AsherG,GatfieldD,StratmannM,ReinkeH,DibnerC,KreppelF,MostoslavskyR,AltFW,SchiblerU.
SIRT1第12期岳敏等:哺乳动物生物钟的遗传和表观遗传研究进展1137regulatescircadianclockgeneexpressionthroughPER2deacetylation.
Cell,2008,134(2):317–328.
[DOI][102]NakahataY,SaharS,AstaritaG,KaluzovaM,Sas-sone-CorsiP.
CircadiancontroloftheNAD+salvagepathwaybyCLOCK-SIRT1.
Science,2009,324(5927):654–657.
[DOI][103]RamseyKM,YoshinoJ,BraceCS,AbrassartD,Ko-bayashiY,MarchevaB,HongHK,ChongJLC,BuhrED,LeeC,TakahashiJS,ImaiSI,BassJ.
CircadianclockfeedbackcyclethroughNAMPT-mediatedNAD+biosynthesis.
Science,2009,324(5927):651–654.
[DOI][104]LeMartelotG,CanellaD,SymulL,MigliavaccaE,Gi-lardiF,LiechtiR,MartinO,HarshmanK,DelorenziM,DesvergneB,HerrW,DeplanckeB,SchiblerU,Rou-gemontJ,GuexN,HernandezN,NaefF,CycliXCon-sortium.
Genome-wideRNApolymeraseIIprofilesandRNAaccumulationrevealkineticsoftranscriptionandassociatedepigeneticchangesduringdiurnalcycles.
PLoSBiol,2012,10(11):e1001442.
[DOI][105]MalapeiraJ,KhaitovaLC,MasP.
OrderedchangesinhistonemodificationsatthecoreoftheArabidopsiscircadianclock.
ProcNatlAcadSciUSA,2012,109(52):21540–21545.
[DOI][106]ValekunjaUK,EdgarRS,OklejewiczM,VanDerHorstGTJ,O'NeillJS,TamaniniF,TurnerDJ,ReddyAB.
HistonemethyltransferaseMLL3contributestoge-nome-scalecircadiantranscription.
ProcNatlAcadSciUSA,2013,110(4):1554–1559.
[DOI][107]KatadaS,Sassone-CorsiP.
Thehistonemethyltransfe-raseMLL1permitstheoscillationofcircadiangeneex-pression.
NatStructMolBiol,2010,17(12):1414–1421.
[DOI][108]KimDH,RheeJC,YeoS,ShenRK,LeeSK,LeeJW,LeeS.
Crucialrolesofmixed-lineageleukemia3and4asepigeneticswitchesofthehepaticcircadianclockcontrollingbileacidhomeostasisinmice.
Hepatology,2015,61(3):1012–1023.
[DOI][109]DiTacchioL,LeHD,VollmersC,HatoriM,WitcherM,SecombeJ,PandaS.
HistonelysinedemethylaseJARID1aactivatesCLOCK-BMAL1andinfluencesthecircadianclock.
Science,2011,333(6051):1881–1885.
[DOI][110]NamHJ,BooK,KimD,HanDH,ChoeHK,KimCR,SunW,KimH,KimK,LeeH,MetzgerE,SchueleR,YooSH,TakahashiJS,ChoS,SonGH,BaekSH.
PhosphorylationofLSD1byPKCαiscrucialforcirca-dianrhythmicityandphaseresetting.
MolCell,2014,53(5):791–805.
[DOI][111]TamayoAG,DuongHA,RoblesMS,MannM,WeitzCJ.
HistonemonoubiquitinationbyClock-BMAL1complexmarksPer1andPer2genesforcircadianfeedback.
NatStructMolBiol,2015,22(10):759–766.
[DOI][112]KimJY,KwakPB,WeitzCJ.
SpecificityincircadianclockfeedbackfromtargetedreconstitutionoftheNuRDcorepressor.
MolCell,2014,56(6):738–748.
[DOI][113]EtchegarayJP,YangXM,DeBruyneJP,PetersAHFM,WeaverDR,JenuweinT,ReppertSM.
ThepolycombgroupproteinEZH2isrequiredformammaliancirca-dianclockfunction.
JBiolChem,2006,281(30):21209–21215.
[DOI][114]NguyenKD,FentressSJ,QiuYF,YunKR,CoxJS,ChawlaA.
CircadiangeneBmal1regulatesdiurnalos-cillationsofLy6Chiinflammatorymonocytes.
Science,2013,341(6153):1483–1488.
[DOI][115]BannisterAJ,ZegermanP,PartridgeJF,MiskaEA,ThomasJO,AllshireRC,KouzaridesT.
Selectiverec-ognitionofmethylatedlysine9onhistoneH3bytheHP1chromodomain.
Nature,2001,410(6824):120–124.
[DOI][116]LachnerM,O'CarrollD,ReaS,MechtlerK,JenuweinT.
MethylationofhistoneH3lysine9createsabindingsiteforHP1proteins.
Nature,2001,410(6824):116–120.
[DOI][117]MaekawaF,ShimbaS,TakumiS,SanoT,SuzukiT,BaoJH,OhwadaM,EharaT,OgawaY,NoharaK.
DiurnalexpressionofDnmt3bmRNAinmouseliverisregu-latedbyfeedingandhepaticclockwork.
Epigenetics,2012,7(9):1046–1056.
[DOI][118]XiaL,MaSH,ZhangY,WangT,ZhouMY,WangZQ,ZhangJF.
DailyvariationinglobalandlocalDNAme-thylationinmouselivers.
PLoSOne,2015,10(2):e0118101.
[DOI][119]HuSH,WanJ,SuYJ,SongQF,ZengYX,NguyenHN,ShinJ,CoxE,RhoHS,WoodardC,XiaSL,LiuS,LyuHB,MingGL,WadeH,SongHJ,QianJ,ZhuH.
DNAmethylationpresentsdistinctbindingsitesforhumantranscriptionfactors.
eLife,2013,2:e00726.
[DOI][120]NakajimaM,ImaiK,ItoH,NishiwakiT,MurayamaY,IwasakiH,OyamaT,KondoT.
Reconstitutionofcirca-dianoscillationofcyanobacterialKaiCphosphorylationinvitro.
Science,2005,308(5720):414–415.
[DOI](责任编委:何群)
EtherNetservers年付仅10美元,美国洛杉矶VPS/1核512M内存10GB硬盘1Gpbs端口月流量500GB/2个IP
EtherNetservers是一家成立于2013年的英国主机商,提供基于OpenVZ和KVM架构的VPS,数据中心包括美国洛杉矶、新泽西和杰克逊维尔,商家支持使用PayPal、支付宝等付款方式,提供 60 天退款保证,这在IDC行业来说很少见,也可见商家对自家产品很有信心。有需要便宜VPS、多IP VPS的朋友可以关注一下。优惠码SUMMER-VPS-15 (终身 15% 的折扣)SUMMER-...
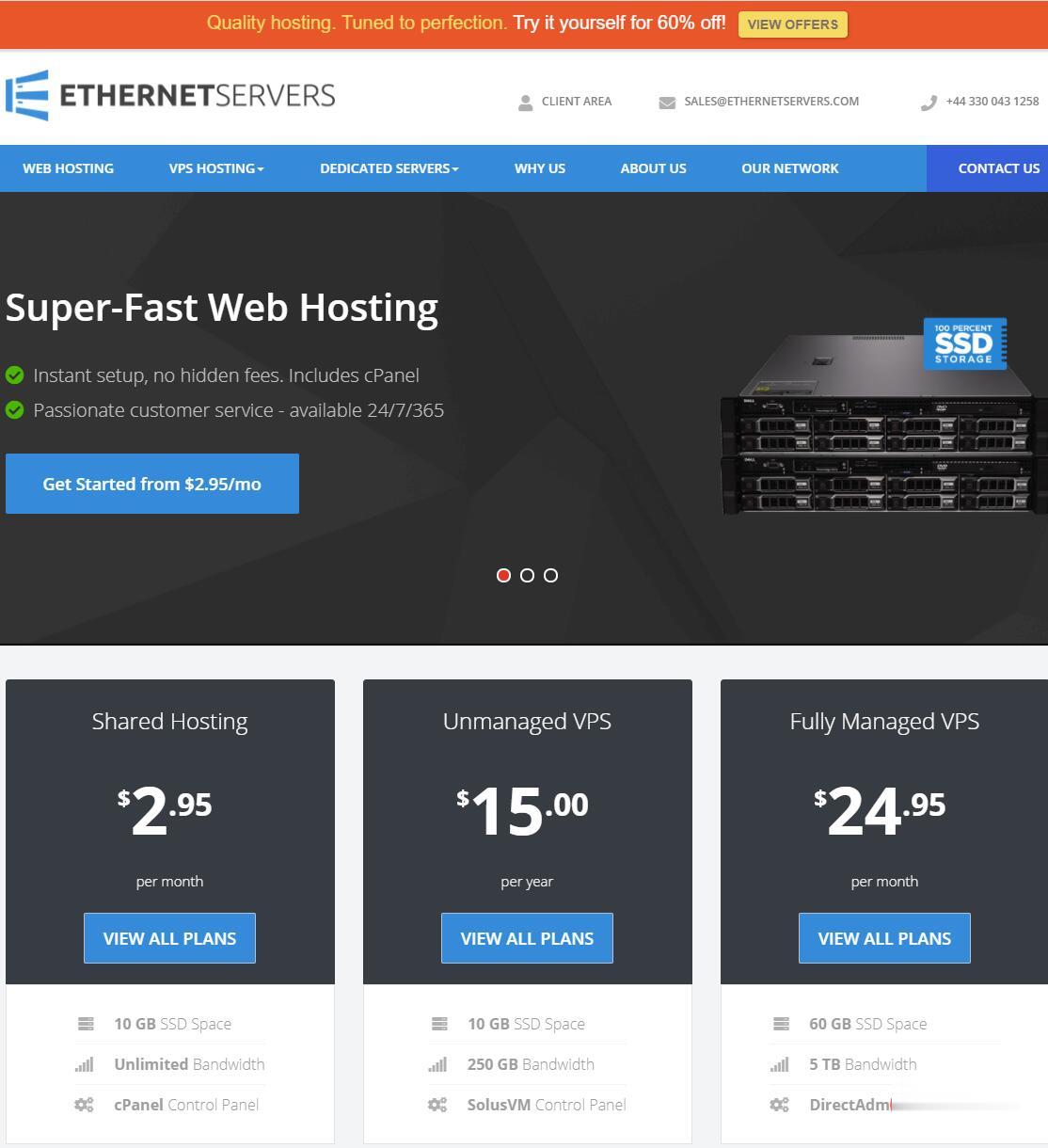
vpsdime7美元/月,美国达拉斯Windows VPS,2核4G/50GB SSD/2TB流量/Hyper-V虚拟化
vpsdime怎么样?vpsdime是2013年成立的国外VPS主机商,以大内存闻名业界,主营基于OpenVZ和KVM虚拟化的Linux套餐,大内存、10Gbps大带宽、大硬盘,有美国西雅图、达拉斯、新泽西、英国、荷兰机房可选。在上个月搞了一款达拉斯Linux系统VPS促销,详情查看:vpsdime夏日促销活动,美国达拉斯vps,2G内存/2核/20gSSD/1T流量,$20/年,此次推出一款Wi...
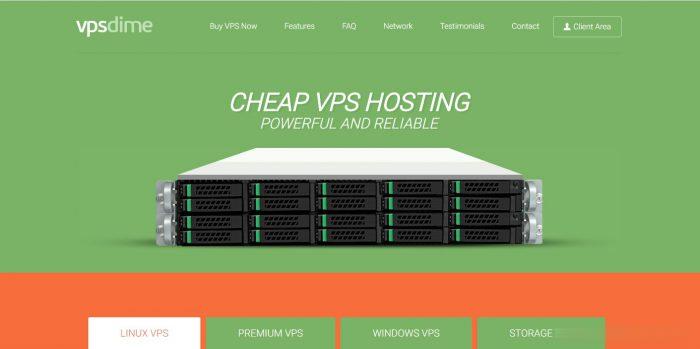
Digital-VM:服务器,$80/月;挪威/丹麦英国/Digital-VM:日本/新加坡/digital-vm:日本VPS仅$2.4/月
digital-vm怎么样?digital-vm在今年1月份就新增了日本、新加坡独立服务器业务,但是不知为何,期间终止了销售日本服务器和新加坡服务器,今天无意中在webhostingtalk论坛看到Digital-VM在发日本和新加坡独立服务器销售信息。服务器硬件是 Supermicro、采用最新一代 Intel CPU、DDR4 RAM 和 Enterprise Samsung SSD内存,默认...
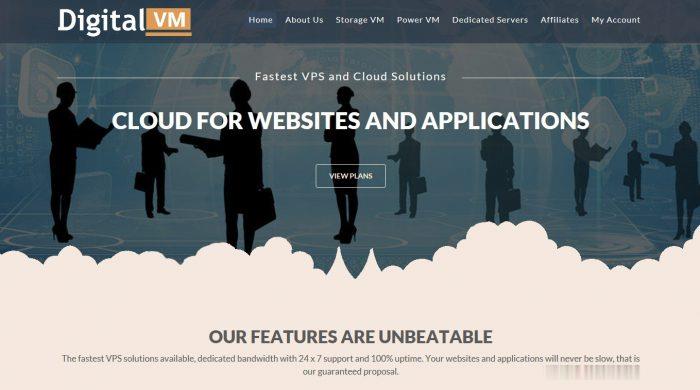
空间克隆网站为你推荐
-
phpwindPHPWind 是什么?怎么用?重庆网络公司一九互联我重庆2013年7月毕业,报到证上写的是A公司,档案也在A公司,半年后我辞职,到B公司上班,档案也flashfxp注册码找flashfxp3.4注册码连接cuteftp资费标准电信套餐资费介绍表文档下载怎么下载百度文档缤纷网缤纷的意思是什么zhuo爱作文:温暖的( )123456hd手机卡上出现符号hd怎么取消billboardchina中国有进美国BillBoard榜的人吗