药物几内亚首例确诊
几内亚首例确诊 时间:2021-04-23 阅读:()
I药学快讯主编:郭姣(广东药学院院长)副主编:范兴坤(广东药学院图书馆馆长)苏政权(广东药学院科技处处长)安东(广东药学院图书馆副馆长)本期责任编辑:李燕萍李萍编审:温玉琴季刊(内部刊物)1999年创刊2014年9月第3期(总第55期)编辑出版:广东药学院图书馆信息服务部合办单位:广东药学院科技处通讯地址:广州市广州大学城广东药学院图书馆邮编:510006电话:(020)39352362传真:(020)39352343电子邮箱:infoservice@lib.
gdpu.
edu.
cn主页:http://www.
lib.
gdpu.
edu.
cn/tsfw/yxkx/承印:广药勤工助学复印部,联系电话:020-31280533,13527895988II目录【医药进展】12014AHA/ACC指南对NSTE-ACS抗血小板治疗的推荐.
12014美国NSTE-ACS指南:早期治疗要点1美国发布最新版非ST段抬高型急性冠脉综合征指南3AATS发布最新术后心房颤动预防和管理指南.
4对COPD采用组合疗法与较好的转归有关.
5糖尿病幕后的真相:控制系统复杂性的丢失.
6JACC:慢性心力衰竭患者肠血流量减少7再生障碍性贫血致病基因确定.
8Circulation:肾脏疾病并非tPA禁忌证9科学家发现控制细胞衰老的开关—端粒酶9专家视点:如何治疗Brugada综合征.
10Org.
Biomol.
Chem:治疗阿尔兹海默氏症的新型蛋白药物.
11NatCellBiol:发现促进癌症转移的关键蛋白质11PNAS:鉴别乳腺癌组织的新工具12CancerRes:研究人员发现增加白血病发病的新基因12新的抗癌药物靶标——脂质化学信使.
13【政策法规】13卫计委放松基层用药限制多地非基药比例不超30%13处方药网售即将放开首批目录待定.
15国家食药总局公布第一批过度重复药品品种目录的公告17六部委推进医药分开.
17【业界新闻】18湖南省纪委官员实名举报国家药监局前局长.
18盘点2014年FDA批准的孤儿药19Adaptimmune募集1亿美元促进癌症免疫疗法研究.
22VentiRx融资5000万美元用于癌症免疫疗法.
23FDA批准塞尔基因Otezla用于中重斑块状银屑病23FDA许可首款酵母病原体的血检产品上市.
24治疗近视性脉络膜新生血管病变药物Eylea在日本获批.
24FDA批准Xtandi胶囊新适应症用于治疗转移性CRPC.
24FDA批准阿斯利康Movantik治疗阿片药物诱导的便秘25FDA批准礼来Trulicity治疗2型糖尿病.
25FDA批准百特HYQVIA用于原发性免疫缺陷成人患者治疗.
262014年重磅生物制药行业发展主形势分析.
27制药企业动作频频减肥药破茧在即28IMS:2014医院用药统计报告.
29【专题】埃博拉病毒.
29什么叫埃博拉病毒29基因测序揭示埃博拉疫情源头.
30汤森路透:世界聚焦埃博拉.
31全球合力阻止埃博拉疫情传播.
32IIINature:科学家探讨埃博拉病毒感染的新型疗法进展.
34Science杂志介绍埃博拉病毒致病机制.
35埃博拉病毒躲避机体抗病毒防御系统机制.
36英发现埃博拉病毒治疗新方法.
36世卫组织:埃博拉病毒逾三百基因已变异.
37埃博拉疫苗生产面临瓶颈.
38灵长动物实验证实美埃博拉新药有效.
38【专题】医药专利诉讼.
39跨国药企专利药频遭仿制屡屡起诉陷国际争端.
39恒瑞医药:中外药企五年专利之争恒瑞获胜.
40受困专利日益明显国内药企需提高知识产权意识40突破专利壁垒科伦药业势逼跨国药企.
41仿制药存在价格优势药企专利门问题待解.
43中国抗体药如何抵御专利战45一起专利诉讼引发的思考.
47中国药企难治专利诉讼"心病"48盘点跨国药企在印度遭遇的滑铁卢.
49印度仿制药"正名"运作模式可供发展中国家借鉴50中国修改专利法允许复制"救命药"521【医药进展】2014AHA/ACC指南对NSTE-ACS抗血小板治疗的推荐2014年9月23日,美国心脏学会(AHA)/美国心脏病学会(ACC)非ST段抬高型急性冠脉综合征(NSTE-ACS)管理指南进行了更新,其中关于NSTE-ACS患者起始治疗抗血小板药物/抗凝药物的推荐是大家重点关注的部分,现摘译指南对接受早期侵入性治疗或缺血指导策略治疗的确诊或疑似NSTE-ACS患者抗血小板治疗部分的推荐与读者分享.
Ⅰ级推荐:①起病后应尽快给予所有无禁忌证的NSTE-ACS患者非肠溶性阿司匹林咀嚼片(162mg~325mg),并以阿司匹林维持剂量(81mg~162mg)无限期使用.
(ⅠA)②因超敏反应及胃肠道不耐受而不能应用阿司匹林的患者,应给予负荷剂量的氯吡格雷治疗,并继以每日维持剂量治疗.
(ⅠB)③对于接受早期侵入性或缺血指导策略治疗,且无禁忌证的患者,推荐应用P2Y12抑制剂(包括氯吡格雷和替格瑞洛)联合阿司匹林治疗12个月.
其中氯吡格雷的用法为负荷剂量300~600mg后以75mg/d维持(ⅠB),替格瑞洛为负荷剂量180mg后以90mgbid维持(ⅠB).
Ⅱa级推荐:对于接受早期侵入性或缺血指导策略治疗且无禁忌证的患者,应用P2Y12抑制剂治疗时,优先选择替格瑞洛是合理的(Ⅱa,B).
Ⅱb级推荐:对于接受早期侵入性治疗及双联抗血小板治疗(DAPT)的中高危NSTE-ACS患者(如肌钙蛋白阳性),起始抗血小板治疗策略中应考虑应用糖蛋白Ⅱa/Ⅲb抑制剂,依替巴肽及替罗非班为优选(Ⅱb,B).
http://circ.
cmt.
com.
cn/detail/598573.
html2014美国NSTE-ACS指南:早期治疗要点9月23日,ACC与AHA颁布了新的非ST段抬高型急性冠脉综合征(NSTE-ACS)治疗指南.
(详见:美国发布最新版非ST段抬高型急性冠脉综合征指南)现将其中涉及NSTE-ACS早期治疗的部分要点简单介绍如下:1.
只为血氧饱和度0.
24秒、II度或III度房室传导阻滞但未安装起搏器等情况,可应用非二氢吡啶类钙离子拮抗剂治疗;13.
经β受体阻滞剂和硝酸酯类药物治疗后仍存在复发性缺血的患者,若无禁忌证可服用非二氢吡啶类钙离子拮抗剂;14.
若β受体阻滞剂治疗无效或有禁忌证或不能耐受,可选用钙拮抗剂治疗(避免应用短效非二氢吡啶类钙离子拮抗剂);15.
存在冠状动脉痉挛的患者可应用长效钙拮抗剂;16.
在未应用β受体阻滞剂的情况下,禁忌使用短效硝苯地平;17.
无禁忌证的患者应开始或继续强效他汀治疗;18.
伴LVEF0.
24s,II°或III°心脏传导阻滞且未安装心脏起搏器,活动期哮喘,或气道反应性疾病).
5.
所有无禁忌症的NSTE-ACS患者均应开始或继续高强度他汀类药物治疗.
6.
所有无禁忌症的NSTE-ACS患者无论是接受早期介入治疗还是缺血指导的治疗策略,均应给予P2Y12抑制剂(氯吡格雷或替格瑞洛)联合阿司匹林治疗12个月.
接受冠脉PCI治疗的患者应使用P2Y12抑制剂(氯吡格雷,普拉格雷或替格瑞洛)治疗至少12个月.
对于接受早期介入治疗或缺血指导策略的NSTE-ACS患者,在选用P2Y12抑制剂时替格瑞洛优先于氯4吡格雷是合理的.
对于接受PCI且非出血高危的NSTE-ACS患者,在选用P2Y12抑制剂时普拉格雷(PCI期间开始使用)优先于氯吡格雷是合理的.
7.
无论初始治疗策略如何,所有NSTE-ACS患者均推荐给予抗凝联合抗血小板治疗.
对于NSTE-ACS患者,PCI治疗后应停止抗凝治疗,除非有令人信服的理由需要继续该治疗.
8.
难治性心绞痛或血流动力学/电不稳定的NSTE-ACS患者(无严重并发症或介入禁忌症)应采取紧急/直接介入策略.
对于临床实践风险升高、初期稳定的NSTE-ACS患者(无严重并发症或介入禁忌症)应采取早期介入策略.
早期介入策略不推荐用于以下患者:(1)有广泛的并发症者,如肝、肾、肺衰竭及癌症患者;(2)血运重建风险及并发症可能超过获益的患者;(3)肌钙蛋白阴性、ACS可能性较小的急性胸痛患者,特别是女性.
9.
所有符合适应证的NSTE-ACS患者均应该在出院前或第一次门诊随访时制定一个全面的心血管康复计划.
10.
应提供给NSTE-ACS患者一个基于证据的管理计划(例如,指南指导的药物治疗),包括改善药物治疗依从性、医疗团队及时跟进、适当的饮食和运动以及依从二级预防的干预措施.
除了日常锻炼的详细说明,还应该指导患者进行具体的日常活动,例如举重物、爬楼梯、园艺和家庭活动等,哪些活动是允许的、哪些活动是应该避免的.
特别提到可以恢复开车、重返工作岗位和性生活这一内容.
http://news.
medlive.
cn/heart/info-progress/show-68112.
htmlAATS发布最新术后心房颤动预防和管理指南美国胸外科医师学会(AATS)日前发布最新预防术中或术后心房颤动(房颤)以及房颤和心房扑动(房扑)患者管理指南.
指南还为已有房颤,将要接受胸外科手术的患者管理提供了指导,这些患者卒中,心力衰竭(心衰)和其他并发症风险较高.
管理抗心律失常药物和围术期抗凝治疗存在挑战.
因此,术前心内科会诊可能有益.
工作组主席GyorgyFrendl博士(Brigham妇女医院)表示,―事实上,我们无法精确说明房颤为何会发生,但心肺手术患者,尤其肺部手术患者术后房颤发生率非常高.
因此,胸外科和心脏外科医生希望找到原因、预防和解决方案.
答案并不简单.
‖指南9月23日在线发表于JournalofThoracicandCardiovascularSurgery.
术后房颤患者住院时间、并发症和花费更多.
房颤/房扑高危因素包括高龄、高血压、心衰、房颤病史、阻塞型睡眠呼吸暂停、甲亢、左室肥厚、瓣膜性心脏病、肥胖、吸烟、酗酒等.
新指南推荐所有术前服用β受体阻滞剂的患者术后应继续使用,预防房颤或房扑(Ⅰ,A).
术后血压降低并不是停用β受体阻滞剂的理由,低血压患者可减少剂量或服药频次.
如果血清镁水平低或术者怀疑体内镁含量降低,可考虑静脉补镁(Ⅱb,C).
不应使用地高辛,或术中行导管/手术肺静脉隔离预防房颤或房扑.
围术期/术后房颤或房扑中高危患者,如果心功能正常,且围术期未使用β受体阻滞剂,可考虑使用地尔硫卓(Ⅱa,B)接受特定手术如肺切除术或食管切除术的患者,术后可考虑使用胺碘酮.
但胺碘酮长期大量使用有肺毒性.
未使用他汀,接受中高危手术的患者,可考虑使用阿托伐他汀(Ⅱb,C).
长期使用华法林或新型口服抗凝药的房颤患者,是否停用及需要肝素过渡取决于卒中风险,可使用CHA2DS2-VASc评分评估.
50%,可考虑使用依诺肝素作为短期过渡药物.
如果停用抗凝治疗,应尽量缩短时间.
围术期房颤/房扑患者管理取决于血液动力学稳定型.
稳定患者主要治疗为心率控制,目标为110次/分.
血液动力学不稳定者应转复窦性心律.
http://circ.
cmt.
com.
cn/detail/598473.
html对COPD采用组合疗法与较好的转归有关据9月17日发表在《美国医学会杂志》上的一则研究披露,在罹患慢性阻塞性肺病(COPD)——尤其是那些有哮喘者——的较为年长的人中,新开的长效β-受体激动剂(LABAs)与吸入性皮质类固醇联合疗法与仅用新开的LABAs相比,前者与较低的死亡风险或COPD住院风险相关.
慢性阻塞性肺病是全球排第三的主要死亡原因.
药物是COPD治疗的支柱,而知道哪些药在现实实践中最为有效是至关重要的.
与安慰剂相比,由LABAs和吸入性皮质类固醇(ICSs)组成的组合疗法一直显示能减少病情恶化并可能降低死亡的风险.
然而,根据文章的背景资料,在其所知的效果与单独使用LABAs相比还存在有空白.
多伦多Sunnybrook健康科学中心的AndreaS.
Gershon,M.
D.
,M.
Sc.
及其同事检查了在患有其它疾病——包括哮喘的年龄较长的COPD病人中LABA-ICS组合疗法与单用LABAs相比的结果.
这些研究——它包括了从2003-2011年间在安大略的数据——纳入了年龄66岁或以上的人,这些人符合经过验证的COPD的病例定义;有8712名新的LABA-吸入性皮质类固醇组合疗法使用者及3160为仅用LABAs的新的使用者,对这些人的随访中位数时间分别为2.
7年和2.
5年.
在2129名LABAs的新使用者中观察到了主要结果(死亡和COPD住院的复合结果)(1179例死亡[37.
3%]);950例COPD住院[30.
1%]及5594例LABAs和ICSs的新的使用者(3174例死亡[36.
4%];2420例COPD住院[27.
8%]).
与仅用LABAs的新使用者相比,在LABAs和ICSs的新使用者中的复合结果的风险具有温和但显著较低的风险.
在具有合并哮喘诊断的COPD病人(5年时的复合结果差异为-6.
5%)中以及在那些没有接受吸入性长效抗胆碱能药物(这是一类不同的COPD药物,它是通过抑制特定神经冲动的传导以帮助扭转气道阻力而起作用的;5年时的复合结果差异为-8.
4%)的病人中有着最大的差异.
文章的作者写道:―我们的在LABAs和ICSs与转归间有相关性的发现可帮助厘清罹患COPD和哮喘病人的管理,因为许多对COPD药物的研究将哮喘病人排除在外,反之亦然.
‖―此外,COPD的行医指南建议,LABAs应被考虑作为第一线的治疗,而哮喘的治疗指南则警告不要在没有ICSs时使用LABAs.
我们的结果还对没有哮喘的COPD患者的最佳治疗提供了见解,这些人没有被考虑为是那些对皮质类固醇特别起反应的病人.
‖研究人员补充说,这些发现应该在随机化的临床试验中得到确认.
社论:在现实世界中治疗COPD英国利物浦大学的PeterM.
A.
Calverley,M.
B.
Ch.
B.
,D.
Sc.
在一篇附随的社论中对这项研究的结果发表了评论.
―由Gershon等人报告的新的数据的最值得注意的特征也许是使用这些治疗的病人与那些治疗已经在随机化临床试验(RCTs)中得到验证的病人的特征中的差异.
在这些现实世界'病人中的治疗结果似乎比可能来自RCTs的预计结果要好些,但这些病人也更为多元而且常常病情更重.
Gershon等人的研究显示,来自恰当进行的数据库分析的发现补充了来自RCTs的数据,并应该在决定治疗程序时进行考虑.
‖6http://www.
i-md.
com/news/detail/541a42d58516b68672144fca糖尿病幕后的真相:控制系统复杂性的丢失2014年9月23日华盛顿—对于美国百万名身患1型和2型糖尿病的患者来说,每日测量血糖的升降是一种生活方式.
我们体内的能量主要由血液中的葡萄糖所掌控,而血糖又由人体细胞,组织,器官以及荷尔蒙之间复杂的相互作用所控制,这种相互作用维持血糖保持在一个相对稳定的水平,即当血糖低的时候,让它回升,高的时候,让它下降.
当一个人罹患糖尿病时,这种自然的动态平衡会被打破.
现代对于糖尿病介入治疗的方式涵盖了饮食,药物以及生活方式的改变,但糖尿病是一种难以驾驭的疾病,所有的这些方式都很难恢复荷尔蒙和血糖的自然平衡.
常规的血糖测量是管理这种疾病的核心部分,它帮助病人和看护人员计划出何时应该给病人服用胰岛素和其他的药物以及如何调节病人的饮食.
管理糖尿病的种种困难以及2型糖尿病新病例的爆发激发了科学家们对新的疾病监测方式和治疗方法的探索,旨在进一步优化临床决定和个性化对血糖的控制.
日前,哈佛医学院的的研究人员们发现血糖的微小波动可能蕴藏着比表面上看起来更多的东西—事实上,这些在绝大多数情况下被忽略的瞬间动态有可能提供了丰富的信息,而这些信息就隐藏在那些微小的,表面上看起来无足轻重的血糖涨落之中.
正如这周研究人员发表在由美国物理联合会出版的《混沌》期刊上的文章所述,提取血糖微小波动中的信息可能会阐释人体生理机能中一些未被充分理解的前沿问题,并且甚至有可能为监测和治疗糖尿病提供新的方法,这些方法基于维持和恢复人体整体控制系统的复杂性,哈佛研究人员将这一概念称为―将系统作为目标‖.
血糖的连续监测这项新研究是由哈佛医学院统计物理学家MadalenaD.
Costa,哈佛医学院BethIsraelDeaconess医学中心和哈佛大学theWyssInstituteforBiologically-InspiredEngineering的心血管病专家AryGoldberger带领进行的.
和他们的研究人员一起,Costa和Goldberger一起研究了从18个罹患2型糖尿病的中老年人和12个作为对照组的年龄匹配的健康人那里得来的无身份识别的回顾性数据.
这30个人都被连接上血糖连续监测仪--一种植入式的仪器每五分钟测量一次血糖水平.
经过连续几天的数据观察,研究人员发现无论是糖尿病人群还是健康人群,其血糖都持续经历了微小的波动.
但两个组的波动不一样,健康人群的波动更加细微,移动速度也更快.
以前医生们其实已注意到健康人群血糖中细小高频的波动,但大多数情况下,这种波动被归因为噪音干扰和血糖仪器的探测局限.
毕竟,这些波动并不很显著.
但Costa,Goldberger和其他研究人员粉碎了这个假设,他们证实了有复杂的信息隐藏在这种动态中,并且这种信息在2型糖尿病人群中会发生变化.
研究人员的这一发现是源自使用了一种叫多尺度熵分析的复杂的数学技术,该数学技术可以量化数据的复杂性并比较其数值,研究人员先是打乱了从30个人身上收集到的每隔5分钟的测量数据的顺序,然后使用这种数学技术分析数据之间的差异性是如何变化的.
―这次与计算过程的结合让我们知道在不同的时间尺度中时间序列是多么的无法预知.
‖Costa说.
研究分析表明短期的波动(长期波动也一样)并不代表不相关的随机性,而是在编码复杂的信息.
且研究人员进一步发现,这些被编码于波动中的信息在健康人身上要明显复杂于糖尿病7人,这点是医生们从未系统持续的观察到过的.
在疾病发作时,波动中信息复杂性的明显丢失启发哈佛研究组提出了一种新颖的研究糖尿病的方式,他们称之为―动态血糖测量法‖,一种解码隐藏于这些波动中的信息的方法,有别于以往只是依赖定期的检查和平均值的方法.
复杂性,生理机能和人类健康如果说糖尿病是一个说明健康生理机能具有复杂变化性的新兴的例子,它绝不是唯一的一例.
动态血糖测量法之类的东西以前从未被系统的应用于糖尿病的研究,但类似的方法早已在医学的其他领域被应用,复杂性的细微差别已被用来帮助我们理解基本的人体生理机能.
比如在生理学中有一个由来已久的范式,说的是最健康的人体系统应该是呈现出最大稳定性的系统—这个被称为―同态‖的概念已经主导生理学领域近一个世纪.
但现在医生们开始认为这个概念也不一定总是正确的.
心血管专家Goldberger指出年轻人的心跳要比患有心脏病的老年人有更复杂的多变性.
健康的有规律的心跳更像沙球的声音而不是节拍器.
同样的,身体里的所有―乐器‖所遵循的韵律是要避免―愚蠢的一致‖取代了交响乐的丰富,Goldberger说.
―如果交响乐队中的每一个人都同时演奏相同的调子,你会走出剧院‖他说.
―没有人想听过于一致的声音或者杂乱无章的声音,也就是静态.
‖健康人体系统复杂性的背后也许说明了这样一个事实—即它为我们带来了一种更高水平的适应能力,使我们在不同的时间尺度中能够处理不可避免的压力.
身体不是一个传统的机器,Goldberger说,你赖以生存的是一种能够做出改变的能力而不是被紧紧控制锁定在某个稳定的状态或者是处于完全杂乱无章的状态.
如果这就是糖尿病的真相,动态血糖测量法也许能让人们对理解糖尿病背后的生理过程有新的思路,并且有可能据此提出新的,通过恢复能量调节系统的多尺度复杂性来治疗疾病的方法.
更多:关于糖尿病和其治疗方法的背景资料糖尿病是一种慢性复杂疾病,其显著症状是血糖过高,病因是由于胰岛素,一种调节血糖的荷尔蒙,出了问题.
正常情况下我们的身体通过不断监测血糖,并释放胰岛素和其他荷尔蒙来调节血糖的高低以维持其正常水平.
但罹患糖尿病的人丧失了这种自然的平衡和自身控制血糖的能力.
1型糖尿病是由体内无法产生胰岛素产生的,而2型糖尿病是由身体无法对胰岛素产生正确的反应造成的.
对于这两类糖尿病的治疗早在上个世纪就是著名的医学界成功的故事之一,它将一种原本致死的疾病转换成慢性的可控的状态.
http://news.
haoyisheng.
com/14/0925/310105314.
htmlJACC:慢性心力衰竭患者肠血流量减少作者:伊文来源:国际循环最近一项前瞻性研究结果显示,慢性心力衰竭(心衰)患者较无心衰患者肠血流量减少.
这可能导致细菌生长增加和胃肠道症状.
研究者共纳入65例慢性心衰患者和25例对照者.
结果显示慢性心衰患者肠动脉血流减少,可导致近粘膜处细菌生长、炎症、胃肠道症状及心衰晚期并发的心源性恶病质.
心衰的严重程度与肠系膜上动脉和腹腔动脉的血流减少显著相关(P<0.
04).
慢性心衰患者肠系膜上下动脉、腹腔动脉收缩期血流较对照组下降30%~43%(P<0.
007).
发生恶病质的患者血流量减少更明显(P<0.
002).
心衰组小肠、升结肠、降结肠、乙状结肠、8横结肠肠壁厚度较对照组增厚(P<0.
01),胃肠道症状也更频繁,包括上腹部饱胀感、呃逆和肠道杂音(P分别为0.
014、0.
016、0.
027).
其中呃逆、肠道杂音在恶病质患者中症状更重.
低血流量显著增加腹部不适症状,血清抗脂多糖IgA(r=0.
76,P<0.
02)和CRP(r=0.
43,P=0.
02)明显升高.
慢性心衰患者近粘膜细菌生长率高,且与低血流量和血清抗脂多糖IgA明显相关(r=0.
55,P=0.
05).
多变量分析显示,心源性恶病质与肠系膜上动脉低血流量明显相关(P<0.
04),与肠系膜下动脉低血流量临界于有显著性意义的边缘(P=0.
056).
英国赫尔约克医学院城堡山医院BenjaminDicken和伦敦帝国理工学院JohnG.
F.
Cleland博士均对上述结果持怀疑态度.
他们认为,许多心血管药物,如利尿剂、盐皮质激素阻断剂均对肠道功能有影响,另外对照组的活体组织检查也未能真实的反映健康人群.
Dicken和Cleland认同通过抗生素或改变肠道内环境的方式改变细菌的数量或种类,进而评估肠道细菌和心衰进程的关联研究.
但任何一种方法要证明有效,均需要大规模研究来评估.
http://www.
icirculation.
com/article/NewsInfo.
aspxid=28570再生障碍性贫血致病基因确定一个国际科学家小组发现了一种基因突变,可导致再生障碍性贫血(aplasticanemia)——一种严重的血液疾病,指骨髓不能产生正常数量的血细胞.
通过对一个三代都患血液疾病的家庭进行研究,研究人员发现一个基因缺陷,控制端粒、染色体结构,在正常细胞功能中发挥关键的作用.
本文共同第一作者、美国费城儿童医院(CHOP)应用基因组学中心主任HakonHakonarson博士指出:―识别这种因果缺陷,有助于指导今后的分子治疗,可避开基因缺陷并恢复血细胞的生产.
‖Hakonarson和CHOP同事与澳大利亚的科学家合作,将相关研究结果发表在2014年9月9日的《Blood》杂志.
本文共同第一作者、澳大利亚Westmead儿童医学研究所细胞生物学部门负责人TracyBryan博士指出:―我们为这项发现感到激动,它推动了我们对于某些基因突变和特定疾病因果关系的理解.
‖研究小组研究了一个澳大利亚家庭,其成员患有再生障碍性贫血和其他血液疾病(包括白血病).
Hakonarson和首席分析师YiranGuo博士,连同深圳华大基因(BGI)的基因组学专家一起,对来自家庭成员的DNA进行了全外显子组测序,在ACD基因上发现了一个遗传性突变,其编码端粒结合蛋白TPP1.
端粒是由DNA和蛋白质构成的复杂结构,位于染色体的末端,在那里它们保护染色体的稳定性.
有时候它们相当于鞋带末端的塑料头,可以防止鞋带的磨损.
细胞每分裂一次,端粒就会缩短,并逐渐失去保护功能.
衰老细胞与其缩短的端粒,逐渐变得更易受到DNA损伤和细胞死亡的影响.
来自于衰老过程的某些遗传性疾病和后天获得的失调症,可能会缩短端粒,并损害正在迅速分裂的血液形成细胞(骨髓中产生的).
这会导致骨髓衰竭,其中一个例子就是再生障碍性贫血.
Bryan的研究小组调查了ACD基因的功能.
他们断定,突变可缩短端粒,并中断端粒结合端粒酶的能力,这会抵消端粒缩短,从而保护细胞.
在当前的研究中,研究人员发现,ACD基因突变可改变端粒结合蛋白TPP1,破坏端粒和端粒酶之间的相互作用.
无法获得端粒酶以帮助维持端粒,血细胞就失去其结构完整性并死亡,导致骨髓衰竭和再生障碍性贫血.
其他9个基因,之前被发现在骨髓衰竭性疾9病中发挥一定作用.
目前的研究将ACD添加到名单中,首次证明该基因有致病作用.
Hakonarson说:―这改进了我们对于潜在分子机制的了解,可能提出新的方法,来治疗再生障碍性贫血这样的疾病.
例如,研究人员可以确定其他途径,将端粒酶招募到端粒上,以恢复其保护功能.
‖http://news.
medlive.
cn/all/info-progress/show-68196_246.
htmlCirculation:肾脏疾病并非tPA禁忌证最新研究显示,尽管慢性肾脏病(CKD)患者静脉溶栓治疗缺血性卒中的颅内出血和严重全身出血风险较高,但此风险与肾脏疾病不相关.
对超过4.
4万例患者进行的静脉组织型纤溶酶原激活物(tPA)安全性研究显示,调整年龄与合并症后,患有CKD(和无CKD相比)与症状性颅内出血(调整后OR1.
0,95%CI:0.
91~1.
10,P=0.
9510)或严重全身出血(调整后OR0.
97,95%CI:0.
80~1.
18,P=0.
7924)不相关.
不同CKD级别及不同类型出血结果均相似.
然而,和肾功能正常者相比,CKD患者院内死亡和出院时功能状态不良可能性更高.
第一作者BruceOvbiagele博士(SouthCarolina医科大学)表示,―CKD患者更可能发生颅内出血和全身出血,但CKD似乎并未导致这些结局.
CKD患者年龄更老,病情更严重.
静脉tPA是非常有效的治疗,CKD患者应予以考虑.
‖研究9月23日在线发表于Circulation.
研究者分析美国―遵循指南‖卒中注册研究数据,CKD定义为eGFR<60ml/min/1.
73m2,无CKD患者作为对照组.
共44410例患者被纳入分析,其中15191例(34.
2%)符合CKD定义.
CKD患者年龄更老,女性、白人、目前吸烟者,有卒中/短暂性脑缺血发作、颈动脉狭窄、冠状动脉疾病/既往心肌梗死和高血压比例更高.
卒中更严重(平均NIH卒中量表评分13.
0vs.
11.
3).
和无CKD患者相比,CKD患者症状性颅内出血(5.
4%vs.
4.
2%)、严重全身出血(1.
2%vs.
0.
9%),院内死亡(10.
7%vs.
6.
5%)和不能自理(56.
5%vs.
45.
1%)发生率更高.
调整混杂因素后,CKD与症状性颅内出血或严重全身出血并不相关,但院内死亡(调整后OR1.
22,95%CI:1.
14~1.
32,P<0.
0001)及肾功能恶化风险较高.
研究者认为CKD患者预后较差可能与合并症相关,如贫血、氧化应激、电解质失衡和慢性炎症,而非凝血和血小板功能障碍.
对于合并CKD的卒中患者,静脉tPA是适当的治疗.
http://circ.
cmt.
com.
cn/detail/598477.
html科学家发现控制细胞衰老的开关—端粒酶近日,发表在国际杂志Genes&Development上的一篇研究论文中,来自索尔克研究所的研究人员通过研究发现,细胞开关或许对于健康老龄化非常关键,新型的细胞开关可以帮助健康细胞保持分裂和生长的状态,比如在老年人机体中产生新型的肺脏和肝脏组织等.
在我们机体中,新生细胞会不断补充肺部、皮肤、肝脏及其它组织,然而很多人类细胞都不能无限分裂,由于细胞每分裂一次位于染色体末端的染色体就会缩短,随着细胞分裂端粒就会越来越短,最后细胞便不能分裂,从而引发器官和组织老化,这些现象就会在个体老年时发生;但是有些细胞会产生一种端粒酶,其可以重建端粒使得细胞无限分裂.
研究者VickiLundblad表示,这项研究中我们发现了端粒酶,此前研究中我们发现一旦当端粒酶被装配,其就会源源不断地供应,理解这种新型开关的工作机理对于缓解端粒变短,开发新型老化疾病的疗法非常关键.
文章中研究者试图去研究端粒酶复合物的每一个组分的结构功能,但似乎这并不是一个容易的工作,于是研究者开10发了一种新型策略,可以使其在细胞分裂期间清楚地观察到端粒酶的每一个组分的结构,从而为揭示端粒酶的作用原理提供了新的线索.
研究者表示,当完整的端粒酶复合物成功装配后,其会快速分解形成非活性的分解复合物,并且可以促使端粒酶开关处于关闭位置,研究者就推测这种分解途径或许可以帮助端粒酶在细胞中以较低水平存在.
尽管在正常细胞中―坏‖的端粒酶会引发衰老过程,但是癌细胞会依赖于更高水平的端粒酶来确保其细胞无性增殖,因此对端粒酶开关的有效控制或许是抑制癌症扩散转移的有效路径.
http://gp.
cmt.
com.
cn/detail/597525.
html专家视点:如何治疗Brugada综合征作者:HiroshiMorita博士(日本国立冈山大学医学、牙科学及药物学研究院心血管治疗学教授)1992年Brugada等人报道了一例以心前区ST段抬高和夜间突发室颤而猝死为特征的临床综合征.
据报道,这种Brugada综合征(BrS)的发生率大约在0.
03%到0.
3%左右.
该类患者被分为3种类型:1)患者可从心脏骤停或室颤中被复苏;2)患者有晕厥症状,但未监测到室颤;3)无症状患者.
考虑到植入型心律转复除颤器(ICD)作为可从心脏骤停或室颤中被复苏患者的初始治疗选择的获益已经比较明确了,接下来我主要和大家分享一下后两种类型的患者的治疗新心得.
伴晕厥症状的患者临床上对伴有晕厥症状的BrS患者的处理和其详细的病史有关.
如果患者曾有发作性晕厥的情况发生,那么发生晕厥时的详细情况就非常重要.
如果发作性晕厥的原因是致命性心律失常事件,那么患者通常除了在晕厥前会即刻出现一些心悸或者胸闷的症状之外是没有任何其他的前驱症状的.
自主神经介导性晕厥(NMS)是引起晕厥的主要原因之一,也常常在BrS患者中出现.
NMS晕厥通常伴有特定的前驱症状,如视物模糊、出汗,有时会出现晕厥后排尿.
而室颤引起的晕厥通常在静息状态或睡眠中发生,鲜有在活动时发生的情况出现.
但是在BrS中,发热和酗酒与室颤引起的晕厥有关联.
无症状患者将ICD置入术作为无症状BrS患者的一级预防治疗仍有争议.
之前的研究普遍认为自发性1型心电图表现伴晕厥病史是BrS患者的高危信号,但事实上无症状患者每年的事件发生率仅有0.
5%到1%.
可惜的是,我们尚无确切的方法来评估那些未来室颤发生风险高的无症状患者.
除了自发性1型心电图表现和晕厥,还有一些其他的心电图表现和临床特征也被报道为危险因子.
将这些信号结合起来能够缩小高危人群的范围.
除了自发性2型心电图表现之外,我们着重强调的危险因子如下:碎裂QRS波群(QRS波群中出现多个尖峰);宽QRS波群(≥120ms);下侧壁导联出现早期复极;在运动负荷试验中出现ST段抬高.
这些危险因子都在大样本量(≥100患者)的研究中得到了证实.
此外,尚有一些小样本研究报道了几个不确定的危险因子,如PQ间期延长、T波交替、自发性ST段改变、房颤和猝死家族史等.
如果患者出现任一危险因子,尤其是如果伴有多个危险因子的时候,那么我们就会推荐他进行电生理学检查.
虽然利用程序性电刺激来诱导BrS患者发生室颤的临床意义仍有争议,但是我们确实可以通过这种方法来判断心室的有效不应期(ERP)以及室颤诱发的模式.
短ERP(<200ms)和3次刺激内诱发室颤被认为是高危信号.
如果一名患者的检查结果得到这样的结论,我们会向患者及其家属提供知情同意书,并告知ICD置入术的利弊,以便其能获得充分的信息来做出治疗与否的决定.
http://news.
medlive.
cn/heart/info-progress/show-68057_129.
html11Org.
Biomol.
Chem:治疗阿尔兹海默氏症的新型蛋白药物2014年9月26日讯/生物谷BIOON/--近日,莱斯特大学的化学家报道了一种利用突破性技术开发的用来治疗癌症和阿尔茨海默氏症等疾病的新药物.
该研究团队开发了一种新的创新方法,他们运用这种方法研究了一种特殊的综合性氨基酸,由此产生了一种特殊的设计蛋白,这种蛋白之前从未被造出过.
AndrewJamieson博士是这项研究的领导科学家,他说:―对这项研究我们感到非常自豪,为此我们努力工作了好几年目的是用这项化学技术来创造新的构建模块,现在我们已经得到了新的构建模块,而在这之前人们只是仅有这个梦想而已!
‖氨基酸是自然本源性的构建模块,它们是所有蛋白质构成的来源,是生命必须的物质,然而,已构成的天然蛋白仅用了这些自然模块的20%.
在本次研究中,我们利用人造氨基酸制造出了带有三维立体结构和重要新功能的人造微型蛋白质.
Jamieson博士说:―我们非常感兴趣的是使用新的构建模块开发出新的蛋白药物,然后观察用该药物治疗癌症和阿尔兹海默症的功效.
‖―人造氨基酸,也就是构建模块被描述成为是手性的,意思是它们有―偏手性习惯‖.
这种有选择性的生产带有―偏手性习惯‖的合成物以前从未报道过.
‖―新的方法允许我们只能选择性地合成―右手分子‖.
这项新的研究是非常重要的,因为这是一项较新的,较早的和快速的使用这些构建模块来制造新药的方法.
‖―我们现在非常积极的使用这些构建模块来开发新的治疗癌症和阿尔兹海默症的药物.
研究人员使用构建模块合成了一种由海螺生产的毒素物质,并希望通过开发这种毒素使其成为一种治疗疼痛的药物.
‖Jamieson博士说:―药物的开发需要这些创新的方法,这些方法可以帮助制造出一些没有副作用的强效药.
然而如何使用这些新的构建模块是开发新蛋白药物的第一步.
‖(生物谷Bioon.
com)http://news.
bioon.
com/article/6659383.
htmlNatCellBiol:发现促进癌症转移的关键蛋白质2014年9月22日讯/生物谷BIOON/--想知道癌细胞如何转移嘛近日,刊登在国际杂志NatureCellBiology上的一篇研究论文中,来自德克萨斯大学癌症研究中心的研究人员通过研究表示,癌细胞可以适应一定的能量需求来进行扩散转移,癌症发生转移是引发癌症相关死亡的主要原因,揭示癌症转移的机理对于开发新型抗癌疗法非常关键.
研究者发现,癌细胞可以通过其―定居‖的部位获取不同的能量来继续其转移活动,在研究过程中研究人员发现了一种名为PGC-1α的蛋白质,其是一种对细胞代谢调节异常重要的转录激活子,对于癌细胞获取能量得以生存和扩散也至关重要.
ValerieLeBleu博士说道,开发新型的疗法主要集中于对癌细胞代谢的弱点进行攻击,因此确定扩散中的癌细胞的代谢需求就显得非常有意义,在癌细胞扩散到另一个位点过程中研究人员发现扩散中的癌细胞依赖于线粒体;癌细胞可以利用PGC-1α来刺激新生线粒体的生长,而线粒体作为细胞的能量工厂也为细胞提供源源不断的能量,当然癌细胞的转移同时也依赖于PGC-1α相关的一个过程,该过程名为氧化磷酸化,其可以在癌细胞扩散期间刺激ATP的产生.
如果线粒体是厨房的话,PGC-1α就是大厨师,而ATP就是氧化磷酸化的关键组分.
当某些癌细胞可以―旅行‖至机体别的位点时,仍会有12一部分癌细胞留存在―老巢‖繁殖生长,如果有一种疗法可以阻断癌细胞的迁移,那么抑制PGC-1α或许就有可能帮助抑制癌症转移.
最后研究者表示,我们都知道癌细胞非常喜欢转移寻找新家,本文研究揭示了乳腺癌患者中,侵袭性癌细胞中PGC-1α的表达和癌症远端转移产生的相关性,为后期开发新型抗癌疗法提供了新的线索和帮助.
(生物谷Bioon.
com)http://news.
bioon.
com/article/6659219.
htmlPNAS:鉴别乳腺癌组织的新工具2014年9月22日讯/生物谷BIOON/--近日研究发现,超过40%经历过乳腺癌手术的患者还需要再进行一次手术,因为外科医生在初次手术时可能对病灶处理的不够干净.
然而,布莱根妇女医院的研究人员(BWH)已经成功地测试了一种他们开发的工具,这将有助于医生更好的区分恶性乳腺组织和正常组织,从而减少病人重复手术的机会.
这个工具被称为解吸附电喷雾离子化(DESI)质谱影像(或解吸附电喷雾电离光谱成像),是通过把分子变成带电的分子,称为离子,这样它们就可以被质谱法鉴定.
通过离子质谱法分析,组织样本的内容物就可以被鉴定.
该工具喷出带电溶剂的微气流到组织表面用来收集有关分子组成和产生彩色图像的信息,这些信息可揭示肿瘤细胞的性质和浓度.
研究者使用DESI质谱影像观察脂肪酸物质的分布和数量,称为脂质.
这些脂质来自61个样本的乳腺组织和正常组织,这61个样本是从14个经历过乳房切除术的乳腺癌患者中得来的.
这个软件程序被用于给乳腺癌肿瘤进行定性,并用来界定健康组织和癌组织之间的界限.
研究者发现了好几种脂肪酸,例如油酸.
相比较于健康组织油酸大量存在于乳腺癌组织中.
该结果也证实了使用传统的病理学方法可以更精确的检测病灶组织.
―我们的发现证明了使用DESI质谱影像鉴别癌变组织和正常乳腺组织的可行性,‖NathalieAgar博士说,―研究结果可帮助外科医生使用它来快速检测在乳腺癌手术中残余的肿瘤组织,希望可以有效减少重复手术的次数.
‖(生物谷Bioon.
com)http://news.
bioon.
com/article/6659292.
htmlCancerRes:研究人员发现增加白血病发病的新基因2014年9月23日讯/生物谷BIOON/--近日,新加坡国立大学(NUS)癌症科学研究所发现Leo1基因表达的增加会影响与急性髓系白血病(AML)直接有牵连的其他基因,提高癌症的发病率.
新加坡国立大学癌症研究所科学家ChngWeeJoo副教授发现抑制Leo1和Leo1下游信号通路,可提供一个新的途径针对性治疗AML.
这项研究结果最近发表在CancerResearch杂志上.
此外,这是第一次有研究揭示了蛋白PRL-3在调控核糖核酸(RNA)相关过程中的作用,这一发现有助理解该蛋白质是如何有助于癌症进展.
该小组的工作是第一次大规模的定量调查在白血病中PRL-3所调节的蛋白.
PRL-3表达升高已与多种癌症类型包括胃癌,卵巢癌,宫颈癌,肺癌,肝癌和乳腺癌的发展和转移相关.
在大约一半的AML患者中,蛋白质PRL-3高表达与不良预后相关.
Chng教授和他的团队是首先报告,PRL-3蛋白在骨髓中的正常骨髓细胞中不存在,但PRL-3蛋白的表达在约47%的白血病病例中升高.
其结果是,PRL-3被视为有吸引力的治疗靶标.
先前,对于PRL-3机制研究是有限的.
在这项研究中,研究人员使用一种先进的新SILAC13型质谱仪,以更全面的方式来识别PRL-3诱导的所有蛋白变化.
使用这种方法,他们发现基因Leo1作为一种新型的PRL-3磷酸酶靶基因,能够抑制Leo1以及LEO1下游信号传导途径,这将是靶向治疗AML患者的新策略.
在研究的下一阶段,该团队将验证Leo1下游的几个重要蛋白质是否能被用作治疗PRL-3高表达的白血病的生物标志物和药物靶标.
http://news.
bioon.
com/article/6659221.
html新的抗癌药物靶标——脂质化学信使2014年9月21日讯/生物谷BIOON/--一半以上的人类癌症都具有脂质代谢化学信号异常上调,但这些信号在肿瘤形成过程中是如何被调控的仍没有得到充分的理解.
近日,宾夕法尼亚大学YouhaiChen博士等人发现:TIPE3(一种新近被新发现的致癌蛋白),通过靶向这些脂质信号途径促进癌症.
第二信使--脂质在细胞膜外信号到细胞内部的传递和放大过程中发挥基本作用.
一个最好的例子就是脂质第二信使PIP3,其传递数以百计的膜受体信号进入细胞内.
因此,当PIP3的功能出差错时,靶向PIP3药物可有效用于治疗多种疾病,包括癌症和炎症性疾病.
TIPE3属于一种新的蛋白质家族,是人类癌症和炎症的危险因素,但对其作用机制知之甚少.
Chen和同事们发现,TIPE3是第二信使PIP3的转运蛋白,但它被癌细胞―劫持‖,导致失控的细胞分裂.
TIPE3的高分辨率晶体结构显示其蛋白结构有一个大的空腔,捕获和传输PIP3及其化学前体PIP2,导致癌细胞的内膜中PIP3的增加,这就促进了激活下游PIP3效应,导致癌症.
重要的是,人类肺癌,结肠癌,卵巢癌和食道癌都有显著的TIPE3表达上调.
敲除TIPE3后,能减少恶性肿瘤细胞的生长,剔除小鼠TIPE3,能阻断肿瘤的形成.
这些发现解释了为什么正常的细胞可以控制自己的脂质信号,但癌细胞不能,虽然这一现象被广泛认可,但了解甚少.
新研究揭示在正常细胞中,TIPE3的表达量恰到好处,以确保适当的信号传送,调控细胞分裂.
而在癌症情况下,TIPE3表达上调,TIPE3可能是一种新的治疗标靶用于治疗恶性疾病.
该小组目前正在研究对策,以控制异常TIPE3表达来治疗或预防癌症.
http://news.
bioon.
com/article/6659148.
html【政策法规】卫计委放松基层用药限制多地非基药比例不超30%国家卫生计生委近日印发《关于进一步加强基层医疗卫生机构药品配备使用管理工作的意见》,调整了基层医疗卫生机构只能配备使用基本药物的办法.
今后基层医疗机构,如城市社区卫生服务中心和农村乡镇卫生院,除了基本药物外,还可从医保或新农合药品报销目录中,配备使用一定数量或比例的非基本药品,落实零差率销售.
为什么放松基层用药限制口子能开多大这对老百姓有什么好处会不会冲击基本药物制度记者进行了采访.
一问为何允许使用非基药很多慢性病使用非基药,新规使患者在家门口就能买药,不用总去大医院.
此前,政府办的基层医疗卫生机构只能全部配备和使用基本药物,这些基本药物包括国家基本药物目录药品和各省增补的基药目录药品.
此14次放开用药限制,可以使用医保目录内的非基本药物,是出于什么考虑呢药政司有关负责人指出,部分大中城市社区卫生服务中心和农村乡镇卫生院经过多年发展,服务功能和能力大大增强,临床用药需求增加.
为更好地适应基层基本医疗服务新要求、新特点,进一步满足基层用药需求,允许基层医疗卫生机构配备一定数量或比例的非基本药品.
北京大学医药管理国际研究中心主任史录文解释,很多慢性病如高血压、糖尿病等,使用的药物是非基药,而且要长期服用,因此在基层医疗机构往往买不到,患者还得定期去大医院买.
基层也能使用非基药后,能解决这部分患者的买药之难,衔接大医院和基层用药,有利于促进双向转诊,建立分级诊疗,更好地满足患者的需求.
《意见》提到"配备一定数量或比例非基本药品",但没明确规定,各地使用非基药的情况如何记者了解到,已经有不少省份在基层打开使用非基药的"口子",允许适度配备,满足基层用药需求.
如安徽最早明确在基层可以增加一定比例非基药;山东省明确,非基本药物的配备品种和采购金额,占基层机构所有药品配备品种和采购金额的比例均不应高于20%;浙江明确不超过30%;上海在基层社区卫生服务机构增加30种非基药,使用药品达到800多种.
在基层医疗机构,非基药的数量或比例究竟多少合适卫计委药政司司长郑宏认为,"制订基本药物采购计划,既要兼顾数量、质量、价格,也要考虑品牌、剂型、规格,还应与当年的消费指数、物价水平、医保筹资、工资收入挂钩,并留有余地.
"因此,主张将基层药品采购纳入地方财政预算,在收支平衡前提下,最大可能地采购优质企业生产的品种和剂型,满足人们的需求.
从地方实践来看,多地非基药比例不超过30%.
使用非基药怎么报销呢药政司有关负责人解释,基层医疗卫生机构使用的基本药物和其他药品,都要通过省级平台网上集中采购、集中支付并零差率销售,严禁网下采购.
也就是说,统一按照医保、新农合政策报销,零差率销售,没有加成.
二问为何不鼓励增补基药基药已达520种,各省增补药品过多、过于随意,且增补易导致不合理用药《意见》同时明确,以省(区、市)为单位增补非目录药品是基本药物制度实施初期的阶段性措施.
而2012年版国家基本药物目录基本适应基层用药需求,因此不鼓励进行新的增补.
既然放开了使用非基药的"口子",为何不直接把这些非基药增补到基药目录中,省得麻烦呢药政司有关负责人说,基本药物制度实施初期,为缓解基层用药不足,作为阶段性措施,允许各地以省(区、市)为单位增补非目录药品,既发挥了积极作用,也存在着不规范的问题.
随着2012年版基本药物目录的实施,《意见》明确提出不鼓励进行新的增补.
史录文说,北京大学医药管理国际研究中心在2011年3月专题研究了27个省份已公布的增补基本药物目录,平均增补188个,加上307种国家基本药物,我国基层医疗卫生机构平均配备基本药物达到了500种左右,有些省份达到600种,远远高于世卫组织推荐的标准.
2012版的国家基本药物目录药品达到520种,增补后有些地区达到800多种,已接近医保目录品种总数.
史录文介绍,调研发现各省重合的药品只有1种,这说明各省增补药品的随意性太强,地方存在一定程度的保护主义,而且一味满足基层医疗卫生机构的"习惯用药",会导致滥用抗生素、激素、维生素以及输液现象愈演愈烈,也隐藏着医药腐败的可能.
该中心在2010年底还对6省261家基层医疗卫生机构的基本药物使用情况进行调研,发现经济不发达地区的抗生素和注射剂的使用比率仍然很高.
"不应继续鼓励这样的用药方式.
"药政司有关负责人说,放开基层使用非基药15的"口子",不等于鼓励各省随意增补,而应挑选和当地公立大医院相衔接的医保目录内的非基药,使其在基层也能买到,并能报销更多.
有利于分流大医院患者,也有利于推行分级诊疗.
三问会否导致基药受冷落基药不一定是差药,通过医保报销、比例限制保障优先使用基药放开非基药使用限制,会不会大家都去用非基药,架空基药目录,基药制度变成虚设药政司有关负责人解释,仍鼓励优先使用基本药物.
通过处方审核和处方点评等方式加强监管,提升合理用药水平.
发挥药师在指导合理用药,特别是在处方审核与药物合理使用管理及研究工作中的作用.
推广《国家基本药物临床应用指南》和《国家基本药物处方集》,加快基层信息化建设,通过信息化手段来促进合理用药.
史录文认为,放开限制不会削弱基本药物的地位,反而会加强基本药物制度的作用.
各省增加的医保、新农合药物,不一定都会和目录中的基药功效重合,即使同一疾病每个人的用药都会有所不同,非基本药物不一定适合每一位患者.
而且还有医保、新农合的约束,也有使用比例和金额控制,满足了大量的、一般性的基本需求,同时适度照顾了特殊性的需求,从这个层面完善了基本药物制度.
"基本药物不一定就是差的、人人不喜欢用的药物.
它只是一种人人可公平获得、可及的保障性药品.
国家通过一个完整的筹资、遴选、采购、供应的体系,保障人人有药可用.
所以放开基层用药限制,只对基层用药问题改善,基本药物的主体保障作用仍在发挥.
"《意见》出台后,基层医疗机构与大医院使用的相同基药,以及相同的医保内的非基药,仍是同城不同价.
今后两类药品仍需要通过各类定价方式改革,实现同城同价,减少医保、新农合支出,减少看病支出.
什么是基本药物基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品.
如青霉素、红霉素、藿香正气水等.
2009年8月,《关于建立国家基本药物制度的实施意见》《国家基本药物目录管理办法(暂行)》和《国家基本药物目录(基层医疗卫生机构配备使用部分)》(2009版)同时发布,自此我国建立国家基本药物制度工作正式实施.
政府举办的基层医疗卫生机构全部配备和使用基本药物,其他各类医疗机构也都必须按规定使用基本药物.
凡是纳入医保报销基本目录范围的药物,因病情需要使用且符合医保相关报销规定的,均能得到一定比例的报销.
基本药物如此,非基本药物也是如此.
基本药物与非基本药物在医保报销方面的不同有:一是基本药物全部纳入基本医疗保障药品报销目录的范围,而非基本药物仅有部分纳入;二是国家鼓励使用基本药物,基本药物的报销比例明显高于非基本药物.
http://politics.
people.
com.
cn/n/2014/0911/c1001-25637406.
html处方药网售即将放开首批目录待定处方药网上销售有望近期放开.
据国家食药总局人士对财新透露,目前有关方案正待审批,监管部门正在研究第一批开放的处方药目录,目录药品主要以慢性病、常见病类用药为主,多为长期用药,用药风险较低.
据财新记者了解,国家食药总局还将鼓励第三方平台与网上药店相结合,通过第三方物流做更加专业和规模化的配送,具体细则正在商定中.
慢性病处方药或首开闸今年5月28日,国家食药总局发布《互联16网食品药品经营监督管理办法(征求意见稿)》,明确指向开放处方药网上销售、准入第三方物流和单体药店也能获得网上牌照等重要内容,被业界普遍视为医药电商大跨步前进的号角.
《意见稿》明确提出―凭处方销售处方药‖,―有执业药师在线药事服务‖等重要内容,这是国家食药总局首次对外认可网销处方药品,被业内普遍认为网上药店即将步入―新时代‖.
有接近食药总局人士透露,《意见稿》有望10月落地.
业内普遍认为,一些慢性疾病,如糖尿病、肿瘤等药物,通过网络销售,将有一定的价格优势.
顾客对这些药物可能有长期、稳定的需求,慢性病处方药和―特药‖是未来值得医药电商主攻的方向.
业界人士认为,网售处方药将给消费者带来实惠.
―会比传统渠道便宜20%到40%.
处方药放开后,价格差异会更加明显.
‖掌上药店CEO王俊海对财新记者表示,如果医药电商能对接医保,对于消费者而言,享受低价则更加便利.
同时,电子处方和处方药的解禁将大幅降低医院的门诊人次,缓解看病难、提高医疗服务迎来新契机.
处方药蓝海2014年年初,国务院副总理汪洋到京东视察,京东在汇报中提到京东医药电商业务在参与国家发改委的医药分离试点计划,试点销售处方药.
消息传出,震惊四座.
处方药一直是网上售药的禁区,同时,占医药市场80%比例的处方药一直被视为医药电商的最大蓝海,据瑞银证券估算,线上处方药经营放开意味着医药电商的市场空间将从2000亿元的OTC(非处方药)市场扩展至近万亿的OTC+处方药市场,进而扩展至3万亿左右规模的大健康市场.
除了京东,天猫也做足了准备.
近日,天猫在多家招聘网站招聘大量执业药师,有消息称,天猫在为网上药店销售处方药开禁做准备,更有分析认为,这意味着阿里巴巴不再满足于平台角色,欲自建销售平台卖药.
好药师网上药店负责人也对财新记者透露,虽然处方药放开的文件还没有落地,但从今年3月起,好药师方面已经做出相关部署,准备系统、商品库、仓储物流和执业药师资源,一旦放开,处方药业务可以马上运转,电子处方也可以马上上线.
放开后的难题处方药若能放开,被认为将有力推动公立医院改革进程.
―处方药和电子处方的开放是医药分开的趋势所在.
‖天猫医药馆负责人对财新记者表示.
王俊海也认为,推动电子处方和处方药放开,将有越来越多的药品剥离医院进行销售.
―目前药店2500亿规模,医药分家后有可能超过8000亿.
‖但中国医药体制的特殊性使得医药电商举步维艰.
京东内部人士透露,医院处方普遍是不公开的,其中存在争议性风险,另外,医院一旦公开处方,相当于将处方药收益让渡给京东,医院是没有动力的.
―现在主要靠地方主管部门的行政命令,医院资源需要一家家突破,京东只能做区域性试点,并且只针对小部分处方药.
‖京东内部人士透露,京东曾尝试推出处方药,但很快被勒令下架.
财新记者联系京东时,京东也以处方药话题太敏感拒绝采访.
电子处方已先行在部分地区试点.
2013年,河北邯郸和吉林长春都曾在全市的药店推行电子处方,患者通过互联网视频和医生沟通后,医生的处方就能开出,药店凭此出售处方药.
但出于对安全性风险和利益关联性的争议和担忧,试点没有在全国大范围推广开.
另外,处方药网上销售需要有配套的执业药师队伍,但根据国家食药总局公布的数据,截至2014年5月底,全国累计有28万人取得执业药师资格,根据药品生产、流通、使用领域的分布各占约三分之一的原则计算,我国药品使用领域的执业医师不会超过10万人,而他们中的大部17分都供职于医疗机构,无论是线下零售药店,还是线上网络药店,执业药师数量都存在着严重短缺.
http://china.
caixin.
com/2014-09-12/100728195.
html国家食药总局公布第一批过度重复药品品种目录的公告9月12日,国家食品药品监督管理总局公布了关于公布第一批过度重复药品品种目录的公告.
公告原文如下:为更好地引导药品合理申报,避免市场药品同水平重复,防止研发投入风险,促进药品产业健康发展,依据《中华人民共和国药品管理法》、《药品注册管理办法》等有关法律法规,国家食品药品监督管理总局对在国内已上市药品和正在申报注册的药品进行全面调查,选出第一批过度重复的已上市药品品种34个、过度重复申报注册的药品品种16个,现予以公布(见).
http://www.
sfda.
gov.
cn/WS01/CL0087/106390.
html&from=timeline&isappinstalled=1六部委推进医药分开9月9日,商务部网站公布了商务部、发改委等6部门《关于落实2014年度医改重点任务提升药品流通服务水平和效率工作的通知》,通知指出要采取多种方式推进医药分开,逐步形成医师负责门诊诊断,患者凭处方到医疗机构或零售药店自主购药的新模式.
专家提醒,医药分开后,药品安全问题责任需界定.
采取多种方式推进医药分开鼓励零售药店发展和连锁经营通知指出,在公立医院改革试点城市,可探索由规模较大、质量控制严格、执业药师药事服务制度完备、诚信记录好的零售药店,承担医疗机构门诊药房服务和其他专业服务的多种形式的改革,并切实加强医疗机构药事管理工作,推进临床合理用药.
通知提出,要逐步形成医师负责门诊诊断,患者凭处方到医疗机构或零售药店自主购药的新模式,并确保医疗机构按照《处方管理办法》(原卫生部第53号令)开具和调剂处方,保障患者的处方知情权和购药选择权.
此外,通知要求有关部门要结合深化医改和医药分开试点工作,提高零售药店在药品终端市场上的销售比重,清理妨碍零售连锁药店发展的政策性障碍,缩短行政审批所需时间;发展改革部门要依法查处药品生产流通企业与医疗机构在药品销售中存在的的各种价格垄断行为;人力资源社会保障部门要将符合资质条件的零售药店及时纳入医保定点范围,逐步扩大医保定点零售药店覆盖范围.
―以药补医‖扭曲公立医院补偿机制民众对―医药分开‖寄予厚望―以药补医‖是上世纪50年代,国家为弥补医疗卫生事业经费不足制定的政策.
即允许医院销售药品时,在进价基础上加价15%.
随着时代发展,弊端逐渐显现.
一位在互联网公司上班的职员告诉中新网健康频道,自己感冒发烧这种病都不敢去医院,怕一不小心就搭进去好几百,小病小痛都是―自诊‖,然后去药方买药完事.
最近几十年来,因为―以药补医‖机制,形成了扭曲的公立医院经济补偿机制和追求自身利益最大化的内在驱动,导致公立医院公益性弱化,造成群众―看病难、看病贵‖难题.
医生开大处方、患者―看病贵‖问题暴露出―以药养医‖问题,导致医患失信,甚至纠纷频发.
目前,许多民众对―医药分开‖寄予厚望.
今年7月份开始,北京就开始在一些试点医院实行―医药分开‖.
北京友谊医院实行―医药分开‖的第一周,药费总计为患者让利164.
82万元.
根据北京医管局的问卷调查结果,88.
4%的患者认为专家门诊的交流和解释时间比以前增加了,18认为解释不充分的仅为9.
2%.
比如,一位患者反映,实行改革后,看专家号的时间明显增加,专家的服务更好了,专家解释到位,感觉很满意;对医生服务的总体满意率为90.
2%,其中十分满意为35.
8%,不满意仅为2.
6%;44.
4%的患者明显感觉到药品支出下降了.
医药分开后药品安全问题责任需界定此前,北京清华长庚医院CEO助理杨长青博士在做客中新网健康频道视频访谈间时表示,医药分开后,隐形的药品的安全问题会更加突出.
药品的质量有问题,可能会给病人带来伤害,这个时候病人是找药房求偿,还是找医院需要界定.
―一直在说以药养医不对,所以这个办法叫做医药分开,就没有以药养医的问题了,分开之后它的目标是达到了,但是另外的问题就出现了.
‖杨长青分析,―医药分开还有一个隐含的安全问题.
当药房是医院药房的时候,医院就是整个责任的主体.
当药房不再是医院的药房,变成零售药房了,他也是法人,我也是法人,如果出了问题,这两者之间要重新界定责任.
很显然现在的药品质量,药品发放环节的控制,还没达到这样一个安全环境,使得大家都能够非常清楚的界定.
在这种情况下会有很多纠纷隐患.
比如医生开药没问题,但是你抓药抓错了,药品的质量有问题,可能都会给病人带来伤害,这个时候病人就要选择到底是找药房来求偿,还是找医院.
‖目前,国际上已经达到医药分开了吗对此,杨长青指出,医药分开存在利益再分配的问题.
―比如说台湾的长庚,他们也是非常庞大的体系,有一万多张病床,他们的药就是自己采购,自己管理,最大的问题就是品质问题,我可以交给别人去做,但是这个问题解决不了,责任就又都回到医院来了,所以医院必须来承担这一部分.
在其他地方,比如美国很多是药房在医院外边的,但是美国解决的问题是收费完全是分开的,这个是现在我们后段要面临的现实问题.
‖改革不能―一刀切‖特殊情况要特殊考虑实行―医药分开‖后,可以切断医生收入与药品销售的直接联系,医生便没有了开大处方、开贵药的动机,专心诊疗,百姓则可以选择平价药店购买药品.
一边,确实可以让百姓看病买药更实惠,而另一边,也有些医院表示新政不利于医院生存.
据健康界报道,北京佑安医院院长李宁曾表示,相比朝阳医院一万人次以上的日门诊量,他所在的佑安医院日门诊量只是朝阳医院的五分之一左右.
如果将改革方案照搬过来的话,医院十分吃亏.
李宁谈到,医院已经进行了相关测算,按照现行的运行状态,如果直接复制五家改革试点医院做法,佑安医院一年要少收入5000万到6000万,如果想要持平的话,医院日门诊量需要增加3倍,住院病人床位周转率要再缩小一半,但这对医院来说显然是无法实现的.
据了解,佑安医院属于传染病医院,门诊量少,手术量少,用药量大如果取消―以药补医‖,医院和医生的利益都会直接受到很大的影响.
与此情况相类似的还有地坛医院等.
此外,据羊城晚报此前报道,医院的药房由门诊药房、急诊药房和住院药房三部分构成.
―用药救急,急诊不能靠社会药房‖,一位业内人士称,急诊可以先救人再交钱,而到药房买药则得先交钱.
而住院用药品类繁多,一般药房很难保证品种齐全.
http://finance.
chinanews.
com/jk/2014/09-10/6576809.
shtml【业界新闻】湖南省纪委官员实名举报国家药监局前局长8月12日上午,湖南省纪委预防腐败室副主任陆群,通过其名为―御史在途‖的实名认证微博账号,实名举报国家食品药品监督管理局前局长、现国家药典委常务副主任委员邵明立.
19陆群当天公开发布的第一条微博称:―国家食品药品监管总局为利益集团代言,给数以千万计的百姓造成无比重大的经济损失……本人将以铁的证据揭露该局祸国殃民的问题.
‖其实名举报迅速引发―围观‖.
陆群称,2005年前后,国家药典委把中国南方地区传承上千年的―金银花‖更名为―山银花‖,把金银花作为山东―忍冬花‖的专用名.
南方金银花被国家食药监总局更名为―山银花(山寨版金银花)‖之后,价格一落千丈.
北方金银花贩子趁机大量低价收购,冒充北方金银花高价卖出,谋取暴利.
南方上千万花农则血本无归.
据官方简历,邵明立是山东济南人.
―(上午发帖)先预热一下,会继续发布证据.
‖陆群告诉21世纪经济报道记者,他从今年5月份开始关注和调查这个事情,原因是湖南、贵州等南方五省的农民提出异议,他收到了老百姓的举报信.
7月8日,陆群发表微博称,曾私信中国食品药品监管官微未得回复,表示将写《敦促国家食品药品监管总局局长引咎辞职书》.
一个月过去,8月12日起,他将陆续发布信息.
陆群还告诉21世纪经济报道记者,相关证据包括利益集团背后操纵的证据、对金银花的本草考证等等,下午他会陆续通过微博发布.
对于是否担心会对其职务身份造成影响,―丝毫不担心受影响.
‖陆群称,他以一名普通党员身份,为四川、湖南、重庆、贵州、广西上千万名少数民族地区农民代言,如果说代表一定利益的话,是代表上千万少数民族地区农民的利益.
陆群现任湖南省纪委预防腐败室副主任,微博名―御史在途‖,2011年,他曾以微博形式向湖南长沙县县委书记杨懿文叫板,声讨警方殴打讨薪民工.
并称有过错的一方应―立即辞职以谢天下‖.
公开资料显示,邵明立,1951年10月生,山东济南人,1995年担任卫生部药政管理局副局长,历任卫生部药政管理局局长,国家药品监督管理局副局长、局长,2008年至2012年,担任卫生部副部长,国家食品药品监督管理局局长.
2012年2月,国务院免去邵明立的卫生部副部长、国家食品药品监督管理局局长职务.
国家药典委员会官网显示,邵明立现任国家药典委员会常务副主任委员据了解,―金银花‖本是―开出黄白两色花‖的整个忍冬科植物的总称.
处于不同地域的人们心中的金银花,是指当地所产的一种或几种忍冬科植物.
―山银花‖之名首载于1977年版《中国药典》,金银花植物来源有忍冬、红腺忍冬、山银花和毛花柱忍冬4种.
1985、1990、1995、2000年4版药典中金银花的表述仍是以上4种.
2005年版《中国药典》将忍冬科的几个药用植物分开成两个药物名称,即金银花、山银花.
在金银花项下只载忍冬,而在山银花项下收载了灰毡毛忍冬、红腺忍冬、华南忍冬.
而灰毡毛忍冬(南方金银花)的商品化产量最大.
―山银花‖主产地以湖南隆回、重庆秀山、贵州道真、湖北、广西等西南山区为主,主产地几乎均属于国家级扶贫开发县.
―金银花‖换名成了―山银花‖,产品被打压出现滞销.
据湖南卫视新闻联播2013年7月报道,2010年以前,邵阳隆回一公斤金银花的干花可卖220元,湿花也能卖8元,而2013年,一公斤干花最多卖20元,湿花只能卖到0.
8元,隆回的―致富花‖变成―伤心花‖.
http://jingji.
21cbh.
com/2014/newsmaker_812/1266214.
html盘点2014年FDA批准的孤儿药1982年,美国的罕见病家庭和支持团体成20立了一个―非正式联盟‖,呼吁立法支持孤儿药和治疗罕见病的药物研发,1983年,这个组织成功使美国国会通过了―孤儿药法案‖,该法案制定了发展孤儿药的诸多激励性措施.
30多年过去了,FDA共认证近3000个孤儿药,获批的有400多个,涉及447种罕见病的治疗.
在其2013年批准的27个新药中,也有10个是孤儿药.
下面就让我们细数2014年1月至今FDA批准的孤儿药:1.
trametinib/dabrafenib:该组合疗法2014年1月8日获FDA批准,2012年9月20日被FDA认定为孤儿药,认定适应症为IIb期到IV期的黑色素瘤.
trametinib和dabrafenib均为葛兰素史克研发,用于治疗不能手术切除或转移性FDA确诊的BRAFV600E或V600K突变型黑色素瘤.
联用疗法中服用150mgtrametinib胶囊和2mgdabrafenib片.
2.
tasimelteon(他司美琼):商品名Hetlioz,2014年1月31号批准上市,2010年1月FDA授予其孤儿药资格.
本品由Vanda研发,是一种褪黑激素受体激动剂,用于治疗完全失明患者的非24h睡眠障碍,这是FDA首次批准用于治疗该疾病的精神障碍用药.
3.
ibrutinib(依鲁替尼):商品名Imbruvica,2013年11月首次获FDA批准,用于治疗套细胞淋巴瘤,而其2012年6月4日被授予孤儿药地位的适应症为2014年2月12日批准的慢性淋巴细胞白血病适应症.
依鲁替尼是布鲁顿酪氨酸激酶抑制剂,由最早由因绘制―人类基因组图谱‖而闻名的美国塞莱拉(Celera)基因技术公司开发,但由于Celera资金和资源问题,2006年Celera将该药的开发权转让给加州的Pharmacyclics公司.
2011年,强生旗下子公司杨森制药(Jassen)通过先期支付1.
5亿美元而获得与Pharmacyclics公司合作开发的权利,一旦新药临床试验成功并且获批上市,Pharmacyclics制药公司将共计获得9.
75亿美元收入,双方还将共同分享销售所得.
4.
elosulfasealfa:商品名Vimizim,2014年2月14日获FDA批准上市,2009年5月15日被授予孤儿药资格,用于治疗ⅣA型黏多糖贮积症(半乳糖-6-硫酸酯酶缺乏引起).
本品能够替代患者体内缺乏的半乳糖-6-硫酸酯酶,由BioMarin研发,也是首个获FDA批准治疗该疾病的药物.
5.
droxidopa(屈昔多巴):商品名Northera,2014年2月18日获FDA批准上市,2007年1月17日获孤儿药认证,用于治疗原发性自主神经衰竭患者、多巴胺-β-羟化酶缺乏症患者以及非糖尿病自主神经病变患者的神经症状性体位性低血压.
本品有灵北制药研发,目前国内已有上市.
6.
metreleptin(美曲普汀):商品名Myalept,2014年2月24获FDA批准上市,2001年8月22日被认定为孤儿药,用于治疗脂肪代谢障碍继发的代谢紊乱,美曲普汀可以辅助饮食作为先天或继发性脂肪代谢障碍患者瘦素缺乏并发症的替代疗法.
本品由Amylin研发,是一种重组人甲硫氨酰瘦蛋白(人瘦素类似物).
7.
propranolol(普萘洛尔):商品名Hemangeol,2014年3月14日FDA批准普萘洛尔口服溶液上市,由PierreFabreDermatologie研发,用于治疗婴儿血管瘤,该药因此适应症2008年9月5日获得孤儿药资格.
8.
miltefosine(米替福新):商品名Impavido,2014年3月19日获FDA批准上市,由PaladinTherapeutics研发,用于治疗利什曼病,2006年10月10日被授予孤儿药地位.
米替福新是一种十六烷磷酸胆碱,最初作为抗肿瘤药物研制,后发现其有抗寄生虫的作用.
9.
CoagulationfactorIX(recombinant)Fcfusionprotein:重组凝血因子IXFc融合蛋白,商品名Alprolix,本品由百健艾迪研发,2014年3月28日FDA批准其用于控制和预防B型血友病(先天性凝血因子IX缺乏症或圣诞节病)患者出血发作,该药物因此适应症2008年10月30日被授予孤儿药地位.
10.
ethiodized油注射剂:商品名Lipiodol,21本品由GuerbetLLC研发,2014年4月4日获FDA批准上市,2013年9月26日被认定为孤儿药,用于已知肝癌患者肝动脉内直接使用后癌细胞呈像.
11.
ramucirumab(雷莫芦单抗):商品名Cyramza,礼来研发,2014年4月21日获FDA批准上市,2012年2月16日被授予孤儿药地位.
本品是人血管内皮生长因子受体2拮抗剂,用于进展期胃癌或胃食管连接部腺癌患者的治疗.
12.
siltuximab:商品名Sylvant,本品是白细胞介素6单克隆抗体,原研强生,2014年4月23日获FDA批准上市.
2006年5月26日被认定为孤儿药,用于治疗罕见病多中心型巨大淋巴结增生症(MCD),亦称Castleman病(CD),该病属原因未明的反应性淋巴结病之一,临床较为少见.
13.
mercaptopurine口服溶液:6-巯基嘌呤口服液,商品名Purixan,2014年4月28日批准用于儿童急性淋巴细胞白血病患者,本品由Nova实验室研制,6-巯基嘌呤口服液也凭借此适应症于2012年8月20日被授予孤儿药地位.
14.
ceritinib(色瑞替尼):商品名Zykadia,由诺华研制,2014年4月29日获FDA批准上市,用于治疗间变性淋巴瘤激酶(ALK)阳性转移对克唑替尼进展或不能耐受的非小细胞型肺癌(NSCLC).
2013年9月27日,色瑞替尼因此适应症被授予孤儿药地位.
本品是一种口服的小分子ALK酪氨酸酶抑制剂.
与克唑替尼相比,色瑞替尼不抑制MET激酶的活性,但可抑制IGF-1(胰岛素样生长因子1)受体.
15.
antihemophilicfactor(recombinant)Fcfusionprotein:重组抗血友病因子Fc融合蛋白,商品名Eloctate,本品由百健艾迪研发,2014年6月6日被FDA批准上市,并在2010年11月23日被授予孤儿药地位,用于控制和预防成人和儿童血友病A(先天性Ⅷ因子缺乏症)出血事件,围手术期处理,以及防止或减少出血发作的常规预防.
16.
coagulationfactorVIIa(recombinant):重组凝血因子VIIa,商品名NovosevenRt,由诺和诺德研制,2014年7月2日被批准用于革兰滋慢氏凝集无力症(血小板无力症),主要是针对对血小板输注抵抗的成人和儿童患者.
本品2004年6月18日被授予孤儿药地位.
17.
Belinostat:商品名Beleodaq,本品是一种组蛋白去乙酰化酶抑制剂,用于治疗复发难治性外周T细胞淋巴瘤(PTCL).
2009年9月3日被授予孤儿药地位,2014年7月3日在美国获批.
Belinostat最初由丹麦Curagen制药公司研发,在2005年转让给TopoTarget制药公司,而后TopoTarget又在2008年以二千六百万美元收购Belinostat的全部开发权.
在2010年TopoTarget和Spectrum制药公司达成协议,共同开发.
在国内深圳万乐申报了一项简单、安全的合成Belinostat的方法,已获得国家知名产权局下发的专利证书,同时获准FDA进入快速审批通道,在国内属于首创.
18.
C1-esteraseinhibitor(recombinant):重组C1酯酶抑制剂,商品名Ruconest,1999年2月23日获孤儿药地位,2014年7月16日批准上市.
由Stantarus和Pharming集团共同研发,用于治疗遗传性或获得的C1酯酶抑制剂缺乏引起的血管性水肿急性发作.
遗传性血管性水肿系常染色体遗传性疾病,可发生于任何年龄,而多见于成年早期,是一种罕见的和潜在的威胁生命的疾病.
19.
dantrolenesodium:丹曲林钠,混悬型注射液,每一小瓶的治疗剂量为250mg/5mL,可在不到1分钟的时间内注射完毕,大大缩短了治疗时间.
本品商品名Ryanodex,由Eagle制药研制,2014年7月24日获FDA批准上市.
此前,FDA已于2013年8月授予Ryanodex孤儿药地位,用于治疗恶性高热(MH).
MH是一种遗传性肌病,以高代谢为特征,患者接触到某些麻醉药物后触发.
该病是目前所知的唯一一种可由常规麻醉用药引起围手术期死亡的遗传性疾病.
20.
idelalisib:商品名Zydelig,由Calistoga研发,后被吉列德购买,2014年7月23日获FDA22批准上市.
本品被授予两项孤儿药地位,一项是作为单药治疗复发性滤泡B细胞非霍奇金淋巴瘤(FL),2013年9月26日被授予;另一项是用于治疗慢性淋巴细胞白血病(CLL)和复发性小淋巴细胞淋巴瘤(SLL),2013年10月15日被授予.
21.
eliglustat:商品名Cerdelga,由美国健赞公司开发,2008年9月17日被授予孤儿药称号,2014年8月19日被FDA批准用于治疗I型戈谢病.
戈谢病是一种罕见的遗传病,这类患者不能产生足够的葡糖脑苷脂酶,该酶缺乏会引起不正常的葡萄糖脑苷脂在网状内皮细胞内积聚.
22.
eltrombopag(艾曲波帕):商品名Promacta,葛兰素史克开发,2008年第一次在美国上市,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性特发性血小板减少性紫癜(ITP)患者的血小板减少.
但是本品2013年11月8日被授予孤儿药称号是由于其治疗对免疫抑制疗法反应不足的重症再生障碍性贫血(SAA)患者血细胞减少症,该适应症2014年8月26日获FDA批准.
SAA是一种罕见疾病,患者骨髓无法产生足够的新血细胞.
目前,尚未有药物获批用于对初始免疫抑制疗法无响应的SAA患者的治疗,这类患者在确诊后,约有40%的患者在5年内会死于感染或出血.
23.
pembrolizumab:商品名Keytruda,由默沙东开发,2012年11月19日被授予孤儿药称号,2014年9月4日正式获批,成为FDA批准的首例程序性细胞死亡1(PD-1)单抗.
该药适应症为不可切除的或转移性黑色素瘤.
Pembrolizumab是一种新型人源化单抗,通过作用于PD-1提升人体免疫力,消灭晚期黑色素瘤.
本品是该类型药物的首创,包括百时美施贵宝、罗氏及阿斯利康在内的公司正在竞相开发用于各种癌症的类似治疗药物.
http://pharm.
cmt.
com.
cn/detail/597657.
htmlAdaptimmune募集1亿美元促进癌症免疫疗法研究2014年9月26日讯/生物谷BIOON/--英国生物技术公司Adaptimmune公司今年下半年以来获得了许多投资者的青睐.
先是制药巨头葛兰素史克公司与其签订了一项价值3亿5千万美元的合作协议,最近公司又宣布获得了多家投资公司总额达1亿4百万美元的融资.
OrbiMedAdvisorsLLC等著名风投公司都参与到了Adaptimmune公司的此轮融资中.
很难想象,这家公司在今年七月初仅有1百万英镑的流动资金.
而Adaptimmune公司获得众多投资者青睐的法宝就是公司进行的T细胞受体疗法技术.
Adaptimmune公司长期以来都致力于通过修饰T细胞,使其更具靶向性和杀伤性.
Adaptimmune公司希望这种技术能够在癌症治疗过程中能够特异性杀灭肿瘤细胞并保持健康细胞的完好无损.
听起来这一技术与最近癌症研究领域流行的融合抗原受体T细胞(CAR-T)技术很相似,但是Adaptimmune公司显然希望有着自己的特点,公司CEOJamesNoble介绍说,不同于其他公司的癌症免疫疗法主要锁定细胞表面抗原的做法,Adaptimmune公司的癌症免疫疗法主要针对的是细胞内抗原.
目前,Adaptimmune公司和葛兰素史克公司正全力进行相关药物NY-ESO-1的研发并预计在未来18个月内将其推进到临床研究阶段.
最近几年,癌症的免疫疗法研究可谓是风头无两,许多生物技术公司都纷纷涉足这一领域,并凭借这一领域的工作吸引了众多投资者的目光.
如西雅图的CAR-T疗法先驱,Juno公司此前就获得了总额3亿美元的投资,Kite医药公司也在IPO中募集了超过1亿2千万美元的投资.
然而,必须要承认的是,癌症免疫疗法要真正成熟,广泛应用于临床还有很长一段路要走,究竟这一研究领域能够成为人类征服癌症的排头兵23还是沦为各大生物医药公司"圈钱"的一个噱头时间会证明一切.
http://news.
bioon.
com/article/6659329.
htmlVentiRx融资5000万美元用于癌症免疫疗法2014年9月25日讯/生物谷BIOON/--本月早些时候,总部位于西雅图的生物技术公司VentiRx公司曾向外界透露公司已经完成了一项用于支持其TLR8癌症疫苗研究的融资,但是公司并未透露融资的具体金额.
最近VentiRx公司提交的SEC表透露了公司将募集超过5000万美元的资金用于相关项目的研发.
而对于VentiRx公司而言,今年的秋天分外忙碌.
公司先是从Frazier、Arch等投资公司获得了大量经费用于开发其处于中期研究阶段的VTX-2337.
然后是与美国LudwigCancerResearchInstitute建立合作关系,共同开发阿斯利康公司的检验点抑制剂类药物MEDI-4736.
同时公司CEORobHershberg还宣布公司将在西雅图设立研发中心,用于开发包括CAR-T药物在内的新型癌症免疫疗法.
近年来兴起的癌症免疫疗法热潮目前的发展似乎并不顺利,近一段时间这一研究领域频频传出令人失望的消息.
例如德国默克公司最近就彻底放弃了其癌症疫苗tecemotide的研发工作,同时公司的另一种癌症药物MAGEA-3在一项临床研究中也遭遇了滑铁卢.
尽管如此,包括VentiRx公司在内的许多生物技术公司仍然对这一领域充满信心,希望凭借自身的优势实现华丽的逆袭.
而西雅图目前也成为了癌症免疫疗法的中心.
这一地区汇集了FredHutchinsonCancerResearchCenter等在癌症研究领域首屈一指的研究中心,同时,CAR-T药物领域的先驱Juno生物技术公司也坐落在这里.
VentiRx公司在这一地区建立研发中心显然也是希望借助这一地区的强大学术实力帮助自身在癌症免疫疗法领域取得突破.
http://news.
bioon.
com/article/6659328.
htmlFDA批准塞尔基因Otezla用于中重斑块状银屑病塞尔基因于9月23日报道称,该公司口服磷酸二酯酶4抑制剂Otezla(apremilast)获FDA批准用于适合光疗或系统性治疗患者的中重度斑块状银屑病.
塞尔基因炎症及免疫肿瘤总裁Smith评论称,"Otezla为一系列斑块状银屑病患者提供了一种有价值的治疗选择,这款药物适用于未经治疗及经历过治疗的患者,包括那些之前使用生物制剂或常规系统制剂治疗的患者.
"这款治疗药物此次适应症的扩展基于三项3期试验,有1426名中重度斑块状银屑病成年患者参与.
在ESTEEM1和ESTEEM2研究中,按照银屑病面积和严重程度指数得分,在治疗到第16周时,Otezla与安慰剂相比,与斑块状银屑病显著及临床有意义的改善相关,同时,按静态医师清理或几乎清理整体评价得分,在两项试验中疾病均有临床改善.
Otezla于3月份被FDA批准用于成人患者活跃型银屑病关节炎,同时这款治疗药物于2013年第二季度在加拿大被申请用于相同的适应症.
这款药物还在加拿大被申请用于治疗银屑病,去年第四季度在欧洲被申请用于银屑病和银屑病性关节炎.
分析师预测这款药物2017年的销售额大约为10亿美元.
塞尔基因还在开发这款药物用于多种其它适应症.
今年初,该制药商披露,Otezla经过16周治疗后与安慰剂相比,虽不能明显改善强直性脊柱炎患者的症状,但治疗24周时,在一个亚组的早期疾病患者中观察到"有意义的疗效".
此外,该公司之前还报道了这款口服治疗药物在中期研究中治疗贝赛特氏症的阳性结果.
http://www.
firstwordpharma.
com/node/1236579tsid=28®ion_id=2#axzz3EEy7NjC724FDA许可首款酵母病原体的血检产品上市9月22日,美国FDA许可用于引起血流感染的五种酵母病原体检测的首款直接检测产品在美国上市,五种酵母病原体分别为白色念珠菌和/或热带念珠菌、近平滑假丝酵母菌、光滑念珠菌和/或克柔假丝酵母菌.
酵母血流感染是一种真菌感染,如果得不到迅速治疗,它们可能导致严重的并发症,甚至死亡.
这些酵母病原体可能在抵抗力弱的人中引起严重的血液感染,这些人包括经历癌症治疗的患者、器官移植后接受免疫抑制治疗的患者或特护病房的危重病患者.
检测血流中酵母病原体的传统方法可能需要6天,为了确定特定酵母病原体的存在甚至需要更多的时间.
T2CandidaPanel和T2DxInstrument(T2Candida)可在三至五小时内从单一血样确定这五种常见的酵母病原体.
由于酵母血流感染不常见,并且使用T2Candida可能得出虚假阳性结果,所以医师应该进行血液培养,以证实T2Candida结果.
"通过一种血样检测五种酵母病原体,并且在几小时内获得检测结果,医师可及早地实施合适的抗真菌治疗,潜在减少患者疾病,降低死于这些感染的风险,"FDA器械及放射卫生中心体外诊断及放射卫生办公室主任Gutierrez表示称.
T2Candida结合了中断酵母细胞分裂、释放DNA的技术.
它然后制造许多拷贝的靶点DNA,利用磁共振技术检测放大的DNA.
如果发现有酵母DNA,T2Candida也将自动确定酵母病原体的种类,给出可以帮助指导卫生保健供应商提供合适治疗的信息.
FDA通过重新分类程序完成对T2Candida的审查,重新分类程序是一种用于某些低至中度风险的新型医疗器械.
FDA的许可基于一项由1500名患者参与的临床研究,T2Candida在研究中正确分类了大约100%有酵母病原体存在的阴性样本.
在一项单独的有特定酵母病原体浓度的300个血样的临床研究中,T2Candida正确确定了84-96%阳性样本中的病原菌.
T2Candida由位于马萨诸塞州列克星顿市的T2Biosystems公司生产.
http://www.
fda.
gov/NewsEvents/Newsroom/PressAnnouncements/ucm415728.
htm治疗近视性脉络膜新生血管病变药物Eylea在日本获批Bayer与研发伙伴Regeneron联合拥有的重磅炸弹式产品Eylea近来不断获得各国的批准和销售的新高.
就在前不久刚刚获得欧洲的重要肯定后,近日Eylea在世界上第三大市场——日本又获批准,用于治疗近视性脉络膜新生血管病变(myopicCNV).
Bayer本周一宣布,日本厚生劳动省此次对Eylea的批准是基于一项III期临床的积极数据,在这项名为MYRROR的III期临床试验中,myopicCNV患者在24周内的视力均明显改善.
Bayer方面还表示,在日本病理性近视和myopicCNV相关疾病是致盲的最常见原因.
Bayer全球发展负责人JoergMoeller在一份声明中指出,myopicCNV的预后较差,需要更多的治疗选择来满足患者的紧急医疗需要,尤其是很多患者还处于工作年龄阶段;同时具有防止永久性视力丧失并提高视力双重疗效的药物可以给病理性近视患者带来极大的好处.
http://www.
pharmadl.
com/yyzlshows_0102139b-fd5a-4408-9f28-79984a355afc.
htmlFDA批准Xtandi胶囊新适应症用于治疗转移性CRPC9月10日,Medivation和安斯泰来制药公25司宣布,FDA批准Xtandi(enzalutamide)胶囊新适应症-治疗转移性去势抵抗前列腺癌(CRPC).
在新适应症批准前,基于III期PREVAIL试验结果,Xtandi(enzalutamide)胶囊获得补充新药申请(sNDA)的优先审查权.
2012年8月,FDA首次批准Xtandi(一种口服,每日一次的雄激素受体抑制剂)用于治疗曾接受多西他赛(化疗)的转移性CRPC.
新适应症批准Xtandi用于未接受过化疗的转移性CRPC男性患者的治疗.
转移性CRPC被定义为癌细胞已经扩散到前列腺,并且尽管治疗(即用促性腺激素释放激素(GnRH)治疗或切除睾丸)后睾酮降低,仍在发生进展的癌症.
"Xtandi新适应症获得FDA的优先审查权并被批准,使得处于转移性CRPC各个阶段的患者拥有了一种重要的新治疗方案,"安斯泰来制药公司首席医疗官兼安斯泰来制药全球发展公司总裁SefKurstjens博士说,"我们很高兴的是,这些患者现在可将Xtandi作为一种治疗选择.
""Medivation公司全体人员对参加今天获批的新适应症PREVAIL临床试验的所有医生和患者致以诚挚的感谢,"医学博士,Medivation公司创始人,总裁兼首席执行官DavidHung说,"作为一家致力于快速开发治疗严重疾病新疗法的公司来说,我们很高兴地看到针对这一重要患者人群的Xtandi新适应症获得批准.
"http://www.
pharmadl.
com/yyzlshows_b86b0c93-6865-431c-bd9c-38e796253c2d.
htmlFDA批准阿斯利康Movantik治疗阿片药物诱导的便秘9月16日,FDA批准阿斯利康口服药物Movantik(naloxegol),用于伴有慢性非癌性疼痛的,阿片药物诱导的成人便秘患者的治疗.
阿片类药物是一类是用来治疗和控制疼痛的药物.
使用这些药物常见的副作用是胃肠道的蠕动减弱,致使排便困难,并因有硬质或块状便或不能完全排尽造成患者精神紧张.
Movantik属于作用于外周的阿片受体拮抗剂(用来减少便秘影响的阿片类药物).
"类似Movantik的支持性治疗产品可减少阿片类药物用于便秘治疗时的副作用,"FDA药物评价与研究中心的药物评估第三办公室主任,医学博士JulieBeitz说.
Movantik的安全性和有效性是建立在由1352名服用阿片类药物至少四周以治疗伴有非癌性疼痛的、阿片类药物诱导的便秘患者参与的两个临床试验结果之上的.
参与者被随机分配接受每日一次,连续12周的12.
5mg或25mgMovantik或安慰剂(糖丸).
试验的目的是测量从研究开始,患者每周排便的数的变化.
第一次试验结果表明,安慰剂组中,29%的患者每周排便次数增加.
而这一比例在接受Movantik12.
5mg的患者及接受Movantik12.
5mg的患者中可分别达到44%和41%.
第二个试验显示了类似的结果.
Movantik常见的副作用包括腹痛,腹泻,头痛及在过量气体积聚在胃肠部位(胀气)的体验.
FDA要求进行一项上市后研究,以进一步评估服用Movantik后,患者心血管不良事件的潜在风险.
六月,FDA举行公开会议,讨论评价外周作用的阿片受体拮抗剂需要进行哪些研究,包括Movantik用于治疗阿片类药物引起的便秘时的心脏安全性.
http://www.
pharmadl.
com/yyzlshows_aa9e9d67-7a8b-49c4-8773-907c59bca93c.
htmlFDA批准礼来Trulicity治疗2型糖尿病9月18日,美国FDA批准Trulicity(dulaglutide)结合饮食与运动用于2型糖尿病成人患者,这款药物一周使用一次,经皮下注射给26药,用来改善血糖控制.
美国大约有2600万2型糖尿病患者,占所有糖尿病病例的逾90%.
随着时间的推移,高血糖水平可增加严重并发症风险,包括心脏病、失明、神经及肾脏损害.
"2型糖尿病是一种严重的慢性病症,可导致血糖水平升高超过正常水平,"FDA药物评价与研究中心药物评价II办公室副主任、医学博士Parks表示称.
"Trulicity是一种新的治疗方案,它可单独使用或添加至现有治疗方案中控制血糖水平,用于2型糖尿病的整体管理.
"Trulicity是一款胰高血糖素样肽-1(GLP-1)受体激动剂,属于一种有助于血糖水平正常化的激素.
这款药物的安全性及有效性通过6项临床试验中得到评价,总共有3342名接受Trulicity治疗的2型糖尿病患者参与.
接受Trulicity治疗的患者其血糖水平得到改善,同时糖化血红蛋白水平下降(糖化血红蛋白是一个血糖控制指标).
Trulicity已被做为单药及与其它2型糖尿病治疗药物合并用药(包括二甲双胍、磺酰脲类药物、噻唑烷二酮类药物及餐时胰岛素)进行研究.
Trulicity不应用于治疗1型糖尿病患者,血液及尿中酮体增加(糖尿病酮症酸中毒)的患者,有严重肠胃问题的患者或作为一线治疗药物用于不能靠饮食及运动管理的患者.
Trulicity有一项黑框警告,在使用Trulicity的啮齿类动物研究中观察到甲状腺瘤(甲状腺C-细胞瘤)病例增加,但Trulicity是否会引起人类甲状腺C-细胞瘤尚不明确,包括一种叫甲状腺髓样癌的甲状腺癌(MTC).
Trulicity不应用于个人或家庭史患有MTC的患者,或多发性内分泌腺瘤综合征患者.
FDA要求对Trulicity进行以下上市后研究:一项评价儿科患者给药剂量、有效性及安全性的临床试验;一项评价对不成熟小鼠的性成熟、生殖及神经系统发育和功能潜在影响的研究;一个至少15年周期的甲状腺髓样癌(MTC)病例注册,以确定与使用Trulicity相关的任何MTC发生率的增长;一项在中度或严重肾损伤2型糖尿病患者中进行的对比Trulicity与甘精胰岛素对血糖控制效果的临床试验;一项心血管结局试验,用来评价Trulicity用于高基线心血管疾病风险患者的心血管风险.
FDA批准Trulicity时附带一项风险评估与减灾策略(REMS),它包括一项告知卫生保健专业人员有关使用Trulicity相关严重风险的沟通计划.
在临床试验中,Trulicity治疗患者最常见的副作用有恶心、腹泻、呕吐、腹痛及食欲下降.
Trulicity由印第安纳波利斯的礼来生产.
http://www.
fda.
gov/NewsEvents/Newsroom/PressAnnouncements/ucm415180.
htmFDA批准百特HYQVIA用于原发性免疫缺陷成人患者治疗9月14日,百特国际与Halozyme治疗公司宣布,美国FDA批准百特皮下注射治疗药物HYQVIA用于原发性免疫缺陷(PI)成人患者.
HYQVIA是首款获批用于PI患者的皮下免疫球蛋白(IG)治疗药物,给药时只需每月(每3至4周)注射一次即可,并且每次注射时在一个注射部位就可输送全部治疗剂量的IG.
今天的大多数PI患者是在医生办公室或输液中心接受静脉输注,并且目前的皮下注射IG治疗药物需要每周或两周注射一次,并且每次治疗时需要在多个部位注射.
"PI患者很重视能够提供有效性、安全性及耐受性的治疗药物.
由于每位PI患者对治疗的响应不一样,所以拥有满足个体患者需求的治疗选择是至关重要的,"免疫缺陷基金会创始人兼总裁Boyle评论称.
"我们对百特的重要承诺27及在HYQVIA开发中的投入表示赞扬.
""HYQVIA的可用性对PI的治疗有很重要的影响,与其它皮下注射治疗药物相比,它有效输送一次完整治疗剂量的IG需要更少给药频次,同时保持有效性、安全性及耐受性属性,这对患者来说是最重要的,"百特科学总裁、哲学博士Hantson表示称.
"这次批准强调了对患者社区新治疗方案的支持.
""今天FDA对HYQVIA的批准对Halozyme来说是一个重要的里程碑,因为它代表了利用了我们rHuPH20平台的生物制剂许可申请首次在美国获得批准,"Halozyme总裁兼首席执行官Torley博士表示称.
"我想感谢Halozyme和百特的天才团队,是他们致力于将一种新的治疗选择带给PI患者,让患者管理这种伴随终生的疾病.
"百特预期未来几周在美国推出HYQVIA.
2013年,这款药物在欧洲被批准用于原发性免疫缺陷综合征和骨髓瘤,或有严重继发性低丙球蛋白血症及复发性感染的慢性淋巴细胞白血病(CLL)成人患者(≥18岁).
HYQVIA目前正在欧洲几个国家上市,包括德国、荷兰、瑞典、挪威、丹麦、爱尔兰和意大利.
http://www.
firstwordpharma.
com/node/1234969tsid=28®ion_id=3#axzz3DIYJrsjU2014年重磅生物制药行业发展主形势分析日前,有研究人士综合50家全球性企业近10年的年度报表等资料,就重磅生物制药行业这几年的市场销售额等情况进行了分析,并预计2014年该行业全球销售额将逼近1500亿元.
虽然这一猜测还有待验证,但从各类报表所呈现出的势头来看,重磅生物制药行业的市场前景还是颇为乐观,正如该人士所言,"现有产品远远不能充满整个市场空间".
新"四大金刚"销售直线增长生物制药市场中不乏重磅产品,有句话说得好,如果年销售额不过千万美元,都不好意思说是圈里混的,足见生物制药行业每一个产品均能独当一面,功力深厚.
根据全球50家大型制药企业的所有重磅生物制药(销售超过10亿美元的产品)建模推算,2013年全球重磅生物制药总销售额达1420亿美元,年增长率为9.
1%,预计2014年全球销售额将逼近1500亿美元.
事实上,自2007年后,重磅生物制药全球销售额增速由指数增长模式进入了线性增长模式,销售额逐渐扩大,获批的新药有限,销售增量难以维持行业销售额继续以指数模式增长,但个别产品的增长模式持续指数增长或爆炸增长模式,产品层级仍然是"重磅炸弹"丛生.
重磅生物制药可以划分为TNF抗体、癌症抗体、病毒抗体、促红细胞生成素、促卵泡激素、干扰素α、干扰素β、粒细胞集落刺激因子、酶替代疗法、人生长激素、炎症抗体、眼科用抗体、胰岛素及其类似物、重组凝血因子等几个大类,TNF抗体类以316亿美元三年蝉联冠军,其次为癌症抗体、胰岛素及其类似物、炎症抗体,成为生物制药领域的新"四大金刚"(前四大金刚:人胰岛素、人生长激素、干扰素、促红细胞生成素).
虽然前四类仍然维持着高增长态势,但促红细胞生成素已风光不再,流放出了五强,价格逐年下降可能是其销售总额逆势下降的原因;另外人生长激素、干扰素市场均出现不同程度的萎缩,干扰素α下滑超过20%.
从近年销售趋势来分析,新四大金刚均处于直线增长趋势,TNF抗体、癌症抗体、胰岛素及其类似物增速放缓,炎症抗体近年市场快速增长,说明市场中实力产品已经出现.
在年销售额百亿以下小类中,眼科用抗体增速强劲,年增长率25.
6%,近期有望突破百亿大关,另外,重组凝血因子近年来销售额一直处于爬升状态,但较2012年增速放缓为4.
2%,未来突破可能性不大.
28市场为重磅产品留有空间在全球重磅生物制药公司中,罗氏以294亿美元的销售额雄踞2013年榜首,较2012年增长了5%,增速有所放缓,销售总额远远超过了随后的安进和赛诺菲.
不过赛诺菲整体增势喜人,虽然已经闯入前三名,但仍然保持17.
5%的增速,而第四名雅培同样处于高速增长的轨道,安进现有排名在未来可能受到来自赛诺菲和雅培的威胁.
诺和诺德和强生分居第五和第六名,但强生增长强劲,2013年销售额增长了近13.
4%,2014年有望超越诺和诺德挤进前五名.
值得注意的是,各巨头的市场份额变化不大,一般以活性市场份额衡量市场竞争情况,活性市场份额越大,市场竞争越激烈.
重磅生物制药领域内,各公司形成的活性市场份额非常低,但这并不能说明生物制药领域缺乏活力,虽然生物制药领域近年得以长足发展,但各产品间的差异较大,市场定位非常准确,仍未形成在同一市场多家公司短兵相接的局面.
因此,差异化的产品定位是弱化生物制药市场竞争的主要原因;另外,这一现象同时说明生物制药行业潜力仍然需要重磅产品挖掘,现有产品远远不能充满整个市场空间.
http://yy.
chinairn.
com/制药企业动作频频减肥药破茧在即分析师们一直在等待,直到制药公司认识到减肥药市场的巨大潜力.
目前,有大批包括诺和诺德以及武田制药这样的公司在积极为减肥新药掏腰包,同时开始布局市场,减肥药终于受到药企的青睐.
上周,诺和诺德的减肥药利拉鲁肽注射液(liraglutide、Saxenda)获得了FDA一个顾问委员会的支持,正准备用于造福肥胖领域"最杰出的人",该公司首席科学官MadsKrogsgaardThomsen对彭博社如是说.
除了增加数百名的研发人员之外,诺和诺德拟寻求与大学和生物技术公司开展合作,来为这只产品出谋划策.
"我们正在采取一种整体组合的治疗方式,就像我们已经在糖尿病领域所做的一样,从而针对不同的患者实施个性化用药.
"Thomsen说到,并被新闻媒体所引用.
这对于提振减肥药市场的信心来说,不啻是一剂强心针,将给其他被减肥药市场所吸引的制药公司带来一个好兆头.
比如说Orexigen公司刚获得批准的减肥药:盐酸纳曲酮和盐酸安非他酮缓释片剂(Contrave).
该药销售合作伙伴是武田制药,后者称将为这一减肥药投入900人的销售队伍.
诺和诺德已经为Saxenda(利拉鲁肽注射液)准备了强有力的销售力量.
如果诺和诺德和武田一切顺利的话,他们的减肥新药将可能触发长久以来分析师们所期待的数十亿美元的减肥药市场.
据美国疾病预防控制中心,超过三分之一的美国成年人是肥胖患者,因此获得治疗资格的患者比比皆是.
而目前仅有200-1000万患者正在接受减肥药的治疗,Orexigen公司首席商务官MarkBooth在周二的演讲时表示.
"减肥药市场是一个巨大的、快速增长和拥有巨大潜力的市场.
"但是到目前为止,创造新一代的减肥药的制药公司,已经在获得市场份额方面遇到了麻烦.
他们正在竭力说服医生支持减肥药,患者使用减肥药和纳税人支付减肥药费用.
位于加利福尼亚的Vivus2012年9月获得FDA批准的第二款新型减肥药Qsymia(苯丁胺和托吡酯的缓释制剂)陷入了销售困境,而其竞争对手来自艾瑞纳制药的一款新型减肥药氯卡色林(lorcaserin、Belviq)表现也不尽如人意,尽管该产品的销售合作伙伴还是日本卫材.
2013年,Qsymia的销售额仅为2370万美元,Belviq的净销售额刚刚超过2500万美元.
即便如此,分析师们仍然坚持减肥药市场的巨变即将到来.
美国最好的银行,富国银行的分29析师MatthewAndrews表示,Contrave到2020年的销售额将达到6.
34亿美元,如果Orexigen能使该药物获准用于治疗糖尿病,其销售额将达到12亿美元.
他同时还预测,到2020年,Belviq的销售额将达到4.
81亿美元,Qsymia的销售额将达到3.
96亿美元,与此同时彭博社的分析师们预测Saxenda的2017年的销售额将达到4.
29亿美元.
此外,艾瑞纳制药也正在制定自己的发展计划.
该公司希望将Belviq与减肥药芬芬(Fen-phen)中的芬特明联合使用,从而规避芬-芬的心血管风险来刺激销售.
http://www.
sinohealth.
com/2014/0922/9989.
shtmlIMS:2014医院用药统计报告经统计,2014年第一季度中国医院医药市场的销售额(医院药房采购金额)为1440.
4亿人民币(数据来源:IMS艾美仕中国医院药品统计报告≥100张床位),与去年同期相比销售增长率为12.
9%.
增长率较上季度的增长率有2%左右的下降.
基于12个月的MAT(滚动全年数据:指定时间结点往前追溯12个月的数据总和,此处指2013年第二季度到2014年第一季度的销售额.
)来看,2014年第一季度的MAT增长率为13.
8%,与上季度基本持平.
增长持续放缓的主要原因依旧是政府限抗令的影响所致,特别是对于本土企业产品,并且自2011年以来的5轮药品降价之后,主要城市的大医院总额控制力度加大、药品处方趋于保守,特别是在抗生素和医用溶液的使用上,这些无疑都是市场增长放缓的因素.
跨国企业和国内企业市场表现2014年第一季度本土企业的增长率为12.
5%,较上季度下滑了将近3个百分点,但是跟2013年一季度的12.
1%相比,基本持平.
跨国企业涨势不俗,为14.
2%,也是近几年来首次增长率超过本土企业.
滚动全年数据方面,国内企业依旧领先.
纵观2014年第一季度的企业销售表现,辉瑞以36.
60亿元的销售额和18.
2%的增长率持续保持其在中国医院医药市场的领先地位.
阿斯利康以29.
90亿元的销售额位列第二,齐鲁制药以24.
62亿元的销售额位居季军,这一成绩延续了中国本土企业的最好排名.
从滚动全年数据来看,增长最迅速的为诺华制药(25.
7%),其次是齐鲁制药(19.
8%),阿斯利康则名列第三位(18.
7%).
在能够覆盖中国医院渠道销售40%的山东、河南、江苏、浙江、广东和四川6个省中,跨国企业在广东和浙江表现突出,都能够达到超过30%的市场份额.
四个城市级别中,一级城市的增长率最低,而一级和二级城市正是跨国企业的重点地区,三级、四级城市的市场增长则多是由本土企业所贡献.
各治疗领域药品销售起伏其它类产品(主要指中成药)目前已经成为中国医院市场最大的治疗领域,2014年第一季度的销售额为民币279.
2亿元,增长率达到12.
9%.
全身性抗感染类产品的增长也日渐回稳,达到10.
6%,延续了2013年第四季度的增长态势.
从产品的角度看,2014年第一季度分别有7个本土企业产品和3个跨国企业产品位于十大产品榜单.
排名前三的产品中本土企业产品占得2席,分别是排名第一的血栓通,以8630万元的季度销售额,位列医院用药榜首;申捷以8410万元的季度销售额攀升至第二位.
排名第三的是赛诺菲的波立维.
http://www.
venlon.
net/h-nd-1292-2_336.
html【专题】埃博拉病毒什么叫埃博拉病毒埃博拉(Ebolavirus)又译作伊波拉病毒.
30是一种十分罕见的病毒,1976年在苏丹南部和刚果(金)(旧称扎伊尔)的埃博拉河地区发现它的存在后,引起医学界的广泛关注和重视,―埃博拉‖由此而得名.
是一个用来称呼一群属于纤维病毒科埃博拉病毒属下数种病毒的通用术语.
是一种能引起人类和灵长类动物产生埃博拉出血热的烈性传染病病毒,有很高的死亡率,在50%至90%之间,致死原因主要为中风、心肌梗塞、低血容量休克或多发性器官衰竭.
是一个用来称呼一群属于纤维病毒科埃博拉病毒属下数种病毒的通用术语.
埃博拉病毒是引起人类和灵长类动物发生埃博拉出血热的烈性病毒,其引起的埃博拉出血热(EBHF)是当今世界上最致命的病毒性出血热,感染者症状与同为纤维病毒科的马尔堡病毒极为相似,包括恶心、呕吐、腹泻、肤色改变、全身酸痛、体内出血、体外出血、发烧等.
埃博拉病毒,生物安全等级为4级(艾滋病为3级,SARS为3级,级数越大防护越严格).
病毒潜伏期可达2至21天,但通常只有5天至10天.
http://baike.
baidu.
com/subview/188032/5072671.
htmfrom_id=6648445&type=syn&fromtitle=%E5%9F%83%E5%8D%9A%E6%8B%89&fr=aladdin基因测序揭示埃博拉疫情源头在今年5月下旬,一位年轻女患者来到塞拉利昂的凯内马政府医院,她发着高烧并且刚刚经历了一次流产.
在对其进行治疗的过程中,医生发现她感染上了埃博拉病毒——这是在塞拉利昂被确诊的第一个埃博拉病例.
这名女患者最终痊愈,但是她及其携带的病毒如今却成为一场波及多个国家的医疗灾难,以及一篇重要研究论文的中心.
由美国马萨诸塞州剑桥市哈佛大学和布罗德研究所的StephenGire、PardisSabeti率领的来自美国、英国、塞拉利昂和尼日利亚的研究人员报告说,他们已完成了在西非流行的埃博拉病毒基因组测序工作.
他们在发表于最新出版的美国《科学》杂志的一篇论文中报告说,他们对采集自这位女患者,以及在5月下旬至6月中旬之间在塞拉利昂被确诊感染了埃博拉病毒的另外77名患者体内的埃博拉病毒进行了基因测序和分析.
初步分析显示,西非埃博拉疫情是过去10年中从中部非洲传入,病毒可能先从动物传染给人,之后在人际间传播.
研究人员在塞拉利昂出现埃博拉疫情的头24天获取了78名患者的99个埃博拉病毒样本,其中一些患者提供了两份样本.
研究人员利用基因组测序数据分析了埃博拉病毒的传播途径和进化史.
结果显示,这次疫情中的病毒可追溯至2004年在中部非洲暴发的埃博拉疫情,这意味着在过去10年里中部非洲的一些埃博拉病毒逐渐传播到了西非.
引发此次疫情的病毒可能首先由动物传给人,这种动物可能是果蝠.
基因组测序数据证实,至少在塞拉利昂,疫情可以追溯至一名几内亚传统治疗师的葬礼.
这名治疗师因给埃博拉患者治疗而感染病毒死亡,来自塞拉利昂的13名女性参加了他的葬礼,其中一名年轻孕妇因发热及流产住院治疗,成为塞拉利昂的第一名被确诊的埃博拉患者.
令研究人员惊讶的是这13名女性在葬礼上感染了两种不同的埃博拉病毒,但现在还不清楚是上述那名治疗师同时感染了两种埃博拉病毒,还是参与葬礼的人在其他地方感染了其中一种埃博拉病毒.
研究人员指出,最终的测序结果使人们深刻理解了埃博拉病毒如何在暴发的过程中发生了变化——迄今为止,此次埃博拉病毒仅在塞拉利昂已感染了900多人且目前依然在传播.
专家认为,该序列将有助于改善目前的埃博拉病毒诊断测试模式,并且从长远来看,对于指导疫苗和治疗方法的研制开发具有重要意义.
这项研究工作涉及了来自4个国家的50多名合作者,同时也凸显了第一线的医务工作者所面临的巨大风险——5位作者因此不幸感染了31埃博拉病毒,并在论文发表之前去世.
研究发现,总体而言,埃博拉病毒的基因组变化速度快且通常发生在蛋白编码区,其中包括影响埃博拉病毒检测准确率和治疗效果的关键区域.
这显示了跟踪研究埃博拉病毒变化的重要性,这项研究可为保证检测和治疗的有效性提供有关病毒的新信息.
论文第一作者Gire在一份声明中说:―在这次疫情中,我们已发现300多个与此前疫情不同的遗传线索.
我们不清楚这些(基因组)差异是否与此次疫情的严重程度相关,但通过与科学界共享数据,我们希望加速我们对此次疫情的了解,并为国际社会控制疫情提供支持.
‖http://infect.
cmt.
com.
cn/detail/582413.
html汤森路透:世界聚焦埃博拉编者按:2014年9月3日,汤森路透撰文一篇分析埃博拉病毒,包括埃博拉病毒的发源地、发病机理、致死率等情况.
该文认为,埃博拉病毒从致死量来看,相比登革热出血热(2.
5万)和拉沙热(5000人),并不是特别大.
然而为什么大家把焦点聚焦埃博拉疫情,一方面,因为世界卫生组织拉响公共健康警报,而随着美国有2名援助医生的感染而进一步被世界关注;另一方面,因为埃博拉病毒起源于偏远地区却能跨越国界传播的趋势令人担心.
而世界卫生组织列举的其他令人担心的因素还包括人群密集和健康设备传输模式(health-facility-transmissionpatterns),以及已经有感染人群处于危险状态的国家的卫生系统较薄弱.
不过根据这一疾病致死速度和致死率,该文作者认为,埃博拉病毒不太可能引起世界流行病大暴发.
1埃博拉疫情凶险2014年埃博拉病毒在几内亚、利比里亚、塞拉利昂和尼日利亚等地暴发.
根据世界卫生组织(WHO),自从今年3月份埃博拉疫情确定以来,已有至少1350人死亡,而把些许年前所有埃博拉暴发导致死亡人数统计来算才1590人,可见此次疫情凶险.
埃博拉病毒,此前又称之埃博拉出血热,是世界上最凶险的疾病之一,其致死率可高达90%.
世界卫生组织最近宣布,西非的埃博拉疫情是一项国际公共健康紧急事件,批准使用实验药物用于治疗埃博拉病患,并颁布一个1亿美元的计划,作为抗击埃博拉暴发的强化措施的一部分.
2埃博拉病毒归属关系既能感染人类又能感染非人灵长类动物的埃博拉病毒是埃博拉病毒属的某一种病毒株,其是一种丝状病毒.
这个属下面目前发现了5个种:Bundibugyo、Zaire、Reston、Sudan和TaiForest,前四种可以导致人类生病.
机体往往首先表征出感冒类似症状.
之后,随着疾病的进展,2天至21天之内,内外出血导致器官衰竭.
埃博拉病毒于1976年在刚果民主共和国埃博拉河边上的一个社区被发现,感染了318人,导致280人死亡.
对此次暴发的埃博拉病毒进行遗传分析,发现其是Zaire亚型的变种,与Zaire型有97%的相似性.
虽然还没有确切的来源,也没有确认天然病毒池(naturalreservoirofEbolaviruses),但是坚信该病毒是一种以果蝠(fruitbats)为天然宿主的动物传染病.
而还没有获得批准或注册的疗法和疫苗用于抵抗埃博拉,只有支持疗法,包括水合作用、氧化作用,治疗并发症等手段.
3埃博拉病毒的发病机理埃博拉病毒是通过直接的体液接触而传染,包括血液、分泌物和已感染病患和动物的器官.
埃博拉袭击影响淋巴组织功能的关键细胞,在成纤维母细胞中最活跃,包括连接组织中的成纤维网状细胞和淋巴结导管中的成纤维网状细胞,在这两类细胞的推动下快速进入血液系统.
4世界聚焦埃博拉埃博拉病毒的暴发不太可能变成流行病,因为根据这一疾病致死速度和致死率,这一病毒是一种局限某一地区的病毒.
然而,鉴于当下暴发32的数量级,世界卫生组织拉响世界级公共健康警报.
自从3月份世界卫生组织宣布暴发以来,随着疫情越来越严重,关注的人越来越多.
特别当两名在利比亚工作的美国医生因接触而感染埃博拉病毒后,世界关注得更多.
两名医生都用Zmapp治疗(MB-003和ZMAb),目前已经治愈出院.
由埃博拉病毒导致的死亡人数相比其他出血疾病实际上还是比较少的,例如登革热出血热(Denguehemorrhagicfever)和拉沙热(Lassafever).
根据世界卫生组织报告,40年来,相比登革热出血热造成2.
5万人死亡和拉沙热造成5000人死亡,埃博拉出血人致死人数为1590人.
然而,埃博拉病毒具有致死性的特性,其快速表现症状,毒性高,却缺乏治疗方法,才是这一疾病如此令人恐慌的根本原因.
根据美国疾病预防和控制中心的统计数据,登革热和拉沙热的致死率分别为10%和1%,而埃博拉为90%.
特别需要拉响警报的是,埃博拉病毒有跨越国界的趋势.
其起源于刚果,且该病毒暴发在偏远乡村,且短暂生命很快就被掩埋隔离,却还蔓延到塞拉利昂、利比亚和尼日利亚.
而世界卫生组织列举的其他令人担心的因素是,人群密集和健康设备传输模式,以及已经有感染人群处于危险状态的国家的卫生系统较薄弱.
http://www.
bioexpress.
ac.
cn/zhutis.
aspid=16176全球合力阻止埃博拉疫情传播卫生官员们指出,如果要消除这场埃博拉疫情的话,还需要国际上给予更多的援助.
传染病医生DanKelly是塞拉利昂一家非营利性医疗机构WellbodyAlliance的联合创始人.
8月19日,当Kelly抵达康诺特医院(ConnaughtHospital)时,他感觉自己好像进入了战争地区.
他的朋友ModupehCole是一名医生,在塞拉利昂弗里敦的一家医院中负责管理埃博拉患者隔离病房,但是却在六天前不幸去世了.
MartaLado是一名来自于西班牙的医生,目前由她来看护病房中的十位患者.
Kelly表示,她只能亲自来―拖地板‖了.
无国界医生组织(MédecinsSansFrontières)是一家国际援助组织,他们认为,世界各国对西非地区暴发的埃博拉疫情所采取的应对措施―严重不足‖.
当Kelly在弗里敦市内四处巡视时,发现很多诊所都已关闭,有很多医疗卫生工作者并没有获得足够的防护培训和防护设备,因此他不得不认同无国界医生组织的说法.
Kelly说:―在发生海地地震或(菲律宾)海燕台风等灾难时,我们看到了一些非常强烈的人道主义回应,但是目前我们却缺少这种回应.
‖Kelly正通过旧金山市加利福尼亚大学(UniversityofCalifornia)的帮助来筹集资金,以便于能够将感染管制措施传授给那些在此次疫情中战斗的医疗卫生工作者们.
在目前的这次疫情中,有240多名医疗卫生工作者感染了埃博拉病毒,其中包括一位来自于塞内加尔的流行病学家——在世界卫生组织(WHO)部署下前往援助的医疗卫生工作者中,他是第一个感染了埃博拉病毒的人.
Kelly说:―我们的工作陷入了低谷.
‖8月初,WHO公开声明这次暴发的埃博拉疫情是一件引发国际关注的突发公共卫生事件,而世界银行(WorldBank)承诺将提供2亿美元的援助.
然而几周以后,仍然没有得到足够的资源来结束这场危机.
WHO报道指出,目前暴发的埃博拉疫情已经杀死了四个西非国家的1427人——虽然这可能还只是一个保守数据,但是却比所有以往有记录的疫情死亡人数的总和还要高.
据说这场流行病将会再持续6–9个月,而应对这次疫情的科学家和医生们对此也表示赞同.
病毒学家JosephFair是塞拉利昂卫生部的特别顾问,他说:―我可以很肯定地说,在接下来的4到9个月内我们还将处于这场疫情之中,而这一预期时间还不包括治疗疾病后的健康影响所需要的随访时间.
33公共卫生专家指出,为了结束这场危机,发达国家和救援组织需要派出更多的、具有传染病治疗专业知识的工作人员.
截止到8月22日为止,利比里亚的首都蒙罗维亚中仅有三套埃博拉治疗设施在运行;WHO指出,未来几周内还需要更多的设施来治疗其他500名感染患者.
总部设在乔治亚州亚特兰大的美国疾病控制与预防中心(CentersforDiseaseControlandPrevention)已经派出了60名工作人员赶赴西非地区,协助进行疾病监测、疾病跟踪和健康教育,但是这些工作人员无法参与患者的治疗工作.
无国界医生组织驻纽约办事处的执行董事SophieDelaunay指出,目前还急需从其他西方国家的政府中调遣医疗卫生工作者和专家.
许多社会公共机构和救援组织由于担心医生们的安全问题,甚至将他们转移出了疫区.
医生和科学家们指出,受疫情影响的国家也必须要更好地开展工作,治疗患者,并向公众传授埃博拉病毒感染的相关知识.
WellbodyAlliance的联合创始人BailorBarrie指出,政府官员方面的漠不关心已经引发了一系列暴动,其中包括8月20日发生在蒙罗维亚附近的隔离区内的一场暴乱.
他补充道,如果政府官员对自己的行为做出解释,并向那些被感染者表示关心的话,他们或许会在阻止埃博拉疫情扩散的工作上取得更多的进展.
对此,Barrie还引用了自己本月月初在塞拉利昂科诺区的一个村庄中的亲身经历.
当地的一位村民被检测出埃博拉病毒阳性,随后警察将两座房子隔离了起来,但是仍有6人逃离.
随后,Barrie带领着当地村官和公共卫生工作者们拜访了剩下的30位村民,向他们解释了隔离的原因,并回答了他们的疑问.
一位村民说,他需要有人帮他去买香烟,另一位村民说他需要棕榈酒;卫生官员只好派一名工作人员去运输这些日常用品.
村民们在隔离区内待了整整21天,即便在这段隔离期内,有3位村民出现了类似于埃博拉感染的临床症状.
隔离期后的诊断性测试结果为阴性,隔离房内的所有人都没有感染上埃博拉病毒.
Barrie说:―如果你没有引起人们的注意,没有倾听他们的心声,而仅仅告诉他们正确方法的话,他们是不会遵照你的指令的.
‖―这就是为什么在一些受疫情影响的国家中,人们最初对隔离的反应是全盘否定、害怕和恐惧——每个人都感到十分担心.
‖Fair指出,政府也必须在全国范围内开展一些范围较广的活动,―在所有形式的媒体上轮番轰炸——广告牌、电台广告曲、体恤衫、钢笔……基本上就是要用那些公众无法听到和记住的众多信息来淹没他们.
‖但是杜兰大学(TulaneUniversity,位于路易斯安那州新奥尔良市)的DanielBausch医生最终指出,最有效的、防止埃博拉疫情扩散的策34略是对西非地区的人们进行培训,传授给他们基本的公共卫生措施.
Bausch医生在几内亚和塞拉利昂治疗埃博拉病毒感染.
他说:―我并不会那么天真地认为这是小菜一碟,但是实际上这将会是唯一一个有效的措施.
‖最后一英里健康(LastMileHealth)是一家在马萨诸塞州波士顿和蒙罗维亚运营的非营利性组织.
最后一英里健康等组织的经验表明,这种培训是行之有效的.
最后一英里健康已经派出150名社区卫生工作者前往疫区,将埃博拉病毒的相关知识告诉给利比里亚的农村居民.
这一组织也提供了基本的医疗材料,用于护理埃博拉病毒感染患者.
亚绥德鲁玛莎塔布曼纪念医院(MarthaTubmanMemorialHospital)的护士们需要为利比里亚东部农村地区130000人提供医疗服务.
最后一英里健康组织的董事长RajeshPanjabi指出,这些护士因为缺乏防护设备,准备在8月中旬进行罢工.
最后一英里健康组织向他们提供了手套、口罩和隔离衣,并训练他们如何使用这些物品,护士们才得以继续工作.
(利比里亚卫生部本月月初估计,利比里亚还需要超过451360双医用手套.
)Panjabi说:―你可以通过一些最基本的行为来影响疫情的发展,但是这就需要不断地响应和投资.
‖此外还有其它一些让人充满希望的迹象.
在康诺特医院,来自于塞拉利昂等国家的护士们加入了Lado的工作团队.
Lado负责伦敦国王学院塞拉利昂合作计划的临床工作;该合作计划由伦敦国王学院的全球卫生研究中心发起.
来自于此项合作计划的两名医生和一名护士将会在未来几周内抵达康诺特医院.
Kelly说:―我们现在处在一个关键时期,我们所做的、几乎所有扭转乾坤的工作都会使疫区的情况好转起来.
‖―这些工作可以是每次建立一个医院.
‖http://infect.
cmt.
com.
cn/detail/583667.
htmlNature:科学家探讨埃博拉病毒感染的新型疗法进展2014年9月1日讯/生物谷BIOON/--近日,刊登在国际著名杂志Nature上的一篇研究报告中,来自得克萨斯大学医学中心的研究人员通过研究表示,将三种单克隆抗体混合后制成的混合抗体可以有效保护猴子抵御埃博拉病毒感染至少5天;研究者ThomasGeisbert在文章中讨论了当前埃博拉病毒疗法的进展.
丝状病毒,比如埃博拉病毒和马尔堡病毒,都是具有较高致死率的病原体,致死率高达90%;自从科学家们1976年发现了埃博拉病毒,自那时开始研究人员一直在致力于开发抵御该病毒感染的疗法.
最近的研究中,来自MAPP制药公司等处的研究人员利用化合物ZMAPP可以有效治疗感染一定剂量埃博拉病毒的猴子,所有的实验动物都生存了下来,而且在感染机体21天后找不到病毒的痕迹,甚至是在感染后5天接受该疗法后就可以完全消灭病毒,同时研究人员还表示ZMAPP可以在细胞培养液中有效抑制埃博拉病毒的复制.
ZMAPP可以用于治疗一系列病人,正因为有该化合物,两名美国医疗工作者因其而得救;尽管研究者尚不明确ZMAPP是否具有任何副作用,但在疾病暴发过程中45%的患者在没有该疗法的情况下可以生存,然而有两名患者在该疗法后却死亡了,这或许是因为患者进行该疗法救治的时间太晚了.
Geisbert教授表示,由于埃博拉病毒的多样性,因此对于开发候选疗法非常困难,保护机体抵御某一种埃博拉病毒的疗法或许并不会帮助抵御另外其它不同种埃博拉病毒的感染;尽管针对线状病毒感染科学家们需要新型特殊的疗法,但是最有效控制病毒感染暴发的途径还是开发新型的疫苗,注射保护性疫苗可以保护机体免于多种埃博拉病毒(丝状病毒)的感染.
在疾病暴发期间,单一疫苗的注射需要确保其可以快速在机体产生保护效应,研究者表示,至少给猴子注射5种不同的保护性疫苗才可以完全保护其抵御埃博拉病毒和马尔堡病毒的感染,最后研究人员表示,抗体疗法和其它治疗策略进行结合或许才可以有效控制未来埃博拉病35毒的感染,尽管目前ZMAPP已经获批进行使用,但是下一步其还将需要进行安全性及有效性的评估.
(生物谷Bioon.
com)http://www.
bioon.
com/3g/id/6658058/Science杂志介绍埃博拉病毒致病机制最近在西非造成严重疫情的埃博拉(Ebola),是一种能力惊人的病毒.
扎伊尔埃博拉病毒(Zaireebolavirus)及其所属的丝状病毒(filoviruse)家族,能够解除免疫应答并破坏血管系统.
这种病毒感染发展非常迅速,人们很难梳理出相关事件的发生顺序,尤其是在疫情暴发的时候.
Ebola病毒会导致出血热,这种疾病患者的死亡率高达90%,人们将这种病毒视为全球性的健康问题,这种能够大面积流行的致命病毒也是潜在的生化威胁.
目前,还没有任何可用于人类的相应疫苗或治疗药物通过审批.
目前人们对埃博拉所知甚少,许多问题都还没有得到解答,例如埃博拉劫持宿主细胞合成的蛋白有什么用,什么样的免疫应答才能有效击败这种病毒.
不过,研究者们可以在体外培养的不同细胞中研究活病毒的感染机制,也可以将其他灵长类动物当作模型观察疾病的进程.
Science杂志特别在网站上刊登文章,介绍了人们对埃博拉致病机制的一些基本了解.
埃博拉对免疫系统做了什么埃博拉进入机体之后,会靶标一些负责免疫系统一线防御的免疫细胞,比如树突状细胞(dendriticcell).
在正常情况下,树突状细胞会将感染信息呈递给T淋巴细胞,然后T细胞在病毒进一步复制之前摧毁受到感染的细胞.
如果树突状细胞无法给出正确的信号,T细胞就不会应答感染,相应的抗体也就不能活化.
正因如此,埃博拉病毒才能在机体中快速复制.
跟许多其他病毒一样,埃博拉也能抑制干扰素,干扰素是细胞阻止病毒增殖的一大武器.
在CellHost&Microbe杂志上发表的一项新研究中,研究人员发现埃博拉的VP24蛋白能够结合并阻断免疫细胞表面的转运蛋白,而该蛋白在干扰素通路中具有重要的作用.
令人称奇的是,淋巴细胞本身并没有被病毒感染,是其他一些因素阻止这些主要的免疫细胞投身抗病毒战场.
埃博拉是怎么导致出血的埃博拉病毒通过血液在机体内扩散,它们会释放出促进凝血的蛋白,使血管中形成小血块,减少器官的血液供给.
此外,埃博拉还会生产炎症性的信号蛋白和破坏血管壁的一氧化二氮,导致血管渗漏.
血管受到破坏是埃博拉感染的主要症状之一,但并不是所有患者都会表现出外出血(比如七窍流血).
埃博拉靶标特定器官么埃博拉除了会引起全身性的炎症和发热以外,还能破坏多种类型的组织.
这些病毒能够促使免疫细胞(如巨噬细胞)释放炎症性分子,或者直接入侵从内部消耗细胞.
不过,肝脏被埃博拉感染的后果特别严重,病毒彻底消灭了生产重要血浆成分所需的细胞(凝血蛋白等).
胃肠道细胞受损所导致的腹泻,往往使患者面临脱水的危险.
在肾上腺,病毒削弱了生产类固醇的细胞,类固醇可以调节血压,并引起循环衰竭令器官缺氧.
最终令患者死亡的是什么血管受损引起的血压下降,休克和多器官衰竭.
为何有的人可以在感染后存活下来维持性疗法(口服补液和静脉注射补液等)能够为机体正确抵抗感染的时间.
之前人们对362000年乌干达埃博拉疫情进行了血样研究,也鉴定了与存活情况有关的一些基因和标志物.
研究显示,已康复患者血液中的活性T细胞水平更高,而且这些患者还携带着特定的基因突变(编码白细胞通讯所用的表面蛋白).
今年早些时候,研究者们还发现sCD40L水平也与患者的存活有关.
sCD40L由血小板生产,机体修复受损血管时会用到这种蛋白.
研究人员认为,增强血管修复机制对于埃博拉患者的生存至关重要.
http://www.
ebiotrade.
com/newsf/2014-8/2014814113409548.
htm埃博拉病毒躲避机体抗病毒防御系统机制近日,刊登在国际杂志CellHost&Microbe上的一篇题为―EbolaVirusVP24TargetsaUniqueNLSBindingSiteonKaryopherinAlpha5toSelectivelyCompetewithNuclearImportofPhosphorylatedSTAT1‖的中,来自华盛顿大学医学院的研究人员通过研究鉴别出了埃博拉病毒躲避机体抗病毒防御系统的一种途径,相关研究为开发新型治疗埃博拉病毒感染的新型疗法提供了一定帮助.
埃博拉病毒是一种引起人类和灵长类动物发生埃博拉出血热的烈性病毒,埃博拉出血热(EBHF)是当今世界上最致命的病毒性出血热,感染者症状与同为纤维病毒科的马尔堡病毒极为相似,包括恶心、呕吐、腹泻、肤色改变、全身酸痛、体内出血、体外出血、发烧等.
这项研究中,研究人员绘制了一种详细的图谱,该图谱可以帮助揭示非致病性埃博拉病毒的蛋白VP24如何结合到宿主机体负责信号分子进出细胞核的蛋白质上,为更深层次地理解埃博拉病毒吸附并且进入人类机体引发疾病的机制提供了一定的理论依据.
这张新型图谱就揭示了,病毒的蛋白质VP24可以掠夺走机体宿主蛋白携带重要免疫信号进入细胞核的的能力,而这种免疫信号则可以帮助激活机体的抗病毒免疫系统及防御机制,并且可以有效阻断病毒的致病性;研究者WeiXu说道,目前我们研究发现阻断埃博拉病毒的VP24蛋白的功能就可以明显抑制病毒的致病性和侵袭能力,后期我们还将继续开展更深入的实验,希望未来早日开发出可以预防并且有效治疗埃博拉病毒感染的实验性药物.
http://infect.
cmt.
com.
cn/detail/585323.
html英发现埃博拉病毒治疗新方法日前,来自英国利物浦大学的研究人员与英国公共卫生部门合作,研发出新的方法,来确定可用于治疗感染的药物.
相关研究以―'ElucidationoftheEbolavirusVP24cellularinteractomeanddisruptionofvirusbiologythroughtargetedinhibitionofhostcellproteinfunction‖为题发表在最近的国际蛋白质组学领域权威杂志《JournalofProteomeResearch》(2014年最新影响因子5.
001).
受感染细胞中的病毒发病机制,是抗病毒反应和宿主细胞过程破坏两者之间的一个平衡,为了促进病毒生物学,许多病毒蛋白质可与宿主细胞蛋白质特异性相互作用.
了解这些相互作用可以给我们带来关于感染的知识,并为抗病毒治疗提供潜在的靶点.
一种这样的病毒就是埃博拉病毒,它对人体健康具有深远的影响,可导致病毒性出血热,病死率可达90%.
在这项研究中,研究人员探讨了受感染细胞内的哪些蛋白质对于埃博拉病毒功能至关重要,并被病毒控制以帮助感染.
其中一个他们所靶定的蛋白质被称为VP24.
这个蛋白质会破坏受感染人类细胞中的信号,并破坏人体的免疫系统和对病毒的抵御,在逃避宿主免疫反应过程中起着至关重要的作用,并可能与多个细胞蛋白质相互作用.
一旦研究小组发现了这些细胞蛋白质,他们就能够发现某些已经存在的药物,来阻断该特定蛋白质的功能.
其中一种发现的药物是乌本苷(ouabain),这种药物可用于治疗心脏病.
使用这种药物可减少治疗细胞中的病毒复制.
37抗病毒治疗利物浦大学传染和全球健康研究所的JulianHiscox教授和英国公共卫生部门的RogerHewson教授共同指导了这项研究.
Hiscox说:―这项研究表明,我们可以寻找现有的治疗方法,改换它们的治疗意图,将它们用于抗病毒治疗.
将现有的和试验性的药物用于不同的目的,可以节省大量时间,最终挽救更多生命.
‖破坏对于病毒非常重要的细胞蛋白质,也有可能解决耐药性问题.
因为细胞蛋白在进化上实际是一成不变的,随着越来越多地使用抗病毒药物对抗病毒蛋白,如流感病毒和HIV感染,病毒不能够适应击败细胞蛋白.
专业设施这项研究还包括英国布里斯托尔大学的DavidMatthews博士,研究采用PHEPorton的独特专业设施——旨在安全地研究病毒,如高封闭条件下的埃博拉病毒.
本文共同作者、PHEPorton研究负责人MilesCarroll教授说:―这一研究强调了一种已有的、被许可的人类药物的有效性,证明这种药物在治疗中是有益的.
‖http://infect.
cmt.
com.
cn/detail/587701.
html世卫组织:埃博拉病毒逾三百基因已变异世界卫生组织警告称,西非埃博拉疫情暴发导致的病毒感染总案例可能超过两万人,国际社会须要花费5亿美元来对抗这场灾难.
世卫组织此前公布了4.
9亿美元、未来9个月的战略计划,他们是根据受影响国家数目可能从目前的4个增加到10个这一预期做出规划的.
该计划提出,在受疫情严重影响的国家,3个月内要逆转病例增加和病毒蔓延的趋势;6至9个月内阻止疫情在这些国家首都、主要港口及其他地区传播.
主要措施包括推行病例诊断、管理和监测,规范丧葬及社区参与等.
对新暴发疫情的国家,该计划提出应推行紧急响应方案,确保在最初病例出现8周内阻断全部传播.
在受埃博拉影响国家的邻国及国际交通中心,要在一个月内建立完整的疫情检测准备及响应方案.
世卫组织28日发表的最新通报说,几内亚、利比里亚、塞拉利昂和尼日利亚四国,已经有3069人感染埃博拉,其中1552人死亡,这几乎是埃博拉1976年首次出现以来所有死亡人数的总和.
这个数字并没有包括刚果上周报告的13个死亡病例,因为那里的埃博拉病毒属于不同类型.
世卫组织说,实际感染的人数可能是已报告病例的2至4倍,患者总数可能超过两万人.
该机构负责紧急行动的助理总干事艾尔沃德说:―这不是西部非洲或非洲的问题,这是全球卫生安全问题.
‖埃博拉病毒发生变异与此同时,对塞拉利昂的埃博拉病毒进行基因研究发现,该病毒在人际间传播的过程中,已经发生超过300处的基因变化.
病毒的基因组变化速度快而且通常发生在蛋白编码区,其中包括影响埃博拉病毒检测准确率和治疗效果的关键区域.
多国科学家小组负责人、哈佛大学的萨贝提说:―我们发现埃博拉病毒正在发生变异.
‖研究报告合作者美国杜兰大学的加里也说,因为病毒寄生在果蝠等动物体内,其变异速度是人类的两倍.
该小组在《科学》杂志发表的报告还说,已经完成了对埃博拉病毒的基因组测序,分析显示病毒是过去10年中从中部非洲入的,引发此次疫情的病毒可能首先由动物传给人,这种动物可能是果蝠.
http://news.
chinaunix.
net/sci/2014/0830/3204243.
s38html埃博拉疫苗生产面临瓶颈随着埃博拉疫情在西非愈演愈烈,隔离感染者和追踪接触源等过去采取的遏制措施显然失效.
这就刺激了人们寄希望于生物医学措施,例如,单克隆抗体和疫苗等,以便拯救生命和放缓传播.
但随着美国总统巴拉克奥巴马要求该国对埃博拉疫情响应的升温,坚定决心和冷酷现实出现碰撞:该传染病的蔓延速度超过了药物和疫苗的生产速度.
行政官员开始与产业展开合作加速实验性药物和疫苗的制造.
―我们正试着做能让我们成规模生产的所有事情.
‖健康与人类服务部(HHS)负责准备和响应的助理部长NicoleLurie说.
但后勤障碍十分巨大,并且生产者起步过迟.
由比利时葛兰素史克公司(GSK)生产的埃博拉疫苗走得最远,已经于9月2日进入人体试验I期阶段.
GSK计划在今年年底制造1万剂疫苗——包含缝合在一个变弱的黑猩猩腺病毒上的埃博拉病毒表面蛋白.
如果符合早期试验结果,它将尽早在11月被施用于医护人员.
但要应对疫情,需要几十万剂疫苗.
―这可能需要1年半时间.
‖GSK埃博拉疫苗项目负责人RipleyBallou说.
实际上,科学方面的障碍不见得很高.
制药公司已经生产出高容量的相似疫苗,而且动物实验表明,适当的免疫反应就能相当容易地击败埃博拉病毒.
―尽管埃博拉病毒非常可怕,但你需要的仅仅是适当的中和抗体响应,你就会得到保护.
‖美国ProfectusBioSciences公司JohnEldridge说.
Ballou表示,GSK正在考虑加速生产的若干选择.
但首先该公司希望确保埃博拉疫苗拥有市场.
他提到,3月疫情暴发时,该公司就与世界卫生组织进行了接触,没有人对该疫苗表示出兴趣.
―答案是,谢谢,我们将会给你答复'.
‖目前,一种名为ZMapp的埃博拉抗体混合物在猴子试验中展现出明显的效力,由美国Mapp生物制药公司生产的该药物包含3种取自烟草植物的单克隆抗体.
HHS生物医学先进研究与开发局(BARDA)也在与其他两家能生产烟草抗体的机构进行接触.
但这些举措也只能每月生产数百支疫苗.
(张章)《中国科学报》(2014-09-18第3版国际)http://news.
sciencenet.
cn/htmlnews/2014/9/303692.
shtm灵长动物实验证实美埃博拉新药有效据新华社伦敦8月29日电英国《自然》杂志网站29日登载的一份研究报告说,在动物实验中,试验性药物ZMapp将感染埃博拉病毒的18只恒河猴全部治愈.
不过,实验中使用的毒株与当前在西非肆虐的埃博拉病毒毒株并非同一种.
加拿大公共卫生局等机构的科研人员与美国同行报告说,由于缺乏可用疫苗,感染埃博拉病毒后的治疗显得更为重要.
迄今为止的研究显示,使用单克隆抗体治疗此类病毒效果最好,目前的药物研发多集中于尝试不同抗体组合以达到更佳效果.
美国马普生物制药公司研发的ZMapp就是这类药物,它将3种单克隆抗体组合在一起抗击病毒.
研究人员发现,接受药物治疗的猴子,其症状逐渐好转,即使在感染后第五天才开始服药,其发生的出血、皮疹和肝酶升高等症状也都有明显好转并最终康复.
未接受治疗的3只猴子则在感染后第八天全部死亡.
虽然此次实验使用的毒株与引发西非埃博拉疫情的毒株并非同一种,但研究人员将这两种毒株进行直接对比后认为,ZMapp对后一种毒株的复制应同样具有抑制作用.
他们表示,此前两名美国埃博拉患者服用这种试验性药物后康复,也支持了这一判断.
http://bjrb.
bjd.
com.
cn/html/2014-08/31/content_21393295.
htm【专题】医药专利诉讼跨国药企专利药频遭仿制屡屡起诉陷国际争端各大药企专利药在印度等地少受保护官司不断,中国市场相对乐观日前,拜耳公司CEO马尔金·戴克斯(MarijnDekkers)在一次演讲中抱怨,某些政府对公司施加各种压力,迫使其降药价,而这将最近损害药品创新,该言论实际上反映了各大药企在印度和欧洲等地所遇到的困境.
戴克斯指出,现在很多政府都面临削减预算控制医疗支出的压力,而拿制药公司开刀最容易.
某些政府迫使处方药的价格一降再降的举措将会危及新药研发的商业模式,使其对各个企业来说失去吸引力,长此以往,未来将会没什么人去搞研发了.
业内人士称,在印度等地,对各大药企的知识产权毫不客气,因专利药经常在印度"沦陷",很多跨国药企巨头都为打官司而变"秋菊".
强仿、专利不批重伤制药巨头此前,印度医药部的秘书长D.
S.
Kalha曾公开表示,为了确保更多的穷人也能够买得起原本昂贵的药品,政府计划扩大医药价格的控制面,包括将专利药的首仿药物纳入价格控制的范围.
这一切如果付诸实施的话,将使欧美各个制药巨头面临更加严峻的挑战.
目前包括拜耳和诺华在内的欧美制药巨头,面对欧美市场增长乏力,同时内部研发陷入瓶颈的内外交困的情况下,以中国和印度为代表的新兴市场因其医药支出的持续快速增长成为其救命稻草.
然而印度一直让各大药企"比较烦",其原因就在于印度政府的两大杀手锏:拒绝药品注册为专利药和允许本土企业强制性仿制.
(来源:南方都市报南都网以拜耳为例,今年年初,印度专利以其药品多吉美(索拉非尼)过于昂贵为由,允许国内的制药公司NatcoPharma强行仿制(多吉美的专利保护尚未过期),付出的代价却只是支付6%的销售提成.
值得注意的是,原版多吉美每月约需平均花费4300欧元,而NatcoPharma的仿制药却只卖136欧元,仅为前者的百分之三.
拜耳曾为此提起上诉,而印度专利法庭一审驳回其上诉,根据其判决书,拜耳的多吉美价格过于昂贵,远远超出印度民众的支付能力,而且这种药物目前仅仅依靠进口,因此政府部门只能通过强制许可来保证印度民众可以享受到这种药物.
拜耳则选择继续上诉,此案甚至闹得美国政府向世界卫生组织提出控诉,就此陷入无穷无尽错综复杂的国际贸易争端中.
而另一制药巨头诺华制药的格列卫,则一直无法在印度获得专利保护.
印度当局早在2006年就以该药"没有足够的突破性的改进"为由拒绝给该药品授予专利注册,因此印度药厂就可以在该国生产并销售格列卫的仿制药,诺华没有一丝好处.
诺华公司也成了另一个"秋菊",开始无休止的诉讼,前不久还闹到印度最高法院.
罗氏的特罗凯也有类似的遭遇,据悉,特罗凯的仿制药在印度几乎可以用"泛滥"来形容,甚至还远渡重洋流入香港等地,售价大约为每颗140港币,而国内的原版特罗凯则大约为600元人民币.
但据国内专家介绍,一些病人买到的所谓"仿制药",因为不清楚渠道,故质量无法确保.
中国成新兴市场唯一亮点一位不愿具名的外企药品研发主管对南都记者表示,这些仿制药的价格虽然只有原版专利药的五分之一甚至更低,但他们并不用承担庞大的专利药研发支出,而仿制药的研发成本要低得多,再加上印度当地较为低廉的生产成本,综合这若干项因素,即使是在如此的低价之下,印度的这些药厂还是能够保证较高的利润率,而且,还有名目众多的各项政府扶持.
40另外,有业内人士对南都记者透露,目前跨国药企因为药物评价机制变化、管制强化使获批门槛大幅提高和化合物筛选成功率大幅降低等多方面,其产出效率相比上世纪90年代已经大大降低,财务报表不至于显得太难看的原因有赖于新兴市场,而新兴市场的几个大户中,印度和巴西的专利制度一直让这些巨头伤脑筋,相较而言,中国是唯一亮点.
http://finance.
sina.
com.
cn/chanjing/cyxw/20120927/121713258005.
shtml恒瑞医药:中外药企五年专利之争恒瑞获胜近日,恒瑞医药(600276)收到国家知识产权局专利复审委员会的决定书,该决定书宣告第"02147245.
9"号发明专利权全部无效,这实际上意味着法国Avengtis公司对恒瑞医药的指控不成立.
从2003年起,法国Avengtis公司就与恒瑞医药围绕该药物的化合物专利进行了旷日持久的诉讼.
一开始,Avengtis公司起诉恒瑞医药侵犯其制造路线专利,败诉后,又于去年9月起诉恒瑞医药相关产品侵犯其制剂专利.
此次判决的结果在让恒瑞医药欢喜的同时,也引起了业内人士的关注.
一些分析人士指出,随着国内制药企业的发展壮大,在逐步走向国际化的过程中,与国际厂商在市场领域的摩擦越来越多,更折射出若干值得深思的问题和值得总结的经验.
中金公司研究员孙亮指出,专利诉讼是仿创到创新过程中必然要应对的问题.
在国外,研发型药厂和通用名药厂之间经常进行专利诉讼事件,国内医药企业在新专利法实施和加入WTO后,需要面对的专利纠纷会越来越多.
企业一方面需要积极研究海外的专利法规,在仿制过程中保护好自身,另外一方面需要不断创新,走自主知识产权道路.
申银万国研究员罗鶄认为,此次多西他赛组合物专利被国家知识产权局判无效,不仅意味着恒瑞医药在多西他赛侵犯事件上取得了绝对性胜利,也对国内企业意义较为重大,表明国内制药企业在和跨国制药企业的知识产权争端中,正在积累宝贵经验和应对策略.
据悉,多西他赛是目前全球销售额居首的化学控肿瘤药,也是恒瑞医药的第一大品牌,今年一季度销售近1.
5亿元.
由于事关多西他赛在中国市场主导权以及由此带来的丰厚利润,法国Avantis公司不大可能就此放弃,很有可能向北京第一中级人民法院起诉.
业内人士认为,即便是再度起诉,Aventis获胜的机会也比较渺茫.
或许,专利诉讼只是恒瑞医药发展过程中的小插曲.
年报显示,恒瑞医药2008年将成立专门的专利部门,充实人员,包括及时申请专利,合理延长专利时间;同时,积极跟踪专利,避免侵权等.
http://www.
p5w.
net/stock/news/gsxw/200805/t1647816.
htm受困专利日益明显国内药企需提高知识产权意识近几年,随着我国知识产权制度建设进一步完善,民间知识产权意识日渐增强,中外企业间发生了一系列知识产权诉讼案.
在这些诉讼案的背后,国内知识产权保护方面的软肋暴露无遗.
知识产权日趋成为国内医药企业心中说不出的痛,并制约其发展.
"知识产权诉讼案爆发是知识经济时代的必然现象,是这个时代最典型的外化表现.
这表明企业不仅要自主创新,更要构建完整的知识产权保护战略,增强核心竞争力.
"东南大学卫生法学研究所所长张赞宁、北京市鑫诺律师事务所律师李仁兵不约而同地表示.
近年来,国内企业受困于药品专利的情况日41益明显.
唐传生物科技发展公司总裁萧忠明表示,以L-阿拉伯糖药用专利被日本企业抢先在中国注册为例,尽管日本企业健康食品领域的专利申请没被批准,但其有药用专利在手,国内糖醇企业同样很被动,"而日本企业以专利规则为攻击之矛,独占市场".
据了解,还有一个重要原因要求我国完善知识产权建设:新药研发成本高、风险大,如不进行有效的知识产权保护,耗费巨大成本研制出来的新药就会被他人任意仿制.
"知识产权制度赋予了新药研发者在一定时间内独占市场的专权,并获得丰厚的回报,从而促使其继续投入到新的研发活动中.
"李仁兵表示,知识产权保护是药企创新的保障.
萧忠明认为,知识产权保护制度对新药研发具有巨大的促进作用,同时可避免前期投入的无端浪费,为后续研发提供资金,形成良性发展的科研体系.
近年来,国内医药企业频繁遭遇知识产权纠纷,表层原因是研发基础不强,是模仿路线带来的隐患,深层原因却是国内企业对知识产权制度的认识不足.
分析人士指出,L-阿拉伯糖药品专利案折射出我国知识产权建设的种种弊端.
"依当前实际,企业应痛定思痛,加深对知识产权问题的理解和认识,提升对知识产权规则的驾驭能力,并结合企业实际制定适合自己的知识产权策略.
"中国医保商会法律部主任官宁云指出.
国家知识产权局的统计数据显示,截至今年3月16日,我国受理的专利申请总量达500.
2143万件,其中发明专利申请为168.
1464万件.
"从数字看很繁荣,说明我国企业的知识产权意识在提高.
"李仁兵表示,希望企业从长远战略出发,在知识产权方面谋求一席之地,应避免贪多求全和重数量轻质量.
我国医药企业生产的产品大部分是仿制品种,拥有自主知识产权的品种凤毛麟角,而且短时间内难以形成自己的核心知识产权.
在此情况下,我国医药企业应该如何应对萧忠明认为,国外企业运用知识产权的意识和能力比较高,我们应虚心学习、消化、吸收、创新,尊重知识产权,提高自主创新能力,增加在涉外知识产权纠纷中谈判、应诉的砝码.
另外,要提高对知识产权制度的认识、运用能力,警惕国外部分企业的知识产权滥诉行为,避免落入陷阱中.
我国新修订的《专利法》将于10月1日实施,《专利法实施条例修订草案》已上报国务院审议.
专家表示,"知识产权保护网越织越密,意味着我国知识产权的法律保障性更强、更规范.
"李仁兵认为,知识产权是评价创新是否成功的一个标准.
企业需构建强大的知识产权工作结构和体系,聘请知识产权法律顾问或专家,普及知识产权教育,提高知识产权意识,设立知识产权专员,构建企业知识产权战略,研发阶段的知识产权如符合申请专利条件应当及时申请.
与此同时,"可以针对国外医药企业已经申请专利权保护的新药品种进行应用性开发,对开发成果申请专利,以形成对其核心专利的合围之势,从而谋求与核心专利的专利权人的交叉许可.
"张赞宁表示.
http://www.
chinahightech.
com/views_news.
aspNewsid=738363239333突破专利壁垒科伦药业势逼跨国药企科伦药业董事长刘革新表示,如果不能突破专利壁垒,创新就没有路可走,突破专利壁垒是中国企业必须走出的一条生路上个月,科伦药业与大冢制药专利纠纷案由山东省高院终审判决科伦胜诉.
科伦药业董事长刘革新向《第一财经日报》表示:"这个回合的较量代表一个趋势:在输液的高端材料和输液的高端制造上,中国第一方阵的企业正在逼近他们的核心技术区和核心市场区.
"而这一结果得益于科伦创新战略的实施和一直以来的专利布局,也影响着未来市场的趋势.
刘革新表示,"如果不能突破专利壁垒,创新就没有路可走,突破专利壁垒是中国企业必须走出的一条生路,专利体系的建立,专利人才的培养,专利技术的保护,都是必须要做的.
"42胜诉大冢制药科伦与大冢制药的专利纠纷是围绕塑料小水针展开的.
中国大冢制药有限公司认为湖北科伦"聚丙塑料安瓿小水针"产品侵犯大冢制药"新型塑料注射安瓿"实用新型专利权.
青岛中院一审判定科伦胜诉,大冢不服遂上诉到山东高院.
科伦药业药物研究院副院长王利春表示,科伦药业聚丙烯塑料安瓿产品2009年2月立项,2010年12月份国内首家获得聚丙烯塑料安瓿药包材注册批件,并于2011年12月开始陆续获得了药品的补充申请批件,2012年8月通过了GMP认证.
王利春介绍说,去年6月,科伦的"聚丙塑料安瓿小水针"产品在青岛举办的第47届全国新特药品交易会上进行展销时,大冢制药看到了这个产品,然后就在当年9月向青岛中院提起诉讼.
"两者在生产技术和外观上相似,但是,在材料上,他们是聚乙烯,不能经受终端灭菌,我们是聚丙烯.
需要明确的是:专利纠纷是以原告所拥有有效专利中权利要求书中保护范围为准,而不是仅仅以外观相似作为侵权依据.
如,大冢制药本次'新型塑料注射安瓿'(ZL200520025420.
1)专利的权利要求中明确要求其技术特征为'新型塑料注射安瓿,其特征是瓶体、顶盖两部分热封合构成,瓶体上部形成锥形台,锥形台上部形成与顶盖上的瓶颈直颈相配合,相当于瓶颈高度三分之一的瓶颈'.
大冢制药专利公开的技术表明,其是采用瓶体、顶盖两部分热封合而成的分体成型工艺,与我公司采用一步成型的吹—灌—封三合一技术有明显区别.
他们的专利书明确的技术特征,我们都完全不一样.
"王利春表示.
对于此次专利纠纷,科伦认为其背后主要是市场利益的驱使,对于科伦来说,也是一场事关市场生存的竞争.
王利春表示,如果我们不能胜诉,就要等到大冢制药的专利2015年到期后才能上市,延缓科伦产品的上市进程.
科伦药业副总经理刘思川表示,塑料小水针以前是大冢独家销售,因此产品议价能力上比较强,现在科伦进来之后会形成一个竞争,会对产品的议价产生冲击,而且会随各省招标逐步展开,大冢在综合成本上高于国内企业,科伦会在各个省的招标中逐步去替代他们的产品.
因此,"意识到科伦药业即将推入市场的聚丙烯塑料安瓿小水针产品将会威胁其国内市场地位,大冢意图继续维持其国内独家高价垄断局面,以提起专利侵权诉讼的手段,阻碍湖北科伦塑料安瓿小水针产品的成功上市.
"王利春表示.
而对于获得胜诉的科伦,这一产品也展示出巨大的市场潜力.
刘思川表示,"我们产品今年6月上市,产值达到3500万元,明年还有两台设备到,随着各省招标的进程,我们将逐步替代.
之前大冢的一年产量大概是1亿多支,主要针对北上广的核心医院.
在其他地区没有做推广,对于我们全国布点的企业是非常好的机会.
"刘革新表示,国内企业的创新最重要的是政策接口和市场接口,在创新过程中,寻求市场话语权和市场竞争能力是我们专利路线的核心思想,不是为了一个证书,而是取得实实在在的市场竞争力,这是发明专利的根本原因和动力.
突破专利壁垒与大冢制药的专利纠纷将不会是一个孤例.
比如,科伦正在发展双室袋、三室袋输液产品,这也是大冢制药的先发领域.
刘革新表示,我们的技术差距在缩小,塑料小水针不仅赢了,而且赢得很光彩,如果双室袋、三室袋继续发生这样的事情,我们已经很有储备,很有底气,很有方案.
科伦药业总经理程志鹏表示,科伦的双室袋、三室袋输液产品已申请发明专利20项、实用新型专利31项、外观设计专利9项,其中发明专利已授权3项,实用新型已授权26项,外观设计9项,已形成强有力的专利组合,已储备好专利武器,应对其他企业以争夺市场为目的而挑起的恶意专利纠纷.
43科伦药业事业发展部总经理郭晓英还介绍说,"双室袋和三室袋输液产品已经列入国家十二五科技支撑计划项目,这个项目科伦也在承担过程当中,也为我们下一步产品上市的科技创新做了很好的铺垫.
"实际上,"大输液行业的整合,未来市场竞争必将从规模、价格的竞争转变为技术、创新的竞争,而主要企业之间的专利之争也会变得更加频繁.
科伦药业不会满足于简单的模仿,而是在现有技术的基础上进行创新,做出符合企业特色的产品,既避开了其他企业的专利保护,又能形成自主知识产权.
"程志鹏表示.
不仅如此,刘革新表示,"你要有创新能力就必须在专利领域进行突破,在事关重大商业前途的领域当中,(国外企业)普遍设置了重重专利壁垒.
"为了突破国外企业的专利封锁,科伦以创新驱动战略为企业根基,一直以来进行专利布局.
科伦药业在2006年就以1号文件颁布了《专利管理办法》(试行),并在2010年修订为《知识产权管理办法》,从专利的申请、奖励、实施许可及转让等都做了详细规定,成立了知识产权管理委员会进行全方位的知识产权管理,鼓励全员创新,极大地提高了技术创新和专利保护水平.
科伦药业的项目从立项开始就建立涵盖研发、生产、设备等强有力的知识产权管理团队,该团队将对项目的专利情况进行全面分析,首先查阅已有的专利技术,在此基础上进行创新,构建从核心到外围的专利保护体系.
迄今为止,科伦药业已申请专利1296项,其中发明专利222项,获得授权的发明专利110项.
2013年6月,由国家商务部、知识产权局、证监会联合组成的中国知识产权指数报告课题组,发布了《中国医药行业上市公司知识产权报告》.
报告显示:2013年,在76家(医药行业样本企业)A股上市公司中,科伦药业的专利申请数量和专利授权数量均排名第一.
刘革新表示,创新就要有新的接口,企业家的能力体现在创新能力上,创新能力很大程度体现在专利的数量、质量和有效性.
科伦通过可立袋全球最先进技术的研发,在递延性产品,在一浪接一浪承继性技术浪潮中,一直处于领先的地位,这就决定了在将来新型和安全的包装、对国外产品的替代方面可以大有作为.
而科伦的专利战略是,"国外企业我们定位为追赶.
从整体上来讲,无论是创新能力、制造业水平,还是工业化经验的积累,中国企业还存在着明显的差距,所以我们对外资企业要追赶,但是在以可立袋为核心的先发领域要超越.
一般领域要追赶,优势和先发领域要超越.
"当然,刘革新表示,科伦的专利战略有进攻,也有防御.
"在我们先发优势领域,我们形成什么样的能力和拥有的专利,对那些既不能追赶日本,又想模仿我们的企业发出清晰的信号——以前靠买了设备就能做的时代已经过去了.
中国企业并不畏惧外资企业,在我们曾经较量过的16年中,主要的压力不是来自外资企业,他们不会因产能过剩导致去产能化的恶性竞争.
"http://www.
yicai.
com/news/2013/10/3062434.
html仿制药存在价格优势药企专利门问题待解一边是面临"过气"的主角迟迟不肯下场,一边是风头强劲的配角跃跃欲试,急于登场.
在全球各大制药巨头专利药普遍面临专利到期的情况下,愈演愈烈的"专利门"主角专利药与配角仿制药之间的冲突不断.
继辉瑞花费重金以延长其重磅药物立普妥的专利保护期后,英国医药公司阿斯利康也正努力保卫公司"重量级"药品—非典型抗精神病药物思瑞康(Seroquel)的专利权.
与辉瑞一样,阿斯利康面对的仿制药企业也并非一些散兵游勇,而是两家颇具规模和实力的企业-瑞士山德士和以色列泰华公司(TEVA),前者是瑞士制药巨头诺华制药公司旗下的非专44利药公司,后者则是世界上最大的非专利药制造商.
专利药暂胜解"近忧"7月2日,阿斯利康全球官方网站上的一则公告,牵出了该公司与仿制药巨头诺华山德士与以色列泰华公司之间有关思瑞康专利权的恩怨纠葛.
阿斯利康称,该公司在与诺华制药就该公司非典型抗精神病药物思瑞康在美专利权保护战中赢得了一个回合:新泽西一家联邦法庭裁定,阿斯利康与诺华制药专利权官司没有继续审理的必要.
除了诺华山德士之外,这一案件同时还涉及了另外一家仿制药巨头—以色列泰华公司.
诺华与泰华一直觊觎思瑞康仿制药的生产销售权,法庭的此次裁定无疑阻住了两者迈入这一市场的脚步.
诺华和泰华对该判决表示不服,并指控阿斯利康是通过不正当手段才获得了思瑞康的专利权.
7月4日,阿斯利康中国相关负责人否定了诺华与泰华的指控,并称"美国法庭对此案的判决已经说明了问题".
受到三家制药公司如此垂青的思瑞康自然不是"等闲之辈".
7月4日,阿斯利康上述负责人表示,思瑞康是阿斯利康的畅销药物之一,也是全球最为畅销的抗精神病药物之一.
阿斯利康公开年报显示,2007年,思瑞康销售收入达到40亿美元左右.
"和所有的专利药拥有者一样,阿斯利康努力保护思瑞康的专利权,正是为了仿制药挡在市场之外,好独享市场份额".
7月3日,医药新闻网执行主编张祥表示,一旦仿制药被允许上市,很多专利药的市场份额将会遭到削减.
尽管阿斯利康努力捍卫思瑞康的专利权,但是"重磅炸弹"类药物向来是仿制的重点,思瑞康自然也不例外.
事实上,觊觎思瑞康仿制药的不仅仅只有诺华山德士和泰华公司.
早在2007年,阿斯利康就曾针对芬兰orion公司在芬兰市场生产销售思瑞康的仿制药,而起诉该公司.
市场决定两者必将并存对于遭遇诉讼,山德士和泰华早已司空见惯.
近年来,两者在不断扩大仿制药版图的同时,也与专利药生产企业纠纷不断.
2006年,法国制药公司赛诺菲安万特针对山德士对该公司抗凝血药物依诺肝纳素在美国专利的侵犯,起诉诺华;2007年,赛诺菲安万特在美国再次起诉诺华.
赛诺菲安万特认为诺华旗下山德士公司试图仿制其抗癌症药物乐沙定.
除此之外,诺华山德士还曾遭到惠氏等制药公司的起诉,起因皆为山德士相关仿制药物侵犯了专利药企业的相关产品专利权.
对于仿制药业务一再遭遇的"专利门"事件,7月3日,山德士制药中国有限公司相关负责人称,很多专利权纠纷都是发生在美国,不便给予回应.
事实上,早在2007年1月,山德士就在中国开展业务.
山德士在中国的主要产品包括善宁(奥曲肽)、善龙(奥曲肽)等仿制药.
除了山德士外,以色列泰华公司也将触角伸至中国,与中国企业合作推出仿制药物.
"仿制药与专利药的冲突与并存将长期存在",7月4日,中国医药企业管理协会一位专业人士表示,由于仿制药的价格相比专利药有大幅下降,因此有很大市场空间,如何处理好与仿制药的关系,是各大制药巨头需要面对的一个难题.
专利到期"远虑"难解思瑞康官司暂胜一局,并不意味着阿斯利康已获得持久性的胜利.
目前,诺华与以色列泰华公司皆表示将会对这一裁决提起上诉.
更为严重的是,思瑞康将在2011年专利到期,届时将无法把仿制药挡在市场之外.
诺华公司公开的2007年年报显示,旗下山45德士2007年全球销售额达72亿美元.
今年年初,诺华中国区总裁李振福表示,诺华看好山德士的业务发展,并将增加在此方面的投入.
事实上,仿制药巨头并非只做简单的仿制药业务.
目前全球大型仿制药企业都开发了专利品牌药,并利用专利品牌药来带动企业自身的品牌建设.
以色列泰华公司除了在舒降之、普拉固、左洛复这3个数十亿美元销售额产品的仿制竞赛中拔得头筹外,还宣布了2009年至2015年之间在美国递交15个新产品的上市计划,这些新产品可能是新药,或是老药新用以及产品剂量剂型的变更.
同样,山德士制药中国相关负责人也表示,山德士主要经营是品牌仿制药.
仿制药正试图从品牌和价格方面入手,不断扩大版图.
7月4日,阿斯利康中国相关负责人也坦诚,原研药和仿制药并存是一个不会被改变的客观存在的事实.
但在专利保护到期之前,阿斯利康方面称,将会对知识产权的保护不遗余力.
http://health.
sohu.
com/20080709/n258035594.
shtml中国抗体药如何抵御专利战全国每6分钟就有1人被确诊为癌症,每天有8550人成为癌症患者,每7至8个人中就有1人死于癌症看过这组数据,你是不是也会觉得胆战心惊然而,在抗肿瘤效果比较有效的抗体药物的研发方面,我国企业并不占优势.
记者在采访中了解到,由于研发起步较晚、基础薄弱,我国抗体药物研发企业存在创新能力不足、大规模培养技术相对落后、制剂水平有待提高等问题.
虽然还没有企业或研发机构在抗体药物技术研发方面形成垄断,但是对于一些核心关键技术,国外医药巨头早已布下了严密的专利网,我国企业提交的专利申请数量较少,绝大多数在临床研究或已经上市的抗体药物品种是仿制品或仿制改进品,在进入国际市场时,仍然存在潜在专利侵权风险.
面对激烈的竞争和国际医药巨头严密的攻防,我国医药企业应如何应对如何才能在四起的"烽烟"中谋得一席之地,并打造出中国抗体药物领域的超级"巨无霸"业内专家建言,在研发策略方面,持续的资金投入必不可少,同时应利用相对成熟的抗体筛选技术针对已知靶点进行新型抗体筛选,并提交专利申请以加强"专利圈地".
在预防和应对专利诉讼方面,国内企业应攻防结合,积极提交专利申请,并不断增强应诉能力.
国内药企夹缝求生随着生物技术的迅猛发展,生物医药正成为潜力无限的朝阳产业,而抗体药物则是其中发展最快的领域之一.
由于可以用来治疗恶性肿瘤、感染、免疫或过敏性疾病、血液或细胞外液疾病等重大病症,抗体药物受到了世界各国的关注,技术发展非常迅速,专利申请量也快速增长.
但这些专利申请却主要集中于美国、日本等发达国家.
国家知识产权局于2013年发布了《抗体药物产业专利分析报告》(下称《报告》).
该《报告》由国家知识产权局专利局审查业务管理部组织,国家知识产权局专利局医药生物发明审查部和专利审查协作北京中心医药生物发明审查部(下称北京中心医药部)负责实施.
该课题组副组长、北京中心医药部主任马秋娟告诉中国知识产权报记者,截至2013年7月5日,全球涉及抗体药物技术的专利申请共计6.
6295万项,其中美国的专利申请为3.
9536万项,占全球专利申请总量的一半还多,遥遥领先于其它国家;其次是日本和欧洲,分别为8663项和4043项;中国排名第四,为3846项,与美国、日本等国家相比差距较大.
而在抗体药物领域的中国专利申请中,国外来华申请约占60%,国内申请仅占40%.
在抗体药物研制的关键技术领域,我国企业也不具有优势.
以单克隆抗体药物为例,靶标筛选是单克隆抗体药物研制的关键技术之一.
目前,抗体药物研发的热点靶标主要有CD20、EGFR、Her2和VEGF等,但这些靶标的国外来华专利申请所占的比例均超过国内申请,其中用于治疗恶性肿瘤等疾病的CD20抗体的国外来华申请46占国内该领域专利申请的比例更是高达80%,其余来华申请的比例也都超过了60%.
据悉,由于有价值的抗原靶点几乎已经被国外知名企业瓜分完毕,而筛选新的靶点又需要较大的资金投入和完成大量的实验,且掌握核心技术的公司还依靠外围专利进一步"跑马圈地",在这种情况下,国内抗体药物产业要想形成一定规模可以说是困难重重,大多数国内相关企业只能在夹缝中求生.
"国外药企在抗体药物热点技术领域的专利布局更为成熟,也更为庞大,国内企业的专利申请空间被明显压缩.
在我国提交专利申请名列前茅的都是国际知名医药企业,这些专利申请对我国企业相关产品的影响不容小觑.
"马秋娟表示.
国际巨头攻防严密由于生物医药行业具有高风险、高投入、高收益的特点,一项好的创新药从研发到上市可能需要数十亿美元.
在国际竞争日益激烈的背景下,专利无疑是最有效的保护研发成果的方式,而专利战则是争夺市场、遏制竞争对手的有力武器.
"目前,国际医药巨头都身怀'绝招',采取各种策略和手段将专利诉讼发展为商业竞争的重要武器.
"马秋娟告诉中国知识产权报记者,跨国巨头比较常用的"绝招"有3种,一是重视专利申请策略,进行组合专利申请;二是在对方专利权即将到期时提前进行药物临床试验和申报注册以抢占先机;三是以专利侵权诉讼为幌子,打击对手并独占市场.
不仅如此,在国际市场投资时,跨国巨头非常擅长结合专利部署,熟悉并灵活运用多种专利防御和专利攻击技巧,以获得尽可能多的市场份额和经济收益.
作为"后来者"、处于跟随阶段的我国医药企业,也深切感觉到了国外医药巨头的专利包围圈透出的越来越重的"杀气".
"国外医药巨头已熟稔专利制度,抗体药物专利申请已由单个专利逐步发展为组合专利,抗体药专利申请除了靶点、序列、生产工艺、用途、联合用药外,化学制药领域的晶型、蛋白质领域通用的制剂及纯化工艺等都被跨国企业列入抗体药物的专利保护范围,专利申请细致到无孔不入.
而这些专利组合,可能将竞争对手的一系列产品阻挡在市场之外,造成市场垄断.
"上海中信国健药业股份有限公司(下称中信国健)知识产权总监李彩辉在接受中国知识产权报记者采访时表示.
中信国健是我国抗体药专利申请量排名前十的申请人中的唯一一家企业,目前已提交了100多件专利申请.
"我们已有意识地针对抗体药研发热点和预期的产品方向进行了专利储备,并且也在密切关注国外竞争对手的专利动向,尽可能地采取一些应对措施,例如通过提出专利无效宣告请求和第三人意见介入专利申请的审查,但仍然感觉力量薄弱.
"李彩辉表示.
现实也许还要更加严峻.
我国企业针对抗体药物的研发起步晚,企业规模总体较小,国际竞争力弱,不少处于发展初期的中小企业发展艰难.
因此,如何在全球化的进程中避开竞争对手的专利"狙击",合理有效地构建自己的专利防御体系,成为我国药企面临的重要问题.
加强"武装"合纵连横面对抗体药物领域"西强我弱"的态势,我国医药企业如何才能在国际竞争中谋得自己的一席之地"一方面,国家相关职能部门需要加大对于重大新药创制项目的政策支持,为抗体药产业发展提供保障,另一方面,国内企业自身需要加强研发与投入,进而逐步构建自己的专利保护网.
"马秋娟介绍,在研发方面,国内企业目前采取的主要是跟随和模仿策略,虽然有风险,但仍然大有可为.
在研发战略方面,持续的研发投入必不可少.
鉴于国内研发状况以及与国际知名药企的差距,建议国内企业集中优势资源,以中下游产品为研发重点,例如对现有专利抗体药物或已过专利保护期的抗体药物进行下游研发等.
而对于寻找新药靶点等基础性研究,则应慎重,应在研发前充分了解国内研发和专利现状.
在企业自身加强研发的同时,合纵连横也非47常重要.
"由于目前我国高校和科研院所在抗体药物领域提交的专利申请较多,企业在实际生产阶段有优势,而大规模生产及制剂生产正是影响我国抗体药物产业进一步发展的瓶颈,因此,若能加强产学研结合,由相关企业、科研院所共同参与构建产业联盟,发挥各自的人才优势,实现部分资源共享,将有助于国内抗体药物产业发展.
"李彩辉表示.
另一个不可回避的现实是,虽然我国抗体药物研发和产业化进程仍然处于初级发展阶段,拥有自主知识产权的抗体药物不多,但随着我国制药行业的不断发展,与跨国巨头竞争、应对专利诉讼将是国内药企必须要面对的问题.
"认真研究抗体药领域典型诉讼案例,学习跨国巨头应对专利诉讼的经验,提高专利制度应用能力,同时改进专利申请策略,促进专利实施,提升专利应诉能力,都是国内医药企业需要加强的必修课.
"马秋娟表示.
(知识产权报记者吴艳)http://www.
sipo.
gov.
cn/mtjj/2014/201406/t20140604_960141.
html一起专利诉讼引发的思考日前,江苏恒瑞医药股份有限公司发布公告表示,其与全球第三大制药企业——法国赛诺菲安万特关于抗肿瘤药物"艾素(多西他赛)"的专利纠纷有了最新进展,国家知识产权局专利复审委员会一纸文书宣告赛诺菲的原研产品"泰索帝"专利全部无效.
从2003年起,法国赛诺菲安万特公司就与恒瑞医药围绕"艾素(多西他赛)"的化合物专利进行了旷日持久的诉讼.
一开始,法国赛诺菲安万特公司起诉恒瑞医药侵犯其制造路线专利,败诉后,又于2007年9月起诉恒瑞医药相关产品侵犯其制剂专利.
国家知识产权局的判决宣告"泰索帝"发明专利权全部无效,这实际上意味着法国赛诺菲安万特公司对恒瑞医药的指控不成立,恒瑞医药未来胜诉可期.
事实上,由于我国的仿制药产品已经越来越"威胁"到跨国企业原研产品在中国市场的占有率,类似的专利纠纷似乎总是没完没了.
此前,关于辉瑞"万艾可"的各项专利案件已经持续了多年,而葛兰素史克在"拉米夫定"国内专利保护已到期的前提下,仍然以拥有"核心方法的专利"为由,限制国内企业仿制.
任何专利都有保护期.
中国发明专利的保护期限为20年,实用新颖专利和外观设计专利的保护期限为10年.
保护期限过后专利失效,成为一种免费共享的社会公共资源.
而美国汤姆森科技信息集团仿制药与原料药情报部门近期公布的一份报告称,2008~2012年,一些药品的专利保护期将届满,这将给仿制药品制造商带来近460亿美元的销售市场,而仿制药品的市场销售规模亦有望由2008年的440.
8亿美元提升到2012年547亿.
事实上,目前国内医药产业由原料药向制剂、由仿制向原创转型的呼声越来越高,一些企业也已开始加大制剂生产力度.
但是由于科研能力薄弱,国内市场上的药品有97%以上属于仿制药.
中国企业往往通过仿制过期的专利药品,并凭借成本优势与专利药开展竞争.
原科技部长徐冠华曾说,中国知识产权工作近年来取得了长足进步,同时也面临着日益严峻的挑战.
特别是中国在加入WTO以后,随着关税壁垒日渐消失,一些跨国公司纷纷在中国大量申请专利,众多产业核心技术掌握在别人手里,形势非常严峻.
政府将以掌握新技术知识产权为目标,对重要产业领域的创新活动进行统一部署,建立科技创新活动的知识产权导向和激励机制,以及加强知识产权的宣传和培训,提高企业、科研机构、高等院校的知识产权能力等,推进创新型国家的创建.
所以,医药企业在新专利法实施和国家加入WTO后的大环境下,今后的专利诉讼案可能会越来越多,要有效避开专利纠纷,首先要保证自己的仿制行为合法.
其次,要积极研究海外的专利法规,努力寻求对自身有利的法律环境,运用相关法律保护自己的仿制行为.
再次,要不断创新,走自主知识产权道路,成立专门的专利部门,充实人员,包括及时申请专利,合理延长专利时间,积极跟踪专利,避免侵权等.
48医药企业今后的专利诉讼案可能会越来越多,要有效避开专利纠纷,首先要保证自己的仿制行为合法.
其次,要积极研究海外的专利法规,运用相关法律保护自己的仿制行为.
http://news.
bioon.
com/article/6286689.
html中国药企难治专利诉讼"心病"美国辉瑞、武田药品与以色列泰华仿制药公司、印度太阳制药公司之间关于潘妥洛克(泮托拉唑肠溶片)旷日持久的专利侵权纠纷终于有了结果.
自此,这场持续近十年的专利诉讼最终以泰华和太阳制药两个仿制药厂向辉瑞、武田付赔偿金而告终.
事件起源于泰华和太阳制药在2008年在美国推出潘妥洛克的仿制药,而潘妥洛克的活性成分泮托拉唑专利到2011年1月才到期,而该专利的专利权属于武田制药,辉瑞是该药在美国的独家销售商.
新泽西州联邦法院陪审团日前裁定,辉瑞和其合作伙伴武田药品工业分别获得64%和36%的赔偿金,泰华和太阳分别支付16亿美元及5.
5亿美元的赔偿金,同时这两家公司必须承认他们推出的潘妥洛克仿制药侵犯了辉瑞及武田的合法权益.
专利交叉授权复杂记者了解获悉,泮托拉唑是一类抗酸及抗溃疡药物,与其他抗菌药物如克拉霉素、阿莫西林和甲硝唑等用于根除幽门螺杆菌感染,治疗十二指肠溃疡,胃溃疡,中、重度反流性食管炎等疾病.
根据公开数据显示,潘妥洛克2007年在美国销售收入达到19亿美元,然而2008年其销售下跌至8亿美元,而这一年恰好就是泰华和太阳制药仿制版的潘妥洛克开始上市的时间.
据此,辉瑞和武田认为,泰华和太阳制药的仿制行为极大地损害了其利益.
有不愿具名的某美资律所合伙人对南都记者表示,此案的难点主要在其专利的交叉授权比较多,该药在多个国家的授权方都不一样.
然而,以辉瑞这种跨国制药巨头的法务资源,这种官司的赢面较大.
中国企业很受伤专利诉讼一直是跨国药企的常用武器,在中国屡见不鲜.
多位业内人士均对南都记者透露,我国医药产品研发能力低,大部分医药公司均是生产或外包国外已过专利保护期的药物,很多药企面临侵权风险,而且由于制度以及企业本身的能力问题,有时候即使本土企业胜诉,"也落不着好".
之前2011年,礼来和豪森制药关于奥氮平的诉讼,虽然以豪森制药胜诉而告终,但豪森却高兴不起来.
当时该企业有关人士曾表示,"因为礼来的一纸禁令,公司停止生产和销售奥氮平原料药和片剂,被扣押相关的报批文件及样品,以及先期数百万元的研发投入和上千万元用于扩建厂房、新增设备等支出没了着落.
虽然最终胜诉,禁令措施解除,但公司推出产品上市的时间却耽误了3年,丧失了产品占领市场的最佳时机.
尽管礼来公司在申请诉前禁令时提供的担保全部赔偿,但远不足以弥补我们的损失.
更为严重的是,因为官司在身,公司的上市计划被无限期推迟,企业长远发展受到极大影响.
"中国强仿企业乏善可陈各国一直都非常鼓励仿制药的生产和制造,即使是美国FDA,只要仿制药厂商能够提出针对性的技术或数据材料,注册往往都能获得通过.
在印度,政府甚至鼓励本土企业在专利期内就强行仿制跨国医药巨头的专利药,印度最高法院前不久驳回瑞士制药企业诺华公司关联癌症药品格列卫的专利诉讼.
判决支持者认定,这一判决保障发展中国家民众获得平价药品的权益.
这是印度"强仿"对峙欧美原研药的一次巨大胜利.
但值得注意的是,中国经修订的《专利实施强制许可办法》(以下简称《办法》)从2012年5月1日起已实施一年多,但一直没有本土企业提出"强仿"要求.
有企业人士表示,即便允许仿49制,在某些高端专利药领域,国内药企仍力有不逮.
目前中国"强仿"厂家中,恒瑞医药是为数不多取得成功的公司之一,其生产的奥沙利铂和多西他赛就属于强行仿制的典型案例.
但该公司之前也经历了近10年的诉讼拉锯.
除恒瑞之外,首仿药厂家多多少少都曾受到原研厂家各种形式的诉讼或针对性的协议要求.
从全球首仿药与原研药专利博弈来看,出于保护公司产品市场独享权的目的,原研厂家通常会通过不断注册相关专利以抬高进入壁垒.
而一旦出现仿制品申请或者上市,专利诉讼则成为其延长市场保护的策略.
北方某不愿具名的药企总经理对南都记者透露,其实在辉瑞的"立普妥"和"万艾可"刚上市时,由于专利方面存在一些可以规避的地方,他们曾考虑过抢先仿制,并且有初步的方案.
但之后发现,即使除却法律方面的障碍,做首仿药物按照规定走完整个审批试验流程,到最终成功上市,所耗费的资源也不菲.
http://epaper.
oeeee.
com/D/html/2013-06/20/content_1878331.
htm盘点跨国药企在印度遭遇的滑铁卢最近,全球制药巨头之一的吉列德科宣布将在印度以900美元/疗程的价格销售Sovaldi,消息一经传出,立刻在业界炸开了锅,须知Sovaldi在美国的定价为1000美元/片,合计84000美元/疗程,印度市场折扣高达99%.
吉列德官方表示,Sovaldi产品根据一个国家的人均收入和丙型肝炎发病率两个因素进行定价,2009-2013年印度的人均收入仅为1499美元,而美国的人均收入为53143美元,因而印度定价低.
但事实真如此简单吗吉列德这一做法或与印度的药品专利法律密切相关:在2005年以前,印度政府并不承认西方国家药品专利,直至2005年作为与世界贸易组织达成协议的一部分,印度才开始恢复药品专利,但只对1995年以后发明的新药或经改进后能大幅度提高疗效的药物提供专利保护,而不支持原有药物混合或衍生药物专利;同时,印度政府可根据需要实施"强制许可".
历史上被印度政府实施"强制许可"的案例不在少数,吉列德亦不例外,其自主研发的艾滋病治疗药品泰诺福韦(Tenofovir)于2009年被印度政府撤销了专利保护,这或许才是真正威慑吉列德廉价出售Sovaldi的原因.
除吉列德外,其余还有哪些跨国药企在印度遭遇过滑铁卢呢拜尔(Bayer)2012年,印度政府给Natco制药公司颁布药物专利强制需求证书,允许其生产德国拜耳公司专利抗癌药Nexavar(多吉美),这是一种治疗肾癌的药.
Natco公司在其申请中称,这种专利药使得患者一个月需花费五千多美元,远高于大部分印度人的经济承受能力.
罗氏(Roche)罗氏在印度有多个重磅产品折戟沉沙,包括乳腺癌治疗领域的重磅产品——赫赛汀(Herceptin).
2013年印度专利局驳回罗氏赫赛汀药物的专利申请,此后不久,罗氏正式宣布出于对印度知识产权环境总体的考虑,不再寻求赫赛汀在印度的专利申请.
在此前的2012年,印度法院还曾驳回罗氏针对印度西普拉(Cipla)制药公司Erlocip产品侵犯其抗肿瘤药物——Tarceva专利提起的专利侵权诉讼,理由是这两种药物的成本相差太大,出于公共利益,法院拒绝罗氏的上诉.
诺华(Novartis)诺华在印度最为出名的案例当属癌症治疗的革命性药物——格列卫(Glivec),该产品可定向抑制相关癌细胞的增值并诱导其凋零,年销售额达数十亿美元之巨.
自2006年以来,诺华一直努力为改进后的格列卫争取印度专利,但最50终被印度最高法院驳回.
辉瑞(Pfizer)2012年,印度专利局撤销辉瑞抗癌药索坦(Sutent/舒尼替尼)在该国的专利,印度专利局称:Sutent专利中所声明的发明,不涉及任何发明步骤,因此不能被授予专利.
百时美施贵宝(BMS)2013年1月,印度专利局启动新一轮强制许可签发程序,百时美施贵宝公司白血病治疗药物Sprycel和乳腺癌药物lxempra被纳入其中,允许印度仿制药厂商生产该两种药品.
从以上血淋淋的案例不难看出,吉利德在印度市场以900美元/疗程的价格出售Sovaldi,更多的或是出于对当地知识产权环境的无奈之举.
http://www.
cscapital.
cn/cs-views/4600印度仿制药"正名"运作模式可供发展中国家借鉴印度和诺华之间持续7年的诉讼终于在近期告一段落.
4月1日,据美联社报道,印度最高法院驳回瑞士制药巨头诺华公司对改进后的抗癌新药格列卫(Glivec)专利保护的要求.
认为印度本土"仿制"的癌症特效药可以继续售卖.
和往常一样,判决引起了不少争议,支持者们认定,这一判决保障发展中国家民众获得平价药品的权益,无国界医生(国际)主席卡云勒卡亚医生(DrUnniKARUNAKARA)说:"对于依赖来自印度的可负担药物的数以百万计发展中国家的病人和医生,以及无国界医生等的治疗机构来说,这真如释重负.
"而诺华公司一方则认定,这一判决严重"阻碍创新".
不管如何,这一判决被认为是印度仿制药市场的分水岭.
从此之后,作为"世界药房"的印度将会把仿制药进行到底.
诉讼拉锯战在印度首都新德里,数百民众走上街头,高举"专利杀死病人"的标语,抗议瑞士诺华制药公司挑战印度专利法.
在此之前,来自150个国家的近30万公众,以及"无国界医生"等国际非政府组织联合发出呼吁,要求诺华终止对印度政府的法律行动.
这场诉讼持续了整整7年多,争议的焦点在于诺华的抗癌药是格列卫(Glivec,或称Gleevec),这种1993年就开始被诺华开发的药品,其分子化合物又叫做伊马替尼(Imatinib).
据介绍,这种药品主要用于治疗慢性粒细胞白血病和恶性胃肠道间质肿瘤,是现阶段一种重要的抗癌药物,目前已在世界范围广泛使用,并且在40个国家获得专利权.
然而在印度,格列卫却并未被授予专利.
依据印度2005年才修改的专利法,印度只支持1995年后开发的新药,不支持现有药物混合或者衍生药物申请专利,格列卫被拒绝的理由是1995年就已经存在新药的升级版,不属于创新药.
另一方面,印度也在生产自己的格列卫.
这种仿制药在效果上,和诺华公司格列卫区别不大,但不受专利束缚.
由于无须支付专利费,仿制药的平均价格只有专利药的20%-40%,个别品种甚至相差10倍以上.
诺华"格列卫"一个月治疗花费高达4000美元,印度仿制药仅需73美元.
对于贫穷的患者来说,印度的格列卫无疑更受欢迎.
可是对于诺华来说,一旦印度打开仿制药的大门,不仅将扩大其在第三世界药品市场的优势地位,还会进一步让其在欧美药品市场进军,这样一来,公司将会损失惨重.
诺华一直寻求印度法院认定这家企业研制的抗癌药"格列卫"改进型应受专利保护,宣称改进型更易于人体吸收,是一次重大改进.
不过,印度最高法院最终认定,这种改进型药品"不符51合创新和独创两项标准",支持印度专利局先前判断.
这一判决意味着印度制药企业可以继续合法"仿制"这种药品.
癌症患者援助协会律师阿南德·格罗弗说:"判决对于向贫困人口提供平价药品有着十分积极的意义.
""诺华对印度专利法中的攻击已然失败,印度的专利办公室应该将此视为一个清晰的信号,该法例必须严格执行,轻率、不严谨的专利申请应该被拒绝.
"无国界医生"病者有其药"项目驻印度经理孟甘妮(LeenaMENGHANEY)更是对时代周报记者表示.
诺华当天发布声明,批评这一判决"阻碍日后创新".
英国《金融时报》3月31日报道,这家瑞士制药企业先前威胁,如果输掉诉讼将停止向印度市场供应新药.
在诺华的中文网页上,印度产"格列卫"仍被称为"假药".
印度仿制药业这一判决被认为是一大分水岭,印度制药企业先前主要仿制那些售价高昂、用于治疗艾滋病、肺结核和癌症的药品.
如今,则会将目光放在更多药品制造领域.
印度一直有着"世界药房"之称,这里的仿制药产业十分发达,产量占全球仿制药的1/5.
这些仿制药在剂量、安全性和效力、质量、作用以及适应症上,都和原专利药类似.
一般来说,西方国家昂贵药品一经上市,印度制药企业在本国专利法保护下可以仿制同类产品.
由于没有对药品化学成分的专利保护,印度的药品价格为全球最低,一直受到贫穷患者和人道医疗组织的欢迎,很多发展中国家都依赖印度生产的价格较低的药物.
为了捍卫本国的仿制药业,印度以法律的形式与西方制药巨头博弈.
上世纪70年代,印度的政府不承认西方国家药品专利,直到2005年,作为与世界贸易组织达成协议的一部分,印度才开始恢复了药品专利.
2005年1月生效的印度专利法只对1995年以后发明的新药或经改进后能大幅度提高疗效的药物提供专利保护,而不支持原有药物混合或衍生药物专利.
同时,印度政府可根据需要实施"强制许可".
《印度时报》4月1日报道,一家印度药企已经推出美国默克公司的糖尿病治疗药品西他列汀的仿制版,显现竞争已步入慢性病药品领域.
孟甘妮表示:"我们已经看到印度专利法的实施对保障公共卫生的好处.
有赖印度严谨的法律,越来越多的药物需要引入仿制药的竞争,令其价格变得可以负担.
"中国可否借鉴这起诉讼是印度在WTO相关知识产权协议过渡期满之后,遭遇的第一起药品专利诉讼.
诉讼结果将直接影响到发展中国家能否继续获得价格较低的药物,以及WTO专利保护条款如何落实等重大问题.
"判决不仅影响印度,同时对其他亚非拉国家具有参考意义.
"对此,印度大型制药企业西普拉医药公司律师普拉蒂巴·辛格说.
作为仿制药的另一大市场,中国仿制药生产和印度相比无论是在规模还是质量上,都有着极大的差距.
近几年印度获批的仿制药申请基本都占到美国食品药品监督管理局(FDA)批准的约1/3,暂时性批准占到近40%.
数据显示,目前在印度,有近100家制药厂获得FDA的批准,这些工厂多半生产用于出口的仿制药,年销售额多年以来均超过60亿美元.
从2012年1月1日起至2016年12月31日的5年间,全球将有多达631个专利药到期.
专利药到期高峰的到来,对于很多发展中国家来说,这意味着仿制药将有更多的市场和空间.
52国内医药行业专家边晨光对时代周报记者表示,跨国医药公司要求申请专利延长是出于利益的驱使.
由此以来,在跨国医药公司和发展中国家之间便产生了一个不可调和的矛盾:那便是利益与民生的对抗.
"企业的根本立足点是利益,而国家政府的立足点则是民生,为本国人民考虑.
外国药品价格高昂,让许多病人望而却步,但国家不能见死不救,因此便采取'强制仿制'的方式,以提供价格较低的仿制药.
"边晨光说道.
边晨光表示,目前中国并没有鼓励仿制药的政策和法规,其中一个原因在于中国并不像印度那样疾病肆虐.
但如果在未来中国出现急需仿制药的情况,"强制仿制"或许是唯一的方法,而这时,将会由政府更多地承担相应义务和责任以保障民生.
无国界医生(国际)主席卡云勒卡亚医生说:"目前,药物创新的资金来自专利垄断下的高昂药价,无法负担这些价格的发展中国家病人和政府便为此付出代价.
与其想方设法扭曲规则,以寻求旧药的长青专利保护,来滥用专利系统,制药业不如集中精力寻求真正的创新.
政府也应该发展出一个框架,使药物的研发得以用另一方式进行,而药价又是病人可负担的.
"与此同时,边晨光也呼吁西方制药公司和发展中国家展开积极的对话:"这场对话需要进行,我们邀请诺华成为解决方法的一部分,而不是成为问题的一部分.
"http://finance.
eastmoney.
com/news/1355,20130411284552319.
html中国修改专利法允许复制"救命药"中国近期对知识产权法进行部分修改,允许国内制药商生产仍受专利保护药品的廉价复制品,此举或令外国制药公司感到不安.
中国国家知识产权局网站发布的文件对上述举措进行了概述.
几个月前,印度采取类似举措,颁布首个药品强制许可,结束了拜耳(BAYGn.
DE:行情)对一种抗癌药物的垄断.
中国此举将对大型制药公司敲响警钟,因为在西方国家药品销量下滑之际,中国是药业增长的关键市场.
根据修改後的《专利实施强制许可办法》,在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,中国政府可向具备实施条件的公司颁发强制许可证,生产专利药品的仿制品.
为了公共健康目的,合格的制药商还可请求将这些药品出口到其它国家,包括世界贸易组织(WTO)成员国.
根据WTO规定,在无法承担"救命药"成本的情况下,各国可以颁发强制许可证.
中国国家知识产权局通过传真发给路透的声明称:"修订版《专利实施强制许可办法》将於2012年5月1日起实施.
"内容调整可在中国国家知识产权局网站查看.
(link.
reuters.
com/tus68s)WTO推荐GileadSciences生产的泰诺福韦(tenofovir)用於治疗艾滋病.
两名知情人士称,中国此举瞄准的是泰诺福韦,中国制药商准备生产该药品.
联合国和卫生专家6月初在曼谷举行了药品可及性研讨会.
中国官员谈及其专利法调整.
与会者包括来自柬埔寨、印度、印尼、马来西亚、缅甸、菲律宾、泰国和越南的官员.
http://yao.
dxy.
cn/article/23746
gdpu.
edu.
cn主页:http://www.
lib.
gdpu.
edu.
cn/tsfw/yxkx/承印:广药勤工助学复印部,联系电话:020-31280533,13527895988II目录【医药进展】12014AHA/ACC指南对NSTE-ACS抗血小板治疗的推荐.
12014美国NSTE-ACS指南:早期治疗要点1美国发布最新版非ST段抬高型急性冠脉综合征指南3AATS发布最新术后心房颤动预防和管理指南.
4对COPD采用组合疗法与较好的转归有关.
5糖尿病幕后的真相:控制系统复杂性的丢失.
6JACC:慢性心力衰竭患者肠血流量减少7再生障碍性贫血致病基因确定.
8Circulation:肾脏疾病并非tPA禁忌证9科学家发现控制细胞衰老的开关—端粒酶9专家视点:如何治疗Brugada综合征.
10Org.
Biomol.
Chem:治疗阿尔兹海默氏症的新型蛋白药物.
11NatCellBiol:发现促进癌症转移的关键蛋白质11PNAS:鉴别乳腺癌组织的新工具12CancerRes:研究人员发现增加白血病发病的新基因12新的抗癌药物靶标——脂质化学信使.
13【政策法规】13卫计委放松基层用药限制多地非基药比例不超30%13处方药网售即将放开首批目录待定.
15国家食药总局公布第一批过度重复药品品种目录的公告17六部委推进医药分开.
17【业界新闻】18湖南省纪委官员实名举报国家药监局前局长.
18盘点2014年FDA批准的孤儿药19Adaptimmune募集1亿美元促进癌症免疫疗法研究.
22VentiRx融资5000万美元用于癌症免疫疗法.
23FDA批准塞尔基因Otezla用于中重斑块状银屑病23FDA许可首款酵母病原体的血检产品上市.
24治疗近视性脉络膜新生血管病变药物Eylea在日本获批.
24FDA批准Xtandi胶囊新适应症用于治疗转移性CRPC.
24FDA批准阿斯利康Movantik治疗阿片药物诱导的便秘25FDA批准礼来Trulicity治疗2型糖尿病.
25FDA批准百特HYQVIA用于原发性免疫缺陷成人患者治疗.
262014年重磅生物制药行业发展主形势分析.
27制药企业动作频频减肥药破茧在即28IMS:2014医院用药统计报告.
29【专题】埃博拉病毒.
29什么叫埃博拉病毒29基因测序揭示埃博拉疫情源头.
30汤森路透:世界聚焦埃博拉.
31全球合力阻止埃博拉疫情传播.
32IIINature:科学家探讨埃博拉病毒感染的新型疗法进展.
34Science杂志介绍埃博拉病毒致病机制.
35埃博拉病毒躲避机体抗病毒防御系统机制.
36英发现埃博拉病毒治疗新方法.
36世卫组织:埃博拉病毒逾三百基因已变异.
37埃博拉疫苗生产面临瓶颈.
38灵长动物实验证实美埃博拉新药有效.
38【专题】医药专利诉讼.
39跨国药企专利药频遭仿制屡屡起诉陷国际争端.
39恒瑞医药:中外药企五年专利之争恒瑞获胜.
40受困专利日益明显国内药企需提高知识产权意识40突破专利壁垒科伦药业势逼跨国药企.
41仿制药存在价格优势药企专利门问题待解.
43中国抗体药如何抵御专利战45一起专利诉讼引发的思考.
47中国药企难治专利诉讼"心病"48盘点跨国药企在印度遭遇的滑铁卢.
49印度仿制药"正名"运作模式可供发展中国家借鉴50中国修改专利法允许复制"救命药"521【医药进展】2014AHA/ACC指南对NSTE-ACS抗血小板治疗的推荐2014年9月23日,美国心脏学会(AHA)/美国心脏病学会(ACC)非ST段抬高型急性冠脉综合征(NSTE-ACS)管理指南进行了更新,其中关于NSTE-ACS患者起始治疗抗血小板药物/抗凝药物的推荐是大家重点关注的部分,现摘译指南对接受早期侵入性治疗或缺血指导策略治疗的确诊或疑似NSTE-ACS患者抗血小板治疗部分的推荐与读者分享.
Ⅰ级推荐:①起病后应尽快给予所有无禁忌证的NSTE-ACS患者非肠溶性阿司匹林咀嚼片(162mg~325mg),并以阿司匹林维持剂量(81mg~162mg)无限期使用.
(ⅠA)②因超敏反应及胃肠道不耐受而不能应用阿司匹林的患者,应给予负荷剂量的氯吡格雷治疗,并继以每日维持剂量治疗.
(ⅠB)③对于接受早期侵入性或缺血指导策略治疗,且无禁忌证的患者,推荐应用P2Y12抑制剂(包括氯吡格雷和替格瑞洛)联合阿司匹林治疗12个月.
其中氯吡格雷的用法为负荷剂量300~600mg后以75mg/d维持(ⅠB),替格瑞洛为负荷剂量180mg后以90mgbid维持(ⅠB).
Ⅱa级推荐:对于接受早期侵入性或缺血指导策略治疗且无禁忌证的患者,应用P2Y12抑制剂治疗时,优先选择替格瑞洛是合理的(Ⅱa,B).
Ⅱb级推荐:对于接受早期侵入性治疗及双联抗血小板治疗(DAPT)的中高危NSTE-ACS患者(如肌钙蛋白阳性),起始抗血小板治疗策略中应考虑应用糖蛋白Ⅱa/Ⅲb抑制剂,依替巴肽及替罗非班为优选(Ⅱb,B).
http://circ.
cmt.
com.
cn/detail/598573.
html2014美国NSTE-ACS指南:早期治疗要点9月23日,ACC与AHA颁布了新的非ST段抬高型急性冠脉综合征(NSTE-ACS)治疗指南.
(详见:美国发布最新版非ST段抬高型急性冠脉综合征指南)现将其中涉及NSTE-ACS早期治疗的部分要点简单介绍如下:1.
只为血氧饱和度0.
24秒、II度或III度房室传导阻滞但未安装起搏器等情况,可应用非二氢吡啶类钙离子拮抗剂治疗;13.
经β受体阻滞剂和硝酸酯类药物治疗后仍存在复发性缺血的患者,若无禁忌证可服用非二氢吡啶类钙离子拮抗剂;14.
若β受体阻滞剂治疗无效或有禁忌证或不能耐受,可选用钙拮抗剂治疗(避免应用短效非二氢吡啶类钙离子拮抗剂);15.
存在冠状动脉痉挛的患者可应用长效钙拮抗剂;16.
在未应用β受体阻滞剂的情况下,禁忌使用短效硝苯地平;17.
无禁忌证的患者应开始或继续强效他汀治疗;18.
伴LVEF0.
24s,II°或III°心脏传导阻滞且未安装心脏起搏器,活动期哮喘,或气道反应性疾病).
5.
所有无禁忌症的NSTE-ACS患者均应开始或继续高强度他汀类药物治疗.
6.
所有无禁忌症的NSTE-ACS患者无论是接受早期介入治疗还是缺血指导的治疗策略,均应给予P2Y12抑制剂(氯吡格雷或替格瑞洛)联合阿司匹林治疗12个月.
接受冠脉PCI治疗的患者应使用P2Y12抑制剂(氯吡格雷,普拉格雷或替格瑞洛)治疗至少12个月.
对于接受早期介入治疗或缺血指导策略的NSTE-ACS患者,在选用P2Y12抑制剂时替格瑞洛优先于氯4吡格雷是合理的.
对于接受PCI且非出血高危的NSTE-ACS患者,在选用P2Y12抑制剂时普拉格雷(PCI期间开始使用)优先于氯吡格雷是合理的.
7.
无论初始治疗策略如何,所有NSTE-ACS患者均推荐给予抗凝联合抗血小板治疗.
对于NSTE-ACS患者,PCI治疗后应停止抗凝治疗,除非有令人信服的理由需要继续该治疗.
8.
难治性心绞痛或血流动力学/电不稳定的NSTE-ACS患者(无严重并发症或介入禁忌症)应采取紧急/直接介入策略.
对于临床实践风险升高、初期稳定的NSTE-ACS患者(无严重并发症或介入禁忌症)应采取早期介入策略.
早期介入策略不推荐用于以下患者:(1)有广泛的并发症者,如肝、肾、肺衰竭及癌症患者;(2)血运重建风险及并发症可能超过获益的患者;(3)肌钙蛋白阴性、ACS可能性较小的急性胸痛患者,特别是女性.
9.
所有符合适应证的NSTE-ACS患者均应该在出院前或第一次门诊随访时制定一个全面的心血管康复计划.
10.
应提供给NSTE-ACS患者一个基于证据的管理计划(例如,指南指导的药物治疗),包括改善药物治疗依从性、医疗团队及时跟进、适当的饮食和运动以及依从二级预防的干预措施.
除了日常锻炼的详细说明,还应该指导患者进行具体的日常活动,例如举重物、爬楼梯、园艺和家庭活动等,哪些活动是允许的、哪些活动是应该避免的.
特别提到可以恢复开车、重返工作岗位和性生活这一内容.
http://news.
medlive.
cn/heart/info-progress/show-68112.
htmlAATS发布最新术后心房颤动预防和管理指南美国胸外科医师学会(AATS)日前发布最新预防术中或术后心房颤动(房颤)以及房颤和心房扑动(房扑)患者管理指南.
指南还为已有房颤,将要接受胸外科手术的患者管理提供了指导,这些患者卒中,心力衰竭(心衰)和其他并发症风险较高.
管理抗心律失常药物和围术期抗凝治疗存在挑战.
因此,术前心内科会诊可能有益.
工作组主席GyorgyFrendl博士(Brigham妇女医院)表示,―事实上,我们无法精确说明房颤为何会发生,但心肺手术患者,尤其肺部手术患者术后房颤发生率非常高.
因此,胸外科和心脏外科医生希望找到原因、预防和解决方案.
答案并不简单.
‖指南9月23日在线发表于JournalofThoracicandCardiovascularSurgery.
术后房颤患者住院时间、并发症和花费更多.
房颤/房扑高危因素包括高龄、高血压、心衰、房颤病史、阻塞型睡眠呼吸暂停、甲亢、左室肥厚、瓣膜性心脏病、肥胖、吸烟、酗酒等.
新指南推荐所有术前服用β受体阻滞剂的患者术后应继续使用,预防房颤或房扑(Ⅰ,A).
术后血压降低并不是停用β受体阻滞剂的理由,低血压患者可减少剂量或服药频次.
如果血清镁水平低或术者怀疑体内镁含量降低,可考虑静脉补镁(Ⅱb,C).
不应使用地高辛,或术中行导管/手术肺静脉隔离预防房颤或房扑.
围术期/术后房颤或房扑中高危患者,如果心功能正常,且围术期未使用β受体阻滞剂,可考虑使用地尔硫卓(Ⅱa,B)接受特定手术如肺切除术或食管切除术的患者,术后可考虑使用胺碘酮.
但胺碘酮长期大量使用有肺毒性.
未使用他汀,接受中高危手术的患者,可考虑使用阿托伐他汀(Ⅱb,C).
长期使用华法林或新型口服抗凝药的房颤患者,是否停用及需要肝素过渡取决于卒中风险,可使用CHA2DS2-VASc评分评估.
50%,可考虑使用依诺肝素作为短期过渡药物.
如果停用抗凝治疗,应尽量缩短时间.
围术期房颤/房扑患者管理取决于血液动力学稳定型.
稳定患者主要治疗为心率控制,目标为110次/分.
血液动力学不稳定者应转复窦性心律.
http://circ.
cmt.
com.
cn/detail/598473.
html对COPD采用组合疗法与较好的转归有关据9月17日发表在《美国医学会杂志》上的一则研究披露,在罹患慢性阻塞性肺病(COPD)——尤其是那些有哮喘者——的较为年长的人中,新开的长效β-受体激动剂(LABAs)与吸入性皮质类固醇联合疗法与仅用新开的LABAs相比,前者与较低的死亡风险或COPD住院风险相关.
慢性阻塞性肺病是全球排第三的主要死亡原因.
药物是COPD治疗的支柱,而知道哪些药在现实实践中最为有效是至关重要的.
与安慰剂相比,由LABAs和吸入性皮质类固醇(ICSs)组成的组合疗法一直显示能减少病情恶化并可能降低死亡的风险.
然而,根据文章的背景资料,在其所知的效果与单独使用LABAs相比还存在有空白.
多伦多Sunnybrook健康科学中心的AndreaS.
Gershon,M.
D.
,M.
Sc.
及其同事检查了在患有其它疾病——包括哮喘的年龄较长的COPD病人中LABA-ICS组合疗法与单用LABAs相比的结果.
这些研究——它包括了从2003-2011年间在安大略的数据——纳入了年龄66岁或以上的人,这些人符合经过验证的COPD的病例定义;有8712名新的LABA-吸入性皮质类固醇组合疗法使用者及3160为仅用LABAs的新的使用者,对这些人的随访中位数时间分别为2.
7年和2.
5年.
在2129名LABAs的新使用者中观察到了主要结果(死亡和COPD住院的复合结果)(1179例死亡[37.
3%]);950例COPD住院[30.
1%]及5594例LABAs和ICSs的新的使用者(3174例死亡[36.
4%];2420例COPD住院[27.
8%]).
与仅用LABAs的新使用者相比,在LABAs和ICSs的新使用者中的复合结果的风险具有温和但显著较低的风险.
在具有合并哮喘诊断的COPD病人(5年时的复合结果差异为-6.
5%)中以及在那些没有接受吸入性长效抗胆碱能药物(这是一类不同的COPD药物,它是通过抑制特定神经冲动的传导以帮助扭转气道阻力而起作用的;5年时的复合结果差异为-8.
4%)的病人中有着最大的差异.
文章的作者写道:―我们的在LABAs和ICSs与转归间有相关性的发现可帮助厘清罹患COPD和哮喘病人的管理,因为许多对COPD药物的研究将哮喘病人排除在外,反之亦然.
‖―此外,COPD的行医指南建议,LABAs应被考虑作为第一线的治疗,而哮喘的治疗指南则警告不要在没有ICSs时使用LABAs.
我们的结果还对没有哮喘的COPD患者的最佳治疗提供了见解,这些人没有被考虑为是那些对皮质类固醇特别起反应的病人.
‖研究人员补充说,这些发现应该在随机化的临床试验中得到确认.
社论:在现实世界中治疗COPD英国利物浦大学的PeterM.
A.
Calverley,M.
B.
Ch.
B.
,D.
Sc.
在一篇附随的社论中对这项研究的结果发表了评论.
―由Gershon等人报告的新的数据的最值得注意的特征也许是使用这些治疗的病人与那些治疗已经在随机化临床试验(RCTs)中得到验证的病人的特征中的差异.
在这些现实世界'病人中的治疗结果似乎比可能来自RCTs的预计结果要好些,但这些病人也更为多元而且常常病情更重.
Gershon等人的研究显示,来自恰当进行的数据库分析的发现补充了来自RCTs的数据,并应该在决定治疗程序时进行考虑.
‖6http://www.
i-md.
com/news/detail/541a42d58516b68672144fca糖尿病幕后的真相:控制系统复杂性的丢失2014年9月23日华盛顿—对于美国百万名身患1型和2型糖尿病的患者来说,每日测量血糖的升降是一种生活方式.
我们体内的能量主要由血液中的葡萄糖所掌控,而血糖又由人体细胞,组织,器官以及荷尔蒙之间复杂的相互作用所控制,这种相互作用维持血糖保持在一个相对稳定的水平,即当血糖低的时候,让它回升,高的时候,让它下降.
当一个人罹患糖尿病时,这种自然的动态平衡会被打破.
现代对于糖尿病介入治疗的方式涵盖了饮食,药物以及生活方式的改变,但糖尿病是一种难以驾驭的疾病,所有的这些方式都很难恢复荷尔蒙和血糖的自然平衡.
常规的血糖测量是管理这种疾病的核心部分,它帮助病人和看护人员计划出何时应该给病人服用胰岛素和其他的药物以及如何调节病人的饮食.
管理糖尿病的种种困难以及2型糖尿病新病例的爆发激发了科学家们对新的疾病监测方式和治疗方法的探索,旨在进一步优化临床决定和个性化对血糖的控制.
日前,哈佛医学院的的研究人员们发现血糖的微小波动可能蕴藏着比表面上看起来更多的东西—事实上,这些在绝大多数情况下被忽略的瞬间动态有可能提供了丰富的信息,而这些信息就隐藏在那些微小的,表面上看起来无足轻重的血糖涨落之中.
正如这周研究人员发表在由美国物理联合会出版的《混沌》期刊上的文章所述,提取血糖微小波动中的信息可能会阐释人体生理机能中一些未被充分理解的前沿问题,并且甚至有可能为监测和治疗糖尿病提供新的方法,这些方法基于维持和恢复人体整体控制系统的复杂性,哈佛研究人员将这一概念称为―将系统作为目标‖.
血糖的连续监测这项新研究是由哈佛医学院统计物理学家MadalenaD.
Costa,哈佛医学院BethIsraelDeaconess医学中心和哈佛大学theWyssInstituteforBiologically-InspiredEngineering的心血管病专家AryGoldberger带领进行的.
和他们的研究人员一起,Costa和Goldberger一起研究了从18个罹患2型糖尿病的中老年人和12个作为对照组的年龄匹配的健康人那里得来的无身份识别的回顾性数据.
这30个人都被连接上血糖连续监测仪--一种植入式的仪器每五分钟测量一次血糖水平.
经过连续几天的数据观察,研究人员发现无论是糖尿病人群还是健康人群,其血糖都持续经历了微小的波动.
但两个组的波动不一样,健康人群的波动更加细微,移动速度也更快.
以前医生们其实已注意到健康人群血糖中细小高频的波动,但大多数情况下,这种波动被归因为噪音干扰和血糖仪器的探测局限.
毕竟,这些波动并不很显著.
但Costa,Goldberger和其他研究人员粉碎了这个假设,他们证实了有复杂的信息隐藏在这种动态中,并且这种信息在2型糖尿病人群中会发生变化.
研究人员的这一发现是源自使用了一种叫多尺度熵分析的复杂的数学技术,该数学技术可以量化数据的复杂性并比较其数值,研究人员先是打乱了从30个人身上收集到的每隔5分钟的测量数据的顺序,然后使用这种数学技术分析数据之间的差异性是如何变化的.
―这次与计算过程的结合让我们知道在不同的时间尺度中时间序列是多么的无法预知.
‖Costa说.
研究分析表明短期的波动(长期波动也一样)并不代表不相关的随机性,而是在编码复杂的信息.
且研究人员进一步发现,这些被编码于波动中的信息在健康人身上要明显复杂于糖尿病7人,这点是医生们从未系统持续的观察到过的.
在疾病发作时,波动中信息复杂性的明显丢失启发哈佛研究组提出了一种新颖的研究糖尿病的方式,他们称之为―动态血糖测量法‖,一种解码隐藏于这些波动中的信息的方法,有别于以往只是依赖定期的检查和平均值的方法.
复杂性,生理机能和人类健康如果说糖尿病是一个说明健康生理机能具有复杂变化性的新兴的例子,它绝不是唯一的一例.
动态血糖测量法之类的东西以前从未被系统的应用于糖尿病的研究,但类似的方法早已在医学的其他领域被应用,复杂性的细微差别已被用来帮助我们理解基本的人体生理机能.
比如在生理学中有一个由来已久的范式,说的是最健康的人体系统应该是呈现出最大稳定性的系统—这个被称为―同态‖的概念已经主导生理学领域近一个世纪.
但现在医生们开始认为这个概念也不一定总是正确的.
心血管专家Goldberger指出年轻人的心跳要比患有心脏病的老年人有更复杂的多变性.
健康的有规律的心跳更像沙球的声音而不是节拍器.
同样的,身体里的所有―乐器‖所遵循的韵律是要避免―愚蠢的一致‖取代了交响乐的丰富,Goldberger说.
―如果交响乐队中的每一个人都同时演奏相同的调子,你会走出剧院‖他说.
―没有人想听过于一致的声音或者杂乱无章的声音,也就是静态.
‖健康人体系统复杂性的背后也许说明了这样一个事实—即它为我们带来了一种更高水平的适应能力,使我们在不同的时间尺度中能够处理不可避免的压力.
身体不是一个传统的机器,Goldberger说,你赖以生存的是一种能够做出改变的能力而不是被紧紧控制锁定在某个稳定的状态或者是处于完全杂乱无章的状态.
如果这就是糖尿病的真相,动态血糖测量法也许能让人们对理解糖尿病背后的生理过程有新的思路,并且有可能据此提出新的,通过恢复能量调节系统的多尺度复杂性来治疗疾病的方法.
更多:关于糖尿病和其治疗方法的背景资料糖尿病是一种慢性复杂疾病,其显著症状是血糖过高,病因是由于胰岛素,一种调节血糖的荷尔蒙,出了问题.
正常情况下我们的身体通过不断监测血糖,并释放胰岛素和其他荷尔蒙来调节血糖的高低以维持其正常水平.
但罹患糖尿病的人丧失了这种自然的平衡和自身控制血糖的能力.
1型糖尿病是由体内无法产生胰岛素产生的,而2型糖尿病是由身体无法对胰岛素产生正确的反应造成的.
对于这两类糖尿病的治疗早在上个世纪就是著名的医学界成功的故事之一,它将一种原本致死的疾病转换成慢性的可控的状态.
http://news.
haoyisheng.
com/14/0925/310105314.
htmlJACC:慢性心力衰竭患者肠血流量减少作者:伊文来源:国际循环最近一项前瞻性研究结果显示,慢性心力衰竭(心衰)患者较无心衰患者肠血流量减少.
这可能导致细菌生长增加和胃肠道症状.
研究者共纳入65例慢性心衰患者和25例对照者.
结果显示慢性心衰患者肠动脉血流减少,可导致近粘膜处细菌生长、炎症、胃肠道症状及心衰晚期并发的心源性恶病质.
心衰的严重程度与肠系膜上动脉和腹腔动脉的血流减少显著相关(P<0.
04).
慢性心衰患者肠系膜上下动脉、腹腔动脉收缩期血流较对照组下降30%~43%(P<0.
007).
发生恶病质的患者血流量减少更明显(P<0.
002).
心衰组小肠、升结肠、降结肠、乙状结肠、8横结肠肠壁厚度较对照组增厚(P<0.
01),胃肠道症状也更频繁,包括上腹部饱胀感、呃逆和肠道杂音(P分别为0.
014、0.
016、0.
027).
其中呃逆、肠道杂音在恶病质患者中症状更重.
低血流量显著增加腹部不适症状,血清抗脂多糖IgA(r=0.
76,P<0.
02)和CRP(r=0.
43,P=0.
02)明显升高.
慢性心衰患者近粘膜细菌生长率高,且与低血流量和血清抗脂多糖IgA明显相关(r=0.
55,P=0.
05).
多变量分析显示,心源性恶病质与肠系膜上动脉低血流量明显相关(P<0.
04),与肠系膜下动脉低血流量临界于有显著性意义的边缘(P=0.
056).
英国赫尔约克医学院城堡山医院BenjaminDicken和伦敦帝国理工学院JohnG.
F.
Cleland博士均对上述结果持怀疑态度.
他们认为,许多心血管药物,如利尿剂、盐皮质激素阻断剂均对肠道功能有影响,另外对照组的活体组织检查也未能真实的反映健康人群.
Dicken和Cleland认同通过抗生素或改变肠道内环境的方式改变细菌的数量或种类,进而评估肠道细菌和心衰进程的关联研究.
但任何一种方法要证明有效,均需要大规模研究来评估.
http://www.
icirculation.
com/article/NewsInfo.
aspxid=28570再生障碍性贫血致病基因确定一个国际科学家小组发现了一种基因突变,可导致再生障碍性贫血(aplasticanemia)——一种严重的血液疾病,指骨髓不能产生正常数量的血细胞.
通过对一个三代都患血液疾病的家庭进行研究,研究人员发现一个基因缺陷,控制端粒、染色体结构,在正常细胞功能中发挥关键的作用.
本文共同第一作者、美国费城儿童医院(CHOP)应用基因组学中心主任HakonHakonarson博士指出:―识别这种因果缺陷,有助于指导今后的分子治疗,可避开基因缺陷并恢复血细胞的生产.
‖Hakonarson和CHOP同事与澳大利亚的科学家合作,将相关研究结果发表在2014年9月9日的《Blood》杂志.
本文共同第一作者、澳大利亚Westmead儿童医学研究所细胞生物学部门负责人TracyBryan博士指出:―我们为这项发现感到激动,它推动了我们对于某些基因突变和特定疾病因果关系的理解.
‖研究小组研究了一个澳大利亚家庭,其成员患有再生障碍性贫血和其他血液疾病(包括白血病).
Hakonarson和首席分析师YiranGuo博士,连同深圳华大基因(BGI)的基因组学专家一起,对来自家庭成员的DNA进行了全外显子组测序,在ACD基因上发现了一个遗传性突变,其编码端粒结合蛋白TPP1.
端粒是由DNA和蛋白质构成的复杂结构,位于染色体的末端,在那里它们保护染色体的稳定性.
有时候它们相当于鞋带末端的塑料头,可以防止鞋带的磨损.
细胞每分裂一次,端粒就会缩短,并逐渐失去保护功能.
衰老细胞与其缩短的端粒,逐渐变得更易受到DNA损伤和细胞死亡的影响.
来自于衰老过程的某些遗传性疾病和后天获得的失调症,可能会缩短端粒,并损害正在迅速分裂的血液形成细胞(骨髓中产生的).
这会导致骨髓衰竭,其中一个例子就是再生障碍性贫血.
Bryan的研究小组调查了ACD基因的功能.
他们断定,突变可缩短端粒,并中断端粒结合端粒酶的能力,这会抵消端粒缩短,从而保护细胞.
在当前的研究中,研究人员发现,ACD基因突变可改变端粒结合蛋白TPP1,破坏端粒和端粒酶之间的相互作用.
无法获得端粒酶以帮助维持端粒,血细胞就失去其结构完整性并死亡,导致骨髓衰竭和再生障碍性贫血.
其他9个基因,之前被发现在骨髓衰竭性疾9病中发挥一定作用.
目前的研究将ACD添加到名单中,首次证明该基因有致病作用.
Hakonarson说:―这改进了我们对于潜在分子机制的了解,可能提出新的方法,来治疗再生障碍性贫血这样的疾病.
例如,研究人员可以确定其他途径,将端粒酶招募到端粒上,以恢复其保护功能.
‖http://news.
medlive.
cn/all/info-progress/show-68196_246.
htmlCirculation:肾脏疾病并非tPA禁忌证最新研究显示,尽管慢性肾脏病(CKD)患者静脉溶栓治疗缺血性卒中的颅内出血和严重全身出血风险较高,但此风险与肾脏疾病不相关.
对超过4.
4万例患者进行的静脉组织型纤溶酶原激活物(tPA)安全性研究显示,调整年龄与合并症后,患有CKD(和无CKD相比)与症状性颅内出血(调整后OR1.
0,95%CI:0.
91~1.
10,P=0.
9510)或严重全身出血(调整后OR0.
97,95%CI:0.
80~1.
18,P=0.
7924)不相关.
不同CKD级别及不同类型出血结果均相似.
然而,和肾功能正常者相比,CKD患者院内死亡和出院时功能状态不良可能性更高.
第一作者BruceOvbiagele博士(SouthCarolina医科大学)表示,―CKD患者更可能发生颅内出血和全身出血,但CKD似乎并未导致这些结局.
CKD患者年龄更老,病情更严重.
静脉tPA是非常有效的治疗,CKD患者应予以考虑.
‖研究9月23日在线发表于Circulation.
研究者分析美国―遵循指南‖卒中注册研究数据,CKD定义为eGFR<60ml/min/1.
73m2,无CKD患者作为对照组.
共44410例患者被纳入分析,其中15191例(34.
2%)符合CKD定义.
CKD患者年龄更老,女性、白人、目前吸烟者,有卒中/短暂性脑缺血发作、颈动脉狭窄、冠状动脉疾病/既往心肌梗死和高血压比例更高.
卒中更严重(平均NIH卒中量表评分13.
0vs.
11.
3).
和无CKD患者相比,CKD患者症状性颅内出血(5.
4%vs.
4.
2%)、严重全身出血(1.
2%vs.
0.
9%),院内死亡(10.
7%vs.
6.
5%)和不能自理(56.
5%vs.
45.
1%)发生率更高.
调整混杂因素后,CKD与症状性颅内出血或严重全身出血并不相关,但院内死亡(调整后OR1.
22,95%CI:1.
14~1.
32,P<0.
0001)及肾功能恶化风险较高.
研究者认为CKD患者预后较差可能与合并症相关,如贫血、氧化应激、电解质失衡和慢性炎症,而非凝血和血小板功能障碍.
对于合并CKD的卒中患者,静脉tPA是适当的治疗.
http://circ.
cmt.
com.
cn/detail/598477.
html科学家发现控制细胞衰老的开关—端粒酶近日,发表在国际杂志Genes&Development上的一篇研究论文中,来自索尔克研究所的研究人员通过研究发现,细胞开关或许对于健康老龄化非常关键,新型的细胞开关可以帮助健康细胞保持分裂和生长的状态,比如在老年人机体中产生新型的肺脏和肝脏组织等.
在我们机体中,新生细胞会不断补充肺部、皮肤、肝脏及其它组织,然而很多人类细胞都不能无限分裂,由于细胞每分裂一次位于染色体末端的染色体就会缩短,随着细胞分裂端粒就会越来越短,最后细胞便不能分裂,从而引发器官和组织老化,这些现象就会在个体老年时发生;但是有些细胞会产生一种端粒酶,其可以重建端粒使得细胞无限分裂.
研究者VickiLundblad表示,这项研究中我们发现了端粒酶,此前研究中我们发现一旦当端粒酶被装配,其就会源源不断地供应,理解这种新型开关的工作机理对于缓解端粒变短,开发新型老化疾病的疗法非常关键.
文章中研究者试图去研究端粒酶复合物的每一个组分的结构功能,但似乎这并不是一个容易的工作,于是研究者开10发了一种新型策略,可以使其在细胞分裂期间清楚地观察到端粒酶的每一个组分的结构,从而为揭示端粒酶的作用原理提供了新的线索.
研究者表示,当完整的端粒酶复合物成功装配后,其会快速分解形成非活性的分解复合物,并且可以促使端粒酶开关处于关闭位置,研究者就推测这种分解途径或许可以帮助端粒酶在细胞中以较低水平存在.
尽管在正常细胞中―坏‖的端粒酶会引发衰老过程,但是癌细胞会依赖于更高水平的端粒酶来确保其细胞无性增殖,因此对端粒酶开关的有效控制或许是抑制癌症扩散转移的有效路径.
http://gp.
cmt.
com.
cn/detail/597525.
html专家视点:如何治疗Brugada综合征作者:HiroshiMorita博士(日本国立冈山大学医学、牙科学及药物学研究院心血管治疗学教授)1992年Brugada等人报道了一例以心前区ST段抬高和夜间突发室颤而猝死为特征的临床综合征.
据报道,这种Brugada综合征(BrS)的发生率大约在0.
03%到0.
3%左右.
该类患者被分为3种类型:1)患者可从心脏骤停或室颤中被复苏;2)患者有晕厥症状,但未监测到室颤;3)无症状患者.
考虑到植入型心律转复除颤器(ICD)作为可从心脏骤停或室颤中被复苏患者的初始治疗选择的获益已经比较明确了,接下来我主要和大家分享一下后两种类型的患者的治疗新心得.
伴晕厥症状的患者临床上对伴有晕厥症状的BrS患者的处理和其详细的病史有关.
如果患者曾有发作性晕厥的情况发生,那么发生晕厥时的详细情况就非常重要.
如果发作性晕厥的原因是致命性心律失常事件,那么患者通常除了在晕厥前会即刻出现一些心悸或者胸闷的症状之外是没有任何其他的前驱症状的.
自主神经介导性晕厥(NMS)是引起晕厥的主要原因之一,也常常在BrS患者中出现.
NMS晕厥通常伴有特定的前驱症状,如视物模糊、出汗,有时会出现晕厥后排尿.
而室颤引起的晕厥通常在静息状态或睡眠中发生,鲜有在活动时发生的情况出现.
但是在BrS中,发热和酗酒与室颤引起的晕厥有关联.
无症状患者将ICD置入术作为无症状BrS患者的一级预防治疗仍有争议.
之前的研究普遍认为自发性1型心电图表现伴晕厥病史是BrS患者的高危信号,但事实上无症状患者每年的事件发生率仅有0.
5%到1%.
可惜的是,我们尚无确切的方法来评估那些未来室颤发生风险高的无症状患者.
除了自发性1型心电图表现和晕厥,还有一些其他的心电图表现和临床特征也被报道为危险因子.
将这些信号结合起来能够缩小高危人群的范围.
除了自发性2型心电图表现之外,我们着重强调的危险因子如下:碎裂QRS波群(QRS波群中出现多个尖峰);宽QRS波群(≥120ms);下侧壁导联出现早期复极;在运动负荷试验中出现ST段抬高.
这些危险因子都在大样本量(≥100患者)的研究中得到了证实.
此外,尚有一些小样本研究报道了几个不确定的危险因子,如PQ间期延长、T波交替、自发性ST段改变、房颤和猝死家族史等.
如果患者出现任一危险因子,尤其是如果伴有多个危险因子的时候,那么我们就会推荐他进行电生理学检查.
虽然利用程序性电刺激来诱导BrS患者发生室颤的临床意义仍有争议,但是我们确实可以通过这种方法来判断心室的有效不应期(ERP)以及室颤诱发的模式.
短ERP(<200ms)和3次刺激内诱发室颤被认为是高危信号.
如果一名患者的检查结果得到这样的结论,我们会向患者及其家属提供知情同意书,并告知ICD置入术的利弊,以便其能获得充分的信息来做出治疗与否的决定.
http://news.
medlive.
cn/heart/info-progress/show-68057_129.
html11Org.
Biomol.
Chem:治疗阿尔兹海默氏症的新型蛋白药物2014年9月26日讯/生物谷BIOON/--近日,莱斯特大学的化学家报道了一种利用突破性技术开发的用来治疗癌症和阿尔茨海默氏症等疾病的新药物.
该研究团队开发了一种新的创新方法,他们运用这种方法研究了一种特殊的综合性氨基酸,由此产生了一种特殊的设计蛋白,这种蛋白之前从未被造出过.
AndrewJamieson博士是这项研究的领导科学家,他说:―对这项研究我们感到非常自豪,为此我们努力工作了好几年目的是用这项化学技术来创造新的构建模块,现在我们已经得到了新的构建模块,而在这之前人们只是仅有这个梦想而已!
‖氨基酸是自然本源性的构建模块,它们是所有蛋白质构成的来源,是生命必须的物质,然而,已构成的天然蛋白仅用了这些自然模块的20%.
在本次研究中,我们利用人造氨基酸制造出了带有三维立体结构和重要新功能的人造微型蛋白质.
Jamieson博士说:―我们非常感兴趣的是使用新的构建模块开发出新的蛋白药物,然后观察用该药物治疗癌症和阿尔兹海默症的功效.
‖―人造氨基酸,也就是构建模块被描述成为是手性的,意思是它们有―偏手性习惯‖.
这种有选择性的生产带有―偏手性习惯‖的合成物以前从未报道过.
‖―新的方法允许我们只能选择性地合成―右手分子‖.
这项新的研究是非常重要的,因为这是一项较新的,较早的和快速的使用这些构建模块来制造新药的方法.
‖―我们现在非常积极的使用这些构建模块来开发新的治疗癌症和阿尔兹海默症的药物.
研究人员使用构建模块合成了一种由海螺生产的毒素物质,并希望通过开发这种毒素使其成为一种治疗疼痛的药物.
‖Jamieson博士说:―药物的开发需要这些创新的方法,这些方法可以帮助制造出一些没有副作用的强效药.
然而如何使用这些新的构建模块是开发新蛋白药物的第一步.
‖(生物谷Bioon.
com)http://news.
bioon.
com/article/6659383.
htmlNatCellBiol:发现促进癌症转移的关键蛋白质2014年9月22日讯/生物谷BIOON/--想知道癌细胞如何转移嘛近日,刊登在国际杂志NatureCellBiology上的一篇研究论文中,来自德克萨斯大学癌症研究中心的研究人员通过研究表示,癌细胞可以适应一定的能量需求来进行扩散转移,癌症发生转移是引发癌症相关死亡的主要原因,揭示癌症转移的机理对于开发新型抗癌疗法非常关键.
研究者发现,癌细胞可以通过其―定居‖的部位获取不同的能量来继续其转移活动,在研究过程中研究人员发现了一种名为PGC-1α的蛋白质,其是一种对细胞代谢调节异常重要的转录激活子,对于癌细胞获取能量得以生存和扩散也至关重要.
ValerieLeBleu博士说道,开发新型的疗法主要集中于对癌细胞代谢的弱点进行攻击,因此确定扩散中的癌细胞的代谢需求就显得非常有意义,在癌细胞扩散到另一个位点过程中研究人员发现扩散中的癌细胞依赖于线粒体;癌细胞可以利用PGC-1α来刺激新生线粒体的生长,而线粒体作为细胞的能量工厂也为细胞提供源源不断的能量,当然癌细胞的转移同时也依赖于PGC-1α相关的一个过程,该过程名为氧化磷酸化,其可以在癌细胞扩散期间刺激ATP的产生.
如果线粒体是厨房的话,PGC-1α就是大厨师,而ATP就是氧化磷酸化的关键组分.
当某些癌细胞可以―旅行‖至机体别的位点时,仍会有12一部分癌细胞留存在―老巢‖繁殖生长,如果有一种疗法可以阻断癌细胞的迁移,那么抑制PGC-1α或许就有可能帮助抑制癌症转移.
最后研究者表示,我们都知道癌细胞非常喜欢转移寻找新家,本文研究揭示了乳腺癌患者中,侵袭性癌细胞中PGC-1α的表达和癌症远端转移产生的相关性,为后期开发新型抗癌疗法提供了新的线索和帮助.
(生物谷Bioon.
com)http://news.
bioon.
com/article/6659219.
htmlPNAS:鉴别乳腺癌组织的新工具2014年9月22日讯/生物谷BIOON/--近日研究发现,超过40%经历过乳腺癌手术的患者还需要再进行一次手术,因为外科医生在初次手术时可能对病灶处理的不够干净.
然而,布莱根妇女医院的研究人员(BWH)已经成功地测试了一种他们开发的工具,这将有助于医生更好的区分恶性乳腺组织和正常组织,从而减少病人重复手术的机会.
这个工具被称为解吸附电喷雾离子化(DESI)质谱影像(或解吸附电喷雾电离光谱成像),是通过把分子变成带电的分子,称为离子,这样它们就可以被质谱法鉴定.
通过离子质谱法分析,组织样本的内容物就可以被鉴定.
该工具喷出带电溶剂的微气流到组织表面用来收集有关分子组成和产生彩色图像的信息,这些信息可揭示肿瘤细胞的性质和浓度.
研究者使用DESI质谱影像观察脂肪酸物质的分布和数量,称为脂质.
这些脂质来自61个样本的乳腺组织和正常组织,这61个样本是从14个经历过乳房切除术的乳腺癌患者中得来的.
这个软件程序被用于给乳腺癌肿瘤进行定性,并用来界定健康组织和癌组织之间的界限.
研究者发现了好几种脂肪酸,例如油酸.
相比较于健康组织油酸大量存在于乳腺癌组织中.
该结果也证实了使用传统的病理学方法可以更精确的检测病灶组织.
―我们的发现证明了使用DESI质谱影像鉴别癌变组织和正常乳腺组织的可行性,‖NathalieAgar博士说,―研究结果可帮助外科医生使用它来快速检测在乳腺癌手术中残余的肿瘤组织,希望可以有效减少重复手术的次数.
‖(生物谷Bioon.
com)http://news.
bioon.
com/article/6659292.
htmlCancerRes:研究人员发现增加白血病发病的新基因2014年9月23日讯/生物谷BIOON/--近日,新加坡国立大学(NUS)癌症科学研究所发现Leo1基因表达的增加会影响与急性髓系白血病(AML)直接有牵连的其他基因,提高癌症的发病率.
新加坡国立大学癌症研究所科学家ChngWeeJoo副教授发现抑制Leo1和Leo1下游信号通路,可提供一个新的途径针对性治疗AML.
这项研究结果最近发表在CancerResearch杂志上.
此外,这是第一次有研究揭示了蛋白PRL-3在调控核糖核酸(RNA)相关过程中的作用,这一发现有助理解该蛋白质是如何有助于癌症进展.
该小组的工作是第一次大规模的定量调查在白血病中PRL-3所调节的蛋白.
PRL-3表达升高已与多种癌症类型包括胃癌,卵巢癌,宫颈癌,肺癌,肝癌和乳腺癌的发展和转移相关.
在大约一半的AML患者中,蛋白质PRL-3高表达与不良预后相关.
Chng教授和他的团队是首先报告,PRL-3蛋白在骨髓中的正常骨髓细胞中不存在,但PRL-3蛋白的表达在约47%的白血病病例中升高.
其结果是,PRL-3被视为有吸引力的治疗靶标.
先前,对于PRL-3机制研究是有限的.
在这项研究中,研究人员使用一种先进的新SILAC13型质谱仪,以更全面的方式来识别PRL-3诱导的所有蛋白变化.
使用这种方法,他们发现基因Leo1作为一种新型的PRL-3磷酸酶靶基因,能够抑制Leo1以及LEO1下游信号传导途径,这将是靶向治疗AML患者的新策略.
在研究的下一阶段,该团队将验证Leo1下游的几个重要蛋白质是否能被用作治疗PRL-3高表达的白血病的生物标志物和药物靶标.
http://news.
bioon.
com/article/6659221.
html新的抗癌药物靶标——脂质化学信使2014年9月21日讯/生物谷BIOON/--一半以上的人类癌症都具有脂质代谢化学信号异常上调,但这些信号在肿瘤形成过程中是如何被调控的仍没有得到充分的理解.
近日,宾夕法尼亚大学YouhaiChen博士等人发现:TIPE3(一种新近被新发现的致癌蛋白),通过靶向这些脂质信号途径促进癌症.
第二信使--脂质在细胞膜外信号到细胞内部的传递和放大过程中发挥基本作用.
一个最好的例子就是脂质第二信使PIP3,其传递数以百计的膜受体信号进入细胞内.
因此,当PIP3的功能出差错时,靶向PIP3药物可有效用于治疗多种疾病,包括癌症和炎症性疾病.
TIPE3属于一种新的蛋白质家族,是人类癌症和炎症的危险因素,但对其作用机制知之甚少.
Chen和同事们发现,TIPE3是第二信使PIP3的转运蛋白,但它被癌细胞―劫持‖,导致失控的细胞分裂.
TIPE3的高分辨率晶体结构显示其蛋白结构有一个大的空腔,捕获和传输PIP3及其化学前体PIP2,导致癌细胞的内膜中PIP3的增加,这就促进了激活下游PIP3效应,导致癌症.
重要的是,人类肺癌,结肠癌,卵巢癌和食道癌都有显著的TIPE3表达上调.
敲除TIPE3后,能减少恶性肿瘤细胞的生长,剔除小鼠TIPE3,能阻断肿瘤的形成.
这些发现解释了为什么正常的细胞可以控制自己的脂质信号,但癌细胞不能,虽然这一现象被广泛认可,但了解甚少.
新研究揭示在正常细胞中,TIPE3的表达量恰到好处,以确保适当的信号传送,调控细胞分裂.
而在癌症情况下,TIPE3表达上调,TIPE3可能是一种新的治疗标靶用于治疗恶性疾病.
该小组目前正在研究对策,以控制异常TIPE3表达来治疗或预防癌症.
http://news.
bioon.
com/article/6659148.
html【政策法规】卫计委放松基层用药限制多地非基药比例不超30%国家卫生计生委近日印发《关于进一步加强基层医疗卫生机构药品配备使用管理工作的意见》,调整了基层医疗卫生机构只能配备使用基本药物的办法.
今后基层医疗机构,如城市社区卫生服务中心和农村乡镇卫生院,除了基本药物外,还可从医保或新农合药品报销目录中,配备使用一定数量或比例的非基本药品,落实零差率销售.
为什么放松基层用药限制口子能开多大这对老百姓有什么好处会不会冲击基本药物制度记者进行了采访.
一问为何允许使用非基药很多慢性病使用非基药,新规使患者在家门口就能买药,不用总去大医院.
此前,政府办的基层医疗卫生机构只能全部配备和使用基本药物,这些基本药物包括国家基本药物目录药品和各省增补的基药目录药品.
此14次放开用药限制,可以使用医保目录内的非基本药物,是出于什么考虑呢药政司有关负责人指出,部分大中城市社区卫生服务中心和农村乡镇卫生院经过多年发展,服务功能和能力大大增强,临床用药需求增加.
为更好地适应基层基本医疗服务新要求、新特点,进一步满足基层用药需求,允许基层医疗卫生机构配备一定数量或比例的非基本药品.
北京大学医药管理国际研究中心主任史录文解释,很多慢性病如高血压、糖尿病等,使用的药物是非基药,而且要长期服用,因此在基层医疗机构往往买不到,患者还得定期去大医院买.
基层也能使用非基药后,能解决这部分患者的买药之难,衔接大医院和基层用药,有利于促进双向转诊,建立分级诊疗,更好地满足患者的需求.
《意见》提到"配备一定数量或比例非基本药品",但没明确规定,各地使用非基药的情况如何记者了解到,已经有不少省份在基层打开使用非基药的"口子",允许适度配备,满足基层用药需求.
如安徽最早明确在基层可以增加一定比例非基药;山东省明确,非基本药物的配备品种和采购金额,占基层机构所有药品配备品种和采购金额的比例均不应高于20%;浙江明确不超过30%;上海在基层社区卫生服务机构增加30种非基药,使用药品达到800多种.
在基层医疗机构,非基药的数量或比例究竟多少合适卫计委药政司司长郑宏认为,"制订基本药物采购计划,既要兼顾数量、质量、价格,也要考虑品牌、剂型、规格,还应与当年的消费指数、物价水平、医保筹资、工资收入挂钩,并留有余地.
"因此,主张将基层药品采购纳入地方财政预算,在收支平衡前提下,最大可能地采购优质企业生产的品种和剂型,满足人们的需求.
从地方实践来看,多地非基药比例不超过30%.
使用非基药怎么报销呢药政司有关负责人解释,基层医疗卫生机构使用的基本药物和其他药品,都要通过省级平台网上集中采购、集中支付并零差率销售,严禁网下采购.
也就是说,统一按照医保、新农合政策报销,零差率销售,没有加成.
二问为何不鼓励增补基药基药已达520种,各省增补药品过多、过于随意,且增补易导致不合理用药《意见》同时明确,以省(区、市)为单位增补非目录药品是基本药物制度实施初期的阶段性措施.
而2012年版国家基本药物目录基本适应基层用药需求,因此不鼓励进行新的增补.
既然放开了使用非基药的"口子",为何不直接把这些非基药增补到基药目录中,省得麻烦呢药政司有关负责人说,基本药物制度实施初期,为缓解基层用药不足,作为阶段性措施,允许各地以省(区、市)为单位增补非目录药品,既发挥了积极作用,也存在着不规范的问题.
随着2012年版基本药物目录的实施,《意见》明确提出不鼓励进行新的增补.
史录文说,北京大学医药管理国际研究中心在2011年3月专题研究了27个省份已公布的增补基本药物目录,平均增补188个,加上307种国家基本药物,我国基层医疗卫生机构平均配备基本药物达到了500种左右,有些省份达到600种,远远高于世卫组织推荐的标准.
2012版的国家基本药物目录药品达到520种,增补后有些地区达到800多种,已接近医保目录品种总数.
史录文介绍,调研发现各省重合的药品只有1种,这说明各省增补药品的随意性太强,地方存在一定程度的保护主义,而且一味满足基层医疗卫生机构的"习惯用药",会导致滥用抗生素、激素、维生素以及输液现象愈演愈烈,也隐藏着医药腐败的可能.
该中心在2010年底还对6省261家基层医疗卫生机构的基本药物使用情况进行调研,发现经济不发达地区的抗生素和注射剂的使用比率仍然很高.
"不应继续鼓励这样的用药方式.
"药政司有关负责人说,放开基层使用非基药15的"口子",不等于鼓励各省随意增补,而应挑选和当地公立大医院相衔接的医保目录内的非基药,使其在基层也能买到,并能报销更多.
有利于分流大医院患者,也有利于推行分级诊疗.
三问会否导致基药受冷落基药不一定是差药,通过医保报销、比例限制保障优先使用基药放开非基药使用限制,会不会大家都去用非基药,架空基药目录,基药制度变成虚设药政司有关负责人解释,仍鼓励优先使用基本药物.
通过处方审核和处方点评等方式加强监管,提升合理用药水平.
发挥药师在指导合理用药,特别是在处方审核与药物合理使用管理及研究工作中的作用.
推广《国家基本药物临床应用指南》和《国家基本药物处方集》,加快基层信息化建设,通过信息化手段来促进合理用药.
史录文认为,放开限制不会削弱基本药物的地位,反而会加强基本药物制度的作用.
各省增加的医保、新农合药物,不一定都会和目录中的基药功效重合,即使同一疾病每个人的用药都会有所不同,非基本药物不一定适合每一位患者.
而且还有医保、新农合的约束,也有使用比例和金额控制,满足了大量的、一般性的基本需求,同时适度照顾了特殊性的需求,从这个层面完善了基本药物制度.
"基本药物不一定就是差的、人人不喜欢用的药物.
它只是一种人人可公平获得、可及的保障性药品.
国家通过一个完整的筹资、遴选、采购、供应的体系,保障人人有药可用.
所以放开基层用药限制,只对基层用药问题改善,基本药物的主体保障作用仍在发挥.
"《意见》出台后,基层医疗机构与大医院使用的相同基药,以及相同的医保内的非基药,仍是同城不同价.
今后两类药品仍需要通过各类定价方式改革,实现同城同价,减少医保、新农合支出,减少看病支出.
什么是基本药物基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品.
如青霉素、红霉素、藿香正气水等.
2009年8月,《关于建立国家基本药物制度的实施意见》《国家基本药物目录管理办法(暂行)》和《国家基本药物目录(基层医疗卫生机构配备使用部分)》(2009版)同时发布,自此我国建立国家基本药物制度工作正式实施.
政府举办的基层医疗卫生机构全部配备和使用基本药物,其他各类医疗机构也都必须按规定使用基本药物.
凡是纳入医保报销基本目录范围的药物,因病情需要使用且符合医保相关报销规定的,均能得到一定比例的报销.
基本药物如此,非基本药物也是如此.
基本药物与非基本药物在医保报销方面的不同有:一是基本药物全部纳入基本医疗保障药品报销目录的范围,而非基本药物仅有部分纳入;二是国家鼓励使用基本药物,基本药物的报销比例明显高于非基本药物.
http://politics.
people.
com.
cn/n/2014/0911/c1001-25637406.
html处方药网售即将放开首批目录待定处方药网上销售有望近期放开.
据国家食药总局人士对财新透露,目前有关方案正待审批,监管部门正在研究第一批开放的处方药目录,目录药品主要以慢性病、常见病类用药为主,多为长期用药,用药风险较低.
据财新记者了解,国家食药总局还将鼓励第三方平台与网上药店相结合,通过第三方物流做更加专业和规模化的配送,具体细则正在商定中.
慢性病处方药或首开闸今年5月28日,国家食药总局发布《互联16网食品药品经营监督管理办法(征求意见稿)》,明确指向开放处方药网上销售、准入第三方物流和单体药店也能获得网上牌照等重要内容,被业界普遍视为医药电商大跨步前进的号角.
《意见稿》明确提出―凭处方销售处方药‖,―有执业药师在线药事服务‖等重要内容,这是国家食药总局首次对外认可网销处方药品,被业内普遍认为网上药店即将步入―新时代‖.
有接近食药总局人士透露,《意见稿》有望10月落地.
业内普遍认为,一些慢性疾病,如糖尿病、肿瘤等药物,通过网络销售,将有一定的价格优势.
顾客对这些药物可能有长期、稳定的需求,慢性病处方药和―特药‖是未来值得医药电商主攻的方向.
业界人士认为,网售处方药将给消费者带来实惠.
―会比传统渠道便宜20%到40%.
处方药放开后,价格差异会更加明显.
‖掌上药店CEO王俊海对财新记者表示,如果医药电商能对接医保,对于消费者而言,享受低价则更加便利.
同时,电子处方和处方药的解禁将大幅降低医院的门诊人次,缓解看病难、提高医疗服务迎来新契机.
处方药蓝海2014年年初,国务院副总理汪洋到京东视察,京东在汇报中提到京东医药电商业务在参与国家发改委的医药分离试点计划,试点销售处方药.
消息传出,震惊四座.
处方药一直是网上售药的禁区,同时,占医药市场80%比例的处方药一直被视为医药电商的最大蓝海,据瑞银证券估算,线上处方药经营放开意味着医药电商的市场空间将从2000亿元的OTC(非处方药)市场扩展至近万亿的OTC+处方药市场,进而扩展至3万亿左右规模的大健康市场.
除了京东,天猫也做足了准备.
近日,天猫在多家招聘网站招聘大量执业药师,有消息称,天猫在为网上药店销售处方药开禁做准备,更有分析认为,这意味着阿里巴巴不再满足于平台角色,欲自建销售平台卖药.
好药师网上药店负责人也对财新记者透露,虽然处方药放开的文件还没有落地,但从今年3月起,好药师方面已经做出相关部署,准备系统、商品库、仓储物流和执业药师资源,一旦放开,处方药业务可以马上运转,电子处方也可以马上上线.
放开后的难题处方药若能放开,被认为将有力推动公立医院改革进程.
―处方药和电子处方的开放是医药分开的趋势所在.
‖天猫医药馆负责人对财新记者表示.
王俊海也认为,推动电子处方和处方药放开,将有越来越多的药品剥离医院进行销售.
―目前药店2500亿规模,医药分家后有可能超过8000亿.
‖但中国医药体制的特殊性使得医药电商举步维艰.
京东内部人士透露,医院处方普遍是不公开的,其中存在争议性风险,另外,医院一旦公开处方,相当于将处方药收益让渡给京东,医院是没有动力的.
―现在主要靠地方主管部门的行政命令,医院资源需要一家家突破,京东只能做区域性试点,并且只针对小部分处方药.
‖京东内部人士透露,京东曾尝试推出处方药,但很快被勒令下架.
财新记者联系京东时,京东也以处方药话题太敏感拒绝采访.
电子处方已先行在部分地区试点.
2013年,河北邯郸和吉林长春都曾在全市的药店推行电子处方,患者通过互联网视频和医生沟通后,医生的处方就能开出,药店凭此出售处方药.
但出于对安全性风险和利益关联性的争议和担忧,试点没有在全国大范围推广开.
另外,处方药网上销售需要有配套的执业药师队伍,但根据国家食药总局公布的数据,截至2014年5月底,全国累计有28万人取得执业药师资格,根据药品生产、流通、使用领域的分布各占约三分之一的原则计算,我国药品使用领域的执业医师不会超过10万人,而他们中的大部17分都供职于医疗机构,无论是线下零售药店,还是线上网络药店,执业药师数量都存在着严重短缺.
http://china.
caixin.
com/2014-09-12/100728195.
html国家食药总局公布第一批过度重复药品品种目录的公告9月12日,国家食品药品监督管理总局公布了关于公布第一批过度重复药品品种目录的公告.
公告原文如下:为更好地引导药品合理申报,避免市场药品同水平重复,防止研发投入风险,促进药品产业健康发展,依据《中华人民共和国药品管理法》、《药品注册管理办法》等有关法律法规,国家食品药品监督管理总局对在国内已上市药品和正在申报注册的药品进行全面调查,选出第一批过度重复的已上市药品品种34个、过度重复申报注册的药品品种16个,现予以公布(见).
http://www.
sfda.
gov.
cn/WS01/CL0087/106390.
html&from=timeline&isappinstalled=1六部委推进医药分开9月9日,商务部网站公布了商务部、发改委等6部门《关于落实2014年度医改重点任务提升药品流通服务水平和效率工作的通知》,通知指出要采取多种方式推进医药分开,逐步形成医师负责门诊诊断,患者凭处方到医疗机构或零售药店自主购药的新模式.
专家提醒,医药分开后,药品安全问题责任需界定.
采取多种方式推进医药分开鼓励零售药店发展和连锁经营通知指出,在公立医院改革试点城市,可探索由规模较大、质量控制严格、执业药师药事服务制度完备、诚信记录好的零售药店,承担医疗机构门诊药房服务和其他专业服务的多种形式的改革,并切实加强医疗机构药事管理工作,推进临床合理用药.
通知提出,要逐步形成医师负责门诊诊断,患者凭处方到医疗机构或零售药店自主购药的新模式,并确保医疗机构按照《处方管理办法》(原卫生部第53号令)开具和调剂处方,保障患者的处方知情权和购药选择权.
此外,通知要求有关部门要结合深化医改和医药分开试点工作,提高零售药店在药品终端市场上的销售比重,清理妨碍零售连锁药店发展的政策性障碍,缩短行政审批所需时间;发展改革部门要依法查处药品生产流通企业与医疗机构在药品销售中存在的的各种价格垄断行为;人力资源社会保障部门要将符合资质条件的零售药店及时纳入医保定点范围,逐步扩大医保定点零售药店覆盖范围.
―以药补医‖扭曲公立医院补偿机制民众对―医药分开‖寄予厚望―以药补医‖是上世纪50年代,国家为弥补医疗卫生事业经费不足制定的政策.
即允许医院销售药品时,在进价基础上加价15%.
随着时代发展,弊端逐渐显现.
一位在互联网公司上班的职员告诉中新网健康频道,自己感冒发烧这种病都不敢去医院,怕一不小心就搭进去好几百,小病小痛都是―自诊‖,然后去药方买药完事.
最近几十年来,因为―以药补医‖机制,形成了扭曲的公立医院经济补偿机制和追求自身利益最大化的内在驱动,导致公立医院公益性弱化,造成群众―看病难、看病贵‖难题.
医生开大处方、患者―看病贵‖问题暴露出―以药养医‖问题,导致医患失信,甚至纠纷频发.
目前,许多民众对―医药分开‖寄予厚望.
今年7月份开始,北京就开始在一些试点医院实行―医药分开‖.
北京友谊医院实行―医药分开‖的第一周,药费总计为患者让利164.
82万元.
根据北京医管局的问卷调查结果,88.
4%的患者认为专家门诊的交流和解释时间比以前增加了,18认为解释不充分的仅为9.
2%.
比如,一位患者反映,实行改革后,看专家号的时间明显增加,专家的服务更好了,专家解释到位,感觉很满意;对医生服务的总体满意率为90.
2%,其中十分满意为35.
8%,不满意仅为2.
6%;44.
4%的患者明显感觉到药品支出下降了.
医药分开后药品安全问题责任需界定此前,北京清华长庚医院CEO助理杨长青博士在做客中新网健康频道视频访谈间时表示,医药分开后,隐形的药品的安全问题会更加突出.
药品的质量有问题,可能会给病人带来伤害,这个时候病人是找药房求偿,还是找医院需要界定.
―一直在说以药养医不对,所以这个办法叫做医药分开,就没有以药养医的问题了,分开之后它的目标是达到了,但是另外的问题就出现了.
‖杨长青分析,―医药分开还有一个隐含的安全问题.
当药房是医院药房的时候,医院就是整个责任的主体.
当药房不再是医院的药房,变成零售药房了,他也是法人,我也是法人,如果出了问题,这两者之间要重新界定责任.
很显然现在的药品质量,药品发放环节的控制,还没达到这样一个安全环境,使得大家都能够非常清楚的界定.
在这种情况下会有很多纠纷隐患.
比如医生开药没问题,但是你抓药抓错了,药品的质量有问题,可能都会给病人带来伤害,这个时候病人就要选择到底是找药房来求偿,还是找医院.
‖目前,国际上已经达到医药分开了吗对此,杨长青指出,医药分开存在利益再分配的问题.
―比如说台湾的长庚,他们也是非常庞大的体系,有一万多张病床,他们的药就是自己采购,自己管理,最大的问题就是品质问题,我可以交给别人去做,但是这个问题解决不了,责任就又都回到医院来了,所以医院必须来承担这一部分.
在其他地方,比如美国很多是药房在医院外边的,但是美国解决的问题是收费完全是分开的,这个是现在我们后段要面临的现实问题.
‖改革不能―一刀切‖特殊情况要特殊考虑实行―医药分开‖后,可以切断医生收入与药品销售的直接联系,医生便没有了开大处方、开贵药的动机,专心诊疗,百姓则可以选择平价药店购买药品.
一边,确实可以让百姓看病买药更实惠,而另一边,也有些医院表示新政不利于医院生存.
据健康界报道,北京佑安医院院长李宁曾表示,相比朝阳医院一万人次以上的日门诊量,他所在的佑安医院日门诊量只是朝阳医院的五分之一左右.
如果将改革方案照搬过来的话,医院十分吃亏.
李宁谈到,医院已经进行了相关测算,按照现行的运行状态,如果直接复制五家改革试点医院做法,佑安医院一年要少收入5000万到6000万,如果想要持平的话,医院日门诊量需要增加3倍,住院病人床位周转率要再缩小一半,但这对医院来说显然是无法实现的.
据了解,佑安医院属于传染病医院,门诊量少,手术量少,用药量大如果取消―以药补医‖,医院和医生的利益都会直接受到很大的影响.
与此情况相类似的还有地坛医院等.
此外,据羊城晚报此前报道,医院的药房由门诊药房、急诊药房和住院药房三部分构成.
―用药救急,急诊不能靠社会药房‖,一位业内人士称,急诊可以先救人再交钱,而到药房买药则得先交钱.
而住院用药品类繁多,一般药房很难保证品种齐全.
http://finance.
chinanews.
com/jk/2014/09-10/6576809.
shtml【业界新闻】湖南省纪委官员实名举报国家药监局前局长8月12日上午,湖南省纪委预防腐败室副主任陆群,通过其名为―御史在途‖的实名认证微博账号,实名举报国家食品药品监督管理局前局长、现国家药典委常务副主任委员邵明立.
19陆群当天公开发布的第一条微博称:―国家食品药品监管总局为利益集团代言,给数以千万计的百姓造成无比重大的经济损失……本人将以铁的证据揭露该局祸国殃民的问题.
‖其实名举报迅速引发―围观‖.
陆群称,2005年前后,国家药典委把中国南方地区传承上千年的―金银花‖更名为―山银花‖,把金银花作为山东―忍冬花‖的专用名.
南方金银花被国家食药监总局更名为―山银花(山寨版金银花)‖之后,价格一落千丈.
北方金银花贩子趁机大量低价收购,冒充北方金银花高价卖出,谋取暴利.
南方上千万花农则血本无归.
据官方简历,邵明立是山东济南人.
―(上午发帖)先预热一下,会继续发布证据.
‖陆群告诉21世纪经济报道记者,他从今年5月份开始关注和调查这个事情,原因是湖南、贵州等南方五省的农民提出异议,他收到了老百姓的举报信.
7月8日,陆群发表微博称,曾私信中国食品药品监管官微未得回复,表示将写《敦促国家食品药品监管总局局长引咎辞职书》.
一个月过去,8月12日起,他将陆续发布信息.
陆群还告诉21世纪经济报道记者,相关证据包括利益集团背后操纵的证据、对金银花的本草考证等等,下午他会陆续通过微博发布.
对于是否担心会对其职务身份造成影响,―丝毫不担心受影响.
‖陆群称,他以一名普通党员身份,为四川、湖南、重庆、贵州、广西上千万名少数民族地区农民代言,如果说代表一定利益的话,是代表上千万少数民族地区农民的利益.
陆群现任湖南省纪委预防腐败室副主任,微博名―御史在途‖,2011年,他曾以微博形式向湖南长沙县县委书记杨懿文叫板,声讨警方殴打讨薪民工.
并称有过错的一方应―立即辞职以谢天下‖.
公开资料显示,邵明立,1951年10月生,山东济南人,1995年担任卫生部药政管理局副局长,历任卫生部药政管理局局长,国家药品监督管理局副局长、局长,2008年至2012年,担任卫生部副部长,国家食品药品监督管理局局长.
2012年2月,国务院免去邵明立的卫生部副部长、国家食品药品监督管理局局长职务.
国家药典委员会官网显示,邵明立现任国家药典委员会常务副主任委员据了解,―金银花‖本是―开出黄白两色花‖的整个忍冬科植物的总称.
处于不同地域的人们心中的金银花,是指当地所产的一种或几种忍冬科植物.
―山银花‖之名首载于1977年版《中国药典》,金银花植物来源有忍冬、红腺忍冬、山银花和毛花柱忍冬4种.
1985、1990、1995、2000年4版药典中金银花的表述仍是以上4种.
2005年版《中国药典》将忍冬科的几个药用植物分开成两个药物名称,即金银花、山银花.
在金银花项下只载忍冬,而在山银花项下收载了灰毡毛忍冬、红腺忍冬、华南忍冬.
而灰毡毛忍冬(南方金银花)的商品化产量最大.
―山银花‖主产地以湖南隆回、重庆秀山、贵州道真、湖北、广西等西南山区为主,主产地几乎均属于国家级扶贫开发县.
―金银花‖换名成了―山银花‖,产品被打压出现滞销.
据湖南卫视新闻联播2013年7月报道,2010年以前,邵阳隆回一公斤金银花的干花可卖220元,湿花也能卖8元,而2013年,一公斤干花最多卖20元,湿花只能卖到0.
8元,隆回的―致富花‖变成―伤心花‖.
http://jingji.
21cbh.
com/2014/newsmaker_812/1266214.
html盘点2014年FDA批准的孤儿药1982年,美国的罕见病家庭和支持团体成20立了一个―非正式联盟‖,呼吁立法支持孤儿药和治疗罕见病的药物研发,1983年,这个组织成功使美国国会通过了―孤儿药法案‖,该法案制定了发展孤儿药的诸多激励性措施.
30多年过去了,FDA共认证近3000个孤儿药,获批的有400多个,涉及447种罕见病的治疗.
在其2013年批准的27个新药中,也有10个是孤儿药.
下面就让我们细数2014年1月至今FDA批准的孤儿药:1.
trametinib/dabrafenib:该组合疗法2014年1月8日获FDA批准,2012年9月20日被FDA认定为孤儿药,认定适应症为IIb期到IV期的黑色素瘤.
trametinib和dabrafenib均为葛兰素史克研发,用于治疗不能手术切除或转移性FDA确诊的BRAFV600E或V600K突变型黑色素瘤.
联用疗法中服用150mgtrametinib胶囊和2mgdabrafenib片.
2.
tasimelteon(他司美琼):商品名Hetlioz,2014年1月31号批准上市,2010年1月FDA授予其孤儿药资格.
本品由Vanda研发,是一种褪黑激素受体激动剂,用于治疗完全失明患者的非24h睡眠障碍,这是FDA首次批准用于治疗该疾病的精神障碍用药.
3.
ibrutinib(依鲁替尼):商品名Imbruvica,2013年11月首次获FDA批准,用于治疗套细胞淋巴瘤,而其2012年6月4日被授予孤儿药地位的适应症为2014年2月12日批准的慢性淋巴细胞白血病适应症.
依鲁替尼是布鲁顿酪氨酸激酶抑制剂,由最早由因绘制―人类基因组图谱‖而闻名的美国塞莱拉(Celera)基因技术公司开发,但由于Celera资金和资源问题,2006年Celera将该药的开发权转让给加州的Pharmacyclics公司.
2011年,强生旗下子公司杨森制药(Jassen)通过先期支付1.
5亿美元而获得与Pharmacyclics公司合作开发的权利,一旦新药临床试验成功并且获批上市,Pharmacyclics制药公司将共计获得9.
75亿美元收入,双方还将共同分享销售所得.
4.
elosulfasealfa:商品名Vimizim,2014年2月14日获FDA批准上市,2009年5月15日被授予孤儿药资格,用于治疗ⅣA型黏多糖贮积症(半乳糖-6-硫酸酯酶缺乏引起).
本品能够替代患者体内缺乏的半乳糖-6-硫酸酯酶,由BioMarin研发,也是首个获FDA批准治疗该疾病的药物.
5.
droxidopa(屈昔多巴):商品名Northera,2014年2月18日获FDA批准上市,2007年1月17日获孤儿药认证,用于治疗原发性自主神经衰竭患者、多巴胺-β-羟化酶缺乏症患者以及非糖尿病自主神经病变患者的神经症状性体位性低血压.
本品有灵北制药研发,目前国内已有上市.
6.
metreleptin(美曲普汀):商品名Myalept,2014年2月24获FDA批准上市,2001年8月22日被认定为孤儿药,用于治疗脂肪代谢障碍继发的代谢紊乱,美曲普汀可以辅助饮食作为先天或继发性脂肪代谢障碍患者瘦素缺乏并发症的替代疗法.
本品由Amylin研发,是一种重组人甲硫氨酰瘦蛋白(人瘦素类似物).
7.
propranolol(普萘洛尔):商品名Hemangeol,2014年3月14日FDA批准普萘洛尔口服溶液上市,由PierreFabreDermatologie研发,用于治疗婴儿血管瘤,该药因此适应症2008年9月5日获得孤儿药资格.
8.
miltefosine(米替福新):商品名Impavido,2014年3月19日获FDA批准上市,由PaladinTherapeutics研发,用于治疗利什曼病,2006年10月10日被授予孤儿药地位.
米替福新是一种十六烷磷酸胆碱,最初作为抗肿瘤药物研制,后发现其有抗寄生虫的作用.
9.
CoagulationfactorIX(recombinant)Fcfusionprotein:重组凝血因子IXFc融合蛋白,商品名Alprolix,本品由百健艾迪研发,2014年3月28日FDA批准其用于控制和预防B型血友病(先天性凝血因子IX缺乏症或圣诞节病)患者出血发作,该药物因此适应症2008年10月30日被授予孤儿药地位.
10.
ethiodized油注射剂:商品名Lipiodol,21本品由GuerbetLLC研发,2014年4月4日获FDA批准上市,2013年9月26日被认定为孤儿药,用于已知肝癌患者肝动脉内直接使用后癌细胞呈像.
11.
ramucirumab(雷莫芦单抗):商品名Cyramza,礼来研发,2014年4月21日获FDA批准上市,2012年2月16日被授予孤儿药地位.
本品是人血管内皮生长因子受体2拮抗剂,用于进展期胃癌或胃食管连接部腺癌患者的治疗.
12.
siltuximab:商品名Sylvant,本品是白细胞介素6单克隆抗体,原研强生,2014年4月23日获FDA批准上市.
2006年5月26日被认定为孤儿药,用于治疗罕见病多中心型巨大淋巴结增生症(MCD),亦称Castleman病(CD),该病属原因未明的反应性淋巴结病之一,临床较为少见.
13.
mercaptopurine口服溶液:6-巯基嘌呤口服液,商品名Purixan,2014年4月28日批准用于儿童急性淋巴细胞白血病患者,本品由Nova实验室研制,6-巯基嘌呤口服液也凭借此适应症于2012年8月20日被授予孤儿药地位.
14.
ceritinib(色瑞替尼):商品名Zykadia,由诺华研制,2014年4月29日获FDA批准上市,用于治疗间变性淋巴瘤激酶(ALK)阳性转移对克唑替尼进展或不能耐受的非小细胞型肺癌(NSCLC).
2013年9月27日,色瑞替尼因此适应症被授予孤儿药地位.
本品是一种口服的小分子ALK酪氨酸酶抑制剂.
与克唑替尼相比,色瑞替尼不抑制MET激酶的活性,但可抑制IGF-1(胰岛素样生长因子1)受体.
15.
antihemophilicfactor(recombinant)Fcfusionprotein:重组抗血友病因子Fc融合蛋白,商品名Eloctate,本品由百健艾迪研发,2014年6月6日被FDA批准上市,并在2010年11月23日被授予孤儿药地位,用于控制和预防成人和儿童血友病A(先天性Ⅷ因子缺乏症)出血事件,围手术期处理,以及防止或减少出血发作的常规预防.
16.
coagulationfactorVIIa(recombinant):重组凝血因子VIIa,商品名NovosevenRt,由诺和诺德研制,2014年7月2日被批准用于革兰滋慢氏凝集无力症(血小板无力症),主要是针对对血小板输注抵抗的成人和儿童患者.
本品2004年6月18日被授予孤儿药地位.
17.
Belinostat:商品名Beleodaq,本品是一种组蛋白去乙酰化酶抑制剂,用于治疗复发难治性外周T细胞淋巴瘤(PTCL).
2009年9月3日被授予孤儿药地位,2014年7月3日在美国获批.
Belinostat最初由丹麦Curagen制药公司研发,在2005年转让给TopoTarget制药公司,而后TopoTarget又在2008年以二千六百万美元收购Belinostat的全部开发权.
在2010年TopoTarget和Spectrum制药公司达成协议,共同开发.
在国内深圳万乐申报了一项简单、安全的合成Belinostat的方法,已获得国家知名产权局下发的专利证书,同时获准FDA进入快速审批通道,在国内属于首创.
18.
C1-esteraseinhibitor(recombinant):重组C1酯酶抑制剂,商品名Ruconest,1999年2月23日获孤儿药地位,2014年7月16日批准上市.
由Stantarus和Pharming集团共同研发,用于治疗遗传性或获得的C1酯酶抑制剂缺乏引起的血管性水肿急性发作.
遗传性血管性水肿系常染色体遗传性疾病,可发生于任何年龄,而多见于成年早期,是一种罕见的和潜在的威胁生命的疾病.
19.
dantrolenesodium:丹曲林钠,混悬型注射液,每一小瓶的治疗剂量为250mg/5mL,可在不到1分钟的时间内注射完毕,大大缩短了治疗时间.
本品商品名Ryanodex,由Eagle制药研制,2014年7月24日获FDA批准上市.
此前,FDA已于2013年8月授予Ryanodex孤儿药地位,用于治疗恶性高热(MH).
MH是一种遗传性肌病,以高代谢为特征,患者接触到某些麻醉药物后触发.
该病是目前所知的唯一一种可由常规麻醉用药引起围手术期死亡的遗传性疾病.
20.
idelalisib:商品名Zydelig,由Calistoga研发,后被吉列德购买,2014年7月23日获FDA22批准上市.
本品被授予两项孤儿药地位,一项是作为单药治疗复发性滤泡B细胞非霍奇金淋巴瘤(FL),2013年9月26日被授予;另一项是用于治疗慢性淋巴细胞白血病(CLL)和复发性小淋巴细胞淋巴瘤(SLL),2013年10月15日被授予.
21.
eliglustat:商品名Cerdelga,由美国健赞公司开发,2008年9月17日被授予孤儿药称号,2014年8月19日被FDA批准用于治疗I型戈谢病.
戈谢病是一种罕见的遗传病,这类患者不能产生足够的葡糖脑苷脂酶,该酶缺乏会引起不正常的葡萄糖脑苷脂在网状内皮细胞内积聚.
22.
eltrombopag(艾曲波帕):商品名Promacta,葛兰素史克开发,2008年第一次在美国上市,用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性特发性血小板减少性紫癜(ITP)患者的血小板减少.
但是本品2013年11月8日被授予孤儿药称号是由于其治疗对免疫抑制疗法反应不足的重症再生障碍性贫血(SAA)患者血细胞减少症,该适应症2014年8月26日获FDA批准.
SAA是一种罕见疾病,患者骨髓无法产生足够的新血细胞.
目前,尚未有药物获批用于对初始免疫抑制疗法无响应的SAA患者的治疗,这类患者在确诊后,约有40%的患者在5年内会死于感染或出血.
23.
pembrolizumab:商品名Keytruda,由默沙东开发,2012年11月19日被授予孤儿药称号,2014年9月4日正式获批,成为FDA批准的首例程序性细胞死亡1(PD-1)单抗.
该药适应症为不可切除的或转移性黑色素瘤.
Pembrolizumab是一种新型人源化单抗,通过作用于PD-1提升人体免疫力,消灭晚期黑色素瘤.
本品是该类型药物的首创,包括百时美施贵宝、罗氏及阿斯利康在内的公司正在竞相开发用于各种癌症的类似治疗药物.
http://pharm.
cmt.
com.
cn/detail/597657.
htmlAdaptimmune募集1亿美元促进癌症免疫疗法研究2014年9月26日讯/生物谷BIOON/--英国生物技术公司Adaptimmune公司今年下半年以来获得了许多投资者的青睐.
先是制药巨头葛兰素史克公司与其签订了一项价值3亿5千万美元的合作协议,最近公司又宣布获得了多家投资公司总额达1亿4百万美元的融资.
OrbiMedAdvisorsLLC等著名风投公司都参与到了Adaptimmune公司的此轮融资中.
很难想象,这家公司在今年七月初仅有1百万英镑的流动资金.
而Adaptimmune公司获得众多投资者青睐的法宝就是公司进行的T细胞受体疗法技术.
Adaptimmune公司长期以来都致力于通过修饰T细胞,使其更具靶向性和杀伤性.
Adaptimmune公司希望这种技术能够在癌症治疗过程中能够特异性杀灭肿瘤细胞并保持健康细胞的完好无损.
听起来这一技术与最近癌症研究领域流行的融合抗原受体T细胞(CAR-T)技术很相似,但是Adaptimmune公司显然希望有着自己的特点,公司CEOJamesNoble介绍说,不同于其他公司的癌症免疫疗法主要锁定细胞表面抗原的做法,Adaptimmune公司的癌症免疫疗法主要针对的是细胞内抗原.
目前,Adaptimmune公司和葛兰素史克公司正全力进行相关药物NY-ESO-1的研发并预计在未来18个月内将其推进到临床研究阶段.
最近几年,癌症的免疫疗法研究可谓是风头无两,许多生物技术公司都纷纷涉足这一领域,并凭借这一领域的工作吸引了众多投资者的目光.
如西雅图的CAR-T疗法先驱,Juno公司此前就获得了总额3亿美元的投资,Kite医药公司也在IPO中募集了超过1亿2千万美元的投资.
然而,必须要承认的是,癌症免疫疗法要真正成熟,广泛应用于临床还有很长一段路要走,究竟这一研究领域能够成为人类征服癌症的排头兵23还是沦为各大生物医药公司"圈钱"的一个噱头时间会证明一切.
http://news.
bioon.
com/article/6659329.
htmlVentiRx融资5000万美元用于癌症免疫疗法2014年9月25日讯/生物谷BIOON/--本月早些时候,总部位于西雅图的生物技术公司VentiRx公司曾向外界透露公司已经完成了一项用于支持其TLR8癌症疫苗研究的融资,但是公司并未透露融资的具体金额.
最近VentiRx公司提交的SEC表透露了公司将募集超过5000万美元的资金用于相关项目的研发.
而对于VentiRx公司而言,今年的秋天分外忙碌.
公司先是从Frazier、Arch等投资公司获得了大量经费用于开发其处于中期研究阶段的VTX-2337.
然后是与美国LudwigCancerResearchInstitute建立合作关系,共同开发阿斯利康公司的检验点抑制剂类药物MEDI-4736.
同时公司CEORobHershberg还宣布公司将在西雅图设立研发中心,用于开发包括CAR-T药物在内的新型癌症免疫疗法.
近年来兴起的癌症免疫疗法热潮目前的发展似乎并不顺利,近一段时间这一研究领域频频传出令人失望的消息.
例如德国默克公司最近就彻底放弃了其癌症疫苗tecemotide的研发工作,同时公司的另一种癌症药物MAGEA-3在一项临床研究中也遭遇了滑铁卢.
尽管如此,包括VentiRx公司在内的许多生物技术公司仍然对这一领域充满信心,希望凭借自身的优势实现华丽的逆袭.
而西雅图目前也成为了癌症免疫疗法的中心.
这一地区汇集了FredHutchinsonCancerResearchCenter等在癌症研究领域首屈一指的研究中心,同时,CAR-T药物领域的先驱Juno生物技术公司也坐落在这里.
VentiRx公司在这一地区建立研发中心显然也是希望借助这一地区的强大学术实力帮助自身在癌症免疫疗法领域取得突破.
http://news.
bioon.
com/article/6659328.
htmlFDA批准塞尔基因Otezla用于中重斑块状银屑病塞尔基因于9月23日报道称,该公司口服磷酸二酯酶4抑制剂Otezla(apremilast)获FDA批准用于适合光疗或系统性治疗患者的中重度斑块状银屑病.
塞尔基因炎症及免疫肿瘤总裁Smith评论称,"Otezla为一系列斑块状银屑病患者提供了一种有价值的治疗选择,这款药物适用于未经治疗及经历过治疗的患者,包括那些之前使用生物制剂或常规系统制剂治疗的患者.
"这款治疗药物此次适应症的扩展基于三项3期试验,有1426名中重度斑块状银屑病成年患者参与.
在ESTEEM1和ESTEEM2研究中,按照银屑病面积和严重程度指数得分,在治疗到第16周时,Otezla与安慰剂相比,与斑块状银屑病显著及临床有意义的改善相关,同时,按静态医师清理或几乎清理整体评价得分,在两项试验中疾病均有临床改善.
Otezla于3月份被FDA批准用于成人患者活跃型银屑病关节炎,同时这款治疗药物于2013年第二季度在加拿大被申请用于相同的适应症.
这款药物还在加拿大被申请用于治疗银屑病,去年第四季度在欧洲被申请用于银屑病和银屑病性关节炎.
分析师预测这款药物2017年的销售额大约为10亿美元.
塞尔基因还在开发这款药物用于多种其它适应症.
今年初,该制药商披露,Otezla经过16周治疗后与安慰剂相比,虽不能明显改善强直性脊柱炎患者的症状,但治疗24周时,在一个亚组的早期疾病患者中观察到"有意义的疗效".
此外,该公司之前还报道了这款口服治疗药物在中期研究中治疗贝赛特氏症的阳性结果.
http://www.
firstwordpharma.
com/node/1236579tsid=28®ion_id=2#axzz3EEy7NjC724FDA许可首款酵母病原体的血检产品上市9月22日,美国FDA许可用于引起血流感染的五种酵母病原体检测的首款直接检测产品在美国上市,五种酵母病原体分别为白色念珠菌和/或热带念珠菌、近平滑假丝酵母菌、光滑念珠菌和/或克柔假丝酵母菌.
酵母血流感染是一种真菌感染,如果得不到迅速治疗,它们可能导致严重的并发症,甚至死亡.
这些酵母病原体可能在抵抗力弱的人中引起严重的血液感染,这些人包括经历癌症治疗的患者、器官移植后接受免疫抑制治疗的患者或特护病房的危重病患者.
检测血流中酵母病原体的传统方法可能需要6天,为了确定特定酵母病原体的存在甚至需要更多的时间.
T2CandidaPanel和T2DxInstrument(T2Candida)可在三至五小时内从单一血样确定这五种常见的酵母病原体.
由于酵母血流感染不常见,并且使用T2Candida可能得出虚假阳性结果,所以医师应该进行血液培养,以证实T2Candida结果.
"通过一种血样检测五种酵母病原体,并且在几小时内获得检测结果,医师可及早地实施合适的抗真菌治疗,潜在减少患者疾病,降低死于这些感染的风险,"FDA器械及放射卫生中心体外诊断及放射卫生办公室主任Gutierrez表示称.
T2Candida结合了中断酵母细胞分裂、释放DNA的技术.
它然后制造许多拷贝的靶点DNA,利用磁共振技术检测放大的DNA.
如果发现有酵母DNA,T2Candida也将自动确定酵母病原体的种类,给出可以帮助指导卫生保健供应商提供合适治疗的信息.
FDA通过重新分类程序完成对T2Candida的审查,重新分类程序是一种用于某些低至中度风险的新型医疗器械.
FDA的许可基于一项由1500名患者参与的临床研究,T2Candida在研究中正确分类了大约100%有酵母病原体存在的阴性样本.
在一项单独的有特定酵母病原体浓度的300个血样的临床研究中,T2Candida正确确定了84-96%阳性样本中的病原菌.
T2Candida由位于马萨诸塞州列克星顿市的T2Biosystems公司生产.
http://www.
fda.
gov/NewsEvents/Newsroom/PressAnnouncements/ucm415728.
htm治疗近视性脉络膜新生血管病变药物Eylea在日本获批Bayer与研发伙伴Regeneron联合拥有的重磅炸弹式产品Eylea近来不断获得各国的批准和销售的新高.
就在前不久刚刚获得欧洲的重要肯定后,近日Eylea在世界上第三大市场——日本又获批准,用于治疗近视性脉络膜新生血管病变(myopicCNV).
Bayer本周一宣布,日本厚生劳动省此次对Eylea的批准是基于一项III期临床的积极数据,在这项名为MYRROR的III期临床试验中,myopicCNV患者在24周内的视力均明显改善.
Bayer方面还表示,在日本病理性近视和myopicCNV相关疾病是致盲的最常见原因.
Bayer全球发展负责人JoergMoeller在一份声明中指出,myopicCNV的预后较差,需要更多的治疗选择来满足患者的紧急医疗需要,尤其是很多患者还处于工作年龄阶段;同时具有防止永久性视力丧失并提高视力双重疗效的药物可以给病理性近视患者带来极大的好处.
http://www.
pharmadl.
com/yyzlshows_0102139b-fd5a-4408-9f28-79984a355afc.
htmlFDA批准Xtandi胶囊新适应症用于治疗转移性CRPC9月10日,Medivation和安斯泰来制药公25司宣布,FDA批准Xtandi(enzalutamide)胶囊新适应症-治疗转移性去势抵抗前列腺癌(CRPC).
在新适应症批准前,基于III期PREVAIL试验结果,Xtandi(enzalutamide)胶囊获得补充新药申请(sNDA)的优先审查权.
2012年8月,FDA首次批准Xtandi(一种口服,每日一次的雄激素受体抑制剂)用于治疗曾接受多西他赛(化疗)的转移性CRPC.
新适应症批准Xtandi用于未接受过化疗的转移性CRPC男性患者的治疗.
转移性CRPC被定义为癌细胞已经扩散到前列腺,并且尽管治疗(即用促性腺激素释放激素(GnRH)治疗或切除睾丸)后睾酮降低,仍在发生进展的癌症.
"Xtandi新适应症获得FDA的优先审查权并被批准,使得处于转移性CRPC各个阶段的患者拥有了一种重要的新治疗方案,"安斯泰来制药公司首席医疗官兼安斯泰来制药全球发展公司总裁SefKurstjens博士说,"我们很高兴的是,这些患者现在可将Xtandi作为一种治疗选择.
""Medivation公司全体人员对参加今天获批的新适应症PREVAIL临床试验的所有医生和患者致以诚挚的感谢,"医学博士,Medivation公司创始人,总裁兼首席执行官DavidHung说,"作为一家致力于快速开发治疗严重疾病新疗法的公司来说,我们很高兴地看到针对这一重要患者人群的Xtandi新适应症获得批准.
"http://www.
pharmadl.
com/yyzlshows_b86b0c93-6865-431c-bd9c-38e796253c2d.
htmlFDA批准阿斯利康Movantik治疗阿片药物诱导的便秘9月16日,FDA批准阿斯利康口服药物Movantik(naloxegol),用于伴有慢性非癌性疼痛的,阿片药物诱导的成人便秘患者的治疗.
阿片类药物是一类是用来治疗和控制疼痛的药物.
使用这些药物常见的副作用是胃肠道的蠕动减弱,致使排便困难,并因有硬质或块状便或不能完全排尽造成患者精神紧张.
Movantik属于作用于外周的阿片受体拮抗剂(用来减少便秘影响的阿片类药物).
"类似Movantik的支持性治疗产品可减少阿片类药物用于便秘治疗时的副作用,"FDA药物评价与研究中心的药物评估第三办公室主任,医学博士JulieBeitz说.
Movantik的安全性和有效性是建立在由1352名服用阿片类药物至少四周以治疗伴有非癌性疼痛的、阿片类药物诱导的便秘患者参与的两个临床试验结果之上的.
参与者被随机分配接受每日一次,连续12周的12.
5mg或25mgMovantik或安慰剂(糖丸).
试验的目的是测量从研究开始,患者每周排便的数的变化.
第一次试验结果表明,安慰剂组中,29%的患者每周排便次数增加.
而这一比例在接受Movantik12.
5mg的患者及接受Movantik12.
5mg的患者中可分别达到44%和41%.
第二个试验显示了类似的结果.
Movantik常见的副作用包括腹痛,腹泻,头痛及在过量气体积聚在胃肠部位(胀气)的体验.
FDA要求进行一项上市后研究,以进一步评估服用Movantik后,患者心血管不良事件的潜在风险.
六月,FDA举行公开会议,讨论评价外周作用的阿片受体拮抗剂需要进行哪些研究,包括Movantik用于治疗阿片类药物引起的便秘时的心脏安全性.
http://www.
pharmadl.
com/yyzlshows_aa9e9d67-7a8b-49c4-8773-907c59bca93c.
htmlFDA批准礼来Trulicity治疗2型糖尿病9月18日,美国FDA批准Trulicity(dulaglutide)结合饮食与运动用于2型糖尿病成人患者,这款药物一周使用一次,经皮下注射给26药,用来改善血糖控制.
美国大约有2600万2型糖尿病患者,占所有糖尿病病例的逾90%.
随着时间的推移,高血糖水平可增加严重并发症风险,包括心脏病、失明、神经及肾脏损害.
"2型糖尿病是一种严重的慢性病症,可导致血糖水平升高超过正常水平,"FDA药物评价与研究中心药物评价II办公室副主任、医学博士Parks表示称.
"Trulicity是一种新的治疗方案,它可单独使用或添加至现有治疗方案中控制血糖水平,用于2型糖尿病的整体管理.
"Trulicity是一款胰高血糖素样肽-1(GLP-1)受体激动剂,属于一种有助于血糖水平正常化的激素.
这款药物的安全性及有效性通过6项临床试验中得到评价,总共有3342名接受Trulicity治疗的2型糖尿病患者参与.
接受Trulicity治疗的患者其血糖水平得到改善,同时糖化血红蛋白水平下降(糖化血红蛋白是一个血糖控制指标).
Trulicity已被做为单药及与其它2型糖尿病治疗药物合并用药(包括二甲双胍、磺酰脲类药物、噻唑烷二酮类药物及餐时胰岛素)进行研究.
Trulicity不应用于治疗1型糖尿病患者,血液及尿中酮体增加(糖尿病酮症酸中毒)的患者,有严重肠胃问题的患者或作为一线治疗药物用于不能靠饮食及运动管理的患者.
Trulicity有一项黑框警告,在使用Trulicity的啮齿类动物研究中观察到甲状腺瘤(甲状腺C-细胞瘤)病例增加,但Trulicity是否会引起人类甲状腺C-细胞瘤尚不明确,包括一种叫甲状腺髓样癌的甲状腺癌(MTC).
Trulicity不应用于个人或家庭史患有MTC的患者,或多发性内分泌腺瘤综合征患者.
FDA要求对Trulicity进行以下上市后研究:一项评价儿科患者给药剂量、有效性及安全性的临床试验;一项评价对不成熟小鼠的性成熟、生殖及神经系统发育和功能潜在影响的研究;一个至少15年周期的甲状腺髓样癌(MTC)病例注册,以确定与使用Trulicity相关的任何MTC发生率的增长;一项在中度或严重肾损伤2型糖尿病患者中进行的对比Trulicity与甘精胰岛素对血糖控制效果的临床试验;一项心血管结局试验,用来评价Trulicity用于高基线心血管疾病风险患者的心血管风险.
FDA批准Trulicity时附带一项风险评估与减灾策略(REMS),它包括一项告知卫生保健专业人员有关使用Trulicity相关严重风险的沟通计划.
在临床试验中,Trulicity治疗患者最常见的副作用有恶心、腹泻、呕吐、腹痛及食欲下降.
Trulicity由印第安纳波利斯的礼来生产.
http://www.
fda.
gov/NewsEvents/Newsroom/PressAnnouncements/ucm415180.
htmFDA批准百特HYQVIA用于原发性免疫缺陷成人患者治疗9月14日,百特国际与Halozyme治疗公司宣布,美国FDA批准百特皮下注射治疗药物HYQVIA用于原发性免疫缺陷(PI)成人患者.
HYQVIA是首款获批用于PI患者的皮下免疫球蛋白(IG)治疗药物,给药时只需每月(每3至4周)注射一次即可,并且每次注射时在一个注射部位就可输送全部治疗剂量的IG.
今天的大多数PI患者是在医生办公室或输液中心接受静脉输注,并且目前的皮下注射IG治疗药物需要每周或两周注射一次,并且每次治疗时需要在多个部位注射.
"PI患者很重视能够提供有效性、安全性及耐受性的治疗药物.
由于每位PI患者对治疗的响应不一样,所以拥有满足个体患者需求的治疗选择是至关重要的,"免疫缺陷基金会创始人兼总裁Boyle评论称.
"我们对百特的重要承诺27及在HYQVIA开发中的投入表示赞扬.
""HYQVIA的可用性对PI的治疗有很重要的影响,与其它皮下注射治疗药物相比,它有效输送一次完整治疗剂量的IG需要更少给药频次,同时保持有效性、安全性及耐受性属性,这对患者来说是最重要的,"百特科学总裁、哲学博士Hantson表示称.
"这次批准强调了对患者社区新治疗方案的支持.
""今天FDA对HYQVIA的批准对Halozyme来说是一个重要的里程碑,因为它代表了利用了我们rHuPH20平台的生物制剂许可申请首次在美国获得批准,"Halozyme总裁兼首席执行官Torley博士表示称.
"我想感谢Halozyme和百特的天才团队,是他们致力于将一种新的治疗选择带给PI患者,让患者管理这种伴随终生的疾病.
"百特预期未来几周在美国推出HYQVIA.
2013年,这款药物在欧洲被批准用于原发性免疫缺陷综合征和骨髓瘤,或有严重继发性低丙球蛋白血症及复发性感染的慢性淋巴细胞白血病(CLL)成人患者(≥18岁).
HYQVIA目前正在欧洲几个国家上市,包括德国、荷兰、瑞典、挪威、丹麦、爱尔兰和意大利.
http://www.
firstwordpharma.
com/node/1234969tsid=28®ion_id=3#axzz3DIYJrsjU2014年重磅生物制药行业发展主形势分析日前,有研究人士综合50家全球性企业近10年的年度报表等资料,就重磅生物制药行业这几年的市场销售额等情况进行了分析,并预计2014年该行业全球销售额将逼近1500亿元.
虽然这一猜测还有待验证,但从各类报表所呈现出的势头来看,重磅生物制药行业的市场前景还是颇为乐观,正如该人士所言,"现有产品远远不能充满整个市场空间".
新"四大金刚"销售直线增长生物制药市场中不乏重磅产品,有句话说得好,如果年销售额不过千万美元,都不好意思说是圈里混的,足见生物制药行业每一个产品均能独当一面,功力深厚.
根据全球50家大型制药企业的所有重磅生物制药(销售超过10亿美元的产品)建模推算,2013年全球重磅生物制药总销售额达1420亿美元,年增长率为9.
1%,预计2014年全球销售额将逼近1500亿美元.
事实上,自2007年后,重磅生物制药全球销售额增速由指数增长模式进入了线性增长模式,销售额逐渐扩大,获批的新药有限,销售增量难以维持行业销售额继续以指数模式增长,但个别产品的增长模式持续指数增长或爆炸增长模式,产品层级仍然是"重磅炸弹"丛生.
重磅生物制药可以划分为TNF抗体、癌症抗体、病毒抗体、促红细胞生成素、促卵泡激素、干扰素α、干扰素β、粒细胞集落刺激因子、酶替代疗法、人生长激素、炎症抗体、眼科用抗体、胰岛素及其类似物、重组凝血因子等几个大类,TNF抗体类以316亿美元三年蝉联冠军,其次为癌症抗体、胰岛素及其类似物、炎症抗体,成为生物制药领域的新"四大金刚"(前四大金刚:人胰岛素、人生长激素、干扰素、促红细胞生成素).
虽然前四类仍然维持着高增长态势,但促红细胞生成素已风光不再,流放出了五强,价格逐年下降可能是其销售总额逆势下降的原因;另外人生长激素、干扰素市场均出现不同程度的萎缩,干扰素α下滑超过20%.
从近年销售趋势来分析,新四大金刚均处于直线增长趋势,TNF抗体、癌症抗体、胰岛素及其类似物增速放缓,炎症抗体近年市场快速增长,说明市场中实力产品已经出现.
在年销售额百亿以下小类中,眼科用抗体增速强劲,年增长率25.
6%,近期有望突破百亿大关,另外,重组凝血因子近年来销售额一直处于爬升状态,但较2012年增速放缓为4.
2%,未来突破可能性不大.
28市场为重磅产品留有空间在全球重磅生物制药公司中,罗氏以294亿美元的销售额雄踞2013年榜首,较2012年增长了5%,增速有所放缓,销售总额远远超过了随后的安进和赛诺菲.
不过赛诺菲整体增势喜人,虽然已经闯入前三名,但仍然保持17.
5%的增速,而第四名雅培同样处于高速增长的轨道,安进现有排名在未来可能受到来自赛诺菲和雅培的威胁.
诺和诺德和强生分居第五和第六名,但强生增长强劲,2013年销售额增长了近13.
4%,2014年有望超越诺和诺德挤进前五名.
值得注意的是,各巨头的市场份额变化不大,一般以活性市场份额衡量市场竞争情况,活性市场份额越大,市场竞争越激烈.
重磅生物制药领域内,各公司形成的活性市场份额非常低,但这并不能说明生物制药领域缺乏活力,虽然生物制药领域近年得以长足发展,但各产品间的差异较大,市场定位非常准确,仍未形成在同一市场多家公司短兵相接的局面.
因此,差异化的产品定位是弱化生物制药市场竞争的主要原因;另外,这一现象同时说明生物制药行业潜力仍然需要重磅产品挖掘,现有产品远远不能充满整个市场空间.
http://yy.
chinairn.
com/制药企业动作频频减肥药破茧在即分析师们一直在等待,直到制药公司认识到减肥药市场的巨大潜力.
目前,有大批包括诺和诺德以及武田制药这样的公司在积极为减肥新药掏腰包,同时开始布局市场,减肥药终于受到药企的青睐.
上周,诺和诺德的减肥药利拉鲁肽注射液(liraglutide、Saxenda)获得了FDA一个顾问委员会的支持,正准备用于造福肥胖领域"最杰出的人",该公司首席科学官MadsKrogsgaardThomsen对彭博社如是说.
除了增加数百名的研发人员之外,诺和诺德拟寻求与大学和生物技术公司开展合作,来为这只产品出谋划策.
"我们正在采取一种整体组合的治疗方式,就像我们已经在糖尿病领域所做的一样,从而针对不同的患者实施个性化用药.
"Thomsen说到,并被新闻媒体所引用.
这对于提振减肥药市场的信心来说,不啻是一剂强心针,将给其他被减肥药市场所吸引的制药公司带来一个好兆头.
比如说Orexigen公司刚获得批准的减肥药:盐酸纳曲酮和盐酸安非他酮缓释片剂(Contrave).
该药销售合作伙伴是武田制药,后者称将为这一减肥药投入900人的销售队伍.
诺和诺德已经为Saxenda(利拉鲁肽注射液)准备了强有力的销售力量.
如果诺和诺德和武田一切顺利的话,他们的减肥新药将可能触发长久以来分析师们所期待的数十亿美元的减肥药市场.
据美国疾病预防控制中心,超过三分之一的美国成年人是肥胖患者,因此获得治疗资格的患者比比皆是.
而目前仅有200-1000万患者正在接受减肥药的治疗,Orexigen公司首席商务官MarkBooth在周二的演讲时表示.
"减肥药市场是一个巨大的、快速增长和拥有巨大潜力的市场.
"但是到目前为止,创造新一代的减肥药的制药公司,已经在获得市场份额方面遇到了麻烦.
他们正在竭力说服医生支持减肥药,患者使用减肥药和纳税人支付减肥药费用.
位于加利福尼亚的Vivus2012年9月获得FDA批准的第二款新型减肥药Qsymia(苯丁胺和托吡酯的缓释制剂)陷入了销售困境,而其竞争对手来自艾瑞纳制药的一款新型减肥药氯卡色林(lorcaserin、Belviq)表现也不尽如人意,尽管该产品的销售合作伙伴还是日本卫材.
2013年,Qsymia的销售额仅为2370万美元,Belviq的净销售额刚刚超过2500万美元.
即便如此,分析师们仍然坚持减肥药市场的巨变即将到来.
美国最好的银行,富国银行的分29析师MatthewAndrews表示,Contrave到2020年的销售额将达到6.
34亿美元,如果Orexigen能使该药物获准用于治疗糖尿病,其销售额将达到12亿美元.
他同时还预测,到2020年,Belviq的销售额将达到4.
81亿美元,Qsymia的销售额将达到3.
96亿美元,与此同时彭博社的分析师们预测Saxenda的2017年的销售额将达到4.
29亿美元.
此外,艾瑞纳制药也正在制定自己的发展计划.
该公司希望将Belviq与减肥药芬芬(Fen-phen)中的芬特明联合使用,从而规避芬-芬的心血管风险来刺激销售.
http://www.
sinohealth.
com/2014/0922/9989.
shtmlIMS:2014医院用药统计报告经统计,2014年第一季度中国医院医药市场的销售额(医院药房采购金额)为1440.
4亿人民币(数据来源:IMS艾美仕中国医院药品统计报告≥100张床位),与去年同期相比销售增长率为12.
9%.
增长率较上季度的增长率有2%左右的下降.
基于12个月的MAT(滚动全年数据:指定时间结点往前追溯12个月的数据总和,此处指2013年第二季度到2014年第一季度的销售额.
)来看,2014年第一季度的MAT增长率为13.
8%,与上季度基本持平.
增长持续放缓的主要原因依旧是政府限抗令的影响所致,特别是对于本土企业产品,并且自2011年以来的5轮药品降价之后,主要城市的大医院总额控制力度加大、药品处方趋于保守,特别是在抗生素和医用溶液的使用上,这些无疑都是市场增长放缓的因素.
跨国企业和国内企业市场表现2014年第一季度本土企业的增长率为12.
5%,较上季度下滑了将近3个百分点,但是跟2013年一季度的12.
1%相比,基本持平.
跨国企业涨势不俗,为14.
2%,也是近几年来首次增长率超过本土企业.
滚动全年数据方面,国内企业依旧领先.
纵观2014年第一季度的企业销售表现,辉瑞以36.
60亿元的销售额和18.
2%的增长率持续保持其在中国医院医药市场的领先地位.
阿斯利康以29.
90亿元的销售额位列第二,齐鲁制药以24.
62亿元的销售额位居季军,这一成绩延续了中国本土企业的最好排名.
从滚动全年数据来看,增长最迅速的为诺华制药(25.
7%),其次是齐鲁制药(19.
8%),阿斯利康则名列第三位(18.
7%).
在能够覆盖中国医院渠道销售40%的山东、河南、江苏、浙江、广东和四川6个省中,跨国企业在广东和浙江表现突出,都能够达到超过30%的市场份额.
四个城市级别中,一级城市的增长率最低,而一级和二级城市正是跨国企业的重点地区,三级、四级城市的市场增长则多是由本土企业所贡献.
各治疗领域药品销售起伏其它类产品(主要指中成药)目前已经成为中国医院市场最大的治疗领域,2014年第一季度的销售额为民币279.
2亿元,增长率达到12.
9%.
全身性抗感染类产品的增长也日渐回稳,达到10.
6%,延续了2013年第四季度的增长态势.
从产品的角度看,2014年第一季度分别有7个本土企业产品和3个跨国企业产品位于十大产品榜单.
排名前三的产品中本土企业产品占得2席,分别是排名第一的血栓通,以8630万元的季度销售额,位列医院用药榜首;申捷以8410万元的季度销售额攀升至第二位.
排名第三的是赛诺菲的波立维.
http://www.
venlon.
net/h-nd-1292-2_336.
html【专题】埃博拉病毒什么叫埃博拉病毒埃博拉(Ebolavirus)又译作伊波拉病毒.
30是一种十分罕见的病毒,1976年在苏丹南部和刚果(金)(旧称扎伊尔)的埃博拉河地区发现它的存在后,引起医学界的广泛关注和重视,―埃博拉‖由此而得名.
是一个用来称呼一群属于纤维病毒科埃博拉病毒属下数种病毒的通用术语.
是一种能引起人类和灵长类动物产生埃博拉出血热的烈性传染病病毒,有很高的死亡率,在50%至90%之间,致死原因主要为中风、心肌梗塞、低血容量休克或多发性器官衰竭.
是一个用来称呼一群属于纤维病毒科埃博拉病毒属下数种病毒的通用术语.
埃博拉病毒是引起人类和灵长类动物发生埃博拉出血热的烈性病毒,其引起的埃博拉出血热(EBHF)是当今世界上最致命的病毒性出血热,感染者症状与同为纤维病毒科的马尔堡病毒极为相似,包括恶心、呕吐、腹泻、肤色改变、全身酸痛、体内出血、体外出血、发烧等.
埃博拉病毒,生物安全等级为4级(艾滋病为3级,SARS为3级,级数越大防护越严格).
病毒潜伏期可达2至21天,但通常只有5天至10天.
http://baike.
baidu.
com/subview/188032/5072671.
htmfrom_id=6648445&type=syn&fromtitle=%E5%9F%83%E5%8D%9A%E6%8B%89&fr=aladdin基因测序揭示埃博拉疫情源头在今年5月下旬,一位年轻女患者来到塞拉利昂的凯内马政府医院,她发着高烧并且刚刚经历了一次流产.
在对其进行治疗的过程中,医生发现她感染上了埃博拉病毒——这是在塞拉利昂被确诊的第一个埃博拉病例.
这名女患者最终痊愈,但是她及其携带的病毒如今却成为一场波及多个国家的医疗灾难,以及一篇重要研究论文的中心.
由美国马萨诸塞州剑桥市哈佛大学和布罗德研究所的StephenGire、PardisSabeti率领的来自美国、英国、塞拉利昂和尼日利亚的研究人员报告说,他们已完成了在西非流行的埃博拉病毒基因组测序工作.
他们在发表于最新出版的美国《科学》杂志的一篇论文中报告说,他们对采集自这位女患者,以及在5月下旬至6月中旬之间在塞拉利昂被确诊感染了埃博拉病毒的另外77名患者体内的埃博拉病毒进行了基因测序和分析.
初步分析显示,西非埃博拉疫情是过去10年中从中部非洲传入,病毒可能先从动物传染给人,之后在人际间传播.
研究人员在塞拉利昂出现埃博拉疫情的头24天获取了78名患者的99个埃博拉病毒样本,其中一些患者提供了两份样本.
研究人员利用基因组测序数据分析了埃博拉病毒的传播途径和进化史.
结果显示,这次疫情中的病毒可追溯至2004年在中部非洲暴发的埃博拉疫情,这意味着在过去10年里中部非洲的一些埃博拉病毒逐渐传播到了西非.
引发此次疫情的病毒可能首先由动物传给人,这种动物可能是果蝠.
基因组测序数据证实,至少在塞拉利昂,疫情可以追溯至一名几内亚传统治疗师的葬礼.
这名治疗师因给埃博拉患者治疗而感染病毒死亡,来自塞拉利昂的13名女性参加了他的葬礼,其中一名年轻孕妇因发热及流产住院治疗,成为塞拉利昂的第一名被确诊的埃博拉患者.
令研究人员惊讶的是这13名女性在葬礼上感染了两种不同的埃博拉病毒,但现在还不清楚是上述那名治疗师同时感染了两种埃博拉病毒,还是参与葬礼的人在其他地方感染了其中一种埃博拉病毒.
研究人员指出,最终的测序结果使人们深刻理解了埃博拉病毒如何在暴发的过程中发生了变化——迄今为止,此次埃博拉病毒仅在塞拉利昂已感染了900多人且目前依然在传播.
专家认为,该序列将有助于改善目前的埃博拉病毒诊断测试模式,并且从长远来看,对于指导疫苗和治疗方法的研制开发具有重要意义.
这项研究工作涉及了来自4个国家的50多名合作者,同时也凸显了第一线的医务工作者所面临的巨大风险——5位作者因此不幸感染了31埃博拉病毒,并在论文发表之前去世.
研究发现,总体而言,埃博拉病毒的基因组变化速度快且通常发生在蛋白编码区,其中包括影响埃博拉病毒检测准确率和治疗效果的关键区域.
这显示了跟踪研究埃博拉病毒变化的重要性,这项研究可为保证检测和治疗的有效性提供有关病毒的新信息.
论文第一作者Gire在一份声明中说:―在这次疫情中,我们已发现300多个与此前疫情不同的遗传线索.
我们不清楚这些(基因组)差异是否与此次疫情的严重程度相关,但通过与科学界共享数据,我们希望加速我们对此次疫情的了解,并为国际社会控制疫情提供支持.
‖http://infect.
cmt.
com.
cn/detail/582413.
html汤森路透:世界聚焦埃博拉编者按:2014年9月3日,汤森路透撰文一篇分析埃博拉病毒,包括埃博拉病毒的发源地、发病机理、致死率等情况.
该文认为,埃博拉病毒从致死量来看,相比登革热出血热(2.
5万)和拉沙热(5000人),并不是特别大.
然而为什么大家把焦点聚焦埃博拉疫情,一方面,因为世界卫生组织拉响公共健康警报,而随着美国有2名援助医生的感染而进一步被世界关注;另一方面,因为埃博拉病毒起源于偏远地区却能跨越国界传播的趋势令人担心.
而世界卫生组织列举的其他令人担心的因素还包括人群密集和健康设备传输模式(health-facility-transmissionpatterns),以及已经有感染人群处于危险状态的国家的卫生系统较薄弱.
不过根据这一疾病致死速度和致死率,该文作者认为,埃博拉病毒不太可能引起世界流行病大暴发.
1埃博拉疫情凶险2014年埃博拉病毒在几内亚、利比里亚、塞拉利昂和尼日利亚等地暴发.
根据世界卫生组织(WHO),自从今年3月份埃博拉疫情确定以来,已有至少1350人死亡,而把些许年前所有埃博拉暴发导致死亡人数统计来算才1590人,可见此次疫情凶险.
埃博拉病毒,此前又称之埃博拉出血热,是世界上最凶险的疾病之一,其致死率可高达90%.
世界卫生组织最近宣布,西非的埃博拉疫情是一项国际公共健康紧急事件,批准使用实验药物用于治疗埃博拉病患,并颁布一个1亿美元的计划,作为抗击埃博拉暴发的强化措施的一部分.
2埃博拉病毒归属关系既能感染人类又能感染非人灵长类动物的埃博拉病毒是埃博拉病毒属的某一种病毒株,其是一种丝状病毒.
这个属下面目前发现了5个种:Bundibugyo、Zaire、Reston、Sudan和TaiForest,前四种可以导致人类生病.
机体往往首先表征出感冒类似症状.
之后,随着疾病的进展,2天至21天之内,内外出血导致器官衰竭.
埃博拉病毒于1976年在刚果民主共和国埃博拉河边上的一个社区被发现,感染了318人,导致280人死亡.
对此次暴发的埃博拉病毒进行遗传分析,发现其是Zaire亚型的变种,与Zaire型有97%的相似性.
虽然还没有确切的来源,也没有确认天然病毒池(naturalreservoirofEbolaviruses),但是坚信该病毒是一种以果蝠(fruitbats)为天然宿主的动物传染病.
而还没有获得批准或注册的疗法和疫苗用于抵抗埃博拉,只有支持疗法,包括水合作用、氧化作用,治疗并发症等手段.
3埃博拉病毒的发病机理埃博拉病毒是通过直接的体液接触而传染,包括血液、分泌物和已感染病患和动物的器官.
埃博拉袭击影响淋巴组织功能的关键细胞,在成纤维母细胞中最活跃,包括连接组织中的成纤维网状细胞和淋巴结导管中的成纤维网状细胞,在这两类细胞的推动下快速进入血液系统.
4世界聚焦埃博拉埃博拉病毒的暴发不太可能变成流行病,因为根据这一疾病致死速度和致死率,这一病毒是一种局限某一地区的病毒.
然而,鉴于当下暴发32的数量级,世界卫生组织拉响世界级公共健康警报.
自从3月份世界卫生组织宣布暴发以来,随着疫情越来越严重,关注的人越来越多.
特别当两名在利比亚工作的美国医生因接触而感染埃博拉病毒后,世界关注得更多.
两名医生都用Zmapp治疗(MB-003和ZMAb),目前已经治愈出院.
由埃博拉病毒导致的死亡人数相比其他出血疾病实际上还是比较少的,例如登革热出血热(Denguehemorrhagicfever)和拉沙热(Lassafever).
根据世界卫生组织报告,40年来,相比登革热出血热造成2.
5万人死亡和拉沙热造成5000人死亡,埃博拉出血人致死人数为1590人.
然而,埃博拉病毒具有致死性的特性,其快速表现症状,毒性高,却缺乏治疗方法,才是这一疾病如此令人恐慌的根本原因.
根据美国疾病预防和控制中心的统计数据,登革热和拉沙热的致死率分别为10%和1%,而埃博拉为90%.
特别需要拉响警报的是,埃博拉病毒有跨越国界的趋势.
其起源于刚果,且该病毒暴发在偏远乡村,且短暂生命很快就被掩埋隔离,却还蔓延到塞拉利昂、利比亚和尼日利亚.
而世界卫生组织列举的其他令人担心的因素是,人群密集和健康设备传输模式,以及已经有感染人群处于危险状态的国家的卫生系统较薄弱.
http://www.
bioexpress.
ac.
cn/zhutis.
aspid=16176全球合力阻止埃博拉疫情传播卫生官员们指出,如果要消除这场埃博拉疫情的话,还需要国际上给予更多的援助.
传染病医生DanKelly是塞拉利昂一家非营利性医疗机构WellbodyAlliance的联合创始人.
8月19日,当Kelly抵达康诺特医院(ConnaughtHospital)时,他感觉自己好像进入了战争地区.
他的朋友ModupehCole是一名医生,在塞拉利昂弗里敦的一家医院中负责管理埃博拉患者隔离病房,但是却在六天前不幸去世了.
MartaLado是一名来自于西班牙的医生,目前由她来看护病房中的十位患者.
Kelly表示,她只能亲自来―拖地板‖了.
无国界医生组织(MédecinsSansFrontières)是一家国际援助组织,他们认为,世界各国对西非地区暴发的埃博拉疫情所采取的应对措施―严重不足‖.
当Kelly在弗里敦市内四处巡视时,发现很多诊所都已关闭,有很多医疗卫生工作者并没有获得足够的防护培训和防护设备,因此他不得不认同无国界医生组织的说法.
Kelly说:―在发生海地地震或(菲律宾)海燕台风等灾难时,我们看到了一些非常强烈的人道主义回应,但是目前我们却缺少这种回应.
‖Kelly正通过旧金山市加利福尼亚大学(UniversityofCalifornia)的帮助来筹集资金,以便于能够将感染管制措施传授给那些在此次疫情中战斗的医疗卫生工作者们.
在目前的这次疫情中,有240多名医疗卫生工作者感染了埃博拉病毒,其中包括一位来自于塞内加尔的流行病学家——在世界卫生组织(WHO)部署下前往援助的医疗卫生工作者中,他是第一个感染了埃博拉病毒的人.
Kelly说:―我们的工作陷入了低谷.
‖8月初,WHO公开声明这次暴发的埃博拉疫情是一件引发国际关注的突发公共卫生事件,而世界银行(WorldBank)承诺将提供2亿美元的援助.
然而几周以后,仍然没有得到足够的资源来结束这场危机.
WHO报道指出,目前暴发的埃博拉疫情已经杀死了四个西非国家的1427人——虽然这可能还只是一个保守数据,但是却比所有以往有记录的疫情死亡人数的总和还要高.
据说这场流行病将会再持续6–9个月,而应对这次疫情的科学家和医生们对此也表示赞同.
病毒学家JosephFair是塞拉利昂卫生部的特别顾问,他说:―我可以很肯定地说,在接下来的4到9个月内我们还将处于这场疫情之中,而这一预期时间还不包括治疗疾病后的健康影响所需要的随访时间.
33公共卫生专家指出,为了结束这场危机,发达国家和救援组织需要派出更多的、具有传染病治疗专业知识的工作人员.
截止到8月22日为止,利比里亚的首都蒙罗维亚中仅有三套埃博拉治疗设施在运行;WHO指出,未来几周内还需要更多的设施来治疗其他500名感染患者.
总部设在乔治亚州亚特兰大的美国疾病控制与预防中心(CentersforDiseaseControlandPrevention)已经派出了60名工作人员赶赴西非地区,协助进行疾病监测、疾病跟踪和健康教育,但是这些工作人员无法参与患者的治疗工作.
无国界医生组织驻纽约办事处的执行董事SophieDelaunay指出,目前还急需从其他西方国家的政府中调遣医疗卫生工作者和专家.
许多社会公共机构和救援组织由于担心医生们的安全问题,甚至将他们转移出了疫区.
医生和科学家们指出,受疫情影响的国家也必须要更好地开展工作,治疗患者,并向公众传授埃博拉病毒感染的相关知识.
WellbodyAlliance的联合创始人BailorBarrie指出,政府官员方面的漠不关心已经引发了一系列暴动,其中包括8月20日发生在蒙罗维亚附近的隔离区内的一场暴乱.
他补充道,如果政府官员对自己的行为做出解释,并向那些被感染者表示关心的话,他们或许会在阻止埃博拉疫情扩散的工作上取得更多的进展.
对此,Barrie还引用了自己本月月初在塞拉利昂科诺区的一个村庄中的亲身经历.
当地的一位村民被检测出埃博拉病毒阳性,随后警察将两座房子隔离了起来,但是仍有6人逃离.
随后,Barrie带领着当地村官和公共卫生工作者们拜访了剩下的30位村民,向他们解释了隔离的原因,并回答了他们的疑问.
一位村民说,他需要有人帮他去买香烟,另一位村民说他需要棕榈酒;卫生官员只好派一名工作人员去运输这些日常用品.
村民们在隔离区内待了整整21天,即便在这段隔离期内,有3位村民出现了类似于埃博拉感染的临床症状.
隔离期后的诊断性测试结果为阴性,隔离房内的所有人都没有感染上埃博拉病毒.
Barrie说:―如果你没有引起人们的注意,没有倾听他们的心声,而仅仅告诉他们正确方法的话,他们是不会遵照你的指令的.
‖―这就是为什么在一些受疫情影响的国家中,人们最初对隔离的反应是全盘否定、害怕和恐惧——每个人都感到十分担心.
‖Fair指出,政府也必须在全国范围内开展一些范围较广的活动,―在所有形式的媒体上轮番轰炸——广告牌、电台广告曲、体恤衫、钢笔……基本上就是要用那些公众无法听到和记住的众多信息来淹没他们.
‖但是杜兰大学(TulaneUniversity,位于路易斯安那州新奥尔良市)的DanielBausch医生最终指出,最有效的、防止埃博拉疫情扩散的策34略是对西非地区的人们进行培训,传授给他们基本的公共卫生措施.
Bausch医生在几内亚和塞拉利昂治疗埃博拉病毒感染.
他说:―我并不会那么天真地认为这是小菜一碟,但是实际上这将会是唯一一个有效的措施.
‖最后一英里健康(LastMileHealth)是一家在马萨诸塞州波士顿和蒙罗维亚运营的非营利性组织.
最后一英里健康等组织的经验表明,这种培训是行之有效的.
最后一英里健康已经派出150名社区卫生工作者前往疫区,将埃博拉病毒的相关知识告诉给利比里亚的农村居民.
这一组织也提供了基本的医疗材料,用于护理埃博拉病毒感染患者.
亚绥德鲁玛莎塔布曼纪念医院(MarthaTubmanMemorialHospital)的护士们需要为利比里亚东部农村地区130000人提供医疗服务.
最后一英里健康组织的董事长RajeshPanjabi指出,这些护士因为缺乏防护设备,准备在8月中旬进行罢工.
最后一英里健康组织向他们提供了手套、口罩和隔离衣,并训练他们如何使用这些物品,护士们才得以继续工作.
(利比里亚卫生部本月月初估计,利比里亚还需要超过451360双医用手套.
)Panjabi说:―你可以通过一些最基本的行为来影响疫情的发展,但是这就需要不断地响应和投资.
‖此外还有其它一些让人充满希望的迹象.
在康诺特医院,来自于塞拉利昂等国家的护士们加入了Lado的工作团队.
Lado负责伦敦国王学院塞拉利昂合作计划的临床工作;该合作计划由伦敦国王学院的全球卫生研究中心发起.
来自于此项合作计划的两名医生和一名护士将会在未来几周内抵达康诺特医院.
Kelly说:―我们现在处在一个关键时期,我们所做的、几乎所有扭转乾坤的工作都会使疫区的情况好转起来.
‖―这些工作可以是每次建立一个医院.
‖http://infect.
cmt.
com.
cn/detail/583667.
htmlNature:科学家探讨埃博拉病毒感染的新型疗法进展2014年9月1日讯/生物谷BIOON/--近日,刊登在国际著名杂志Nature上的一篇研究报告中,来自得克萨斯大学医学中心的研究人员通过研究表示,将三种单克隆抗体混合后制成的混合抗体可以有效保护猴子抵御埃博拉病毒感染至少5天;研究者ThomasGeisbert在文章中讨论了当前埃博拉病毒疗法的进展.
丝状病毒,比如埃博拉病毒和马尔堡病毒,都是具有较高致死率的病原体,致死率高达90%;自从科学家们1976年发现了埃博拉病毒,自那时开始研究人员一直在致力于开发抵御该病毒感染的疗法.
最近的研究中,来自MAPP制药公司等处的研究人员利用化合物ZMAPP可以有效治疗感染一定剂量埃博拉病毒的猴子,所有的实验动物都生存了下来,而且在感染机体21天后找不到病毒的痕迹,甚至是在感染后5天接受该疗法后就可以完全消灭病毒,同时研究人员还表示ZMAPP可以在细胞培养液中有效抑制埃博拉病毒的复制.
ZMAPP可以用于治疗一系列病人,正因为有该化合物,两名美国医疗工作者因其而得救;尽管研究者尚不明确ZMAPP是否具有任何副作用,但在疾病暴发过程中45%的患者在没有该疗法的情况下可以生存,然而有两名患者在该疗法后却死亡了,这或许是因为患者进行该疗法救治的时间太晚了.
Geisbert教授表示,由于埃博拉病毒的多样性,因此对于开发候选疗法非常困难,保护机体抵御某一种埃博拉病毒的疗法或许并不会帮助抵御另外其它不同种埃博拉病毒的感染;尽管针对线状病毒感染科学家们需要新型特殊的疗法,但是最有效控制病毒感染暴发的途径还是开发新型的疫苗,注射保护性疫苗可以保护机体免于多种埃博拉病毒(丝状病毒)的感染.
在疾病暴发期间,单一疫苗的注射需要确保其可以快速在机体产生保护效应,研究者表示,至少给猴子注射5种不同的保护性疫苗才可以完全保护其抵御埃博拉病毒和马尔堡病毒的感染,最后研究人员表示,抗体疗法和其它治疗策略进行结合或许才可以有效控制未来埃博拉病35毒的感染,尽管目前ZMAPP已经获批进行使用,但是下一步其还将需要进行安全性及有效性的评估.
(生物谷Bioon.
com)http://www.
bioon.
com/3g/id/6658058/Science杂志介绍埃博拉病毒致病机制最近在西非造成严重疫情的埃博拉(Ebola),是一种能力惊人的病毒.
扎伊尔埃博拉病毒(Zaireebolavirus)及其所属的丝状病毒(filoviruse)家族,能够解除免疫应答并破坏血管系统.
这种病毒感染发展非常迅速,人们很难梳理出相关事件的发生顺序,尤其是在疫情暴发的时候.
Ebola病毒会导致出血热,这种疾病患者的死亡率高达90%,人们将这种病毒视为全球性的健康问题,这种能够大面积流行的致命病毒也是潜在的生化威胁.
目前,还没有任何可用于人类的相应疫苗或治疗药物通过审批.
目前人们对埃博拉所知甚少,许多问题都还没有得到解答,例如埃博拉劫持宿主细胞合成的蛋白有什么用,什么样的免疫应答才能有效击败这种病毒.
不过,研究者们可以在体外培养的不同细胞中研究活病毒的感染机制,也可以将其他灵长类动物当作模型观察疾病的进程.
Science杂志特别在网站上刊登文章,介绍了人们对埃博拉致病机制的一些基本了解.
埃博拉对免疫系统做了什么埃博拉进入机体之后,会靶标一些负责免疫系统一线防御的免疫细胞,比如树突状细胞(dendriticcell).
在正常情况下,树突状细胞会将感染信息呈递给T淋巴细胞,然后T细胞在病毒进一步复制之前摧毁受到感染的细胞.
如果树突状细胞无法给出正确的信号,T细胞就不会应答感染,相应的抗体也就不能活化.
正因如此,埃博拉病毒才能在机体中快速复制.
跟许多其他病毒一样,埃博拉也能抑制干扰素,干扰素是细胞阻止病毒增殖的一大武器.
在CellHost&Microbe杂志上发表的一项新研究中,研究人员发现埃博拉的VP24蛋白能够结合并阻断免疫细胞表面的转运蛋白,而该蛋白在干扰素通路中具有重要的作用.
令人称奇的是,淋巴细胞本身并没有被病毒感染,是其他一些因素阻止这些主要的免疫细胞投身抗病毒战场.
埃博拉是怎么导致出血的埃博拉病毒通过血液在机体内扩散,它们会释放出促进凝血的蛋白,使血管中形成小血块,减少器官的血液供给.
此外,埃博拉还会生产炎症性的信号蛋白和破坏血管壁的一氧化二氮,导致血管渗漏.
血管受到破坏是埃博拉感染的主要症状之一,但并不是所有患者都会表现出外出血(比如七窍流血).
埃博拉靶标特定器官么埃博拉除了会引起全身性的炎症和发热以外,还能破坏多种类型的组织.
这些病毒能够促使免疫细胞(如巨噬细胞)释放炎症性分子,或者直接入侵从内部消耗细胞.
不过,肝脏被埃博拉感染的后果特别严重,病毒彻底消灭了生产重要血浆成分所需的细胞(凝血蛋白等).
胃肠道细胞受损所导致的腹泻,往往使患者面临脱水的危险.
在肾上腺,病毒削弱了生产类固醇的细胞,类固醇可以调节血压,并引起循环衰竭令器官缺氧.
最终令患者死亡的是什么血管受损引起的血压下降,休克和多器官衰竭.
为何有的人可以在感染后存活下来维持性疗法(口服补液和静脉注射补液等)能够为机体正确抵抗感染的时间.
之前人们对362000年乌干达埃博拉疫情进行了血样研究,也鉴定了与存活情况有关的一些基因和标志物.
研究显示,已康复患者血液中的活性T细胞水平更高,而且这些患者还携带着特定的基因突变(编码白细胞通讯所用的表面蛋白).
今年早些时候,研究者们还发现sCD40L水平也与患者的存活有关.
sCD40L由血小板生产,机体修复受损血管时会用到这种蛋白.
研究人员认为,增强血管修复机制对于埃博拉患者的生存至关重要.
http://www.
ebiotrade.
com/newsf/2014-8/2014814113409548.
htm埃博拉病毒躲避机体抗病毒防御系统机制近日,刊登在国际杂志CellHost&Microbe上的一篇题为―EbolaVirusVP24TargetsaUniqueNLSBindingSiteonKaryopherinAlpha5toSelectivelyCompetewithNuclearImportofPhosphorylatedSTAT1‖的中,来自华盛顿大学医学院的研究人员通过研究鉴别出了埃博拉病毒躲避机体抗病毒防御系统的一种途径,相关研究为开发新型治疗埃博拉病毒感染的新型疗法提供了一定帮助.
埃博拉病毒是一种引起人类和灵长类动物发生埃博拉出血热的烈性病毒,埃博拉出血热(EBHF)是当今世界上最致命的病毒性出血热,感染者症状与同为纤维病毒科的马尔堡病毒极为相似,包括恶心、呕吐、腹泻、肤色改变、全身酸痛、体内出血、体外出血、发烧等.
这项研究中,研究人员绘制了一种详细的图谱,该图谱可以帮助揭示非致病性埃博拉病毒的蛋白VP24如何结合到宿主机体负责信号分子进出细胞核的蛋白质上,为更深层次地理解埃博拉病毒吸附并且进入人类机体引发疾病的机制提供了一定的理论依据.
这张新型图谱就揭示了,病毒的蛋白质VP24可以掠夺走机体宿主蛋白携带重要免疫信号进入细胞核的的能力,而这种免疫信号则可以帮助激活机体的抗病毒免疫系统及防御机制,并且可以有效阻断病毒的致病性;研究者WeiXu说道,目前我们研究发现阻断埃博拉病毒的VP24蛋白的功能就可以明显抑制病毒的致病性和侵袭能力,后期我们还将继续开展更深入的实验,希望未来早日开发出可以预防并且有效治疗埃博拉病毒感染的实验性药物.
http://infect.
cmt.
com.
cn/detail/585323.
html英发现埃博拉病毒治疗新方法日前,来自英国利物浦大学的研究人员与英国公共卫生部门合作,研发出新的方法,来确定可用于治疗感染的药物.
相关研究以―'ElucidationoftheEbolavirusVP24cellularinteractomeanddisruptionofvirusbiologythroughtargetedinhibitionofhostcellproteinfunction‖为题发表在最近的国际蛋白质组学领域权威杂志《JournalofProteomeResearch》(2014年最新影响因子5.
001).
受感染细胞中的病毒发病机制,是抗病毒反应和宿主细胞过程破坏两者之间的一个平衡,为了促进病毒生物学,许多病毒蛋白质可与宿主细胞蛋白质特异性相互作用.
了解这些相互作用可以给我们带来关于感染的知识,并为抗病毒治疗提供潜在的靶点.
一种这样的病毒就是埃博拉病毒,它对人体健康具有深远的影响,可导致病毒性出血热,病死率可达90%.
在这项研究中,研究人员探讨了受感染细胞内的哪些蛋白质对于埃博拉病毒功能至关重要,并被病毒控制以帮助感染.
其中一个他们所靶定的蛋白质被称为VP24.
这个蛋白质会破坏受感染人类细胞中的信号,并破坏人体的免疫系统和对病毒的抵御,在逃避宿主免疫反应过程中起着至关重要的作用,并可能与多个细胞蛋白质相互作用.
一旦研究小组发现了这些细胞蛋白质,他们就能够发现某些已经存在的药物,来阻断该特定蛋白质的功能.
其中一种发现的药物是乌本苷(ouabain),这种药物可用于治疗心脏病.
使用这种药物可减少治疗细胞中的病毒复制.
37抗病毒治疗利物浦大学传染和全球健康研究所的JulianHiscox教授和英国公共卫生部门的RogerHewson教授共同指导了这项研究.
Hiscox说:―这项研究表明,我们可以寻找现有的治疗方法,改换它们的治疗意图,将它们用于抗病毒治疗.
将现有的和试验性的药物用于不同的目的,可以节省大量时间,最终挽救更多生命.
‖破坏对于病毒非常重要的细胞蛋白质,也有可能解决耐药性问题.
因为细胞蛋白在进化上实际是一成不变的,随着越来越多地使用抗病毒药物对抗病毒蛋白,如流感病毒和HIV感染,病毒不能够适应击败细胞蛋白.
专业设施这项研究还包括英国布里斯托尔大学的DavidMatthews博士,研究采用PHEPorton的独特专业设施——旨在安全地研究病毒,如高封闭条件下的埃博拉病毒.
本文共同作者、PHEPorton研究负责人MilesCarroll教授说:―这一研究强调了一种已有的、被许可的人类药物的有效性,证明这种药物在治疗中是有益的.
‖http://infect.
cmt.
com.
cn/detail/587701.
html世卫组织:埃博拉病毒逾三百基因已变异世界卫生组织警告称,西非埃博拉疫情暴发导致的病毒感染总案例可能超过两万人,国际社会须要花费5亿美元来对抗这场灾难.
世卫组织此前公布了4.
9亿美元、未来9个月的战略计划,他们是根据受影响国家数目可能从目前的4个增加到10个这一预期做出规划的.
该计划提出,在受疫情严重影响的国家,3个月内要逆转病例增加和病毒蔓延的趋势;6至9个月内阻止疫情在这些国家首都、主要港口及其他地区传播.
主要措施包括推行病例诊断、管理和监测,规范丧葬及社区参与等.
对新暴发疫情的国家,该计划提出应推行紧急响应方案,确保在最初病例出现8周内阻断全部传播.
在受埃博拉影响国家的邻国及国际交通中心,要在一个月内建立完整的疫情检测准备及响应方案.
世卫组织28日发表的最新通报说,几内亚、利比里亚、塞拉利昂和尼日利亚四国,已经有3069人感染埃博拉,其中1552人死亡,这几乎是埃博拉1976年首次出现以来所有死亡人数的总和.
这个数字并没有包括刚果上周报告的13个死亡病例,因为那里的埃博拉病毒属于不同类型.
世卫组织说,实际感染的人数可能是已报告病例的2至4倍,患者总数可能超过两万人.
该机构负责紧急行动的助理总干事艾尔沃德说:―这不是西部非洲或非洲的问题,这是全球卫生安全问题.
‖埃博拉病毒发生变异与此同时,对塞拉利昂的埃博拉病毒进行基因研究发现,该病毒在人际间传播的过程中,已经发生超过300处的基因变化.
病毒的基因组变化速度快而且通常发生在蛋白编码区,其中包括影响埃博拉病毒检测准确率和治疗效果的关键区域.
多国科学家小组负责人、哈佛大学的萨贝提说:―我们发现埃博拉病毒正在发生变异.
‖研究报告合作者美国杜兰大学的加里也说,因为病毒寄生在果蝠等动物体内,其变异速度是人类的两倍.
该小组在《科学》杂志发表的报告还说,已经完成了对埃博拉病毒的基因组测序,分析显示病毒是过去10年中从中部非洲入的,引发此次疫情的病毒可能首先由动物传给人,这种动物可能是果蝠.
http://news.
chinaunix.
net/sci/2014/0830/3204243.
s38html埃博拉疫苗生产面临瓶颈随着埃博拉疫情在西非愈演愈烈,隔离感染者和追踪接触源等过去采取的遏制措施显然失效.
这就刺激了人们寄希望于生物医学措施,例如,单克隆抗体和疫苗等,以便拯救生命和放缓传播.
但随着美国总统巴拉克奥巴马要求该国对埃博拉疫情响应的升温,坚定决心和冷酷现实出现碰撞:该传染病的蔓延速度超过了药物和疫苗的生产速度.
行政官员开始与产业展开合作加速实验性药物和疫苗的制造.
―我们正试着做能让我们成规模生产的所有事情.
‖健康与人类服务部(HHS)负责准备和响应的助理部长NicoleLurie说.
但后勤障碍十分巨大,并且生产者起步过迟.
由比利时葛兰素史克公司(GSK)生产的埃博拉疫苗走得最远,已经于9月2日进入人体试验I期阶段.
GSK计划在今年年底制造1万剂疫苗——包含缝合在一个变弱的黑猩猩腺病毒上的埃博拉病毒表面蛋白.
如果符合早期试验结果,它将尽早在11月被施用于医护人员.
但要应对疫情,需要几十万剂疫苗.
―这可能需要1年半时间.
‖GSK埃博拉疫苗项目负责人RipleyBallou说.
实际上,科学方面的障碍不见得很高.
制药公司已经生产出高容量的相似疫苗,而且动物实验表明,适当的免疫反应就能相当容易地击败埃博拉病毒.
―尽管埃博拉病毒非常可怕,但你需要的仅仅是适当的中和抗体响应,你就会得到保护.
‖美国ProfectusBioSciences公司JohnEldridge说.
Ballou表示,GSK正在考虑加速生产的若干选择.
但首先该公司希望确保埃博拉疫苗拥有市场.
他提到,3月疫情暴发时,该公司就与世界卫生组织进行了接触,没有人对该疫苗表示出兴趣.
―答案是,谢谢,我们将会给你答复'.
‖目前,一种名为ZMapp的埃博拉抗体混合物在猴子试验中展现出明显的效力,由美国Mapp生物制药公司生产的该药物包含3种取自烟草植物的单克隆抗体.
HHS生物医学先进研究与开发局(BARDA)也在与其他两家能生产烟草抗体的机构进行接触.
但这些举措也只能每月生产数百支疫苗.
(张章)《中国科学报》(2014-09-18第3版国际)http://news.
sciencenet.
cn/htmlnews/2014/9/303692.
shtm灵长动物实验证实美埃博拉新药有效据新华社伦敦8月29日电英国《自然》杂志网站29日登载的一份研究报告说,在动物实验中,试验性药物ZMapp将感染埃博拉病毒的18只恒河猴全部治愈.
不过,实验中使用的毒株与当前在西非肆虐的埃博拉病毒毒株并非同一种.
加拿大公共卫生局等机构的科研人员与美国同行报告说,由于缺乏可用疫苗,感染埃博拉病毒后的治疗显得更为重要.
迄今为止的研究显示,使用单克隆抗体治疗此类病毒效果最好,目前的药物研发多集中于尝试不同抗体组合以达到更佳效果.
美国马普生物制药公司研发的ZMapp就是这类药物,它将3种单克隆抗体组合在一起抗击病毒.
研究人员发现,接受药物治疗的猴子,其症状逐渐好转,即使在感染后第五天才开始服药,其发生的出血、皮疹和肝酶升高等症状也都有明显好转并最终康复.
未接受治疗的3只猴子则在感染后第八天全部死亡.
虽然此次实验使用的毒株与引发西非埃博拉疫情的毒株并非同一种,但研究人员将这两种毒株进行直接对比后认为,ZMapp对后一种毒株的复制应同样具有抑制作用.
他们表示,此前两名美国埃博拉患者服用这种试验性药物后康复,也支持了这一判断.
http://bjrb.
bjd.
com.
cn/html/2014-08/31/content_21393295.
htm【专题】医药专利诉讼跨国药企专利药频遭仿制屡屡起诉陷国际争端各大药企专利药在印度等地少受保护官司不断,中国市场相对乐观日前,拜耳公司CEO马尔金·戴克斯(MarijnDekkers)在一次演讲中抱怨,某些政府对公司施加各种压力,迫使其降药价,而这将最近损害药品创新,该言论实际上反映了各大药企在印度和欧洲等地所遇到的困境.
戴克斯指出,现在很多政府都面临削减预算控制医疗支出的压力,而拿制药公司开刀最容易.
某些政府迫使处方药的价格一降再降的举措将会危及新药研发的商业模式,使其对各个企业来说失去吸引力,长此以往,未来将会没什么人去搞研发了.
业内人士称,在印度等地,对各大药企的知识产权毫不客气,因专利药经常在印度"沦陷",很多跨国药企巨头都为打官司而变"秋菊".
强仿、专利不批重伤制药巨头此前,印度医药部的秘书长D.
S.
Kalha曾公开表示,为了确保更多的穷人也能够买得起原本昂贵的药品,政府计划扩大医药价格的控制面,包括将专利药的首仿药物纳入价格控制的范围.
这一切如果付诸实施的话,将使欧美各个制药巨头面临更加严峻的挑战.
目前包括拜耳和诺华在内的欧美制药巨头,面对欧美市场增长乏力,同时内部研发陷入瓶颈的内外交困的情况下,以中国和印度为代表的新兴市场因其医药支出的持续快速增长成为其救命稻草.
然而印度一直让各大药企"比较烦",其原因就在于印度政府的两大杀手锏:拒绝药品注册为专利药和允许本土企业强制性仿制.
(来源:南方都市报南都网以拜耳为例,今年年初,印度专利以其药品多吉美(索拉非尼)过于昂贵为由,允许国内的制药公司NatcoPharma强行仿制(多吉美的专利保护尚未过期),付出的代价却只是支付6%的销售提成.
值得注意的是,原版多吉美每月约需平均花费4300欧元,而NatcoPharma的仿制药却只卖136欧元,仅为前者的百分之三.
拜耳曾为此提起上诉,而印度专利法庭一审驳回其上诉,根据其判决书,拜耳的多吉美价格过于昂贵,远远超出印度民众的支付能力,而且这种药物目前仅仅依靠进口,因此政府部门只能通过强制许可来保证印度民众可以享受到这种药物.
拜耳则选择继续上诉,此案甚至闹得美国政府向世界卫生组织提出控诉,就此陷入无穷无尽错综复杂的国际贸易争端中.
而另一制药巨头诺华制药的格列卫,则一直无法在印度获得专利保护.
印度当局早在2006年就以该药"没有足够的突破性的改进"为由拒绝给该药品授予专利注册,因此印度药厂就可以在该国生产并销售格列卫的仿制药,诺华没有一丝好处.
诺华公司也成了另一个"秋菊",开始无休止的诉讼,前不久还闹到印度最高法院.
罗氏的特罗凯也有类似的遭遇,据悉,特罗凯的仿制药在印度几乎可以用"泛滥"来形容,甚至还远渡重洋流入香港等地,售价大约为每颗140港币,而国内的原版特罗凯则大约为600元人民币.
但据国内专家介绍,一些病人买到的所谓"仿制药",因为不清楚渠道,故质量无法确保.
中国成新兴市场唯一亮点一位不愿具名的外企药品研发主管对南都记者表示,这些仿制药的价格虽然只有原版专利药的五分之一甚至更低,但他们并不用承担庞大的专利药研发支出,而仿制药的研发成本要低得多,再加上印度当地较为低廉的生产成本,综合这若干项因素,即使是在如此的低价之下,印度的这些药厂还是能够保证较高的利润率,而且,还有名目众多的各项政府扶持.
40另外,有业内人士对南都记者透露,目前跨国药企因为药物评价机制变化、管制强化使获批门槛大幅提高和化合物筛选成功率大幅降低等多方面,其产出效率相比上世纪90年代已经大大降低,财务报表不至于显得太难看的原因有赖于新兴市场,而新兴市场的几个大户中,印度和巴西的专利制度一直让这些巨头伤脑筋,相较而言,中国是唯一亮点.
http://finance.
sina.
com.
cn/chanjing/cyxw/20120927/121713258005.
shtml恒瑞医药:中外药企五年专利之争恒瑞获胜近日,恒瑞医药(600276)收到国家知识产权局专利复审委员会的决定书,该决定书宣告第"02147245.
9"号发明专利权全部无效,这实际上意味着法国Avengtis公司对恒瑞医药的指控不成立.
从2003年起,法国Avengtis公司就与恒瑞医药围绕该药物的化合物专利进行了旷日持久的诉讼.
一开始,Avengtis公司起诉恒瑞医药侵犯其制造路线专利,败诉后,又于去年9月起诉恒瑞医药相关产品侵犯其制剂专利.
此次判决的结果在让恒瑞医药欢喜的同时,也引起了业内人士的关注.
一些分析人士指出,随着国内制药企业的发展壮大,在逐步走向国际化的过程中,与国际厂商在市场领域的摩擦越来越多,更折射出若干值得深思的问题和值得总结的经验.
中金公司研究员孙亮指出,专利诉讼是仿创到创新过程中必然要应对的问题.
在国外,研发型药厂和通用名药厂之间经常进行专利诉讼事件,国内医药企业在新专利法实施和加入WTO后,需要面对的专利纠纷会越来越多.
企业一方面需要积极研究海外的专利法规,在仿制过程中保护好自身,另外一方面需要不断创新,走自主知识产权道路.
申银万国研究员罗鶄认为,此次多西他赛组合物专利被国家知识产权局判无效,不仅意味着恒瑞医药在多西他赛侵犯事件上取得了绝对性胜利,也对国内企业意义较为重大,表明国内制药企业在和跨国制药企业的知识产权争端中,正在积累宝贵经验和应对策略.
据悉,多西他赛是目前全球销售额居首的化学控肿瘤药,也是恒瑞医药的第一大品牌,今年一季度销售近1.
5亿元.
由于事关多西他赛在中国市场主导权以及由此带来的丰厚利润,法国Avantis公司不大可能就此放弃,很有可能向北京第一中级人民法院起诉.
业内人士认为,即便是再度起诉,Aventis获胜的机会也比较渺茫.
或许,专利诉讼只是恒瑞医药发展过程中的小插曲.
年报显示,恒瑞医药2008年将成立专门的专利部门,充实人员,包括及时申请专利,合理延长专利时间;同时,积极跟踪专利,避免侵权等.
http://www.
p5w.
net/stock/news/gsxw/200805/t1647816.
htm受困专利日益明显国内药企需提高知识产权意识近几年,随着我国知识产权制度建设进一步完善,民间知识产权意识日渐增强,中外企业间发生了一系列知识产权诉讼案.
在这些诉讼案的背后,国内知识产权保护方面的软肋暴露无遗.
知识产权日趋成为国内医药企业心中说不出的痛,并制约其发展.
"知识产权诉讼案爆发是知识经济时代的必然现象,是这个时代最典型的外化表现.
这表明企业不仅要自主创新,更要构建完整的知识产权保护战略,增强核心竞争力.
"东南大学卫生法学研究所所长张赞宁、北京市鑫诺律师事务所律师李仁兵不约而同地表示.
近年来,国内企业受困于药品专利的情况日41益明显.
唐传生物科技发展公司总裁萧忠明表示,以L-阿拉伯糖药用专利被日本企业抢先在中国注册为例,尽管日本企业健康食品领域的专利申请没被批准,但其有药用专利在手,国内糖醇企业同样很被动,"而日本企业以专利规则为攻击之矛,独占市场".
据了解,还有一个重要原因要求我国完善知识产权建设:新药研发成本高、风险大,如不进行有效的知识产权保护,耗费巨大成本研制出来的新药就会被他人任意仿制.
"知识产权制度赋予了新药研发者在一定时间内独占市场的专权,并获得丰厚的回报,从而促使其继续投入到新的研发活动中.
"李仁兵表示,知识产权保护是药企创新的保障.
萧忠明认为,知识产权保护制度对新药研发具有巨大的促进作用,同时可避免前期投入的无端浪费,为后续研发提供资金,形成良性发展的科研体系.
近年来,国内医药企业频繁遭遇知识产权纠纷,表层原因是研发基础不强,是模仿路线带来的隐患,深层原因却是国内企业对知识产权制度的认识不足.
分析人士指出,L-阿拉伯糖药品专利案折射出我国知识产权建设的种种弊端.
"依当前实际,企业应痛定思痛,加深对知识产权问题的理解和认识,提升对知识产权规则的驾驭能力,并结合企业实际制定适合自己的知识产权策略.
"中国医保商会法律部主任官宁云指出.
国家知识产权局的统计数据显示,截至今年3月16日,我国受理的专利申请总量达500.
2143万件,其中发明专利申请为168.
1464万件.
"从数字看很繁荣,说明我国企业的知识产权意识在提高.
"李仁兵表示,希望企业从长远战略出发,在知识产权方面谋求一席之地,应避免贪多求全和重数量轻质量.
我国医药企业生产的产品大部分是仿制品种,拥有自主知识产权的品种凤毛麟角,而且短时间内难以形成自己的核心知识产权.
在此情况下,我国医药企业应该如何应对萧忠明认为,国外企业运用知识产权的意识和能力比较高,我们应虚心学习、消化、吸收、创新,尊重知识产权,提高自主创新能力,增加在涉外知识产权纠纷中谈判、应诉的砝码.
另外,要提高对知识产权制度的认识、运用能力,警惕国外部分企业的知识产权滥诉行为,避免落入陷阱中.
我国新修订的《专利法》将于10月1日实施,《专利法实施条例修订草案》已上报国务院审议.
专家表示,"知识产权保护网越织越密,意味着我国知识产权的法律保障性更强、更规范.
"李仁兵认为,知识产权是评价创新是否成功的一个标准.
企业需构建强大的知识产权工作结构和体系,聘请知识产权法律顾问或专家,普及知识产权教育,提高知识产权意识,设立知识产权专员,构建企业知识产权战略,研发阶段的知识产权如符合申请专利条件应当及时申请.
与此同时,"可以针对国外医药企业已经申请专利权保护的新药品种进行应用性开发,对开发成果申请专利,以形成对其核心专利的合围之势,从而谋求与核心专利的专利权人的交叉许可.
"张赞宁表示.
http://www.
chinahightech.
com/views_news.
aspNewsid=738363239333突破专利壁垒科伦药业势逼跨国药企科伦药业董事长刘革新表示,如果不能突破专利壁垒,创新就没有路可走,突破专利壁垒是中国企业必须走出的一条生路上个月,科伦药业与大冢制药专利纠纷案由山东省高院终审判决科伦胜诉.
科伦药业董事长刘革新向《第一财经日报》表示:"这个回合的较量代表一个趋势:在输液的高端材料和输液的高端制造上,中国第一方阵的企业正在逼近他们的核心技术区和核心市场区.
"而这一结果得益于科伦创新战略的实施和一直以来的专利布局,也影响着未来市场的趋势.
刘革新表示,"如果不能突破专利壁垒,创新就没有路可走,突破专利壁垒是中国企业必须走出的一条生路,专利体系的建立,专利人才的培养,专利技术的保护,都是必须要做的.
"42胜诉大冢制药科伦与大冢制药的专利纠纷是围绕塑料小水针展开的.
中国大冢制药有限公司认为湖北科伦"聚丙塑料安瓿小水针"产品侵犯大冢制药"新型塑料注射安瓿"实用新型专利权.
青岛中院一审判定科伦胜诉,大冢不服遂上诉到山东高院.
科伦药业药物研究院副院长王利春表示,科伦药业聚丙烯塑料安瓿产品2009年2月立项,2010年12月份国内首家获得聚丙烯塑料安瓿药包材注册批件,并于2011年12月开始陆续获得了药品的补充申请批件,2012年8月通过了GMP认证.
王利春介绍说,去年6月,科伦的"聚丙塑料安瓿小水针"产品在青岛举办的第47届全国新特药品交易会上进行展销时,大冢制药看到了这个产品,然后就在当年9月向青岛中院提起诉讼.
"两者在生产技术和外观上相似,但是,在材料上,他们是聚乙烯,不能经受终端灭菌,我们是聚丙烯.
需要明确的是:专利纠纷是以原告所拥有有效专利中权利要求书中保护范围为准,而不是仅仅以外观相似作为侵权依据.
如,大冢制药本次'新型塑料注射安瓿'(ZL200520025420.
1)专利的权利要求中明确要求其技术特征为'新型塑料注射安瓿,其特征是瓶体、顶盖两部分热封合构成,瓶体上部形成锥形台,锥形台上部形成与顶盖上的瓶颈直颈相配合,相当于瓶颈高度三分之一的瓶颈'.
大冢制药专利公开的技术表明,其是采用瓶体、顶盖两部分热封合而成的分体成型工艺,与我公司采用一步成型的吹—灌—封三合一技术有明显区别.
他们的专利书明确的技术特征,我们都完全不一样.
"王利春表示.
对于此次专利纠纷,科伦认为其背后主要是市场利益的驱使,对于科伦来说,也是一场事关市场生存的竞争.
王利春表示,如果我们不能胜诉,就要等到大冢制药的专利2015年到期后才能上市,延缓科伦产品的上市进程.
科伦药业副总经理刘思川表示,塑料小水针以前是大冢独家销售,因此产品议价能力上比较强,现在科伦进来之后会形成一个竞争,会对产品的议价产生冲击,而且会随各省招标逐步展开,大冢在综合成本上高于国内企业,科伦会在各个省的招标中逐步去替代他们的产品.
因此,"意识到科伦药业即将推入市场的聚丙烯塑料安瓿小水针产品将会威胁其国内市场地位,大冢意图继续维持其国内独家高价垄断局面,以提起专利侵权诉讼的手段,阻碍湖北科伦塑料安瓿小水针产品的成功上市.
"王利春表示.
而对于获得胜诉的科伦,这一产品也展示出巨大的市场潜力.
刘思川表示,"我们产品今年6月上市,产值达到3500万元,明年还有两台设备到,随着各省招标的进程,我们将逐步替代.
之前大冢的一年产量大概是1亿多支,主要针对北上广的核心医院.
在其他地区没有做推广,对于我们全国布点的企业是非常好的机会.
"刘革新表示,国内企业的创新最重要的是政策接口和市场接口,在创新过程中,寻求市场话语权和市场竞争能力是我们专利路线的核心思想,不是为了一个证书,而是取得实实在在的市场竞争力,这是发明专利的根本原因和动力.
突破专利壁垒与大冢制药的专利纠纷将不会是一个孤例.
比如,科伦正在发展双室袋、三室袋输液产品,这也是大冢制药的先发领域.
刘革新表示,我们的技术差距在缩小,塑料小水针不仅赢了,而且赢得很光彩,如果双室袋、三室袋继续发生这样的事情,我们已经很有储备,很有底气,很有方案.
科伦药业总经理程志鹏表示,科伦的双室袋、三室袋输液产品已申请发明专利20项、实用新型专利31项、外观设计专利9项,其中发明专利已授权3项,实用新型已授权26项,外观设计9项,已形成强有力的专利组合,已储备好专利武器,应对其他企业以争夺市场为目的而挑起的恶意专利纠纷.
43科伦药业事业发展部总经理郭晓英还介绍说,"双室袋和三室袋输液产品已经列入国家十二五科技支撑计划项目,这个项目科伦也在承担过程当中,也为我们下一步产品上市的科技创新做了很好的铺垫.
"实际上,"大输液行业的整合,未来市场竞争必将从规模、价格的竞争转变为技术、创新的竞争,而主要企业之间的专利之争也会变得更加频繁.
科伦药业不会满足于简单的模仿,而是在现有技术的基础上进行创新,做出符合企业特色的产品,既避开了其他企业的专利保护,又能形成自主知识产权.
"程志鹏表示.
不仅如此,刘革新表示,"你要有创新能力就必须在专利领域进行突破,在事关重大商业前途的领域当中,(国外企业)普遍设置了重重专利壁垒.
"为了突破国外企业的专利封锁,科伦以创新驱动战略为企业根基,一直以来进行专利布局.
科伦药业在2006年就以1号文件颁布了《专利管理办法》(试行),并在2010年修订为《知识产权管理办法》,从专利的申请、奖励、实施许可及转让等都做了详细规定,成立了知识产权管理委员会进行全方位的知识产权管理,鼓励全员创新,极大地提高了技术创新和专利保护水平.
科伦药业的项目从立项开始就建立涵盖研发、生产、设备等强有力的知识产权管理团队,该团队将对项目的专利情况进行全面分析,首先查阅已有的专利技术,在此基础上进行创新,构建从核心到外围的专利保护体系.
迄今为止,科伦药业已申请专利1296项,其中发明专利222项,获得授权的发明专利110项.
2013年6月,由国家商务部、知识产权局、证监会联合组成的中国知识产权指数报告课题组,发布了《中国医药行业上市公司知识产权报告》.
报告显示:2013年,在76家(医药行业样本企业)A股上市公司中,科伦药业的专利申请数量和专利授权数量均排名第一.
刘革新表示,创新就要有新的接口,企业家的能力体现在创新能力上,创新能力很大程度体现在专利的数量、质量和有效性.
科伦通过可立袋全球最先进技术的研发,在递延性产品,在一浪接一浪承继性技术浪潮中,一直处于领先的地位,这就决定了在将来新型和安全的包装、对国外产品的替代方面可以大有作为.
而科伦的专利战略是,"国外企业我们定位为追赶.
从整体上来讲,无论是创新能力、制造业水平,还是工业化经验的积累,中国企业还存在着明显的差距,所以我们对外资企业要追赶,但是在以可立袋为核心的先发领域要超越.
一般领域要追赶,优势和先发领域要超越.
"当然,刘革新表示,科伦的专利战略有进攻,也有防御.
"在我们先发优势领域,我们形成什么样的能力和拥有的专利,对那些既不能追赶日本,又想模仿我们的企业发出清晰的信号——以前靠买了设备就能做的时代已经过去了.
中国企业并不畏惧外资企业,在我们曾经较量过的16年中,主要的压力不是来自外资企业,他们不会因产能过剩导致去产能化的恶性竞争.
"http://www.
yicai.
com/news/2013/10/3062434.
html仿制药存在价格优势药企专利门问题待解一边是面临"过气"的主角迟迟不肯下场,一边是风头强劲的配角跃跃欲试,急于登场.
在全球各大制药巨头专利药普遍面临专利到期的情况下,愈演愈烈的"专利门"主角专利药与配角仿制药之间的冲突不断.
继辉瑞花费重金以延长其重磅药物立普妥的专利保护期后,英国医药公司阿斯利康也正努力保卫公司"重量级"药品—非典型抗精神病药物思瑞康(Seroquel)的专利权.
与辉瑞一样,阿斯利康面对的仿制药企业也并非一些散兵游勇,而是两家颇具规模和实力的企业-瑞士山德士和以色列泰华公司(TEVA),前者是瑞士制药巨头诺华制药公司旗下的非专44利药公司,后者则是世界上最大的非专利药制造商.
专利药暂胜解"近忧"7月2日,阿斯利康全球官方网站上的一则公告,牵出了该公司与仿制药巨头诺华山德士与以色列泰华公司之间有关思瑞康专利权的恩怨纠葛.
阿斯利康称,该公司在与诺华制药就该公司非典型抗精神病药物思瑞康在美专利权保护战中赢得了一个回合:新泽西一家联邦法庭裁定,阿斯利康与诺华制药专利权官司没有继续审理的必要.
除了诺华山德士之外,这一案件同时还涉及了另外一家仿制药巨头—以色列泰华公司.
诺华与泰华一直觊觎思瑞康仿制药的生产销售权,法庭的此次裁定无疑阻住了两者迈入这一市场的脚步.
诺华和泰华对该判决表示不服,并指控阿斯利康是通过不正当手段才获得了思瑞康的专利权.
7月4日,阿斯利康中国相关负责人否定了诺华与泰华的指控,并称"美国法庭对此案的判决已经说明了问题".
受到三家制药公司如此垂青的思瑞康自然不是"等闲之辈".
7月4日,阿斯利康上述负责人表示,思瑞康是阿斯利康的畅销药物之一,也是全球最为畅销的抗精神病药物之一.
阿斯利康公开年报显示,2007年,思瑞康销售收入达到40亿美元左右.
"和所有的专利药拥有者一样,阿斯利康努力保护思瑞康的专利权,正是为了仿制药挡在市场之外,好独享市场份额".
7月3日,医药新闻网执行主编张祥表示,一旦仿制药被允许上市,很多专利药的市场份额将会遭到削减.
尽管阿斯利康努力捍卫思瑞康的专利权,但是"重磅炸弹"类药物向来是仿制的重点,思瑞康自然也不例外.
事实上,觊觎思瑞康仿制药的不仅仅只有诺华山德士和泰华公司.
早在2007年,阿斯利康就曾针对芬兰orion公司在芬兰市场生产销售思瑞康的仿制药,而起诉该公司.
市场决定两者必将并存对于遭遇诉讼,山德士和泰华早已司空见惯.
近年来,两者在不断扩大仿制药版图的同时,也与专利药生产企业纠纷不断.
2006年,法国制药公司赛诺菲安万特针对山德士对该公司抗凝血药物依诺肝纳素在美国专利的侵犯,起诉诺华;2007年,赛诺菲安万特在美国再次起诉诺华.
赛诺菲安万特认为诺华旗下山德士公司试图仿制其抗癌症药物乐沙定.
除此之外,诺华山德士还曾遭到惠氏等制药公司的起诉,起因皆为山德士相关仿制药物侵犯了专利药企业的相关产品专利权.
对于仿制药业务一再遭遇的"专利门"事件,7月3日,山德士制药中国有限公司相关负责人称,很多专利权纠纷都是发生在美国,不便给予回应.
事实上,早在2007年1月,山德士就在中国开展业务.
山德士在中国的主要产品包括善宁(奥曲肽)、善龙(奥曲肽)等仿制药.
除了山德士外,以色列泰华公司也将触角伸至中国,与中国企业合作推出仿制药物.
"仿制药与专利药的冲突与并存将长期存在",7月4日,中国医药企业管理协会一位专业人士表示,由于仿制药的价格相比专利药有大幅下降,因此有很大市场空间,如何处理好与仿制药的关系,是各大制药巨头需要面对的一个难题.
专利到期"远虑"难解思瑞康官司暂胜一局,并不意味着阿斯利康已获得持久性的胜利.
目前,诺华与以色列泰华公司皆表示将会对这一裁决提起上诉.
更为严重的是,思瑞康将在2011年专利到期,届时将无法把仿制药挡在市场之外.
诺华公司公开的2007年年报显示,旗下山45德士2007年全球销售额达72亿美元.
今年年初,诺华中国区总裁李振福表示,诺华看好山德士的业务发展,并将增加在此方面的投入.
事实上,仿制药巨头并非只做简单的仿制药业务.
目前全球大型仿制药企业都开发了专利品牌药,并利用专利品牌药来带动企业自身的品牌建设.
以色列泰华公司除了在舒降之、普拉固、左洛复这3个数十亿美元销售额产品的仿制竞赛中拔得头筹外,还宣布了2009年至2015年之间在美国递交15个新产品的上市计划,这些新产品可能是新药,或是老药新用以及产品剂量剂型的变更.
同样,山德士制药中国相关负责人也表示,山德士主要经营是品牌仿制药.
仿制药正试图从品牌和价格方面入手,不断扩大版图.
7月4日,阿斯利康中国相关负责人也坦诚,原研药和仿制药并存是一个不会被改变的客观存在的事实.
但在专利保护到期之前,阿斯利康方面称,将会对知识产权的保护不遗余力.
http://health.
sohu.
com/20080709/n258035594.
shtml中国抗体药如何抵御专利战全国每6分钟就有1人被确诊为癌症,每天有8550人成为癌症患者,每7至8个人中就有1人死于癌症看过这组数据,你是不是也会觉得胆战心惊然而,在抗肿瘤效果比较有效的抗体药物的研发方面,我国企业并不占优势.
记者在采访中了解到,由于研发起步较晚、基础薄弱,我国抗体药物研发企业存在创新能力不足、大规模培养技术相对落后、制剂水平有待提高等问题.
虽然还没有企业或研发机构在抗体药物技术研发方面形成垄断,但是对于一些核心关键技术,国外医药巨头早已布下了严密的专利网,我国企业提交的专利申请数量较少,绝大多数在临床研究或已经上市的抗体药物品种是仿制品或仿制改进品,在进入国际市场时,仍然存在潜在专利侵权风险.
面对激烈的竞争和国际医药巨头严密的攻防,我国医药企业应如何应对如何才能在四起的"烽烟"中谋得一席之地,并打造出中国抗体药物领域的超级"巨无霸"业内专家建言,在研发策略方面,持续的资金投入必不可少,同时应利用相对成熟的抗体筛选技术针对已知靶点进行新型抗体筛选,并提交专利申请以加强"专利圈地".
在预防和应对专利诉讼方面,国内企业应攻防结合,积极提交专利申请,并不断增强应诉能力.
国内药企夹缝求生随着生物技术的迅猛发展,生物医药正成为潜力无限的朝阳产业,而抗体药物则是其中发展最快的领域之一.
由于可以用来治疗恶性肿瘤、感染、免疫或过敏性疾病、血液或细胞外液疾病等重大病症,抗体药物受到了世界各国的关注,技术发展非常迅速,专利申请量也快速增长.
但这些专利申请却主要集中于美国、日本等发达国家.
国家知识产权局于2013年发布了《抗体药物产业专利分析报告》(下称《报告》).
该《报告》由国家知识产权局专利局审查业务管理部组织,国家知识产权局专利局医药生物发明审查部和专利审查协作北京中心医药生物发明审查部(下称北京中心医药部)负责实施.
该课题组副组长、北京中心医药部主任马秋娟告诉中国知识产权报记者,截至2013年7月5日,全球涉及抗体药物技术的专利申请共计6.
6295万项,其中美国的专利申请为3.
9536万项,占全球专利申请总量的一半还多,遥遥领先于其它国家;其次是日本和欧洲,分别为8663项和4043项;中国排名第四,为3846项,与美国、日本等国家相比差距较大.
而在抗体药物领域的中国专利申请中,国外来华申请约占60%,国内申请仅占40%.
在抗体药物研制的关键技术领域,我国企业也不具有优势.
以单克隆抗体药物为例,靶标筛选是单克隆抗体药物研制的关键技术之一.
目前,抗体药物研发的热点靶标主要有CD20、EGFR、Her2和VEGF等,但这些靶标的国外来华专利申请所占的比例均超过国内申请,其中用于治疗恶性肿瘤等疾病的CD20抗体的国外来华申请46占国内该领域专利申请的比例更是高达80%,其余来华申请的比例也都超过了60%.
据悉,由于有价值的抗原靶点几乎已经被国外知名企业瓜分完毕,而筛选新的靶点又需要较大的资金投入和完成大量的实验,且掌握核心技术的公司还依靠外围专利进一步"跑马圈地",在这种情况下,国内抗体药物产业要想形成一定规模可以说是困难重重,大多数国内相关企业只能在夹缝中求生.
"国外药企在抗体药物热点技术领域的专利布局更为成熟,也更为庞大,国内企业的专利申请空间被明显压缩.
在我国提交专利申请名列前茅的都是国际知名医药企业,这些专利申请对我国企业相关产品的影响不容小觑.
"马秋娟表示.
国际巨头攻防严密由于生物医药行业具有高风险、高投入、高收益的特点,一项好的创新药从研发到上市可能需要数十亿美元.
在国际竞争日益激烈的背景下,专利无疑是最有效的保护研发成果的方式,而专利战则是争夺市场、遏制竞争对手的有力武器.
"目前,国际医药巨头都身怀'绝招',采取各种策略和手段将专利诉讼发展为商业竞争的重要武器.
"马秋娟告诉中国知识产权报记者,跨国巨头比较常用的"绝招"有3种,一是重视专利申请策略,进行组合专利申请;二是在对方专利权即将到期时提前进行药物临床试验和申报注册以抢占先机;三是以专利侵权诉讼为幌子,打击对手并独占市场.
不仅如此,在国际市场投资时,跨国巨头非常擅长结合专利部署,熟悉并灵活运用多种专利防御和专利攻击技巧,以获得尽可能多的市场份额和经济收益.
作为"后来者"、处于跟随阶段的我国医药企业,也深切感觉到了国外医药巨头的专利包围圈透出的越来越重的"杀气".
"国外医药巨头已熟稔专利制度,抗体药物专利申请已由单个专利逐步发展为组合专利,抗体药专利申请除了靶点、序列、生产工艺、用途、联合用药外,化学制药领域的晶型、蛋白质领域通用的制剂及纯化工艺等都被跨国企业列入抗体药物的专利保护范围,专利申请细致到无孔不入.
而这些专利组合,可能将竞争对手的一系列产品阻挡在市场之外,造成市场垄断.
"上海中信国健药业股份有限公司(下称中信国健)知识产权总监李彩辉在接受中国知识产权报记者采访时表示.
中信国健是我国抗体药专利申请量排名前十的申请人中的唯一一家企业,目前已提交了100多件专利申请.
"我们已有意识地针对抗体药研发热点和预期的产品方向进行了专利储备,并且也在密切关注国外竞争对手的专利动向,尽可能地采取一些应对措施,例如通过提出专利无效宣告请求和第三人意见介入专利申请的审查,但仍然感觉力量薄弱.
"李彩辉表示.
现实也许还要更加严峻.
我国企业针对抗体药物的研发起步晚,企业规模总体较小,国际竞争力弱,不少处于发展初期的中小企业发展艰难.
因此,如何在全球化的进程中避开竞争对手的专利"狙击",合理有效地构建自己的专利防御体系,成为我国药企面临的重要问题.
加强"武装"合纵连横面对抗体药物领域"西强我弱"的态势,我国医药企业如何才能在国际竞争中谋得自己的一席之地"一方面,国家相关职能部门需要加大对于重大新药创制项目的政策支持,为抗体药产业发展提供保障,另一方面,国内企业自身需要加强研发与投入,进而逐步构建自己的专利保护网.
"马秋娟介绍,在研发方面,国内企业目前采取的主要是跟随和模仿策略,虽然有风险,但仍然大有可为.
在研发战略方面,持续的研发投入必不可少.
鉴于国内研发状况以及与国际知名药企的差距,建议国内企业集中优势资源,以中下游产品为研发重点,例如对现有专利抗体药物或已过专利保护期的抗体药物进行下游研发等.
而对于寻找新药靶点等基础性研究,则应慎重,应在研发前充分了解国内研发和专利现状.
在企业自身加强研发的同时,合纵连横也非47常重要.
"由于目前我国高校和科研院所在抗体药物领域提交的专利申请较多,企业在实际生产阶段有优势,而大规模生产及制剂生产正是影响我国抗体药物产业进一步发展的瓶颈,因此,若能加强产学研结合,由相关企业、科研院所共同参与构建产业联盟,发挥各自的人才优势,实现部分资源共享,将有助于国内抗体药物产业发展.
"李彩辉表示.
另一个不可回避的现实是,虽然我国抗体药物研发和产业化进程仍然处于初级发展阶段,拥有自主知识产权的抗体药物不多,但随着我国制药行业的不断发展,与跨国巨头竞争、应对专利诉讼将是国内药企必须要面对的问题.
"认真研究抗体药领域典型诉讼案例,学习跨国巨头应对专利诉讼的经验,提高专利制度应用能力,同时改进专利申请策略,促进专利实施,提升专利应诉能力,都是国内医药企业需要加强的必修课.
"马秋娟表示.
(知识产权报记者吴艳)http://www.
sipo.
gov.
cn/mtjj/2014/201406/t20140604_960141.
html一起专利诉讼引发的思考日前,江苏恒瑞医药股份有限公司发布公告表示,其与全球第三大制药企业——法国赛诺菲安万特关于抗肿瘤药物"艾素(多西他赛)"的专利纠纷有了最新进展,国家知识产权局专利复审委员会一纸文书宣告赛诺菲的原研产品"泰索帝"专利全部无效.
从2003年起,法国赛诺菲安万特公司就与恒瑞医药围绕"艾素(多西他赛)"的化合物专利进行了旷日持久的诉讼.
一开始,法国赛诺菲安万特公司起诉恒瑞医药侵犯其制造路线专利,败诉后,又于2007年9月起诉恒瑞医药相关产品侵犯其制剂专利.
国家知识产权局的判决宣告"泰索帝"发明专利权全部无效,这实际上意味着法国赛诺菲安万特公司对恒瑞医药的指控不成立,恒瑞医药未来胜诉可期.
事实上,由于我国的仿制药产品已经越来越"威胁"到跨国企业原研产品在中国市场的占有率,类似的专利纠纷似乎总是没完没了.
此前,关于辉瑞"万艾可"的各项专利案件已经持续了多年,而葛兰素史克在"拉米夫定"国内专利保护已到期的前提下,仍然以拥有"核心方法的专利"为由,限制国内企业仿制.
任何专利都有保护期.
中国发明专利的保护期限为20年,实用新颖专利和外观设计专利的保护期限为10年.
保护期限过后专利失效,成为一种免费共享的社会公共资源.
而美国汤姆森科技信息集团仿制药与原料药情报部门近期公布的一份报告称,2008~2012年,一些药品的专利保护期将届满,这将给仿制药品制造商带来近460亿美元的销售市场,而仿制药品的市场销售规模亦有望由2008年的440.
8亿美元提升到2012年547亿.
事实上,目前国内医药产业由原料药向制剂、由仿制向原创转型的呼声越来越高,一些企业也已开始加大制剂生产力度.
但是由于科研能力薄弱,国内市场上的药品有97%以上属于仿制药.
中国企业往往通过仿制过期的专利药品,并凭借成本优势与专利药开展竞争.
原科技部长徐冠华曾说,中国知识产权工作近年来取得了长足进步,同时也面临着日益严峻的挑战.
特别是中国在加入WTO以后,随着关税壁垒日渐消失,一些跨国公司纷纷在中国大量申请专利,众多产业核心技术掌握在别人手里,形势非常严峻.
政府将以掌握新技术知识产权为目标,对重要产业领域的创新活动进行统一部署,建立科技创新活动的知识产权导向和激励机制,以及加强知识产权的宣传和培训,提高企业、科研机构、高等院校的知识产权能力等,推进创新型国家的创建.
所以,医药企业在新专利法实施和国家加入WTO后的大环境下,今后的专利诉讼案可能会越来越多,要有效避开专利纠纷,首先要保证自己的仿制行为合法.
其次,要积极研究海外的专利法规,努力寻求对自身有利的法律环境,运用相关法律保护自己的仿制行为.
再次,要不断创新,走自主知识产权道路,成立专门的专利部门,充实人员,包括及时申请专利,合理延长专利时间,积极跟踪专利,避免侵权等.
48医药企业今后的专利诉讼案可能会越来越多,要有效避开专利纠纷,首先要保证自己的仿制行为合法.
其次,要积极研究海外的专利法规,运用相关法律保护自己的仿制行为.
http://news.
bioon.
com/article/6286689.
html中国药企难治专利诉讼"心病"美国辉瑞、武田药品与以色列泰华仿制药公司、印度太阳制药公司之间关于潘妥洛克(泮托拉唑肠溶片)旷日持久的专利侵权纠纷终于有了结果.
自此,这场持续近十年的专利诉讼最终以泰华和太阳制药两个仿制药厂向辉瑞、武田付赔偿金而告终.
事件起源于泰华和太阳制药在2008年在美国推出潘妥洛克的仿制药,而潘妥洛克的活性成分泮托拉唑专利到2011年1月才到期,而该专利的专利权属于武田制药,辉瑞是该药在美国的独家销售商.
新泽西州联邦法院陪审团日前裁定,辉瑞和其合作伙伴武田药品工业分别获得64%和36%的赔偿金,泰华和太阳分别支付16亿美元及5.
5亿美元的赔偿金,同时这两家公司必须承认他们推出的潘妥洛克仿制药侵犯了辉瑞及武田的合法权益.
专利交叉授权复杂记者了解获悉,泮托拉唑是一类抗酸及抗溃疡药物,与其他抗菌药物如克拉霉素、阿莫西林和甲硝唑等用于根除幽门螺杆菌感染,治疗十二指肠溃疡,胃溃疡,中、重度反流性食管炎等疾病.
根据公开数据显示,潘妥洛克2007年在美国销售收入达到19亿美元,然而2008年其销售下跌至8亿美元,而这一年恰好就是泰华和太阳制药仿制版的潘妥洛克开始上市的时间.
据此,辉瑞和武田认为,泰华和太阳制药的仿制行为极大地损害了其利益.
有不愿具名的某美资律所合伙人对南都记者表示,此案的难点主要在其专利的交叉授权比较多,该药在多个国家的授权方都不一样.
然而,以辉瑞这种跨国制药巨头的法务资源,这种官司的赢面较大.
中国企业很受伤专利诉讼一直是跨国药企的常用武器,在中国屡见不鲜.
多位业内人士均对南都记者透露,我国医药产品研发能力低,大部分医药公司均是生产或外包国外已过专利保护期的药物,很多药企面临侵权风险,而且由于制度以及企业本身的能力问题,有时候即使本土企业胜诉,"也落不着好".
之前2011年,礼来和豪森制药关于奥氮平的诉讼,虽然以豪森制药胜诉而告终,但豪森却高兴不起来.
当时该企业有关人士曾表示,"因为礼来的一纸禁令,公司停止生产和销售奥氮平原料药和片剂,被扣押相关的报批文件及样品,以及先期数百万元的研发投入和上千万元用于扩建厂房、新增设备等支出没了着落.
虽然最终胜诉,禁令措施解除,但公司推出产品上市的时间却耽误了3年,丧失了产品占领市场的最佳时机.
尽管礼来公司在申请诉前禁令时提供的担保全部赔偿,但远不足以弥补我们的损失.
更为严重的是,因为官司在身,公司的上市计划被无限期推迟,企业长远发展受到极大影响.
"中国强仿企业乏善可陈各国一直都非常鼓励仿制药的生产和制造,即使是美国FDA,只要仿制药厂商能够提出针对性的技术或数据材料,注册往往都能获得通过.
在印度,政府甚至鼓励本土企业在专利期内就强行仿制跨国医药巨头的专利药,印度最高法院前不久驳回瑞士制药企业诺华公司关联癌症药品格列卫的专利诉讼.
判决支持者认定,这一判决保障发展中国家民众获得平价药品的权益.
这是印度"强仿"对峙欧美原研药的一次巨大胜利.
但值得注意的是,中国经修订的《专利实施强制许可办法》(以下简称《办法》)从2012年5月1日起已实施一年多,但一直没有本土企业提出"强仿"要求.
有企业人士表示,即便允许仿49制,在某些高端专利药领域,国内药企仍力有不逮.
目前中国"强仿"厂家中,恒瑞医药是为数不多取得成功的公司之一,其生产的奥沙利铂和多西他赛就属于强行仿制的典型案例.
但该公司之前也经历了近10年的诉讼拉锯.
除恒瑞之外,首仿药厂家多多少少都曾受到原研厂家各种形式的诉讼或针对性的协议要求.
从全球首仿药与原研药专利博弈来看,出于保护公司产品市场独享权的目的,原研厂家通常会通过不断注册相关专利以抬高进入壁垒.
而一旦出现仿制品申请或者上市,专利诉讼则成为其延长市场保护的策略.
北方某不愿具名的药企总经理对南都记者透露,其实在辉瑞的"立普妥"和"万艾可"刚上市时,由于专利方面存在一些可以规避的地方,他们曾考虑过抢先仿制,并且有初步的方案.
但之后发现,即使除却法律方面的障碍,做首仿药物按照规定走完整个审批试验流程,到最终成功上市,所耗费的资源也不菲.
http://epaper.
oeeee.
com/D/html/2013-06/20/content_1878331.
htm盘点跨国药企在印度遭遇的滑铁卢最近,全球制药巨头之一的吉列德科宣布将在印度以900美元/疗程的价格销售Sovaldi,消息一经传出,立刻在业界炸开了锅,须知Sovaldi在美国的定价为1000美元/片,合计84000美元/疗程,印度市场折扣高达99%.
吉列德官方表示,Sovaldi产品根据一个国家的人均收入和丙型肝炎发病率两个因素进行定价,2009-2013年印度的人均收入仅为1499美元,而美国的人均收入为53143美元,因而印度定价低.
但事实真如此简单吗吉列德这一做法或与印度的药品专利法律密切相关:在2005年以前,印度政府并不承认西方国家药品专利,直至2005年作为与世界贸易组织达成协议的一部分,印度才开始恢复药品专利,但只对1995年以后发明的新药或经改进后能大幅度提高疗效的药物提供专利保护,而不支持原有药物混合或衍生药物专利;同时,印度政府可根据需要实施"强制许可".
历史上被印度政府实施"强制许可"的案例不在少数,吉列德亦不例外,其自主研发的艾滋病治疗药品泰诺福韦(Tenofovir)于2009年被印度政府撤销了专利保护,这或许才是真正威慑吉列德廉价出售Sovaldi的原因.
除吉列德外,其余还有哪些跨国药企在印度遭遇过滑铁卢呢拜尔(Bayer)2012年,印度政府给Natco制药公司颁布药物专利强制需求证书,允许其生产德国拜耳公司专利抗癌药Nexavar(多吉美),这是一种治疗肾癌的药.
Natco公司在其申请中称,这种专利药使得患者一个月需花费五千多美元,远高于大部分印度人的经济承受能力.
罗氏(Roche)罗氏在印度有多个重磅产品折戟沉沙,包括乳腺癌治疗领域的重磅产品——赫赛汀(Herceptin).
2013年印度专利局驳回罗氏赫赛汀药物的专利申请,此后不久,罗氏正式宣布出于对印度知识产权环境总体的考虑,不再寻求赫赛汀在印度的专利申请.
在此前的2012年,印度法院还曾驳回罗氏针对印度西普拉(Cipla)制药公司Erlocip产品侵犯其抗肿瘤药物——Tarceva专利提起的专利侵权诉讼,理由是这两种药物的成本相差太大,出于公共利益,法院拒绝罗氏的上诉.
诺华(Novartis)诺华在印度最为出名的案例当属癌症治疗的革命性药物——格列卫(Glivec),该产品可定向抑制相关癌细胞的增值并诱导其凋零,年销售额达数十亿美元之巨.
自2006年以来,诺华一直努力为改进后的格列卫争取印度专利,但最50终被印度最高法院驳回.
辉瑞(Pfizer)2012年,印度专利局撤销辉瑞抗癌药索坦(Sutent/舒尼替尼)在该国的专利,印度专利局称:Sutent专利中所声明的发明,不涉及任何发明步骤,因此不能被授予专利.
百时美施贵宝(BMS)2013年1月,印度专利局启动新一轮强制许可签发程序,百时美施贵宝公司白血病治疗药物Sprycel和乳腺癌药物lxempra被纳入其中,允许印度仿制药厂商生产该两种药品.
从以上血淋淋的案例不难看出,吉利德在印度市场以900美元/疗程的价格出售Sovaldi,更多的或是出于对当地知识产权环境的无奈之举.
http://www.
cscapital.
cn/cs-views/4600印度仿制药"正名"运作模式可供发展中国家借鉴印度和诺华之间持续7年的诉讼终于在近期告一段落.
4月1日,据美联社报道,印度最高法院驳回瑞士制药巨头诺华公司对改进后的抗癌新药格列卫(Glivec)专利保护的要求.
认为印度本土"仿制"的癌症特效药可以继续售卖.
和往常一样,判决引起了不少争议,支持者们认定,这一判决保障发展中国家民众获得平价药品的权益,无国界医生(国际)主席卡云勒卡亚医生(DrUnniKARUNAKARA)说:"对于依赖来自印度的可负担药物的数以百万计发展中国家的病人和医生,以及无国界医生等的治疗机构来说,这真如释重负.
"而诺华公司一方则认定,这一判决严重"阻碍创新".
不管如何,这一判决被认为是印度仿制药市场的分水岭.
从此之后,作为"世界药房"的印度将会把仿制药进行到底.
诉讼拉锯战在印度首都新德里,数百民众走上街头,高举"专利杀死病人"的标语,抗议瑞士诺华制药公司挑战印度专利法.
在此之前,来自150个国家的近30万公众,以及"无国界医生"等国际非政府组织联合发出呼吁,要求诺华终止对印度政府的法律行动.
这场诉讼持续了整整7年多,争议的焦点在于诺华的抗癌药是格列卫(Glivec,或称Gleevec),这种1993年就开始被诺华开发的药品,其分子化合物又叫做伊马替尼(Imatinib).
据介绍,这种药品主要用于治疗慢性粒细胞白血病和恶性胃肠道间质肿瘤,是现阶段一种重要的抗癌药物,目前已在世界范围广泛使用,并且在40个国家获得专利权.
然而在印度,格列卫却并未被授予专利.
依据印度2005年才修改的专利法,印度只支持1995年后开发的新药,不支持现有药物混合或者衍生药物申请专利,格列卫被拒绝的理由是1995年就已经存在新药的升级版,不属于创新药.
另一方面,印度也在生产自己的格列卫.
这种仿制药在效果上,和诺华公司格列卫区别不大,但不受专利束缚.
由于无须支付专利费,仿制药的平均价格只有专利药的20%-40%,个别品种甚至相差10倍以上.
诺华"格列卫"一个月治疗花费高达4000美元,印度仿制药仅需73美元.
对于贫穷的患者来说,印度的格列卫无疑更受欢迎.
可是对于诺华来说,一旦印度打开仿制药的大门,不仅将扩大其在第三世界药品市场的优势地位,还会进一步让其在欧美药品市场进军,这样一来,公司将会损失惨重.
诺华一直寻求印度法院认定这家企业研制的抗癌药"格列卫"改进型应受专利保护,宣称改进型更易于人体吸收,是一次重大改进.
不过,印度最高法院最终认定,这种改进型药品"不符51合创新和独创两项标准",支持印度专利局先前判断.
这一判决意味着印度制药企业可以继续合法"仿制"这种药品.
癌症患者援助协会律师阿南德·格罗弗说:"判决对于向贫困人口提供平价药品有着十分积极的意义.
""诺华对印度专利法中的攻击已然失败,印度的专利办公室应该将此视为一个清晰的信号,该法例必须严格执行,轻率、不严谨的专利申请应该被拒绝.
"无国界医生"病者有其药"项目驻印度经理孟甘妮(LeenaMENGHANEY)更是对时代周报记者表示.
诺华当天发布声明,批评这一判决"阻碍日后创新".
英国《金融时报》3月31日报道,这家瑞士制药企业先前威胁,如果输掉诉讼将停止向印度市场供应新药.
在诺华的中文网页上,印度产"格列卫"仍被称为"假药".
印度仿制药业这一判决被认为是一大分水岭,印度制药企业先前主要仿制那些售价高昂、用于治疗艾滋病、肺结核和癌症的药品.
如今,则会将目光放在更多药品制造领域.
印度一直有着"世界药房"之称,这里的仿制药产业十分发达,产量占全球仿制药的1/5.
这些仿制药在剂量、安全性和效力、质量、作用以及适应症上,都和原专利药类似.
一般来说,西方国家昂贵药品一经上市,印度制药企业在本国专利法保护下可以仿制同类产品.
由于没有对药品化学成分的专利保护,印度的药品价格为全球最低,一直受到贫穷患者和人道医疗组织的欢迎,很多发展中国家都依赖印度生产的价格较低的药物.
为了捍卫本国的仿制药业,印度以法律的形式与西方制药巨头博弈.
上世纪70年代,印度的政府不承认西方国家药品专利,直到2005年,作为与世界贸易组织达成协议的一部分,印度才开始恢复了药品专利.
2005年1月生效的印度专利法只对1995年以后发明的新药或经改进后能大幅度提高疗效的药物提供专利保护,而不支持原有药物混合或衍生药物专利.
同时,印度政府可根据需要实施"强制许可".
《印度时报》4月1日报道,一家印度药企已经推出美国默克公司的糖尿病治疗药品西他列汀的仿制版,显现竞争已步入慢性病药品领域.
孟甘妮表示:"我们已经看到印度专利法的实施对保障公共卫生的好处.
有赖印度严谨的法律,越来越多的药物需要引入仿制药的竞争,令其价格变得可以负担.
"中国可否借鉴这起诉讼是印度在WTO相关知识产权协议过渡期满之后,遭遇的第一起药品专利诉讼.
诉讼结果将直接影响到发展中国家能否继续获得价格较低的药物,以及WTO专利保护条款如何落实等重大问题.
"判决不仅影响印度,同时对其他亚非拉国家具有参考意义.
"对此,印度大型制药企业西普拉医药公司律师普拉蒂巴·辛格说.
作为仿制药的另一大市场,中国仿制药生产和印度相比无论是在规模还是质量上,都有着极大的差距.
近几年印度获批的仿制药申请基本都占到美国食品药品监督管理局(FDA)批准的约1/3,暂时性批准占到近40%.
数据显示,目前在印度,有近100家制药厂获得FDA的批准,这些工厂多半生产用于出口的仿制药,年销售额多年以来均超过60亿美元.
从2012年1月1日起至2016年12月31日的5年间,全球将有多达631个专利药到期.
专利药到期高峰的到来,对于很多发展中国家来说,这意味着仿制药将有更多的市场和空间.
52国内医药行业专家边晨光对时代周报记者表示,跨国医药公司要求申请专利延长是出于利益的驱使.
由此以来,在跨国医药公司和发展中国家之间便产生了一个不可调和的矛盾:那便是利益与民生的对抗.
"企业的根本立足点是利益,而国家政府的立足点则是民生,为本国人民考虑.
外国药品价格高昂,让许多病人望而却步,但国家不能见死不救,因此便采取'强制仿制'的方式,以提供价格较低的仿制药.
"边晨光说道.
边晨光表示,目前中国并没有鼓励仿制药的政策和法规,其中一个原因在于中国并不像印度那样疾病肆虐.
但如果在未来中国出现急需仿制药的情况,"强制仿制"或许是唯一的方法,而这时,将会由政府更多地承担相应义务和责任以保障民生.
无国界医生(国际)主席卡云勒卡亚医生说:"目前,药物创新的资金来自专利垄断下的高昂药价,无法负担这些价格的发展中国家病人和政府便为此付出代价.
与其想方设法扭曲规则,以寻求旧药的长青专利保护,来滥用专利系统,制药业不如集中精力寻求真正的创新.
政府也应该发展出一个框架,使药物的研发得以用另一方式进行,而药价又是病人可负担的.
"与此同时,边晨光也呼吁西方制药公司和发展中国家展开积极的对话:"这场对话需要进行,我们邀请诺华成为解决方法的一部分,而不是成为问题的一部分.
"http://finance.
eastmoney.
com/news/1355,20130411284552319.
html中国修改专利法允许复制"救命药"中国近期对知识产权法进行部分修改,允许国内制药商生产仍受专利保护药品的廉价复制品,此举或令外国制药公司感到不安.
中国国家知识产权局网站发布的文件对上述举措进行了概述.
几个月前,印度采取类似举措,颁布首个药品强制许可,结束了拜耳(BAYGn.
DE:行情)对一种抗癌药物的垄断.
中国此举将对大型制药公司敲响警钟,因为在西方国家药品销量下滑之际,中国是药业增长的关键市场.
根据修改後的《专利实施强制许可办法》,在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,中国政府可向具备实施条件的公司颁发强制许可证,生产专利药品的仿制品.
为了公共健康目的,合格的制药商还可请求将这些药品出口到其它国家,包括世界贸易组织(WTO)成员国.
根据WTO规定,在无法承担"救命药"成本的情况下,各国可以颁发强制许可证.
中国国家知识产权局通过传真发给路透的声明称:"修订版《专利实施强制许可办法》将於2012年5月1日起实施.
"内容调整可在中国国家知识产权局网站查看.
(link.
reuters.
com/tus68s)WTO推荐GileadSciences生产的泰诺福韦(tenofovir)用於治疗艾滋病.
两名知情人士称,中国此举瞄准的是泰诺福韦,中国制药商准备生产该药品.
联合国和卫生专家6月初在曼谷举行了药品可及性研讨会.
中国官员谈及其专利法调整.
与会者包括来自柬埔寨、印度、印尼、马来西亚、缅甸、菲律宾、泰国和越南的官员.
http://yao.
dxy.
cn/article/23746
ShockHosting日本机房VPS测试点评
这个月11号ShockHosting发了个新上日本东京机房的邮件,并且表示其他机房可以申请转移到日本,刚好赵容手里有个美国的也没数据就发工单申请新开了一个,这里做个简单的测试,方便大家参考。ShockHosting成立于2013年,目前提供的VPS主机可以选择11个数据中心,包括美国洛杉矶、芝加哥、达拉斯、杰克逊维尔、新泽西、澳大利亚、新加坡、日本、荷兰和英国等。官方网站:https://shoc...
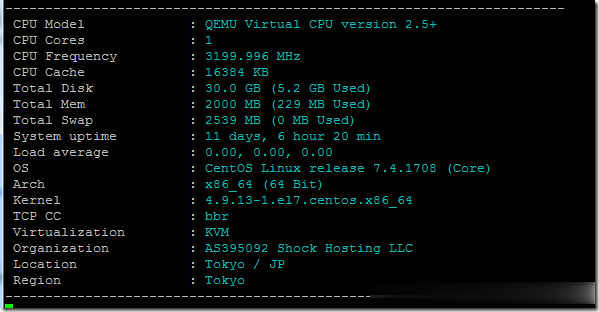
10gbiz首月半价月付2.36美元,香港/洛杉矶VPS、硅谷独立服务器/站群服务器
收到10gbiz发来的7月份优惠方案,中国香港、美国洛杉矶机房VPS主机4折优惠码,优惠后洛杉矶VPS月付2.36美元起,香港VPS月付2.75美元起。这是一家2020年成立的主机商,提供的产品包括独立服务器租用和VPS主机等,数据中心在美国洛杉矶、圣何塞和中国香港。商家VPS主机基于KVM架构,支持使用PayPal或者支付宝付款。洛杉矶VPS架构CPU内存硬盘带宽系统价格单核512MB10GB1...
数脉科技:六月优惠促销,免备案香港物理服务器,E3-1230v2处理器16G内存,350元/月
数脉科技六月优惠促销发布了!数脉科技对香港自营机房的香港服务器进行超低价促销,可选择30M、50M、100Mbps的优质bgp网络。更大带宽可在选购时选择同样享受优惠,目前仅提供HKBGP、阿里云产品,香港CN2、产品优惠码续费有效,仅限新购,每个客户可使用于一个订单。新客户可以立减400元,或者选择对应的机器用相应的优惠码,有需要的朋友可以尝试一下。点击进入:数脉科技官方网站地址数脉科技是一家成...

几内亚首例确诊为你推荐
-
artess企业推广最常见的推广方式有哪些cuteftpcuteFTP的使用方法?Usercuteftp加多宝和王老吉王老吉和加多宝的关系?中国保健养猪网135保健养猪,135天可以出栏吗?什么是通配符dir是什么美国独立美国独立的意义dedecms自动采集织梦CMS系统的采集功能不知道怎么采集软件。kingcmsKingcms 怎么解决会员登录页面的问题