培养基花生壳连接失败
花生壳连接失败 时间:2021-04-03 阅读:()
微生物学实验指导黄文芳张松编著华南师范大学生命科学学院第一部分基础实验实验1培养基的配制一、实验目的和内容目的:学习和掌握配制培养基的一般方法和步骤.
内容:1.
牛肉膏蛋白陈培养基的配制.
2.
高氏1号培养基的配制.
3.
马丁氏培养基的配制.
二、实验材料和用具牛肉膏、蛋白胨、琼脂、可溶性淀粉、葡萄糖、孟加拉红、链霉素、1mol/LNaOH、lmol/LHCl、KNO3、NaCl、K2HPO4·3H2O、MgSO4·7H2O、FeSO4·7H2O.
试管、三角瓶、烧杯、量筒、玻璃棒、天平、牛角匙、pH试纸、棉花、牛皮纸、记号笔、线绳、纱布、漏斗、漏斗架、胶管、止水夹等.
三、操作步骤(一)牛肉膏蛋白胨培养基的配制牛肉膏蛋白胨培养基是一种应用最广泛和最普通的细菌基础培养基.
其配方如下:牛肉膏3g,蛋白胨10g,Nacl5g,琼脂15~20g,水1000mL,PH7.
4~7.
61.
称药品按实际用量计算后,按配方称取各种药品放入大烧杯中.
牛肉膏可放在小烧杯或表面皿中称量,用热水溶解后倒入大烧杯;也可放在称量纸上称量,随后放入热水中,牛肉膏使与称量纸分离,立即取出纸片.
蛋白胨极易吸潮,故称量时要迅速.
2.
加热溶解在烧杯中加入少于所需要的水量,然后放在石棉网上,小火加热,并用玻棒搅拌,待药品完全溶解后再补充水分至所需量.
若配制固体培养基,则将称好的琼脂放入己溶解的药品中,再加热融化,此过程中,需不断搅拌,以防琼脂糊底或溢出,最后补足所失的水分.
3.
调pH检测培养基的pH,若pH偏酸,可滴加lmol/LNaOH,边加边搅拌,并随时用pH试纸检测,直至达到所需pH范围.
若偏碱,则用lmol/LHCl进行调节.
pH的调节通常放在加琼脂之前.
应注意pH值不要调过头,以免回调而影响培养基内各离子的浓度.
4.
过滤液体培养基可用滤纸过滤,固体培养基可用4层纱布趁热过滤,以利培养的观察.
但是供一般使用的培养基,这步可省略.
5.
分装按实验要求,可将配制的培养基分装入试管或三角瓶内.
分装时可用漏斗以免使培养基沾在管口或瓶口上而造成污染.
分装量:固体培养基约为试管高度的l/5,灭菌后制成斜面.
分装入三角瓶内以不超过其容积的一半为宜.
半固体培养基以试管高度的1/3为宜,灭菌后垂直待凝.
6.
加棉塞试管口和三角瓶口塞上用普通棉花(非脱脂棉)制作的棉塞.
棉塞的形状、大小和松紧度要合适,四周紧贴管壁,不留缝隙,才能起到防止杂菌侵入和有利通气的作用.
要使棉塞总长约3/5塞入试管口或瓶口内,以防棉塞脱落.
有些微生物需要更好的通气,则可用8层纱布制成通气塞.
有时也可用试管帽或塑料塞代替棉塞.
7.
包扎加塞后,将三角瓶的棉塞外包一层牛皮纸或双层报纸,以防灭菌时冷凝水沾湿棉塞.
若培养基分装于试管中,则应以5支或7支在一起,再于棉塞外包一层牛皮纸,用绳扎好.
然后用记号笔注明、培养基名称、组别、日期.
8.
灭菌将上述培养基于121.
3℃湿热灭菌20min.
如因特殊情况不能及时灭菌,则应故人冰箱内暂存.
9.
摆斜面灭菌后,如制斜面,则需趁热将试管口端搁在一根长木条上,并调整斜度,便斜面的长度不超过试管总长的1/2.
10.
无菌检查将灭菌的培养基放入37℃温箱中培养24~48h,无菌生长即可使用,或贮存于冰箱或清洁的橱内,备用.
(二)高氏l号培养基的配制高氏1号培养基是用于分离和培养放线菌的合成培养基.
其配方如下:可溶性淀粉20g,KNO31g,NaCl0.
5g,K2HPO4·3H2O0.
5g,MgSO4·7H2O0.
5g,FeSO4·7H2O0.
01g,琼脂15~20g,水1000mL,pH7.
4~7.
6.
l.
称量和溶解先计算后称量,按用量先称取可溶性淀粉,放入小烧杯中,并用少量冷水将其调成糊状,再加至少于所需水量的水,继续加热,边加热边搅拌,至其完全溶解.
再加入其他成分依次溶解.
对微量成分FeSO4·7H2O可先配成高浓度的贮备液后再加入,方法是先在1000mL中加入1g的FeSO4·7H2O,配成浓度为0.
01g/mL的贮备液,再在1000mL培养基中加入以上贮备液1mL即可.
待所有药品完全溶解后,补充水分到所需的总体积.
如要配制固体培养基,其琼脂溶解过程同牛肉膏蛋白胨培养基配制.
2.
pH调节、分装、包扎及无菌检查同牛肉膏蛋白胨培养基配制.
(三)马丁氏培养基的配制马丁氏培养基是用于分离真菌的选择培养基.
其配方如下:K2HPO41g,MgSO4·7H2O0.
5g,蛋白胨5g,葡萄糖l0g,琼脂15~20g,水1000mL,自然pH.
1.
称量和溶解先计算后称量,按用量称取各成分,并将其溶解在少于所需的水中.
待各成分完全溶解后,补充水分到所需体积.
再将孟加拉红配成1%的水溶液,在1000mL培养液中加入以上孟加拉红溶液3.
3mL,混匀后,加入琼脂加热融化,方法同牛肉膏蛋白胨培养基配制.
2.
分装、包扎、灭菌及无菌检查同牛肉膏蛋白膝培养基配制.
3.
链霉素的加入链霉素受热容易分解,所以临用时,将培养基融化后待温度降至45℃左右时才能加入.
可先将链霉素配成1%的溶液(配好的链霉素溶液保存于-20℃),在100mL培养基中加1%链霉素0.
3mL,使每毫升培养基中合链霉素30μg.
四、注意事项称药品用的牛角匙不要混用,称完药品应及时盖紧瓶盖.
调pH时要小心操作,避免回调.
不同培养基各有配制特点,要注意具体操作.
五、实验报告记录本实验配制培养基的名称、数量,并图解说明其配制过程,指明要点.
六、问题和思考l.
配制培养基有哪几个步骤在操作过程中应注意些什么问题为什么2.
培养基配制完成后,为什么必须立即灭菌若不能及时灭菌应如何处理已灭菌的培养基如何进行无菌检查3.
试设计实验对饮料进行无菌检查.
实验2消毒与灭菌一、干热灭菌(一)目的要求1.
了解干热灭菌的原理和应用范围.
2.
学习干热灭菌的操作技术.
(二)基本原理干热灭菌是利用高温使微生物细胞内的蛋白质凝固变性而达到灭菌的目的.
细胞内的蛋白质凝固性与其本身的含水量有关,在菌体受热时,当环境和细胞内含水量越大,则蛋白蛋凝固就越快,反之含水量越少,凝固缓慢.
因此,与湿热灭菌相比,干热灭菌所需温度要高(160~170℃),时间要长(1~2h),但干热灭菌温度不能超过180℃,否则,包器皿的纸或棉塞就会烧焦,甚至引起燃烧.
干热灭菌使用的电烘箱的结构如图2-1.
图2-1电烘箱的外观和结构A.
外观B.
结构1.
温度计;2.
排气阀;3.
箱体;4.
控温器旋钮;5.
箱门;6.
指示灯;7.
加热开关;8.
温度控制阀;9.
控制室;10.
侧门;11.
工作室;12.
保温室;13.
电热器;14.
散热板;15.
搁板(三)器材培养皿、试管、吸管、电烘箱等.
(四)操作步骤1.
装入待灭菌物品将包好的待灭菌物品(培养皿、试管,吸管等)放入电烘箱内,关好箱门.
物品不要摆得太挤,以免妨碍空气流通,灭菌物品不要接触电烘箱内壁的铁板,以防包装纸烤焦起火.
2.
升温接通电源,拨动开关,打开电烘箱排气孔,旋动恒温调节器至绿灯亮,让温度逐渐上升.
当温度升至100℃时,关闭排气孔.
在升温过程中,如果红灯熄灭,绿灯亮,表示箱内停止加温,此时如果还未达到所需的160—170℃温度,则需转动调节器使红灯再亮,如此反复调节,直至达到所需温度.
3.
恒温当温度升达到160~170℃时,恒温调节器会自动控制调节温度,保持此温度2h.
干热火菌过程.
严防恒温调节的自动控制失灵而造成安全事故.
4.
降温切断电源、自然降温.
5.
开箱取物待电烘箱内温度降到70℃以下后,打开箱门,取出灭菌物品.
电烘箱内温度末降到70℃,切勿自行打开箱门以免骤然降温导致玻璃器皿炸裂.
(五)实验报告思考题l.
在干热灭菌操作过程中应注意哪些问题,为什么2.
为什么干热火菌比湿热灭菌所需要的温度要高,时间要长请设计干热灭菌和湿热灭菌效果比较实验方案.
二高压蒸气灭菌(一)目的要求1.
了解高压蒸气灭菌的基本原理及应用范围.
2.
学习高压蒸气灭菌的操作方法.
(二)基本原理高压蒸气灭菌是将待灭菌的物品放在一个密闭的加压灭菌锅内,通过加热,使灭菌锅隔套间的水沸腾而产生蒸气.
待水蒸气急剧地将锅内的冷空气从排气阀中驱尽,然后关闭排气阀,继续加热,此时由于蒸气不能溢出,而增加了灭菌锅内的压力,从而使沸点增高,得到高于100℃的温度.
导致菌体蛋白质凝固变性而达到灭菌的目的.
在同一温度下,湿热的杀菌效力比干热大.
其原因有三:一是湿热中细菌菌体吸收水分,蛋白质较易凝固,因蛋白质含水量增加,所需凝固温度降低(表2—1),二是湿热的穿透力比干热大(表2—2),三是湿热的蒸气有潜热存在.
1g水在100℃时,由气态变为液态时可放出2.
26kJ(千焦)的热量.
这种潜热,能迅速提高被灭菌物体的温度,从而增加灭菌效力.
表2—1蛋白质含水量与凝固所需温度的关系卵白蛋白含水量/%30分钟内凝固所需温度/℃50562574~801880~9061450160~170在使用高压蒸气灭菌锅灭菌时,灭菌锅内冷空气的排除是否完全极为重要,因为空气的膨胀压大于水蒸气的膨胀压,所以,当水蒸气中含有空气时,在同一压力下,含空气蒸气的温度低于饱和蒸气的温度.
灭菌锅内留有不同分量空气时,压力与温度的关系见(表2—3)表2-2干热温热穿透力及灭菌效果比较透过布层的温度/℃温度/℃时间/h20层10层100层灭菌干热130-1404867270.
5不完全湿热105.
33101101101完全表2—3灭菌锅留有不同分量空气时,压力与温度的关系压力数MpaKg/cm2Ib/in2全部空气排出时的温度/℃2/3空气排出时的温度/℃1/2空气排出时的温度/℃1/3空气排出时的温度/℃空气全不排出时的温度/℃0.
030.
355108.
81009490720.
070.
7010115.
6109105100900.
1010.
515121.
31151121091000.
141.
4020126.
21211181151090.
171.
7525130.
01261241211150.
212.
1030134.
6130128126121现在法定压力单位己不用磅和kg/cm2表示,而是用Pa或bar表示,其换算关系为:1kg/cm2=98066.
5Pa;1Ib/in2=6894.
76Pa.
一般培养基用0.
1Mpa(相当于15Ib/in2或1.
05kg/cm2),121.
5℃,15~30min可达到彻底灭菌的目的.
灭菌的温度及维持的时间随灭菌物品的性质和容量等具体情况而有所改变.
例如含糖培养基用0.
06Mpa(8Ib/in2或0.
59kg/cm2)112.
6℃灭菌,然后以无菌操作手续加入灭菌的糖溶液.
又如盛于试管内的培养基以0.
1Mpa,121.
5℃灭菌20min即可,而盛于大瓶内的培养基最好以0.
1Mpa,122℃灭菌30min.
实验中常用的非自控高压蒸气灭菌锅有卧式(图2-2,A)和手提式(图2—2,B)二种,其结构和工作原理相同,本实验以手提式高压蒸气灭菌锅为例,介绍其使用方法,有关自控高压蒸气灭菌锅(autoclave)的使用可参照厂家说明书.
图2—2A卧式灭菌锅图2—2B手提式灭菌锅1.
安全阀;2.
压力表;3.
放气阀;4.
软管;5.
紧固螺栓;6.
灭菌桶;7.
筛架;8.
水(三)器材牛肉膏蛋白胨培养基,培养皿(6套一包),手提式高压蒸气灭菌锅等.
(四)操作步骤1.
首先将内层锅取出,再向外层锅内加入适量的水,使水面与三角搁架相平为宜.
切勿忘记加水,同时水量不可过少,以防灭菌锅烧干而引起炸裂事故.
2.
放回内层锅,并装入待灭菌物品.
注意不要装得太挤,以免防碍蒸气流通而影响灭菌效果.
三角烧瓶与试管口端均不要与锅壁接触,以免冷凝水淋湿包口的纸而透入棉塞.
3.
加盖,并将盖上的排气软管插入内层锅的排气槽内.
再以两两对称的方式同时旋紧相对的两个螺栓,使螺栓松紧一致,勿使漏气.
4.
用电炉或煤气加热,并同时打开排气阀,使水沸腾以排除锅内的冷空气.
待冷空气完全排尽后,关上排气阀,让锅内的温度随蒸气压力增加到逐渐上升.
当锅内压力升到所需压力时,控制热源,维持压力至所需时间.
本实验用0.
1Mpa,121.
5℃,20min灭菌.
灭菌的主要因素是温度而不是压力.
因此锅内冷空气必须完全排尽后,才能关上排气阀,维持所需压力.
5.
灭菌所需时间到后,切断电源或关闭煤气,让灭菌锅内温度自然下降,当压力表的压力降至"0"时,打开排气阀,旋松螺栓,打开盖子,取出灭菌物品.
压力一定要降到"0"时,才能打开排气阀,开盖取物.
否则就会因锅内压力突然下降,使容器内的培养基由于内外压力不平衡而冲出烧瓶口或试管口,造成棉塞沾染培养基而发生污染,甚至灼伤操作者.
6.
将取出的灭菌培养基,需摆斜面的则摆成斜面,然后放入37℃温箱培养24h,经检查若无杂菌生长,即可待用.
(五)实验报告l.
结果检查培养基灭菌是否彻底.
2.
思考题(1)高压蒸气灭菌开始之前,为什么要将锅内冷空气排尽灭菌完毕后,为什么待压力降低"0"时才能打开排气阀,开盖取物(2)在使用高压蒸气灭菌锅灭菌时,怎样杜绝一切不安全的因素(3)灭菌在微生物实验操作中有何重要意义(4)黑曲霉的孢子与芽孢杆菌的孢子对热的抗性哪个最强为什么三、紫外线灭菌(一)目的要求了解紫外线灭菌的原理和方法(二)基本原理紫外线灭菌是用紫外线灯进行的.
波长为200~300nm的紫外线都有杀菌能力,其中以260nm的杀菌力最强.
在波长一定的条件下,紫外线的杀菌效率与强度和时间的乘积成正比.
紫外线杀菌机理主要是因为它诱导了胸腺嘧啶二聚体的形成和DNA链的交联,从而抑制了DNA的复制.
另一方面,由于辐射能使空气中的氧电离成[O],再使O2氧化生成臭氧(O3)或使水(H2O)氧化生成过氧化氢(H2O2).
O3和H2O2均有杀菌作用.
紫外线穿透力不大,所以,只适用于无菌室,接种箱,手术室内的空气及物体表面的灭菌.
紫外线灯距照射物以不超过1.
2m为宜.
此外,为了加强紫外线灭菌效果,在打开紫外灯以前;可在无菌室内(或接种箱内)喷洒3%~5%石炭酸溶液,一方面使空气中附着有微生物的尘埃降落,另一方面也可以杀死一部分细菌.
无菌室内的桌面、凳子可用2%~3%的来苏尔擦洗,然后再开紫外灯照射,即可增强杀菌效果,达到灭菌目的.
(三)器材1.
培养基牛肉膏蛋白胨平板.
2.
溶液或试剂3%~5%石炭酸或2%~3%来苏尔溶液.
3.
仪器或其他用具紫外线灯.
(四)操作步骤l.
单用紫外线照射(1)在无菌室内或在接种箱内打开紫外线灯开关,照射30min,将开关关闭.
(2)将牛肉膏蛋白胨平板盖打开15min,然后盖上皿盖.
置37℃培养24h.
共做三套.
(3)检查每个平板上生长的菌落数.
如果不超过4个,说明灭菌效果良好,否则,需延长照射时间或同时加强其他措施.
2.
化学消毒剂与紫外线照射结合使用(1)在无菌室内,先喷洒3%~5%的石炭酸溶液,再用紫外线灯照射15imn.
(2)无菌室内的桌面,凳子用2%~3%来苏尔擦洗,再打开紫外线灯照射15min.
(3)检查灭菌效果[方法同"单用紫外线照射"(3)].
因紫外线对眼结膜及视神经有损伤作用,对皮肤有刺激作用,故不能直视紫外线灯光下工作.
(五)实验报告1.
结果记录两种灭菌效果于下表中处理方法平板菌落数123灭菌效果比较紫外线照射3%~5%石炭酸+紫外线照射2%~3%来苏尔+紫外线照射2.
思考题.
(1)细菌营养体细胞和细菌芽孢对紫外线和的抵抗力会一样吗,为什么(2)你知道紫外线灯管是用什么玻璃制作的为什么不用普通灯用玻璃(3)在紫外灯下观察实验结果时,为什么要隔一块普通玻璃四微孔滤膜过滤除菌(一)目的要求1.
了解过滤除菌的原理.
2.
掌握微孔滤膜过滤除菌的方法.
(二)基本原理过滤除菌是通过机械作用滤去液体或气体中细菌的方法.
根据不同的需要选用不同的滤器和滤板材料.
微孔滤膜过滤器是由上下二个分别具有出口和入口连接装置的塑料盖盒组成,出口处可连接针头,人口处可连接针筒,使用时将滤膜装入两塑料盖盒之间,旋紧盖盒,当溶液从针筒注入滤器时,此滤器将各种微生物阻留在微孔滤膜上面,从而达到除菌的目的.
根据待除菌溶液量的多少,可选用不同大小的滤器.
此法除菌的最大优点是可以不破坏溶液中各种物质的化学成分,但由于滤量有限,所以一般只适用于实验室中小量溶液的过滤除菌.
(三)器材1.
培养基2%的葡萄糖溶液,肉汤蛋白胨平板.
2.
仪器或其他用具注射器,微孔滤膜过滤器,0.
22μm滤膜,无菌试管,镊子,玻璃刮棒.
(四)操作步骤l.
组装、灭菌将0.
22μm孔径的滤膜装入清洗干净的塑料滤器中,旋紧压平,包装灭菌后待用(0.
lMPa,121.
5℃灭菌20min).
2.
连接将灭菌滤器的入口在无菌条件下,以无菌操作方式连接于装有待滤溶液(2%葡萄糖溶液)的注射器上,将针头与出口处连接并插入带橡皮塞的无菌试管中.
见图2—3.
3.
压滤将注射器中的待滤溶液加压缓缓挤入过滤到无菌试管中,滤毕,将针头拨出.
压滤时,用力要适当,不可太猛太快,以免细菌被挤压通过淀胶.
4.
无菌检查无菌操作吸取除菌滤液0.
1ml于肉汤蛋白胨平板上,涂布均匀,置37℃温室中培养24h,检查是否有菌生长.
5.
清洗弃去塑料滤器上的微孔滤膜,将塑料滤器清洗干净,并换上一张新的微孔滤膜,组装包扎,再经无菌后使用.
整个过程应在无菌条件下严格无菌操作,以防污染,过滤时应避免各连接处出现渗漏现象.
(五)实验报告l.
结果记录无菌检查结果2.
思考题(1)你做的过滤除菌实验效果如何如果经培养检查有杂菌生长,你认为是什么原因造成的(2)如果你需要配制一种含有某抗生素的牛肉膏蛋白胨培养基,其抗生素的终浓度(或工作浓度)为50μg/ml,你将如何操作(3)过滤除菌应注意哪些问题实验3土壤的稀释分离、纯化微生物及无菌操作技术一、实验目的和内容目的:学习从土壤中分离微生物的方法,学习无菌操作技术.
内容:l.
用稀释法分离细菌、放线菌和霉菌.
2.
用平板划线方法分离微生物.
3.
学习斜面接种及穿刺接种等无菌操作技术.
二、实验材料和用具金黄色葡萄球菌(Staphylococcusaureus)和普通变形菌(Proteusvulgaris)斜面菌种.
已灭菌的牛肉膏、高氏1号、土豆蔗糖固体培养基各1瓶,49.
5mL无菌水(带玻璃珠)1瓶,4.
5mL无菌水6管,80%乳酸,10%酚液,95%乙醇.
无菌培养皿12套,1mL无菌移液管10支,土壤样品及天平、称量纸、药勺、试管架、玻璃铅笔、橡皮头(用75%乙醇浸泡)、玻璃刮.
三、操作步骤(一)土壤稀释分离1.
取土壤取表层以下5—10cm处的土样,放入无菌的袋中备用,或放在4℃冰箱中暂存.
2.
制备稀释液(要无菌操作)(1)制备土壤悬液:称土样0.
5g,迅速倒入带玻璃珠的49.
5mL无菌水瓶中(玻璃珠用量以充满瓶底力最好),振荡5~10min,使土样充分打散,即成为10-2的土壤悬液.
(2)稀释:用无菌移液管吸10-2的土壤悬液0.
5mL,放入4.
5mL无菌水中即为10-3稀释液,如此重复,可依次制成10-3~10-8的稀释液(图3-1).
注意:操作时管尖不能接触液面,每一个稀释度换用一支移液管,每次吸入土液后,要将移液管插入液面,吹吸3次,每次吸上的液面要高于前一次,以减少稀释中的误差.
]图3—1稀释法分离土壤微生物操作过程图解3.
混菌法测定菌落数的方法(1)细菌:取10-7、10-6两管稀释液各1mL,分别接人相应标号的平皿中,每个稀释度接两个平皿.
然后取冷却至50℃的牛肉膏琼脂培养基,分别倒入以上培养皿中(装量以铺满皿底高1.
5~2mm为宜),迅速轻轻摇动平皿,使菌液与培养基充分混匀,但不沾湿皿的边缘,待琼脂凝固即成细菌平板.
倒平板时要注意无菌操作,见图3-2.
图3—2倒平板的方法(2)放线菌:取10-5、10-4两管稀释液,在每管中加入10%酚液5~6滴,摇匀,静置片刻,然后分别从两管中吸出1mL加入相应标号的平皿中,选用高氏1号培养基,用与细菌相同的方法倒入平皿中,便可制成放线菌平板.
(3)霉菌:取10-2、10-3两管稀释各1mL,分别接入相应标号的平皿中,每个稀释度接两个平皿.
在融化的土豆蔗糖培养基中,每100mL加入灭菌的乳酸1mL,轻轻摇匀,然后用与细菌相同的方法倒入平皿中,便可制成霉菌的平板.
4.
培养将接种好的细菌、放线菌、霉菌平板倒置,即皿盖朝下放置,于28~30℃中恒温培养,细菌培养1~2d,放线菌培养5~7d,霉菌培养3~5d.
观察生长的菌落,用于进一步纯化分离或直接转接斜面.
(二)平板制作及划线分离方法.
1.
倒平板按无菌操作要求,在火焰旁操作(图3—2),做法如3(1).
2.
划线分离使用接种环,从待纯化的菌落或待分离的斜面菌种只沾取少量菌样,在相应培养基平板中划线分离,划线的方法多样,目的是获得单个菌落,主要方法参见图3—3.
图3—3平板划线方法示意图A.
划线分离操作;B.
用于稀释液中,可连接划线;C.
用于较浓的菌样,分数次划线,每次划线后要烧接种环,然后再划下一区.
3.
培养方法同"土壤稀释分离".
(三)斜面接种和穿刺接种1.
斜面接种(1)取新鲜固体斜面培养基,分别做好标记(写上菌名、接种日期、接种人等),然后用无菌操作方法,把待接菌种接入以上新鲜培养基斜面上.
(2)接种的方法是,用接种环沾取少量待接菌种,然后在新鲜斜面上"之"字形划线,方向是从下部开始,一直划至上部(图3—4A).
注意划线要轻,不可把培养基划破.
图3—4斜面接种(A)及穿刺接种(B)示意图(3)接种后30℃恒温培养,细菌培养48h,放线菌、霉菌培养至孢子成熟方可取出保存.
2.
穿刺接种(1)取两支新鲜半固体牛肉膏蛋白胨柱状培养基,做好标记(写上菌名)、接种日期,接种人等).
(2)接种的方法是,用接种针沾取少量待接菌种,然后从柱状培养基的中心穿入其底部(但不要穿透),然后沿原刺入路线抽出接种针,注意接种针不要移动.
(3)接种后30℃恒温培养,24h后观察,比较两种菌的生长结果.
四、注意事项1.
一般土壤中,细菌最多,放线菌及霉菌次之,而酵母菌主要见于果园及菜园土壤中,故从土壤中分离细菌时,要取较高的稀释度,否则菌落连成一片不能计数.
2.
在土壤稀释分离操作中,每稀释10倍,最好更换一次移液管,使计数准确.
3.
放线菌的培养时间较长,故制平板的培养基用量可适当增多.
五、实验报告1.
记录土壤稀释分离结果,并计算出每克土壤中的细菌、放线菌和霉菌的数量.
计算方法:选择长出菌落数30~300之间的培养皿进行计数,按以下公式:总菌数/g=同一稀释度几次重复的菌落平均数*稀释倍数2.
分别记录平板划线、斜面接种的结果,并自我评价.
3.
比较两种细菌穿刺接种的结果,并进行分析.
七、问题和思考1.
在测定土壤微生物含量中,除混菌法外还可用什么方法2.
试设计实验,从土壤中分离出酵母菌,并进行计数.
实验4微生物菌落的观察一、实验目的和内容目的:识别细菌、酵母菌、放线菌和霉菌四大类微生物的菌落特征.
内容:1.
观察已知菌的菌落的形态、大小、色泽、透明度、致密度和边缘等特征.
2.
根据菌落的形态特征判断未知菌的类别.
二、实验材料和用具大肠杆菌(E.
coli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)、粘红酵母(Rhodotorulagracitis)、热带假丝酵母(Candidatropicalis)、细黄链霉菌(Streptomycesmicroflavus,又称"5406"抗生菌)、灰色链霉菌(Streptomycesgriseus)、黑曲霉(Aspergillusniger)、产黄青霉(Penicilliumchrysogenum)、球孢白伍菌(Beauveriabassiana)等细菌的斜面菌种.
牛肉膏蛋白胨培养基、马铃薯培养基、高氏1号培养基、无菌水.
接种环、接种针、酒精灯、无菌培养皿多套、电热恒温箱.
三、操作步骤(一)制备已知菌的单菌落1.
制备平板将已融化的无菌培养基待冷却至50℃左右,分别制备牛肉膏蛋白胨培养基平板、马铃薯蔗糖培养基平板和高氏1号培养基平板各一皿.
2.
制备菌悬液或孢子悬液在培养好的斜面菌种管内加入5mL无菌水,制成菌悬液后备用.
3.
制备单菌落通过平板划线法获得细菌、酵母菌和放线菌的单菌落.
用三点接种法获得霉菌的单菌落.
细菌于37℃恒温培养24~48h,酵母菌于28℃培养2~3d,霉菌和放线菌置28℃培养5~7d,待长成菌落后,仔细观察四大类微生物菌落的形态特征,并将观察结果记录于表4-1中.
(二)制备未知菌落l.
倒平板2.
接种可用弹土法接种,其要点为:采集校园土壤,待风干磨碎后,可将细土撒在无菌的硬板纸表面,先弹去纸面浮土,然后打开皿盖,便含土的纸面对着平板培养基的表面,用手指在硬板纸背面轻轻一弹即可接种上各种微生物.
3.
培养将牛肉膏蛋白胨培养基平板倒置于37℃培养箱中恒温培养2~3d,将马铃薯蔗糖培养基倒置于28℃培养箱中恒温培养3~5d,即可获得未知菌的单菌落.
4.
编号从培养好的未知平板中,挑选8个不同的单菌落,逐个编号,根据菌落识别要点区分未知菌落类群,并将判断结果填入表4~2中.
(三)直接观察菌落直接用实验3中的"土壤稀释分离"获得的单菌落进行观察识别,并将结果填入表4-2中.
四、注意事项观察菌落特点时,要选择分离得很开的单个较大菌落;已知菌落和未知菌落要编好号,请勿随意移动开盖,以免搞混菌号.
五、实验报告1.
已知菌落的形态特征记录于表4~1中.
2.
将未知菌落的辨别结果记录于表4~2中.
七、问题和思考1.
试比较细菌、放线菌、酵母菌和霉菌菌落形态的差异2.
设计一个实验,检测实验室空气环境中的微生物类别表4—1已知菌菌落的形态辩别要点菌落描述湿干颜色微类生物数菌名厚薄大小松密大小表面边缘隆起形状正面反面水溶性色素透明度大肠杆菌金黄色葡萄球菌细菌枯草杆菌酿酒酵母粘红酵母酵母菌热带假丝酵母细黄链霉菌放线菌灰色链霉菌产黄青霉黑曲霉霉菌球孢白僵菌表4—2未知菌菌落的形态湿干菌落描述颜色判断结果菌落号厚薄大小松密大小表面边缘隆起形状正面反面水溶性色素透明度1212345678注:四大类微生物菌落的识别要点如下:大而扁平…………小小而扁平……细菌大而扁平……湿润:正反面颜色一致大大而隆起……酵母菌小小而致密大而致密……菌落干燥,正反面,中央与边缘颜色不一致大大而疏松……霉菌实验5显微镜油浸系物镜的使用一、实验目的和内容目的:复习显微镜低倍镜和高倍镜的使用技术,了解油浸系物镜的基本原理,掌握油浸系物镜的使用方法.
内容:1.
学习油浸系物镜的使用方法.
2.
用油镜观察枯草芽孢杆菌和金黄色葡萄球菌染色装片.
二、实验材料和用具枯草芽孢杆菌(Bacillussubitilis)、金黄色葡萄球菌(Staphylococcusaureus)的染色装片.
香柏油、二甲苯、显微镜、擦镜纸.
三、操作步骤(一)观察前的准备1.
将显微镜置于平稳的实验台上,镜座距实验台边沿约为4cm.
坐正,练习用左眼观察.
2.
调节光源:将低倍物镜转到工作位置,把光圈完全打开,聚光器升至与载物台相距约1mm左右.
转动反光镜采集光源,光线较强的天然光源宜用平面镜,光线较弱的天然光源或人工光源宜用凹面镜,对光至视野内均匀明亮为止.
观察染色装片时,光线宜强;观察末染色装片时,光线不宜太强.
(二)低倍镜观察染色装片首先上升镜简,将枯草芽孢杆菌染色装片置于载物台上,用标本夹夹住,将观察位置移至物镜正下方,物镜降至距装片0.
5cm处,适当缩小光圈然后两眼从目镜观察,转动粗调节器使物镜逐渐上升(或使镜台下降)至发现物像时,改用细调节器调节到物像清楚为止.
移动装片,把合适的观察部位移至视野中心.
(三)高倍镜观察眼睛离开目镜从侧面观察,旋转转换器,将高倍镜转至正下方,注意避免镜头与玻片相懂.
再由目镜观察,仔细调节光圈,使光线的明亮度适宜.
用细调节器校正焦距使物镜清晰为止.
将最适宜观察部位移至视野中心,绘图.
不要移动装片位置,准备用油镜观察.
(四)油镜观察1.
提起镜筒约2cm,将油镜转至正下方.
在玻片标本的镜检部位(镜头的正下方)滴一滴香柏油.
2.
从侧面注视,小心慢慢降下镜筒,使油镜浸在油中至油圈不扩大为止,镜头几乎与装片接触,但不可压及装片,以免压碎玻片,损坏镜头.
3.
将光线调亮,左眼从目镜观察,用粗调节器将镜筒徐徐上升(切忌反方向旋转),当视野中有物像出现时,再用细调节器校正焦距.
如因镜头下降未到位或镜头上升太快末找到物像,必须再从侧面观察,将油镜降下,重复操作直至物像看清为止.
仔细观察并绘图.
4.
再次观察提起镜筒,换上金黄色葡萄球菌染色装片,依次用低倍镜、高倍镜和油镜观察,绘图.
重复观察时可比第一次少加香柏油.
(五)镜检完毕后的工作1.
移开物镜镜头.
2.
取出装片.
3.
清洁油镜,油镜使用完毕后,须用擦镜纸擦去镜头上的香柏油,再用擦镜纸沾少许二甲苯擦掉残留的香柏油,最后再用干净的擦镜纸擦干残留的二甲苯.
4.
擦净显微镜,将各部分还原.
将接物镜呈"八"字形降下,不可使其正对聚光器,同时降下聚光器,转动反光镜使其镜面垂直于镜座.
最后套上镜罩,对号放入镜箱中,置阴凉干燥处存放.
四、注意事项1.
使用油镜必须按先用低倍镜和高倍镜观察,再用油镜观察2.
下降镜头时,一定要从侧面注视,切忌用眼睛对着目镜,边观察边下降镜头的错误操作,以免压碎玻片而损坏镜头.
3.
使用二甲苯擦镜头时,注意二甲苯不能过多,以防溶解固定透镜的树脂.
4.
注意保持显微镜的洁净,对金属部分要用软布擦拭,擦镜头必须用擦镜纸,切勿用手或用普通布、纸等,以免损坏镜头.
五、实验报告分别绘出在高倍镜和油镜下观察到的枯草芽孢杆菌及金黄色葡萄球菌的形态,注明物镜放大倍数和总放大率.
六、问题和思考1.
用油镜便于观察细菌的依据是什么2.
使用油镜应特别注意哪些问题3.
当物镜从低倍镜转到高倍镜和油镜时,对照明度有何要求应如何调节油镜的基本原理(一)油镜头的辨认油镜头上常刻有OI(oilimmersion)或HI(homogeneneousimmersion)字样,有的还刻有一圈红线或黑线标记,在低倍物镜、高倍物镜和油镜3物镜中,油镜的放大倍数和数值孔径(numericalaperture)最大,而工作距离最短(图5—1)图5—1显微镜物镜参数示意图(二)显微镜的分辨率显微镜性能的优劣不单是看它的总放大倍数,更重要的是看它分辩率的大小.
分辨率是指显微镜能分辨出物体两点间最小距离(D)的能力.
D值愈小表明分辨率愈高.
D值与光线的波长(λ)成正比,与物镜的数值孔径(NA)成反比.
从上式可看出,缩短光波长和增大数值孔径都可提高分辨率.
数值孔径指光线投射到物镜上的最大角度(称镜口角,α)的一半正弦与介质折射率(n)的乘积;影响数值孔径大小的因数,一是镜口角,二是介质的折射率.
当镜与装片之间的介质为空气时,由于空气(n=1.
52)的折射率不同,光线会发生折射,不仅使进入物镜的光线减少,降低了视野的照明度,而且会减少镜口角(图5—2A).
当以香柏油(n=1.
515)为介质时,由于它的折射率与玻璃相近,光线经过载玻片后可直接通过香柏油进入物镜而不发生折射(图5—2B),不仅增加了视野的照明度,更重要的是通过增加数值孔径达到提高分辨率的目的.
可见光的波长平均为0.
55μm.
当使用数值孔径为0.
65的高倍镜时,它能辨别两点之间的距离为0.
42μm;而使用数值孔径为1.
25的油镜时,能辨别两点之间的距离则为0.
22μm.
NAD2λ=2sinα*=nNA图5—2介质为空气(A)与介质为香柏油(B)时光线通过的比较实验6细菌形态的观察一、实验目的和内容目的:巩固油镜的使用;掌握细菌形态观察的基本方法,了解细菌的基本形态.
内容:1.
观察细菌的基本形态染色装片.
2.
观察枯草芽孢杆菌活菌.
3.
观察细菌细胞结构的染色装片.
二、实验材料和用具溶血链球菌(Streptococcushaemolyticus)、棒杆菌(Corymebacterium)、螺菌(Spirillum)、浮游球衣菌(Sphaerotilusnatans)、巨大芽孢杆菌(Bacillusmegaterium)、苏云金芽孢杆菌(Bacillusthuringiensis)、普通变形菌(Proteusvulgaris)、丙酮丁醇梭菌(Clostridumacetotylicum)、褐球固氮菌(Azotobacterchroococcum)等细菌的染色装片,枯草芽泡杆菌(Bacillussubis)的斜面菌种.
香柏油、二甲苯、无菌水;显微镜、擦镜纸、接种环、酒精灯、载玻片、盖玻片、吸水纸、小滴管.
三、操作步骤(一)观察细菌的基本形态用低倍镜、高倍镜和油镜观察溶血链球菌、棒杆菌、螺菌、浮游球衣菌的染色装片,并分别在油镜下绘图.
(二)观察细菌的细胞结构用低倍镜、高倍镜和油镜观察巨大芽孢杆菌(示细胞壁)、巨大芽孢杆菌(示异染粒)、苏云金芽孢杆菌(示伴胞晶体)、普通变形菌(示鞭毛)、丙酮丁醇梭菌(示芽孢)、褐球固氮菌(示荚膜)等细菌的染色装片,并分别在油镜下绘图.
(三)观察枯草杆菌活菌,常用压滴法观察.
1.
将洁净无油腻的载片放于自己右边前方,在中央放一小滴无菌水.
2.
将酒精灯放于自己正前方,点燃.
3.
用无菌操作方法从枯草芽孢杆菌斜面中沾取少量菌体,与载片上的水滴充分混匀,把接种环上残留的菌体杀灭后,放回试管架.
4.
用镊子夹一洁净的盖玻片,使其一边先接触菌液,然后将整个盖玻片慢慢放下,注意不要产生气泡.
如菌液过多,可用吸水纸适当吸去一部分.
5.
先用低倍镜然后转用高倍镜观察,观察时光线要适当调暗些.
四、注意事项1.
注意擦镜头时,只能用擦镜纸.
2,观察完毕,必须将镜筒上升,才能取下装片,放入另一装片后,要按使用油镜要求,重新操作,不能在油镜下直接取下和替换装片,切记!
3.
无菌操作过程中,接种环灭菌后不能触及其他物品,挑菌不能过多.
五、实验报告(一)绘图l.
给出你所观察到的几种细菌的个体形态视野图.
2.
给出你所观察到的细菌细胞结构视野图,并注明各部分.
(二)试指出在制备活菌装片时,应注意什么问题七、问题和思考1.
用明视野显微镜观察细菌的形态时,你认为用染色装片好,还是用非染色的活体装片好,为什么观察活体装片与染色装片,光线调节各有什么不同2.
无菌操作过程中,可否将棉塞放在桌面上为什么3试设计一个准备本实验的工作方案.
实验7细菌单染色法及口腔微生物的观察一、实验目的和内容目的:巩固无菌操作技术,掌握细菌的涂片和单染色技术,了解口腔中的微生物及其观察方法.
内容:1.
学习细菌单染色操作技术.
2.
用单染色法或负染色法观察口腔中的微生物.
二、实验材料和用具大肠杆菌(E.
coli)、金黄色葡萄球菌(Staphylocosccusaureus)的斜面菌种.
吕氏美蓝染色液、石炭酸复红染色液、黑色素液或碳素墨水、香柏油、二甲苯、无菌水;显微镜、擦镜纸、接种环、酒精灯、载玻片、吸水纸、无菌牙签.
三、操作步骤(一)单染色法1.
涂片在洁净无脂的载玻片中央滴一小滴无菌水,用无菌操作方法从菌种斜面挑取少量菌体与水滴充分混匀,涂成薄膜,涂布面积约1~1.
5cm2(图7—1A、B).
2.
干燥将涂片于室温中自然干燥.
3.
固定手扶载片一端,使涂菌的一面向上,将载片通过微火2~3次.
在火上固定时,用手摸涂片反面,以不烫手为宜.
不能将载片在火上烤,否则细菌形态毁坏(图7—1C).
4.
染色将涂片置于水平位置,滴加染色液覆盖于涂菌处,染色约2min(图7—1D)5.
水洗倾去染色液,斜置载片,用自来水的细水流由载片上端流下,不得直接冲在涂菌处,直洗至从载片上流下的水中无染色液的颜色为止(图7—1E).
6.
干燥自然晾干或用吸水纸轻轻地吸干,注意不要擦掉菌体(图7—1F).
7.
待标本完全干燥后,先用低倍镜和高倍镜观察,将典型部位移至视野中央,再用油镜观察.
图7—1单染色的方法(二)口腔微生物的观察1.
单染色法(1)在洁净无油腻的载片中央滴一小滴无菌水,用牙签取牙垢少许与水滴充分混匀,涂成薄膜.
(2)将涂片于室温中自然干燥后,按上面单染色法的步骤,进行固定、染色、水洗,干燥后镜检.
2.
负染色法(1)在洁净无油腻的载片的一端滴一小滴无菌水,用牙签取牙垢少许与水滴充分混匀,然后加少许黑色素溶液,充分混匀.
(2)另取一载片将其边缘放在含菌载片的一端,然后推向另一端,则含菌载片上的混合液被推成薄膜.
(3)于室温中自然干燥.
(4)镜检:将光线调亮,先用低倍镜观察,再用高倍镜观察.
四、注意事项载玻片要洁净无脂,否则菌液涂不开.
涂片时,滴水不要过多,挑菌量宜少,菌膜宜薄.
五、实验报告(一)绘图1.
单染色后观察到的大肠杆菌和金黄色葡萄球菌的形态图.
2.
你所观察到的口腔微生物的形态图,并注明使用的染色方法,菌体和背景的颜色.
(二)单染色法和负染色法操作要点.
七、问题和思考1.
涂片在染色前为什么要先进行固定固定时应注意什么问题2.
制备染色装片时应注意哪些事项,为什么制片为什么要完全干燥后才能用油镜观察3.
你知道口腔中通常存在哪些微生物吗如何进行区分实验8细菌的革兰氏染色目的:初步掌握细菌涂片方法及革兰氏染色法步骤.
内容:1.
制作细菌染色装片.
2.
进行革兰氏染色法操作.
二、实验材料和用具苏云金杆菌或金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(E.
coli)菌液,待测菌菌液1~2种.
革兰氏染色液(结晶紫染液、卢戈氏碘液、95%乙醇、石炭酸复红液等)、香柏油、二甲苯;显微镜、擦镜纸、接种环、载玻片、吸水纸、试管、小滴管、酒精灯.
三、操作步骤(一)制片1.
涂菌用无菌操作方法从试管中沾取菌液一环,用接种环在洁净无脂的载玻片上做一薄而均匀、直径约lcm的菌膜.
涂菌后将接种环火焰灭菌.
2.
干燥于空气中自然干燥.
亦可把玻片置于火焰上部略加温加速干燥(温度不宜过高).
3.
固定目的是杀死细菌并使细菌粘附在玻片上,便于染料着色,常用加热法,即将细菌涂片膜向上,通过火焰3次,以热而不烫为宜,防止菌体烧焦、变形.
此制片可用于染色.
(二)染色l.
初染于制片上滴加结晶紫染液,染lmin后,用水洗去剩余染料.
2.
媒染滴加卢戈氏碘液,lmin后水洗.
3.
脱色滴加95%乙醇脱色,摇动玻片至紫色不再为乙醇脱退为止(根据涂片之厚薄需时30s至lmin),水洗.
4.
复染滴加石炭酸复红液复染lmin,水洗.
5.
滤纸吸干,油镜镜检.
(三)结果革兰氏阳性菌染成蓝紫色,革兰氏阴性菌染成淡红色.
(四)检测未知菌用以上方法对未知菌进行革兰氏染色,并绘图、记录染色结果.
四、注意事项1.
涂片务求均匀,切忌过厚.
2.
在染色过程中,不可使染液干涸.
3.
脱色时间十分重要,过长,则脱色过度,会使阳性菌被染成阴性菌;脱色不够,则会使阴性菌被染成阳性菌.
4.
老龄菌因体内核酸减少,会便阳性菌被染成阴性菌,故不能选用.
五、实验报吉(一)绘图1.
大肠杆菌革兰氏染色视野图.
2.
金黄色葡萄球菌或苏云金杆菌革兰氏染色视野图.
(二)记录革兰氏染色法法步骤,并进行结果分析.
(三)未知菌的检测结果.
六、问题和思考1.
涂片后为什么要进行固定固定时应注意什么2.
什么是革兰氏染色法染色过程应注意什么3.
试分析革兰氏染色法在细菌分类中的意义.
实验9细菌鞭毛染色及其运动的观察一、实验目的和内容目的:了解细菌鞭毛染色的原理,掌握鞭毛染色法;学习观察细菌运动的方法.
内容:1.
细菌的鞭毛染色法.
2.
用压滴法观察细菌的运动.
3.
用悬滴法观察细菌的运动.
二、实验材料和用具普通变形菌(Proteusvulgaris)、金黄色葡萄球菌(Staphylococcusaureus).
牛肉膏蛋白胨培养基斜面、鞭毛染色液、0.
01%美蓝水溶液、香柏油、二甲苯、无菌水、凡士林;显微镜、擦镜纸、接种环、酒精灯、载玻片、凹载玻片、盖玻片、镊子、细玻棒、吸水纸.
三、操作步骤(一)细菌鞭毛染色1.
活化菌种将保存的变形菌在新制备的普通牛肉膏蛋白胨斜面培养基上连续移种2~3次,每次于30℃培养10~15h.
活化后菌种备用.
2.
制片在干净载玻片的一端滴一滴蒸馏水,用无菌操作法,以接种环从活化菌种中取少许菌苔(注意不要带培养基),在载玻片的水滴中轻沾几下.
将载玻片稍倾斜,使菌液随水滴缓缓流到另一端,然后平放,于空气中干燥.
3.
染色(1)滴加鞭毛染色液A液,染3~5min.
(2)用蒸馏水充分洗净A液,使背景清洁.
(3)将残水沥干或用B液冲去残水.
(4)滴加B液,在微火上加热使微冒蒸汽,并随时补充染料以免干涸,染30~60S.
(5)待冷却后,用蒸馏水轻轻冲洗干净,自然干燥或滤纸吸干.
4.
镜检先用低倍镜和高倍镜找到典型区域,然后用油镜观察.
菌体为深褐色,鞭毛为褐色.
注意观察鞭毛着生位置(镜检时应多找几个视野,有时只在部分涂片上染出鞭毛).
(二)细菌运动的观察1.
压滴法(1)制备菌液:从幼龄菌斜面上,挑数环菌放在装有1~2mL无菌水的试管中,制成轻度混浊的菌悬液.
(2)取2~3环稀释菌液于洁净载玻片中央,再加入一环0.
01%的美蓝水溶液,混匀.
(3)用镊子夹一洁净的盖玻片,先使其一边接触菌液,然后慢慢地放下盖玻片,这样可防止产生气泡.
(4)镜检:将光线适当调暗,先用低倍镜找到观察部位,再用高倍镜观察.
要区分细菌鞭毛运动和布朗运动,后者只是在原处左右摆动,细菌细胞间有明显位移者,才能判定为有运动性.
2.
悬滴法(1)取洁净盖玻片,在四周涂少许凡士林.
(2)在盖玻片中央滴一小滴菌液(图9—1A)(3)将凹玻片的凹窝向下,使凹窝中心对准盖玻片中央的菌液(图9-1B),轻轻地盖在盖玻片上,便凹玻片与盖玻片粘在一起(注意液滴不得与凹玻片接触).
(4)小心将玻片翻转过来,使菌液正好悬在窝的中央.
再用火柴棒轻压盖玻片四周使封闭,以防菌液干燥.
(5)镜检:将光线适当调暗,先用低倍镜找到悬滴的边缘后(图9—1D),再将菌液移至视野中央,换用高倍镜观察,注意细菌是如何运动的,它与分子布朗运动的不同.
图9—1悬滴标本的制备四、注意事项1.
鞭毛染色液最好当日配置当日用,次日使用则鞭毛染色浅,观察效果差.
染色时一定要充分洗净A液后再加B液,否则背景不清晰.
2.
观察细菌的运动,载玻片和盖玻片都要洁净无油,否则会影响细菌的运动.
有些细菌,温度太低时不能运动.
五、实验报告1.
绘出你所观察到的细菌的形态及鞭毛着生情况.
2.
试描述你所观察的细菌有无运动性,是如何运动的六、问题和思考1.
鞭毛染色的菌种为什么要先连续传几代,并且要采用幼龄菌种2.
根据你的实验体会,哪些因素影响鞭毛染色的效果如何控制3.
试设计一实验,如何鉴别某种细菌是否能运动,是否有鞭毛,其鞭毛的着生位置.
实验10细菌芽孢、荚膜的染色及观察一、实验目的和内容目的:掌握细菌的芽孢及荚膜染色方法.
内容:1.
细菌的芽泡染色.
2.
细菌的荚膜染色.
二、实验材料和用具枯草芽孢杆菌、褐球固氮菌的斜面菌种.
二甲苯、香柏油、蒸馏水、5%孔雀绿水溶液、0.
5%沙黄水溶液(或0.
05%碱性复红)、绘图墨水(用滤纸过滤后备用)、95%乙醇、石炭酸复红染液;显微镜、接种环、酒精灯、载玻片、盖玻片、小试管(l*6.
5cm)、烧杯(300mL)、滴管、试管夹、擦镜纸、吸水纸.
三、操作步骤(一)芽孢染色法1.
方法1(1)取37℃培养18~24h的枯草芽孢杆菌作涂片,并干燥,固定(参见"细胞单染色法").
(2)于涂片上滴人3~5滴5%孔雀绿水溶液.
(3)用试管夹夹住载玻片在火焰上用微火加热,自载玻片上出现蒸汽时,开始计算时间约4~5min.
加热过程中切勿使染料蒸干,必要时可添加少许染料.
(4)倾去染液,待玻片冷却后,用自来水冲洗至孔雀绿不再褪色为止.
(5)用0.
5%沙黄水溶液(或0.
05%碱性复红)复染lmin,水洗.
(6)制片干燥后用油镜观察.
芽孢呈绿色,菌体红色.
2.
方法2(1)加1~2滴自来水于小试管中,用接种环从斜面上挑取2~3环培养18~24h的枯草芽孢杆菌菌苔于试管中,并充分混匀打散,制成浓稠的菌液.
(2)加5%孔雀绿水溶液2~3滴于小试管中,用接种环搅拌使染料与菌液充分混合.
(3)将此试管浸于沸水浴(烧杯)中,加热15~20min.
(4)用接种环从试管底部挑数环菌于洁净的载玻片上,并涂成薄膜,将涂片通过微火3次固定.
(5)水洗,至流出的水中无孔雀绿颜色为止.
(6)加沙黄水溶液,染2~3min后,倾去染液,不用水洗,直接用吸水纸吸干.
(7)干燥后用油镜观察.
芽孢绿色,菌体红色.
(二)荚膜染色法1.
石炭酸复红染色(1)取培养了72h的褐球固氮菌制成涂片,自然干燥(不可用火焰烘干).
(2)滴入1~2滴95%乙醇固定(不可加热固定).
(3)加石炭酸复红染液染色1~2min,水洗,自然干燥.
(4)在载玻片一端加一滴墨汁,另取一块边缘光滑的载玻片与墨汁接触,再以匀速推向另一端,涂成均匀的一薄层,自然干燥.
(5)干燥后用油镜观察.
菌体红色,荚膜无色,背景黑色.
2.
背景染色(1)先加1滴墨水于洁净的玻片上,并挑少量褐球固氮菌与之充分混合均匀.
(2)放一清洁盖玻片于混合液上,然后在盖玻片上放一张滤纸,向下轻压,吸收多余的菌液.
(3)干燥后用油镜观察.
背景灰色,菌体较暗,在其周围呈现一明亮的透明圈即荚膜.
四、注意事项1.
荚膜染色涂片不要用加热固定,以免荚膜皱缩变形.
2.
供芽孢染色用的菌种应控制菌龄,使大部分芽孢仍保留在菌体上为宜.
五、实验报告(一)绘图1.
枯草芽孢杆菌及巨大芽孢杆菌的菌体及芽孢形态,芽孢的着生位置.
2.
褐球固氮菌菌体及荚膜的形态.
(二)试制片,但不进行染色,观察是否能看到芽孢和荚膜七、问题和思考1.
为什么芽孢染色要加热为什么芽孢及营养体能染成不同的颜色2.
组成荚膜的成分是什么涂片一般用什么固定方法,为什么3.
试设计实验如何鉴定某一产芽孢菌株的芽孢形态、着生位置及所属分类地位.
实验11放线菌的形态观察一、实验目的和内容目的:辨认放线菌的营养菌丝、气生菌丝、孢子丝、孢子的形态;学习放线菌的观察方法.
内容:用水封计法、玻璃纸法、印片法观察放线菌的形态特征.
二、实验材料和用具细黄链霉菌(streptomycsmicuoflavus)又称5406的培养平皿,棘孢小单孢菌(Micromonosporaechinospora)的玻璃纸培养平皿.
0.
1%美蓝染色液、石炭酸复红染色液;盖玻片、载玻片、镊子、接种环、显微镜、涂布器、玻璃纸、打孔器.
三、操作步骤(一)观察自然生长状态的放线菌用镊子小心取出用插片法培养的5406菌培养皿中的一张盖玻片,将其背面附着的菌丝体擦净.
然后将长有菌的一面向上放在洁净的载玻片上,用低倍镜、高倍镜观察.
找出3类菌丝及其分生孢子,并绘图.
注意放线菌的基内菌丝、气生菌丝的粗细和色泽差异.
(二)水封片观察取一滴美蓝染色液置于载玻片中央,将用搭片法培养棘孢小单孢菌培养皿中的盖玻片取出,并将有菌面朝下,放在载玻片上,浸在染色液中,制成水封片,用高倍镜观察其单个分生孢子及其基内菌丝,并绘图.
(三)玻璃纸法的镜检观察l.
直接玻璃纸观察分别用5406和棘孢小单孢菌的玻璃纸制片观察.
制片时,于载玻片上放一小滴蒸馏水,将含菌玻璃纸片小心剪下一小块,移至载玻片上,并使有菌面向上.
在玻璃纸与载玻片间不能有气泡,以免影响观察.
将制片于显微镜下观察,先用低倍镜观察菌的立体生长状况,再用高倍镜仔细观察.
注意区分5406菌的基内菌丝、气生菌丝和弯曲状或螺旋状的孢子丝.
观察棘孢小单孢菌时注意把视野调暗,其基内菌丝纤细发亮,其单个分生孢子发暗,直接生长在基内菌丝长出的小梗上.
绘图.
2.
印片染色法观察用镊子取洁净载玻片并微微加热,然后用这微热载玻片盖在长有5406或棘孢小单孢菌的平皿上,轻轻压一下,注意将载玻片垂直放下和取出,以防载玻片水平移动而破坏放线菌的自然形态.
反转有印痕的载玻片微微加热固定.
用石炭酸复红染色lmin,水洗,晾干.
用油镜观察.
绘图.
注意比较两种菌的形态特征有何不同.
四、注意事项1.
培养放线菌中要注意,放线菌的生长速度较慢,培养期较长,在操作中应特别注意无菌操作,严防杂菌污染.
2.
玻璃纸法培养接种时注意玻璃纸与平板琼脂培养基间不宜有气泡,以免影响其表面放线菌的生长,3.
不同观察方法中严格按要求进行,注意菌体的上下位置.
五、实验报告1.
绘图玻璃纸法、水封片法、印片法及自然生长状态下观察的放线菌形态.
2.
试比较5406菌与棘孢小单孢菌特征的异同.
六、问题和思考1.
在高倍镜或油镜下如何区分放线菌的基内菌丝和气生菌丝2.
用插片法和搭片法如何制备放线菌标本,其主要优点是什么可否用此法观察其他微生物为什么3.
以玻璃纸覆盖法培养和观察放线菌有何优点试用此法设计一个观察青霉菌形态的实验.
注:(一)插片法和搭片法培养放线菌1.
插片法(1)制平板、接种:用冷却至约50℃的高氏1号琼脂培养基倒平板(每皿约20mL),可用两种方法接菌:1、先接种后插片:冷凝后用接种环挑取少量斜面上的5406菌孢子,用平板培养基的一半面积作来回划线接种(接种量可适当加大);2、先插片后接种:用平板培养基的另一半面积进行.
(2)插片及培养:用无菌镊子取无菌盖玻片,在已接种平板上以45°角斜插入培养基内,插人深度约占盖玻片1/2长度(图11-1A).
同时,在另一半未经接种的部位以同样方式插入数块盖玻片,然后接种少量5406菌孢子至盖玻片一侧的基部,且仅接种于其中央位置约占盖玻片长度的一半左右,以免菌丝蔓延至盖玻片的另一侧.
将插片平板倒置于28℃,培养3~7d.
2.
搭片法(1)开槽及接种:用无菌打孔器在凝固后的平板培养基上打洞数个,并将棘孢小单孢菌孢子划线接种至洞内边缘.
(2)搭片及培养:在接种后的洞面上放一无菌盖玻片,平板倒置于28℃,培养3~7d(图11—1B).
(二)玻璃纸法固体培养5406菌和棘孢小单孢菌1.
玻璃纸灭菌将玻璃纸剪成比培养皿直径略小的片状,将滤纸剪成培养皿大小的圆形纸片并稍润湿,然后把滤纸和玻璃纸交互重叠地放在培养皿中,借滤纸将玻璃纸隔开.
然后进行湿热灭菌,备用.
图11—1放线菌的插片与搭片培养示意图A.
插片法;B.
搭片法2.
制平板及铺玻璃纸取冷凝后的高氏1号琼脂培养基,用无菌镊子将预先灭菌的块状玻璃纸平铺至平板培养表面,铺玻璃纸时可用无菌涂布器将玻璃纸与培养基之间的气泡除去.
3.
涂布菌液及培养取0.
lmL的孢子悬液涂布在铺有玻璃纸的平板培养基表面.
接种平板倒置于28℃,培养5~7d.
实验12酵母菌的形态观察一、实验目的和内容目的:了解自然存在的酵母菌及其形态结构.
了解酵母菌产生子囊孢子的条件及其形态.
内容:1.
观察酵母菌个体形态.
2.
观察酵母菌的假菌丝和繁殖过程.
3.
观察自然状态的酵母菌.
二、实验材料和用具酿酒酵母(Saccharomyescerevisiae)、热带假丝酵母(Candidatropicalis)斜面菌种.
PDA培养基、麦氏(McCLary)培养基(醋酸钠培养基)、0.
05%美蓝染色液(以pH6.
0的0.
02mol/L磷酸缓冲液配制)、碘液、0.
04%的中性红染色液%孔雀绿,0.
5%沙黄液、95%乙醇;显微镜、载玻片、擦镜纸、盖玻片、接种环、V形玻璃棒、放置一个三角形玻璃棒支架的培养皿.
三、操作步骤(一)酵母菌形态观察1.
酵母菌的话体染色观察及死亡率的测定(1)以无菌水洗下PDA斜面培养的酿酒酵母菌苔,制成菌悬液.
(2)取0.
05%美蓝染色液1滴,置载玻片中央,并用接种环取酵母菌悬液与染色液混匀,染色2~3min,加盖玻片,在高倍镜下观察酵母菌个体形态,区分其母细胞与芽体,区分死细胞(蓝色)与活细胞(不着色).
(3)在一个视野里计数死细胞和活细胞,共计数5~6个视野.
酵母菌死亡率一般用百分数来表示,以下式来计算:死亡率=死细胞总数÷死活细胞总数*100%2.
酵母菌液泡系的话体观察于洁净载玻片中央加一滴中性红染色液,取少许上述酵母菌悬液与之混合,染色5min,加盖玻片在显微镜下观察.
细胞无色,液泡呈红色.
3.
酵母菌细胞中肝糖粒的观察将1滴碘液置于载玻片中央,接人上述酵母菌悬液,混匀,盖上盖玻片,显微镜观察,细胞内的贮藏物质肝糖颗粒呈深红色.
4.
酵母菌子囊孢子的观察(1)活化酿酒酵母:将酿酒酵母接种至新鲜的麦芽汁培养基上,置28C培养2~3d,然后再移植2~3次.
(2)转接产孢培养基:将活化的酿酒酵母转接至醋酸钠培养基上,置30℃恒温培养14d.
(3)观察:挑取少许产孢菌苔于载玻片的水滴上,经涂片、热固定后,加数滴孔雀绿,lmin后水洗,加95%乙醇30S,水洗,最后用0.
5%沙黄液复染30S,水洗去染色液,最后用吸水纸吸干.
制片干燥后,镜检,子囊孢子呈绿色,子囊为粉红色.
注意观察子囊孢子的数目、形状和子囊的形成率.
(4)计算子囊形成的百分率:计数时随机取3个视野,分别计数产子囊孢子的子囊数和不产孢子的细胞,然后按下列公式计算:子囊形成率(%)=3个视野中形成子囊的总数÷3个视野中(形成子囊的总数+不产孢子细胞总数)*100%5.
酵母菌假菌丝的观察取一无菌载玻片浸于溶化的PDA培养基中,取出放在温室培养的支架上,待培养基凝固后,进行酵母菌划线接种,然后将无菌盖玻片盖在接菌线上(图12—1),28℃培养2~3d后,取出载玻片,擦去载玻片下面的培养基,在显微镜下直接观察.
可见到芽殖酵母形成的藕节状假菌丝,裂殖酵母则形成竹节状假菌丝(图12—2).
图12—1酵母菌假菌丝的培养图12—2酵母菌的假菌丝形态A.
藕节状假菌丝;B.
竹节状假菌丝6.
自然状态下的酵母菌观察取一滴美蓝染色液于载玻片中央,春夏秋季取酱油或淹菜上的白膜,冬季取腌酸菜汤上的白膜,将其置于载玻片染色液中,盖上盖玻片,显微镜下仔细观察酵母菌形态,出芽生殖,假菌丝等.
四、注意事项1.
用于活化酵母菌的麦芽汁培养基要新鲜、表面湿润.
2.
在产孢培养基上加大移种量,可提高子囊形成率.
3.
通过微加热增加酵母的死亡率,易于观察死亡细胞.
五、实验报告(一)绘图1.
数个酵母菌细胞,示观察到的结构.
2.
数个子囊及子囊孢子形态图.
(二)记录并计数酵母菌的死亡率及子囊形成率(原始记录及计算结果).
六、问题和思考1.
酵母菌的假菌丝是怎样形成的与霉菌的真菌丝有何区别2.
如何区别营养细胞和释放出的子囊孢子3.
试设计一个从子囊中分离子囊孢子的试验方案.
注:酵母菌的简易培养配2%葡萄糖水(或自糖水),煮沸,装入三角瓶中(液面高度2~2cm),加HCl调至pH3~5放入几块葡萄皮(或其他糖分较高的果皮),置5~28℃温箱中培养2~3d,闻到酒香味后,即可取培养液镜检.
实验13霉菌的形态观察一、实验目的和内容目的:了解霉菌形态,掌握微生物载玻片湿室培养方法.
内容:1.
霉菌载玻片湿室培养.
2.
曲霉、青霉、根霉、毛霉形态观察.
3.
根霉假根的观察.
二、实验材料和用具产黄青霉(Penicfilliumchrysogenum)、黑曲霉(Aspergillusniger)、黑根霉(Rhizopusnigrians)、总状毛霉(Mucorracemosus)等斜面菌种.
半固体PDA培养基、乳酸苯酚固定液、棉蓝染色液、20%甘油;透明胶带、剪刀、培养皿、载玻片、口形玻棒搁架、盖玻片、圆形滤纸片、细口滴管、镊子、显微镜、接种环.
三、操作步骤(一)霉菌的载玻片湿室培养可4人合作,每人制作一霉菌的载玻片.
1.
准备湿室在培养皿底铺一张圆形滤纸片,其上放一"冂"形载玻片搁架,在搁梁上放一块载玻片和两块盖玻片,盖上皿盖,外用纸包扎,经12lC湿热灭菌30min后,置60℃烘箱中烘干,备用.
2.
接种用接种环挑取少量待观察的霉菌孢子至湿室内的载玻片上,每张载玻片可接同一菌种的孢子两处.
接种时只要将带菌的接种环在载玻片上轻轻碰几下即可(务必记住接种的位置).
3.
加培养基用无菌细口滴管吸取少量融化约60℃的培养基,滴加到载玻片的接种处,培养基应滴得圆而薄,其直径约为0.
5cm(滴加量一般以l/2小滴为宜).
4.
加盖玻片在培养基未彻底凝固前.
用无菌镊子将皿内盖玻片盖在琼脂块薄层上,用镊子轻压,使盖玻片和载玻片间的距离相当接近,但不能压扁,否则不透气.
5.
倒保湿剂每皿倒大约3mL20%的无菌甘油,使皿内的滤纸完全润湿,以保持皿内湿度,皿盖上注明菌名、组别和接种日期.
此为制成的载玻片湿室,置28℃恒温培养3~5d.
(二)黑根霉假根的培养将融化的PDA培养基,冷却至50℃倒入无菌平皿,其量约为平皿高度的l/2.
冷凝后,用接种环沾取根霉孢子,在平板表面划线接种.
然后将平皿倒置,在皿盖内放一无菌载玻片,于28℃培养2~3d后,可见根霉的气生菌丝倒挂成胡须状,有许多菌丝与载玻片接触,并在载玻片上分化出假根和匍匐菌丝等结构(图13—1).
图13—1根霉假根的培养(三)镜检观察1.
湿室培养霉菌镜检载玻片从培养16~20h开始,通过连续观察,可了解孢子的萌发、菌丝体的生长分化和子实体的形成过程.
将湿室内的载玻片取出,直接置于低倍镜和高倍镜下观察曲霉、青霉、毛霉、根霉等霉菌的形态,重点观察菌丝是否分隔,曲霉和青霉的分生孢子形成特点,曲霉的足细胞,根霉和毛霉的孢子囊和孢囊孢子.
绘图.
2.
粘片观察取一滴棉蓝染色液置于载玻片中央,取一段透明胶带,打开霉菌平板培养物,粘取菌体,粘面朝下,放在染液上.
镜检.
3.
假根观察将培养根霉假根的平皿打开,取出皿盖内的载玻片标本,在附着菌丝体的一面盖上盖玻片,置显微镜下观察.
只要用低倍镜就能观察到假根及从根节上分化出的孢子囊梗、孢子囊、孢囊孢子和两个假根间的匍匐菌丝,观察时注意调节焦距以看清各种构造.
4.
制成永久装片把观察到霉菌形态较清晰,完整的片子,制成标本作较长期保存.
制备方法是,轻轻揭去盖玻片,如果载玻片上有琼脂,仔细挑去,然后滴加少量乳酸苯酚固定液,盖上清洁盖玻片,在盖玻片四周滴加树胶封固.
四、注意事项载玻片湿室培养时,盖玻片不能紧贴载玻片,要彼此有极小缝隙,一是为了通气;二是使各部分结构平行排列,易于观察.
五、实验报告(一)绘制镜检形态图1.
毛霉和根霉形态图,示各部.
2.
青霉和曲霉形态图,示各部(二)载玻片观察记录各菌种的载玻片标本观察结果:菌种菌丝体(气生菌丝、营养菌丝的粗细、色泽、菌丝有隔或无隔等)无性孢子特征(孢子梗的分化特征,孢子着生特征等)其他特征结构(有无假根、足细胞匍匐菌丝、囊轴等)六、问题和思考1.
什么叫载玻片湿室培养它适用于观察怎样的微生物,有何优点2.
湿室培养时为何用20%甘油作保湿剂3.
本实验中观察假根的设计原理是什么此设计还适合于培养哪类菌.
实验14细菌大小的测定一、实验目的和内容目的:学会测微尺的使用和计算方法及对球菌和杆菌的测量.
内容:1.
认识测微尺,学习目镜测微尺的标定.
2.
测定金黄色葡萄球菌和大肠杆菌菌体的大小.
二、实验材料和用具金黄色葡萄球菌、大肠杆菌的玻片标本.
香柏油、二甲苯;显微镜、目镜测微尺、镜台测微尺、擦镜纸.
三、操作步骤l.
测微尺的构造显微镜测微尺是由目镜测微尺和镜台接物测微尺组成,目镜测微尺是一块圆形玻璃片,其中有精确的等分刻度,在5mm刻尺上分50份(图14一lC).
目镜测微尺每格实际代表的长度随使用接目镜和接物镜的放大倍数而改变,因此在使用前必须用镜台测微尺进行标定.
镜台测微尺为一专用中央有精确等分线的载玻片(图14—1A),一般将长为1mm的直线等分成100个小格,每格长0.
0lmm即10μm,是专用于校正目镜测微尺每格长度的.
2.
目镜测微尺的标定把目镜的上透镜旋开,将目镜测微尺轻轻放在目镜的隔板上,使有刻度的一面朝下.
将镜台测微尺放在显微镜的载物台上,使有刻度的一面朝上.
先用低倍镜观察,调焦距,待看清镜台测微尺的刻度后,转动目镜,使目镜测微尺的刻度与镜台测微尺的刻度相平行,并使两尺左边的一条线重合,向右寻找另外一条两尺相重合的直线(图15—lB).
3.
计算方法标定公式:目镜测微尺每格长度(μm)=两条重合线间镜台测微尺的格数*10÷两条重合线间目镜测微尺的格数例如,目镜测微尺20个小格等于镜台测微尺3小格,已知镜台测微尺每格为10μm,则3小格的长度为3*10=30μm,那么相应地在目镜测微尺上每小格长度为3*10÷20=1.
5μm.
用以上计算方法分别校正低倍镜、高倍镜及油镜下目镜测微尺每格实际长度.
4.
菌体大小的测定将镜台测微尺取下,分别换上大肠杆菌及金黄色葡萄球菌玻片标本,先在低倍镜和高倍镜下找到目的物,然后在油镜下用目镜测微尺测量菌体的大小.
先量出菌体的长和宽占目镜测微尺的格数,再以目镜测微尺每格的长度计算出菌体的长和宽.
并详细记录于表15—1中.
例如,目镜测微尺在这架显微镜下,每格相当于1.
5μm,测量的结果,若菌体的平均长度相当于目镜测微尺的2格,则菌体长应为3*1.
5μm=3.
0μm.
一般测量菌体的大小,应测定10~20个菌体,求出平均值,才能代表该菌的大小.
四、注意事项1.
镜台测微尺的玻片很薄,在标定油镜头时,要格外注意,以免压碎镜台测微尺或损坏镜头.
2.
标定目镜测微尺时要注意准确对正目镜测微尺与镜台测微尺的重合线.
五、演示1.
目镜测微尺、镜台测微尺的显微镜下示教.
2.
标定及测量方法示范.
六、实验报告1.
目镜测微尺标定结果:低倍镜下倍目镜测微尺每格长度是μm.
高倍镜下倍目镜测微尺每格长度是μm.
油镜下倍目镜测微尺每格长度是μm.
2.
菌体大小测定结果:大肠杆菌测定结果金黄色葡萄球菌的直径大小测定结果目镜测微尺格数实际长度菌号宽长宽长目镜测微尺格数实际直径/m12345678910均值试与己知的大肠杆菌和金黄色葡萄球菌的大小作一比较是否一致为何七、问题和思考1.
为什么更换不同放大倍数的目镜和物镜时必须重新用镜台测微尺对目镜微尺进行标定2.
若目镜不变,目镜测微尺也不变,只改变物镜,那么目镜测微尺每格所测量的镜台上的菌体细胞的实际长度(或宽度)是否相同为什么实验15微生物数量的测定细菌群体生长表现为细胞数目的增加或细胞物质的增加.
测定细胞数目的方法有显微镜直接计数法(directmicroscopiccount)、平板菌落计数法(platecount)、光电比油法(turbidityestimationbyspectrophotometer)、最大或然数法(mostprobablenumberMPN)以及膜过滤法(membranefiltration)等.
测定细胞物质的方法有细胞干重的测定,细胞某种成分如氮的含量、RNA和DNA的含量测定,代谢产物的测定等.
总之,测定微生物生长量的方法很多,各有优缺点,工作中应根据具体情况要求加以选择.
本实验主要介绍生产、科研工作中比较常用的显微镜直接计数法、平板菌落计数法和光电比浊计数法.
一显微镜直接计数法(一)目的要求1.
明确血细胞计数板计数的原理.
2.
掌握使用血细胞计数板进行微生物计数的方法.
(二)基本原理显微镜直接计数法是将小量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器),于显微镜下直接计数的一种简便、快速、直观的方法.
目前国内外常用的计菌器有:血细胞计数板、Peteroff-Hauser计菌器以及Hawksley计菌器等,它们都可用于酵母、细菌、霉菌孢子等悬液的计数,基本原理相同.
后两种计菌器由于盖上盖玻片后,总容积为0.
02mm3,而且盖玻片和载波片之间的距离只有0.
02mm,因此可用油浸物镜对细菌等较小的细胞进行观察和计数.
除了用这些计菌器外,还有在显微镜下直接观察涂片面积与视野面积之比的估算法,此法一般用于牛乳的细菌学检查.
显微镜直接计数法的优点是直观、快速、操作简单.
但此法的缺点是所测得的结果通常是死菌体和活菌体的总和.
目前已有一些方法可以克服这一缺点,如结合活菌染色微室培养(短时间)以及加细胞分裂抑制剂等方法来达到只计数活菌体的目的.
本实验以血球计数板为例进行显微镜直接计数.
另外两种计菌器的使用方法可参看各厂商的说明书.
用血细胞计数板在显微镜下直接计数是一种常用的微生物计数方法.
该计数板是一块特制的载玻片,其上由四条槽构成三个平台;中间较宽的平台又被一短横槽隔成两半,每一边的平台上各列有一个方格网,每个方格网共分为九个大方格,中间的大方格即为计数室.
血细胞计数板构造如图l5-1.
计数室的刻度一般有两种规格,一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格(图15—2);另一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格,但无论是哪一种规格的计数板,每一个大方格中的小方格都是400个.
每一个大方格边长为lmm,则每一个大方格的面积为lmm2,盖上盖玻片后,盖玻片与载玻片之间的高度为0.
lmm,所以计数室的容积为0.
lmm3(万分之一毫升).
图15—1血细胞计数板构造(一)图15—2血细胞计数板构造(二)A.
正面图;B.
纵切面图;放大后的方格网,中间大方格为计数室1.
血细胞计数板;2.
盖玻片;3.
计数室计数时,通常数五个中方格的总菌数,然后求得每个中方格的平均值,再乘上25或16,就得出一个大方格中的总菌数,然后再换算成lml菌液中的总菌数.
设五个中方格中的总菌数为A,菌液稀释倍数为B,如果是25个中方格的计数板,则1mL菌液中的总菌数=A/5*25*104*B=50000A·B(个)同理,如果是16个中方格的计数板,1mL菌液中的总菌数=A/5*16*104*B=32000A·B(个)(三)器材1.
菌种酿酒酵母2.
仪器或其他用具血细胞计数板,显微镜,盖玻片,无菌毛细滴管.
(四)操作步骤l.
菌悬液制备以无菌生理盐水将酿酒酵母制成浓度适当的菌悬液.
2.
镜检计数室在加样前,先对计数板的计数室进行镜检.
若有污物,则需清洗,吹干后才能进行计数.
3.
加样品将清洁干燥的血细胞计数板盖上盖玻片,再用无菌的毛细滴管将摇匀的酿酒酵母菌悬液由盖玻片边缘滴一小滴,让菌液沿缝隙靠毛细渗透作用自动进入计数室,一般计数室均能充满菌液.
取样时先要摇匀菌液;加样时计数室不可有气泡产生.
4.
显微镜计数加样后静止5min,然后将血细胞计数板置于显微镜载物台上,先用低倍镜找到计数室所在位置,然后换成高倍镜进行计数.
调节显微镜光线的强弱适当,对于用反光镜采光的显微镜还要注意光线不要偏向一边,否则视野中不易舌清楚计数室方格线,或只见竖线或只见横线.
在计数前若发现菌液太浓或太稀,需重新调节稀释度后再计数.
一般样品稀释度要求每小格内约有5~10个菌体为宜.
每个计数室选5个中格(可选4个角和中央的一个中格)中的菌体进行计数.
位于格线上的菌体一般只数上方和右边线上的.
如遇酵母出芽,芽体大小达到母细胞的一半时,即作为两个菌体计数.
计数一个样品要从两个计数室中计得的平均数值来计算样品的含菌量.
5.
清洗血细胞计数板使用完毕后,将血细胞计数板在水龙头用水冲洗干净,切勿用硬物洗刷,洗完后自行晾干或用吹风机吹干.
镜检,观察每小格内是否有残留菌体或其他沉淀物.
若不干净,则必须重复洗涤至干净为止.
(五)实验报告l.
结果将结果记录于下表中.
A表示五个中方格中的总菌数;B表示菌液稀释倍数.
各中格中菌数12345AB二室平均值菌数/ml第一室第二室2.
思考题(1)根据你的体会,说明用血细胞计数板计数的误差主要来自哪些方面应如何尽量减少误差.
力求准确(2)某单位要求知道一种干酵母粉中的活菌存活率,请设计1~2种可行的检测方法.
二平板菌落计数法(一)目的要求学习平板菌落计数的基本原理和方法.
(二)、基本原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞.
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数.
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可来自样品中的2~3或更多个细胞.
因此平板菌落计数的结果往往偏低.
为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(colony-formingunits,cfu)而不以绝对菌落数来表示样品的活菌含量.
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是,由于该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测.
(三)器材1.
菌种大肠杆菌菌悬液.
2.
培养基牛肉膏蛋白陈培养基.
3.
仪器或其他用具lm1无菌吸管,无菌平皿,盛有4.
5ml无菌水的试管,试管架,恒温培养箱等.
(四)操作步骤l.
编号取无菌平皿9套,分别用记号笔标明10-4、10-5、10-6.
(稀释度)各3套.
另取6支盛有4.
5mL无菌水的试管,依次标是10-1、10-2、10-3、10-4、10-5、10-6.
2.
稀释用lmL无菌吸管吸取lmL已充分混匀的大肠杆菌菌县液(待测样品),精确地放0.
5ml至10-1的试管中,此即为10倍稀释.
将多余的菌液放回原菌液中.
将10-1试管置试管振荡器上振荡,使菌液充分混匀.
另取一支lml吸管插入10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀.
吹吸菌液时不要太猛太快,吸时吸管伸人管底,吹时离开液面,以免将吸管中的过滤棉花浸湿或使试管内液体外溢.
用此吸管吸取10-1菌液lmL,精确地放0.
5mL至10-2试管中,此即为100倍稀释.
……其余依次类推,整个过程如图15-3所示.
放菌液时吸管尖不要碰到液面,即每一支吸管只能接触一个稀释度的菌悬液,否则稀释不精确,结果误差较大.
3,取样用三支1mL无菌吸管分别吸取10-4、10-5和10-6.
的稀释菌悬液各lmL,对号放入编好号的无菌平皿中,每个平皿放0.
2mL.
不要用lmL吸管每次只靠吸管尖部吸0.
2mL稀释菌液放入平皿臼,这样容易加大同一稀释度几个重复平板间的操作误差.
图15—3平板菌落计数操作步骤4.
倒平板.
尽快向上述盛有不同稀释度菌液的平皿中倒入融化后冷却至45℃左右的牛肉膏蛋白胨培养基约15毫升/平皿,置水平位置迅速旋动平皿,使培养基与菌液混合均匀,而又不使培养基荡出平皿或溅到平皿盖上.
由于细菌易吸附到玻璃器皿表面,所以菌液加入到培养皿后,应尽快倒入融化并于已冷却至45℃左右的培养基,立即摇匀,否则细菌将不易分散或长成的菌落连在一起,影响计数.
待培养基凝固后,将平板倒置于37℃恒温培养箱中培养.
5.
计数培养48h后,取出培养平板,算出同一稀释度三个平板上的菌落平均数,并按下列公式进行计算,每毫升中菌落形成单位(cfu)=同一稀释度三次重复的平均菌落数*稀释倍数*5一般选择每个平板上长有30~300个菌落的稀释度计算每毫升的含菌量较为合适.
同一稀释度的三个重复对照的菌落数不应相差很大,否则表示试验不精确.
实际工作中同一稀释度重复对照平板不能少于三个,这样便于数据统计,减少误差.
由10-4、10-5、10-6三个稀释度计算出的每毫升菌液中菌落形成单位数也不应相差太大.
平板菌落计数法,所选择倒平板的稀释度是很重要的.
一般以三个连续稀释度中的第二个稀释度倒平板培养后所出现的平均菌落数在50个左右为好,否则要适当增加或减少稀释度加以调整.
平板菌落计数法的操作除上述倾注倒平板的方式以外,还可以用涂布平板的方式进行.
二者操作基本相同,所不同的是后者先将牛肉膏蛋白胨培养基融化后倒平板,待凝固后编号,并于37℃左右的温箱中烘烤30min,或在超静工作台上适当吹干,然后用无菌吸管吸取稀释好的菌液对号接种于不同稀释度编号的平板上,并尽快用无菌玻璃涂棒将菌液在平板上涂布均匀,平放于实验台上20~30min,使菌液渗入培养基表层内,然后倒置37℃的恒温箱中培养24~48h.
涂布平板用的菌悬液量一般以0.
1ml较为适宜,如果过少菌液不易涂布开,过多则在涂布完后或在培养时菌液仍会在平板表面流动,不易形成单菌落.
五、实验报告1.
结果2.
将培养后菌落计数结果填入下表稀释度10-410-510-6Cfu数/平板123平均123平均123平均每毫升中的cfu2.
思考题(1)为什么融化后的培养基要冷却至45℃左右才能倒平板(2)要使平板菌落计数准确,需要掌握哪几个关键为什么(3)试比较平板菌落计数法和显微镜下直接计数法的优缺点及应用.
(4)当你的平板上长出的菌落不是均匀分散的而是集中在一起时,你认为问题出在哪里(5)用倒平板法和涂布法计数,其平板上长出的菌落有何不同为什么要培养较长时间(48h)后观察结果三光电比浊计数法一、目的要求1.
了解光电比浊计数法的原理.
2.
学习、掌握光电比浊计数法的操作方法.
二、基本原理当光线通过微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低.
在一定的范围内,微生物细胞浓度与透光度成反比,与光密度成正比,而光密度或透光度可以由光电池精确测出(图15-4).
因此,可用一系列已知菌数的菌悬液测定光密度,作出光密度—菌数标准曲线.
然后,以样品液所测得的光密度,从标准曲线中查出对应的菌数.
制作标准曲线时,菌体计数可采用血细胞计数板计数,平板菌落计数或细胞干重测定等方法.
本实验采用血细胞计数板计数.
光电比浊计数法的优点是简便、迅速,可以连续测定,适合于自动控制.
但是,由于光密度或透光度除了受菌体浓度影响之外,还受细胞大小、形态、培养液成分以及所采用的光波长等因素的影响.
因此,对于不同微生物的菌悬液进行光电比浊计数应采用相同的菌株和培养条件制作标准曲线.
光波的选择通常在400~700nm之间,具体到某种微生物采用多少还需要经过最大吸收波长以及稳定性试验来确定.
另外,对于颜色太深的样品或在样品中还含有其他干扰物质的悬液不适合用此法进行测定.
图15—4比浊法测定细胞浓度的原理(三)器材1.
菌种酿酒酵母培养液2.
仪器或其他用具721型分光光度计,血细胞计数板,显微镜,试管,吸水纸,无菌吸管,无菌生理盐水等.
(四)操作步骤1.
标准曲线制作(1)编号取无菌试管7支,分别用记号笔将试管编号为1、2、3、4、5、6、7.
(2)调整菌液浓度用血细胞计数板计数培养24小时的酿酒酵母菌悬液,并用无菌生理盐水分别稀释调整为每毫升1*106、2*106、4*106、6*106、8*106、10*106、12*106含菌数的细胞悬液.
再分别装入已编好号的1至7号无菌试管中.
(3)测OD值将1至7号不同浓度的菌悬液摇均匀后于560nm波长、1cm比色皿中测定OD值.
比色测定时,用无菌生理盐水作空白对照,并将OD值填入下表管号12345678细胞数106/ml光密度(OD)每管菌悬液在测定OD值时均必须先摇匀后再倒入比色皿中测定(4)以光密度(OD)值为纵坐标,以每毫升细胞数为横坐标,绘制标准曲线.
2.
样品测定将待测样品用无菌生理盐水适当稀释,摇均匀后,用560nm波长、lcm比色皿测定光密度.
测定时用无菌生理盐水作空白对照.
各种操作条件必须与制作标准曲线时的相同,否则,测得值所换算的含菌数就不准确.
3.
根据所测得的光密度值,从标准曲线查得每毫升的含菌数.
(五)实验报告l.
结果每毫升样品原液菌数=从标准曲线查得每毫升的菌数*稀释倍数2.
思考题(1)光电比浊计数的原理是什么这种计数法有何优缺点(2)光电比浊计数在生产实践中有何应用价值(3)本实验为什么采用560nm波长测定酵母菌悬液的光密度如果你在实验中需要测定大肠杆菌生长的OD值,你将如何选择波长四大肠杆菌生长曲线的测定(一)目的要求1.
通过细菌数量的测量了解大肠杆菌的生物特征和规律,绘制生长线.
2.
复习光电比浊法测量细菌数量的方法.
(二)基本原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次.
将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期,对数期、稳定期和衰亡期四个阶段.
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线.
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同.
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义.
用于测定细菌细胞数量的方法已在上述实验作了介绍.
本实验用分光光度计(spectrophotometer)进行光电比浊测定不同培养时间细菌悬浮液的OD值,绘制生长曲线.
也可以直接用试管或带有测定管的三角瓶(图15-5)测定"klettunits"值的光度计.
如图15—6所示,只要接种1支试管或1个带测定管的三角瓶,在不同的培养时间(横坐标)取样测定,以测得的klettunits为纵坐标,便可很方便地绘制出细菌的生长曲线.
如果需要,可根据公式1klettunits=OD/0.
002换算出所测菌悬液的OD值.
图15—5带侧臂试管的三角烧瓶(三)器材1.
菌种大肠杆菌2.
培养基LB液体培养基70ml,分装2支大试管(5ml/支),剩余60ml装入250ml的三角瓶.
3.
仪器或其他用具722型分光光度计,水浴振荡摇床,无菌试管,无菌吸管等.
图15—6直接用试管测OD值(四)操作步骤1.
标记取11支无菌大试管,用记号笔分别标明培养时间,即0、1.
5、3、4、6、8、10、12、14、16和20h.
2.
接种分别用5ml无菌吸管吸取2.
5ml大肠杆菌过夜培养液(培养10~12h)转入盛有50mlLB液的三角瓶内,混合均匀后分别取5ml混合液放入上述标记的11支无菌大试管中.
3.
培养将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.
5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定其光密度值.
4.
比浊测定用未接种的LB液体培养基作空白对照,选用600nm波长进行光电比浊测定.
从早取出的培养液开始依次测定,对细胞密度大的培养液用LB液体培养基适当稀释后测定,使其光密度值在0.
1~0.
65之内(测定OD值前,将待测定的培养液振荡,使细胞均匀分布).
本操作步骤也可用简便的方法代替:1.
用1ml无菌吸管取0.
25ml大肠杆菌过夜培养液转入盛有3~5mlLB液的试管中、混匀后将试管直接插入分光光度计的比色糟中,比色糟上方用自制的暗盒将试管及比色暗室全部罩上,形成一个大的暗环境,另以1支盛有LB液但没有接种的试管调零点,测定样品中培养0h的OD值.
测定完毕后,取出试管置37℃继续振荡培养.
2.
分别在培养0、1.
5、3、4、6、8、10、12、14、16和20h,取出培养物试管按上述方法测定OD值.
该方法准确度高、操作简便.
但须注意的是使用的2支试管要很干净,其透光程度愈接近,测定的准确度愈高.
(五)实验报告1.
结果(1)将测定的OD600值填入下表:培养时间(h)对照01.
534681012141620光密度值OD600(2)绘制大肠杆菌的生长曲线.
2.
思考题(1)如果用活菌计数法制作生长曲线,你认为会有什么不同两者各有什么优缺点培养时间/hOD600值(2)细菌生长繁殖所经历的四个时期中,哪个时期其代时最短若细胞密度为103/ml,培养4.
5h后,其密度高达2*108/ml,计计算出其代时.
(3)次生代谢产物的大量积累在哪个时期根据细菌生长繁殖的规律,采用哪些措施可使次生代谢产物积累更多实验16微生物的生理生化反应微生物生理生化反应的多样性在自然界产生了两种结果:第一是使自然界的有机分子都有可能得到分解;第二是使不同微生物之间有了互相作用和互相依赖的基础.
例如,一种微生物能利用另一种微生物所分解的产物,或者一种微生物的产物可抑制或杀死另一种微生物.
所以微生物的生理生化反应也被作为细菌鉴定和分类的内容.
一大分子物质的水解试验(一)目的要求1.
证明不同微生物对各种有机大分子的水解能力不同,从而说明不同微生物有着不同的酶系统.
2.
掌握进行微生物大分子水解试验的原理和方法.
(二)基本原理微生物对大分子的淀粉、蛋白质和脂肪不能直接利用,必须靠产生的胞外酶将大分子物质分解才能被微生物吸收利用.
胞外酶主要为水解酶,通过加水裂解大的物质为较小的化合物,使其能被运输至细胞内.
如淀粉酶水解淀粉为小分子的糊精、双糖和单糖;脂肪酶水解脂肪为甘油和脂肪酸;蛋白酶水解蛋白质为氨基酸等.
这些过程均可通过观察细菌菌落周围的物质变化来证实:淀粉遇碘液会产生蓝色,但细菌水解淀粉的区域,用碘测定不再产生蓝色,表明细菌产生淀粉酶.
脂肪水解后产生脂肪酸可改变培养基的pH,使pH降低,加入培养基的中性红指示剂会使培养基从淡红色变为深红色,说明胞外存在着脂肪酶.
微生物可以利用各种蛋白质和氨基酸作为氮源外,当缺乏糖类物质时,亦可用它们作为碳源和能源.
明胶是由胶原蛋白经水解产生的蛋白质,在25℃以下可维持凝胶状态,以固体形式存在.
而在25℃以上明胶就会液化.
有些微生物可产生一种称作明胶酶的胞外酶,水解这种蛋白质,而使明胶液化,甚至在4℃仍能保持液化状态.
还有些微生物能水解牛奶中的蛋白质酪素,酪素的水解可用石蕊牛奶来检测.
石蕊培养基由脱脂牛奶和石蕊组成,是昏浊的蓝色.
酪素水解成氨基酸和肽后,培养基就会变得透明.
石蕊牛奶也常被用来检测乳糖发酵,因为在酸存在下,石蕊会转变为粉红色,而过量的酸可引起牛奶的固化(凝乳形成).
氨基酸的分解会引起碱性反应,使石蕊变为紫色.
此外,某些细菌能还原石蕊,使试管底部变为白色.
尿素是由大多数哺乳动物消化蛋白质后被分泌在尿中的废物.
尿素酶能分解尿素释放出氨,这是一个分辨细菌很有用的诊断实验.
尽管许多微生物都可以产生尿素酶,但它们利用尿素的速度比变形杆菌属(Proteus)的细菌要慢,因此尿素酶试验被用来从其他非发酵乳糖的肠道微生物中快速区分这个属的成员.
尿素琼脂含有蛋白胨,葡萄糖,尿素和酚红.
酚红在pH6.
8时为黄色,而在培养过程中,产生尿素酶的细菌将分解尿素产生氨,使培养基的pH升高,在pH升至8.
4时,指示剂就转变为深粉红色.
(三)器材1.
菌种枯草芽胞杆菌,大肠杆菌,金黄色葡萄球菌,铜绿假单胞菌(Pseudomonasaeruginosa),普通变形杆菌.
2.
培养基固体油脂培养基,固体淀粉培养基,明胶培养基试管,石蕊牛奶试管,尿素琼脂试管.
3.
溶液或试剂革兰氏染色用卢戈氏碘液(Lugol'siodinesolution).
4.
仪器或其他用具无菌平板,无菌试管,接种环,接种针,试管架.
(四)操作步骤l.
淀粉水解试验(1)将固体淀粉培养基溶化后冷却至50℃左右,无菌操作制成平板.
(2)用记号笔在平板底部划成四部分.
(3)将枯草芽孢杆菌,大肠杆菌,金黄色葡萄球菌,铜绿假单胞菌分别在不同的部分划线接种,在平板的反面分别在四部分写上菌名.
(4)将平板倒置在37℃温箱中培养24h.
(5)观察各种细菌的生长情况,将平板打开盖子,滴入少量Lugol's碘液于平皿中,轻轻旋转平板,使碘液均匀铺满整个平板.
如菌苔周围出现无色透明圈,说明淀粉己被水解,为阳性.
透明圈的大小可初步判断该菌水解淀粉能力的强弱,即产生胞外淀粉酶活力的高低.
2.
油脂水解试验(1)将溶化的固体油脂培养基冷却至50℃左右时,充分摇荡,使油脂均匀分布.
无菌操作倒入平板,待凝.
(2)用记号笔在平板底部划成四部分,分别标上菌名.
(3)将上述四种菌分别用无菌操作划+字接种于平板的相对应部分的中心.
(4)将平板倒置,于37℃温箱中培养24h.
(5)取出平板,观察菌苔颜色,如出现红色斑点说明脂肪水解,为阳性反应.
3.
明胶水解试验(1)取三支明胶培养基试管,用记号笔标明各管欲接种的菌名.
(2)用接种针分别穿刺接种(见图3—4B)枯草芽抱杆菌,大肠杆菌,金黄色葡萄球菌.
(3)将接种后的试管置20℃中,培养2~5d.
(4)观察明胶液化情况(图16-1).
图16—1明胶穿刺液化的形态4.
石蕊牛奶试验(1)取两支石蕊牛奶培养基试管,用记号笔标明各管欲接种的菌名.
(2)分别接种普通变形杆菌和金黄色葡萄球菌.
(3)将接种后的试管置35℃中,培养24~48h.
(4)观察培养基颜色变化.
石蕊在酸性条件下为粉红色,碱性条件下为紫色,而被还原时为白色.
5.
尿素试验(1)取两支尿素培养基斜面试管,用记号笔标明各管欲接种的菌名.
(2)分别接种普通变形杆菌和金黄色葡萄球菌.
(3)将接种后的试管置35℃中,培养24~48h.
(4)观察培养基颜色变化.
尿素酶存在时为红色,无尿素酶时应为黄色.
(五)实验报告1.
结果将结果填入下表,"+"表示阳性,"-"表示阴性.
菌名淀粉水解试验脂肪水解试验明胶液化试验石蕊牛奶试验尿素试验枯草芽孢杆菌大肠杆菌金黄色葡萄球菌铜绿假单胞菌普通变形杆菌2.
思考题(1)你怎样解释淀粉酶是胞外酶而非胞内酶(2)不利用碘液,你怎样证明淀粉水解的存在(3)接种后的明胶试管可以在35℃培养,在培养后你必须做什么才能证明水解的存在(4)解释在石蕊牛奶中的石蕊为什么能起到氧化还原指示剂的作用(5)为什么尿素试验可用于鉴定Proteus细菌二糖发酵试验(一)目的要求1.
了解糖发酵的原理和在肠道细菌鉴定中的重要作用.
2.
掌握通过糖发酵鉴别不同微生物的方法.
(二)基本原理糖发酵试验是常用的鉴别微生物的生化反应,在肠道细菌的鉴定上尤为重要.
绝大多数细菌都能利用糖类作为碳源和能源,但是它们在分解糖类物质的能力上有很大的差异.
有些细菌能分解某种糖产生有机酸(如乳酸、醋酸、丙酸等)和气体(如氢气、甲烷、二氧化碳等);有些细菌只产酸不产气.
例如大肠杆菌能分解乳糖和葡萄糖产酸并产气;伤寒杆菌分解葡萄糖产酸不产气,不能分解乳糖;普通变形杆菌分解葡萄糖产酸产气,不能分解乳糖.
发酵培养基含有蛋白胨,指示剂(溴甲酚紫),倒置的德汉氏小管和不同的糖类.
当发酵产酸时,溴甲酚紫指示剂可由紫色(pH6.
8)变为黄色(pH5.
2).
气体的产生可由倒置的德汉氏试管中有无气泡来证明.
如图16—2.
图16—2糖发酵试验A.
培养前的情况;B.
培养后产酸不产气;C.
培养后产酸产气(三)器材1.
菌种大肠杆菌,普通变形杆菌斜面各一支.
2.
培养基葡萄糖发酵培养基试管和乳糖发酵培养基试管各3支(内装有倒置的德汉氏小试管).
3.
仪器或其他用具试管架,接种环等.
(四)操作步骤1.
用记号笔在各试管外壁上分别标明发酵培养基名称和所接种的细菌菌名.
2.
取葡萄糖发酵培养基试管3支,分别接入大肠杆菌,普通变形杆菌,第三支不接种,作为照.
另取乳糖发酵培养基试管3支,同样分别接入大肠杆菌,普通变形杆菌,第三支不接种,作为对照.
在接种后,轻缓摇动试管,使其均匀,防止倒置的小管进入气泡.
3.
将接种过和作为对照的6支试管均置37℃培养24~48h.
4.
观察各试管颜色变化及德汉氏小管中有无气泡.
五、实验报告1.
结果将结果填入下表.
"+"表示产酸或产气,"-"表示不产酸或不产气.
糖类发酵大肠杆菌普通变形杆菌对照葡萄糖发酵乳糖发酵2.
思考题假如某种微生物可以有氧代谢葡萄糖,发酵试验应该出现什么结果三IMViC与硫化氢试验(一)目的要求了解IMViC与硫化氢反应的原理及其在肠道菌鉴定中的意义和方法.
(二)基本原理IMViC是吲哚(indoltest)、甲基红(methy1redtest)、伏一普(Voges-Prokauertest)和柠檬酸盐(citratetest)四个试验的缩写,I是在英文中为了发音方便而加上的.
这四个试验主要是用来快速鉴别大肠杆菌和产气肠杆菌(Enterobacteraerogenes),多用于水的细菌学检查.
大肠杆菌虽非致病菌,但在饮用水中若超过一定数量,则表示受粪便污染.
产气肠杆菌也广泛存在于自然界中,因此检查水时要将两者分开.
硫化氢试验也是检查肠道杆菌的生化试验.
吲哚试验是用来检测吲哚的产生.
有些细菌能产生色氨酸酶,分解蛋白胨中的色氨酸产生吲哚和丙酮酸.
吲哚与对二甲基氨基苯甲醛结合,形成红色的玫瑰吲哚.
但并非所有微生物都具有分解色氨酸产生吲哚的能力,因此吲哚试验可以作为一个生物化学检测的指标.
色氨酸水解反应:吲哚与对二甲基氨基苯甲醛反应:大肠杆菌吲哚反应阳性,产气肠杆菌为阴性.
甲基红试验是用来检测由葡萄糖产生的有机酸,如甲酸、乙酸、乳酸等.
当细菌代谢糖产生酸时,培养基就会变酸,使加入培养基的甲基红指示剂由橘黄色(pH6.
3)变为红色(pH4.
2),即甲基红反应.
尽管所有的肠道微生物都能发酵葡萄糖产生有机酸,但这个试验在区分大肠杆菌和产气肠杆菌上仍然是有价值的.
这两个细菌在培养的早期均产生有机酸,但大肠杆菌在培养后期仍能维持酸性pH4,而产气肠杆菌则转化有机酸为非酸性末端产物,如乙醇、丙酮酸等,使pH升至大约6.
因此大肠杆菌为阳性反应,产气肠杆菌为阴性反应.
伏-普试验是用来测定某些细菌利用葡萄糖产生非酸性或中性末端产物的能力,如丙酮酸.
丙酮酸进行缩合、脱羧生成乙酰甲基甲醇,此化合物在碱性条件下能被空气中的氧气氧化成二乙酰.
二乙酰与蛋白胨中精氨酸的胍基作用,生成红色化合物,即伏-普反应阳性;不产生红色化合物者为阴性反应.
有时为了使反应更为明显,可加入少量含胍基的化合物,如肌酸等.
其化学反应过程如下:柠檬酸盐试验是用来检测柠檬酸盐是否被利用.
有些细菌能够利用柠檬酸钠作为碳源,如产气肠杆菌;而另一些细菌则不能利用柠檬酸盐,如大肠杆菌.
细菌在分解柠檬酸盐及培养基中的磷酸铵后,产生碱性化合物,使培养基的pH升高,当加入1%溴麝香草酚蓝指示剂时,培养基就会由绿色变为深蓝色.
溴麝香草酚蓝的指示范围为:pH小于6.
0时呈黄色,pH在6.
0~7.
0时为绿色,pH大于7.
6时呈蓝色.
硫化氢试验是检测硫化氢的产生,也是用于肠道细菌检查的常用生化试验.
有些细菌能分解含硫的有机物,如胱氨酸、半胱氨酸、甲硫氨酸等产生硫化氢,硫化氢一遇培养基中的铅盐或铁盐等,就形成黑色的硫化铅或硫化铁沉淀物.
以半胱氨酸为例,其化学反应过程如下:CH2SHCHNH2COOH+H2O→CH3COCOOH+H2S↑+NH3↑H2S+Pb(CH3COO)2→PbS↓+2CH3COOH(黑色)大肠杆菌为阴性,产气肠杆菌为阳性.
(三)器材l.
菌种大肠杆菌,产气肠杆菌.
2.
培养基蛋白胨水培养基,葡萄糖蛋白胨水培养基,柠檬酸盐斜面培养基,醋酸铅培养基.
在配制柠檬酸盐斜面培养基时,其pH不要偏高,以浅绿色为宜,吲哚试验中用的蛋白胨水培养基中宜选用色氨酸含量高的蛋白胨,如用胰蛋白酶水解酪素得到的蛋白胨较好.
3.
溶液或试剂甲基红指示剂,40%KOH,5%α-萘蔡酚,乙醚,吲哚试剂等.
(四)操作步骤l.
接种与培养(1)用接种针将大肠杆菌、产气肠杆菌分别穿刺接入2支醋酸铅培养基中(硫化氢试验),置37C培养48h.
(2)将上述二菌分别接种于2支蛋白胨水培养基(吲哚试验),2支葡萄糖蛋白胨水培养基(甲基红试验和伏-普试验),2支柠檬酸盐斜面培养基和2支醋酸铅培养基中,置37℃培养2d.
2.
结果观察(1)硫化氢试验培养48h后观察黑色硫化铅的产生.
(2)吲哚试验于培养2d后的蛋白陈水培养基内加3~4滴乙醚,摇动数次,静置1~3min,待乙醚上升后,沿试管壁徐徐加入2滴吲哚试剂,在乙醚和培养物之间产生红色环状物为阳性反应.
配制蛋白胨水培养基,所用的蛋白胨最好用含色氨酸高的,如用胰蛋白酶水解酪素得到的蛋白胨中色氨酸含量较高.
(3)甲基红试验培养2d后,将l支葡萄糖蛋白胨水培养物内加入甲基红试剂2滴,培养基变为红色者为阳性,变黄色者为阴性.
注意甲基红试剂不要加得太多,以免出现假阳性反应.
(4)伏-普试验培养2d后,将另1支葡萄糖蛋白胨水培养物内加入5~10滴40%KOH,然后加入等量的5%α-萘酚溶液,用力振荡,再放入37℃温箱中保温15~30min,以加快反应速度.
若培养物呈红色者,为伏-普反应阳性.
(5)柠檬酸盐试验培养48h后观察柠檬酸盐叙面培养基上有无细菌生长和是否变色.
蓝色为阳性,绿色为阴性.
五、实验报告1.
结果将实验结果填入下表.
"+"表示阳性反应,"-"表示阴性反应.
IMViC试验菌名吲哚试验甲基红试验伏一普试验柠檬酸盐试验硫化氢试验大肠杆菌产气肠菌对照2.
思考题(1)讨论IMViC试验在医学检验上的意义.
(2)解释在细菌培养中吲哚检测的化学原理,为什么在这个试验中用吲哚的存在作为色氨酸活性的指示剂,而不用丙酮酸(3)为什么大肠杆菌是甲基红反应阳性,而产气肠杆菌为阴性这个试验与伏一普试验最初底物与最终产物有何异同处为什么会出现不同(4)说明在硫化氢试验中,醋酸铅的作用,可以用哪种化合物代替醋酸铅实验17微生物与氧关系的检测一、实验目的和内容目的:学会检测微生物与氧关系的方法,了解微生物与氧的关系.
内容:通过调整转速和瓶装量检测微生物生长与氧气的关系.
二、实验材料和用具大肠杆菌斜面菌种、牛肉膏蛋白胨培养基.
吸量管、三角瓶、恒温振荡器、721分光光度计、比色杯等.
三、操作步骤(一)LB培养基的制备1.
配制牛肉膏蛋白胨培养基.
2.
分装取4个300mL三角瓶,每瓶装入50mL培养基,编号为1、2、3、4;另取4个500mL三角瓶,每瓶分别装入50mL、l00mL、150mL和200mL培养基,编号为5、6、7、8.
再取一个100mL三角瓶,装入20mL培养基,剩余的培养基装入到两个500mL三角瓶中,所有三角瓶均用8层纱布和线绳包扎.
3.
灭菌将上述分装的培养基于121C湿热灭菌30min,冷却后备用.
(二)供试菌种的制备l.
菌种活化将冰箱中储藏的大肠杆菌斜面菌种转接至牛肉膏蛋白胨斜面培养基上,37℃培养18~20h备用.
2.
种子制备取上述活化的大肠杆菌一环接人盛有20mL牛肉膏蛋白胨培养基的100mL三角瓶中,37℃,200r/min摇床培养16~18h作为供试种子.
(三)不同转速对大肠杆菌生长的影响取1~4号三角瓶,每瓶接入lmL上述大肠杆菌种子,1号静置于温箱中,2号置75r/min摇床,3号置于150r/min摇床,4号置于225r/min摇床,在37℃下培养12~16h后取出,摇匀,经适当稀释后,测定每个瓶中的OD值(λ=600nm),并同时以原培养基不接种作对照测定.
记录结果于表17-1中.
(四)不同瓶装量对大肠杆菌生长的影响取上述5~8号三角瓶,按1%的接种量接人上述大肠杆菌种子,37C,200r/min培养12~16h后一并取出,用721分光光度计测定OD值(λ=600m),如密度太大可作适当稀释后再测OD值,记录实验结果于表17-2中.
四、注意事项1.
接种前要将种子充分摇匀,接种时要保证接种量一致.
严格无菌操作,以免污染.
2.
测定OD值时要摇匀后再取培养液.
若经稀释后测定,则各瓶培养物的稀释倍数要一致.
五、实验报告1.
将测定结果列于表17-1和表17-2中:表17-1不同转数对大肠杆菌生长量的影响OD值(λ=600nm)转数/r·min-112平均值075150225表17-2不同瓶装量对大肠杆菌生长量的影响OD值(λ=600nm)瓶装量(mL/500mL三角瓶)12平均值50751001502.
绘制曲线分别以转速或瓶装量为横坐标,以OD值为纵坐标绘制大肠杆菌生长与氧关系的曲线.
3.
试对以上曲线进行分析.
六、问题和思考1.
根据微生物与氧的关系,可将微生物分为哪几大类2.
专性厌氧微生物为什么在有氧的条件下不能生长3.
试设计一实验,如何测定酵母菌或放红菌及霉菌与氧的关系.
实验18厌氧微生物的培养一、实验目的和内容目的:学习培养厌氧微生物的方法,了解厌氧微生物生长的特性.
内容:1、深层穿刺法,厌氧培养丙酮丁醇梭菌.
2、真空干燥器厌氧培养丙酮丁醇梭菌及产气荚膜梭菌.
3、针筒厌氧法培养丙酮丁醇梭菌及产气荚膜梭菌.
4、厌氧罐培养法示范.
5、厌氧袋法培养丙酮丁醇梭菌.
二、实验材料和用具丙酮丁醇梭菌(Clostridiumacetobutylicum)、产气荚膜梭菌(Clostridiumperfringens).
RCM培养基(即强化梭菌培养基)、TYA培养基、玉米醪培养基、中性红培养基、明胶麦芽汁培养基.
CaCO3,焦性没食子酸(即邻苯三酚)、Na2CO3,10%NaOH溶液,0.
5%美蓝水溶液,6%葡萄糖水溶液,钯粒(A型),NaBH4,KBH4,NaHCO3,柠檬酸.
带塞或塑料帽玻璃管(直径18~20mm,长180~200mm),1mL血浆瓶,250mL血浆瓶,2OmL和50mL针简,250mL三角瓶,试管,厌氧罐,厌氧袋(不透气的无毒复合透明薄膜塑料袋,14cm*32cm),培养皿,真空泵,带活塞干燥器,氮气钢瓶.
三、操作步骤(一)真空干燥器厌氧培养法此法不适用于培养需要CO2的微生物.
该法是在干燥器内使焦性没食子酸与氢氧化钠溶液发生反应而吸氧,形成无氧的小环境而使厌氧菌生长.
1.
培养基准备与接种将3支装有玉米醪培养基或RCM培养基的大试管放在水浴中煮沸l0min,以赶出其中溶解的氧气,迅速冷却后(切勿摇动)将其中2支试管分别接种丙酮丁醇梭菌和产气荚膜梭菌.
2.
干燥器准备与抽气在带活塞的干燥器内底部,预先放入焦性没食子酸粉末20g和斜放盛有200mL10%NaOH溶液的烧杯.
将接种有厌氧菌的培养管放入干燥器内.
在干燥器口上涂抹凡士林,密封后接通真空泵,抽气3~5min,关闭活塞.
轻轻摇动干燥器,促使烧杯中的NaOH溶液倒入焦性没食子酸中,两种物质混合发生吸氧反应,使干燥器中形成无氧小环境(图18-lA)3.
观察结果将干燥器置于37℃恒温箱中培养约7d,取出培养管,分别制片观察菌体特征.
图18-1厌氧培养示意图A干燥器厌氧培养装置1、连接真空泵;2、干燥器;3、试管;4、10%NaOH溶液;5、焦性没食子酸粉末B深层穿刺分离培养法1、塑料盖;2、营养琼脂;3、无菌橡皮塞;4、接种针穿刺至底部;5、培养后长出菌落(二)深层穿刺厌氧培养法此法操作简单,适用于一般厌氧微生物的活化和分离培养,但不能用于扩大培养.
1.
接种培养将玻璃管一头塞上橡胶塞,装入培养基(RCM或TYA培养基)的高度为管长的2/3,套上塑料帽或橡皮塞,灭菌并凝固后,将丙酮丁醇梭菌用接种针穿刺接种(图18—lB),置37℃恒温箱中培养6~7d.
2.
观察结果观察菌落形态特征并制片于显微镜下观察菌体的细胞形态,并记录结果.
(三)针筒厌氧培养法此法适于活化厌氧菌和小体积的扩大培养.
1.
培养基准备将灭菌的装有RCM或TYA培养基的血浆瓶放在沸水浴中加热10min,在瓶口胶塞上插上2枚医用针头排气,以赶出残留在培养基内的氧气.
随后将血浆瓶从沸水浴中取出,再用氮气钢瓶中的高纯氮气(99.
99%)通过胶塞上的一枚针头引人血浆瓶中,使血浆瓶内充满氮气,瓶内培养基在冷却过程中保持无氧状态.
2.
针筒装灌培养基将灭菌的针筒接上针头经胶塞刺人血浆瓶中,先利用瓶内氮气的压力将针筒的推杆慢慢推开,待吸入一定体积的氮气后取下针筒,排尽针筒内的气体.
按此重复操作3次,以排尽针筒内的残留空气而维持无氧状态.
使血浆瓶口朝下倾斜,利用瓶内压力将培养液缓慢注入针筒内,然后取下针筒,用经灭菌的带孔橡皮塞迅速把针筒头部塞住(图18-2).
图18—2针筒培养基分装装置图18—3针筒间对接法接种3.
接种培养采用无菌操作以菌种液针筒将菌穿刺接入培养液针筒中(图18-3),置37℃恒温培养,用于菌种活化可培养16~18h,用于测定菌体生长可培养6~7d.
4.
观察结果取菌制片观察.
(四)厌氧罐培养法此法利用透明的聚碳酸酯硬质塑料制成的一种小型罐状密封容器,采用抽气换气法充入氢气,利用钯作催化剂与罐内氧气发生作用达到除氧的目的,同时充入10%(V/V)的CO2以促进某些革兰氏阴性厌氧菌的生长(图18-4).
图18—4厌氧罐厌氧培养装置其实验操作过程如下:1.
制备厌氧度指示剂取3mL0.
5%美蓝水溶液用蒸馏水稀释至100mL;6mL0.
1mol/LNaOH溶液用蒸馏水稀释至l00mL;6g葡萄糖加蒸馏水至l00mL.
将上述3种溶液等体积混合,并用针筒注入安瓿管内lmL,沸水浴加热至无色,立即封口即成.
取一根直径1cm、长8cm的无毒透明塑料软管,将装有美蓝指示剂的安瓿管置于软管中,制成美蓝厌氧度指示管.
2.
培养基准备与接种将制成无菌无氧的RCM或TYA培养基平板,在无菌操作下迅速划线接种丙酮丁醇梭菌或产气荚膜梭菌,并立即将平皿倒置放入已准备好的厌氧罐中,同时放入一支美蓝厌氧指示剂管.
随后及时旋紧罐盖,达到完全密封.
3.
抽气换气将真空泵接通厌氧罐抽气接口(图18-4),抽真空至表指针0.
09~0.
093MPa(680~700mmHg柱)时,关闭抽气口活塞,用止血钳夹住抽气橡皮管.
打开氮气钢瓶气阀向厌氧罐内充入氮气,当真空表指针返回到零位终止充氮.
再接上述步骤抽气和充入氮气,如此重复2~3次,使罐中氧的含量达最低度.
最后充入的氮气使真空表指针达0.
02MPa(l60mmHg)时停止充氮气.
再开启CO2钢瓶阀门,向罐内充入CO2直至真空表指针达到0.
011MPa(80mmHg)时停止.
为除尽罐内残留的氧,以氢气袋(用医用"氧气袋"灌满氢气)气管连接向厌氧罐内充入氢气直至真空表指针回到零位为止.
充气完毕,封闭厌氧罐.
4.
恒温培养将厌氧罐置于37℃恒温箱中培养6~7d,注意罐中厌氧指示剂的颜色变化.
5.
观察结果和镜检从罐内取出平皿,观察菌落特征.
并挑取菌落作涂片,用结晶紫染液染色,镜检,比较不同菌的菌体细胞形态特征,并作记录.
(五)厌氧袋培养法厌氧袋除氧是利用氢硼化钠与水反应产生氢,在催化剂钯的作用下,氢与袋中氧结合生成水达到除氧目的,除氧效果可从袋中厌氧度指示剂观察.
同时,利用柠檬酸与碳酸氢钠的作用产生CO2,以有利于需要CO2的厌氧菌的生长.
其反应过程为:1.
厌氧袋选用无毒复合透明薄膜塑料,采用塑膜封口机或电热法烫制成20*40cm塑料袋.
2.
产气管取一根无毒塑料软管(直径2.
0cm,长20cm),管壁制成小孔,一端封实.
天平称取0.
4gNaBH4和0.
4gNaHCO3,用擦镜纸包成小包,塞入软管底部,其上基入3层擦镜纸,将装有5%柠檬酸溶液3mL的安瓿管塞入塑料管中,管口塞上有缺口的泡沫塑料小塞,即制成产气管.
3.
厌氧度指示管取一根无毒透明塑料软管(直径2cm,长10cm).
量取0.
5%美蓝水溶液3mL,用蒸馏水稀释至100mL;取0.
lmol/LNaOH溶液6mL,用蒸馏水稀释至100mL;称取6g葡萄糖加蒸馏水稀释成100mL.
将上述3种溶液等量混合后取2mL装入安瓿管,经沸水浴加热至无色后立即封口,即为厌氧度指示管.
4.
催化剂和吸湿剂催化剂钯粒(A型)10~20粒加热活化,随后装入带孔的小塑料硬管内,制成钯粒催化管.
取变色硅胶少许,用滤纸包好塞入带孔塑料管内,为吸湿剂管.
5.
培养基准备和接种将灭菌的中性红培养基和CaCO3明胶培养基分别在沸水浴中煮沸10min,以赶出其中溶解的氧,冷却至50C左右倒平板,冷凝后接种丙酮丁醇梭菌.
随后立即将平皿放入厌氧袋中,每袋可倒置平放3个平皿.
6.
封袋除氧和培养将产气管、厌氧度指示管、钯粒催化剂管和吸湿剂管分别放入袋中平皿两边,尽量赶出袋中空气,用宽透明胶带将袋口封住,用一根lcm宽、与袋口宽等长的有机玻璃条或小木条将袋口卷折2~3层,用夹子夹紧,严防漏气(图18-5).
使袋口倾斜向上,随后隔袋折断产气管中的安瓿管颈,使试剂反应产生H2和CO2,H2在钯粒催化下与袋内O2化合生成水.
经5~l0min左右,钯粒催化管处升温发热,生成少量水蒸汽.
在折断产气管半小时后,隔袋折断厌氧度指示管中的安瓶管颈,观察指示剂不变蓝,表明袋内己形成厌氧环境.
此时将厌氧袋转入37℃恒温箱中培养6~7d.
7.
观察结果和镜检从袋中取出平皿观察菌落特征.
丙酮丁醇梭菌在中性红平板上显示黄色菌落,挑取典型单菌落涂片染色后进行镜检,观察菌体细胞形态特征,并作记录.
图18—5厌氧袋厌氧培养装置四、注意事项1.
培养需要CO2的厌氧菌时,须在厌氧小环境中供应CO2.
2.
氢气是危险易爆气体,使用氢气钢瓶充氢时,应严格按操作规程进行,切勿大意,严防事故.
3.
选用干燥器、针筒、厌氧罐或厌氧袋时,应事先仔细检查其密封性能,以防漏气.
4.
已制备灭菌的培养基在接种前应在沸水浴中煮沸10min,以消除溶解在培养基中的氧气.
5.
针筒培养液刃天青指示剂出现红色,表明有残留氧气.
厌氧袋和厌氧罐中美蓝厌气度指示剂变成蓝色,表明除氧不够.
6.
产气荚膜梭菌为条件致病菌,防止进入口中和沾上伤口.
五、演示1.
显示深层穿刺厌氧培养的厌氧菌菌落特征及生长情况.
2.
选用真空干燥器、针筒、厌氧罐或厌氧袋厌氧培养法,演示该方法的操作过程,特别是厌氧罐的抽气换气和厌氧袋的封袋除氧操作过程.
六、实验报告1.
实验中选用厌氧培养法的培养结果:菌落形态特征菌体形态特征培养方法菌种名称菌落大小、形状、颜色、光滑度、透明度、气味菌体形态有无芽孢、芽孢形状、碘液染色液体培养特征备注2.
试比较以上厌氧培养方法的优缺点,并分析其成功的关键.
七、问题和思考1.
请设计一个试验方案,如何从土壤中分离、纯化和培养出厌氧菌.
2.
试举例说明研究厌氧菌的实际意义.
实验19免疫血清的制备一、实验目的和内容目的:学习和掌握免疫血清的制备方法,为凝集反应和沉淀反应准备凝集素和沉淀素.
内容:1、抗大肠杆菌血清(凝集素)的制备.
2、牛血清白蛋白抗血清(沉淀素)的制备.
二、实验材料和用具体重2~3kg的健康雄家兔、大肠杆菌(E.
coli)斜面菌种;牛血清白蛋白(蛋白含量1.
5mg/mL)、牛肉膏蛋白胨斜面培养基、0.
3%甲醛液(用0.
85%生理盐水配制)、75%酒精棉球、碘酒棉球、消毒干棉球;细菌比浊标准管、无菌吸管、无菌注射器(5mL、20mL)、注射针头(5号,B19)、无菌试管、装有玻璃珠的无菌血清瓶、解剖用具(解剖台、兔头夹、止血钳、解剖刀、眼科剪刀、镊子、动脉夹等)、双面刀片、丝线、玻璃管、胶管、离心机及无菌离心管、普通冰箱、超净工作台、水浴箱.
三、操作步骤(一)凝集素的制备1.
凝集原(颗粒性抗原)的制备(1)取37C恒温培养24h的牛肉膏蛋白胨大肠杆菌斜面.
(2)每支斜面菌种中加入5mL0.
3%甲醛液,小心地把菌苔洗下制成菌液.
(3)用无菌清洁吸管,吸取以上菌液,注入装有玻璃珠的无菌血清瓶内,振荡10~25min,分散菌块制成菌悬液.
(4)将含菌悬液的血清瓶置于60℃的水浴箱中水浴1h,并不时摇动,把菌杀死.
(5)将菌悬液重新接种至牛肉膏蛋白胨斜面培养基中,37℃培养24~48h,如有菌生长,则要在60℃水温中再处理.
若无菌生长则进行比浊测定其含菌量.
(6)凝集素的制备(1)免疫方法:选择2~3kg健康雄免,从耳缘静脉采血2mL,分离出血清.
该血清与准备免疫用的抗原进行凝集反应,以检查有无天然凝集素.
如没有或只有极微量时,该动物便可用来免疫.
最常用的免疫途径是耳缘静脉注射.
将家兔放在家兔固定箱内,一手轻轻拿起耳朵,用碘酒棉花球在耳外侧边缘静脉处消毒,然后用酒精棉球涂擦,并用手指轻轻弹几下静脉血管,使其扩张.
消毒细菌悬液瓶塞后,用无菌注射器及5号针头吸取菌液,沿着静脉平行方向刺入静脉血管,并慢慢注入菌液,注射完毕,用干棉球按压住注射处,然后拨出针头,并压迫血管注射处片刻,以防止血液向外溢出.
注射时发现注射处隆起,不易推进时,表明针尖不在血管中,应拨出针头,重找位置再注射.
有时针尖口被堵塞,菌液推不进去,应及时更换针头.
注射途径、剂量和日程安排等视抗原和动物不同而有所不同.
大肠杆菌免疫家兔的抗原注射剂量和日程安排如下表:日期第1日第2日第3日第4日第5日注射剂量/mL0.
20.
40.
61.
02.
0(2)试血:通常于最后一次注射后7~11d,从兔耳缘静脉抽取2mL血,分离析出血清,用试管凝集反应测定抗血清效价.
效价合格即可大量采血,如效价不高,可继续注射抗原免疫,提高效价.
(3)采血:采血分为心脏采血和颈动脉放血.
心脏采血:使免疫家兔仰卧于台上,四肢固定.
用左手探明心脏博动最明显处,用碘酒棉球与酒精棉球消毒后,右手握消毒过的20mL注射器和B19号针头,在上述部位的肋骨间隙与胸部呈45°角刺入心脏,微微抽取针筒,此时可发现血液涌入注射器中便可徐徐抽取血液.
2.
5kg家兔一次可取血20~30mL.
取血完毕后,用消毒棉球按压进针处迅速拨出针头,进针处用棉球继续压住.
并马上将所采的血液注入无菌大试管内,斜放,待血液凝固后,置于37℃恒温箱中30min,使血清充分析出,然后放入4~6C冰箱中.
颈动脉采血:将免疫家兔固定于兔台上,用少量乙醚麻醉,剪去颈部的毛,然后用碘酒棉球和酒精棉球消毒.
沿正中线将颈部皮肤切开到锁骨间,拨开肌膜,暴露出气管,在气管深侧处找到搏动的颈动脉.
小心地将颈动脉和迷走神经剥离分开4~5cm.
用镊子拉出颈动脉,用丝线扎紧血管的离心端,在血管的向心端用止血钳夹住.
然后用眼科剪在丝线与止血钳之间的血管上剪一个V型小切口,将弯咀眼科镊自切口插入,使其张开,同时将一小玻管插入,用丝线扎紧,以防玻管脱漏.
玻管另一端接入一条胶管,胶管通入大试管(或大离心管)内,然后将止血钳慢慢松开,使血液流入试管,直至动物死亡,无血液流出为止.
(4)抗血清分离与保存:取凝固血液于4000r/min,离心20min,获得抗血清(即凝集素).
加入石炭酸或硫柳汞使其浓度分别达到0.
5%或0.
01%.
测定抗血清的效价后,封好瓶口,贴好标签,注明抗血清名称、效价及日期,置冰箱保存备用.
(二)沉淀素的制备抗原为可溶性抗原(如脂多糖、类毒素或可溶性蛋白等).
通常每kg兔体重注射2mg蛋白,牛血清白蛋白抗原浓度为1.
5mg/mL,则2.
5kg兔应注射5mg蛋白.
免疫方法、采血方法和抗血清(沉淀素)的分离可参照凝集素制备方法,但效价测定则用沉淀反应来测定.
四、注意事项由于每个动物对免疫反应不同,产生的抗体效份有高有低,所以在制备抗血清时至少免疫两只家兔.
如须保留该免疫动物,刚采取心脏直接取血,取血后应从静脉注射等体积的50%葡萄糖溶液,经过2~3个月的饲养,方可再次免疫.
若不保留动物须一次取大量血时,则采用颈动脉放血法.
五、演示1.
耳缘静脉注射抗原的方法.
2.
心脏取血的操作过程.
六、实验报告1.
记录免疫家兔的操作过程及免疫过程中兔的反应.
2.
实验操作过程的体会.
七、问题和思考1.
如果不用生理盐水来配制抗原,以这样的抗原免疫兔成不成为什么2.
现有一支苏云金杆菌(Bacillusthuringinesis)斜面菌种,你能否制备出相应的凝集素阐述其主要步骤.
实验20凝集反应一、实验目的和内容目的:学习和掌握用试管凝集反应测定抗血清效价的方法.
内容:1、玻片凝集试验.
2、试管凝集试验.
二、实验材料和用具含10亿个/mL大肠杆菌(E.
coli)的生理盐水菌悬液、大肠杆菌抗血清、生理盐水.
载玻片、小试管(1cm*6.
5cm)、试管架、移液管、吸管、水浴箱.
三、操作步骤(一)玻片凝集试验1.
在载玻片两端各滴一滴大肠杆菌悬液.
2.
在一端的菌悬液中加入一滴1:10稀释的大肠杆菌抗血清,另一端悬液加入一滴生理盐水.
3.
将载玻片小心地振动使混合液混匀后静置室温中,数分钟后便可观察到抗血清端产生凝集块,而另一端为生理盐水对照.
若反应不明显,可放入培养皿中(皿内放入湿滤纸,以保持一定湿度),37℃保温30min后观察结果.
亦可将载玻片放置显微镜下,凝集块明显可见.
(二)试管凝集试验1.
抗血清的稀释抗血清稀释采取对倍稀释法.
取干净小试管10支,排列在试管架上,依次注明号码,每支试管用移液管加入0.
5mL生理盐水.
用移液管吸取1:10稀释的大肠杆菌抗血清0.
5mL加入第1管,在管内连续吹吸3次,使血清与生理盐水充分混合,然后吸取0.
5mL加入第2管,同样混匀后吸取0.
5mL加入第3管,依次类推,直至第9管,混匀后从第9管中吸取0.
5mL弃去.
第10管不加血清作为对照.
此时从第1管到第9管的血清稀释倍数分别1:20,1:40,1:80,1:160,1:320,1:640,1:1280,1:2560,1:5120.
2.
加入抗原从第10支管开始,由后向前每支管依次加入0.
5mL大肠杆菌菌悬液.
此时血清稀释倍数相应加大一倍.
3.
抗原抗体反应把各管混合液振摇混匀,置37℃水浴箱中水浴4h或在室温中过夜,观察结果.
4.
结果观察与效价判断(1)生理盐水对照管中的抗原(细菌)应分散,无凝集块沉淀而呈混浊菌悬液.
(2)试验管如有凝集,管底可见到凝集块.
液体上部澄清、半澄清或混浊度降低,管底凝集块轻摇即浮起,呈片块状.
(3)凝集强弱的判断(以"+"表示)"++++":很强,表示细菌完全凝集,凝集块完全沉于管底,菌液澄清.
"+++":很强,表示细菌绝大部分凝集,凝集块小沉于管底,菌液有轻微混浊.
"++":中等强度,表示细菌部分凝集沉于管底,凝集块呈颗粒状,菌液半澄清.
"+":弱,表示细菌少数凝集,菌液混浊.
"-":不凝集,菌液混浊与生理盐水对照管同.
血清的效价就是呈现50%凝集(即"++"反应)的最高血清稀释倍数.
四、注意事项1.
所用载玻片、试管、移液管等用具均应干净.
2.
在血清对倍稀释过程中,力求准确.
一是防止液体溢出管外,二是在连续吸3次混匀液体时,第2次吸人移液管中的液体高度不能低于第1次,最好是每一稀释度换一支洗净的移液管.
3.
试管水浴或静置后,观察前不宜摇动振荡,以免影响实验结果的准确性.
五、演示1.
对倍稀释过程.
2.
玻片凝集的显微示范镜,观察凝集块.
六、实验报告(一)记录玻片凝集试验结果,试比较血清端与生理盐水端结果的不同,并解释其原因.
(二)抗血清的效价测定结果.
1.
抗血清效价测定结果:试管12345678910最后血清稀释倍数凝集强弱2.
确定抗血清的效价为.
七、问题和思考1.
为什么取"++"的抗血清最高稀释倍数作为抗血清的效价2.
在试管凝集试验中,有否出现不正常现象并分析其原因.
3.
现有枯草孢杆菌斜面菌种及未知效价的相应抗血清,你能否测定出其血清效价描述其操作过程.
实验21沉淀反应一、实验目的和内容目的:学习和掌握环状沉淀反应及双向琼脂扩散沉淀反应方法.
内容:1.
用牛血清白蛋白及兔抗牛血清白蛋白,进行环状沉淀反应.
2.
用以上抗原和抗体进行双向琼脂扩散沉淀反应试验.
二、实验材料和用具可溶性抗原(牛血清白蛋白)、兔抗牛血清白蛋白抗血清、生理盐水(0.
85%NaCl).
洗净载玻片、小试管、移液管、玻璃毛细吸管、不锈钢吸管.
三、操作步骤(一)环状沉淀反应1.
取1:25的牛血清白蛋白lmL,用生理盐水以对倍稀释法稀释成1:50,1:100,1:200,1:400,1:800,1:1600,1:3200的抗原溶液.
2.
取9支洁净干燥的小试管,每支小试管如入1:2的兔抗牛血清白蛋白抗血清0.
5mL.
3,用移液管吸取上面已稀释好的牛血清白蛋白(抗原),按表21—1要求,从最大稀释度开始,沿着管壁徐徐加入各小试管中,使与下层抗体之间形成交界面,切勿摇动混匀,第8管加入生理盐水及第9管加入兔抗血清以作对照.
4.
静置15~30min,观察在两液面交界处有无白色环状沉淀物出现.
5.
结果记录凡有白色环状沉淀物者记"+",没有沉淀者记"-".
最大稀释度的抗原与抗体交界面之间还出现白色环状沉淀者,此管的抗原稀释倍数即为抗体(沉淀素)的效价.
表21-1环状沉淀反应记录表试管123456789抗体(1:2)/mL抗原稀释度抗原用量/mL0.
51:500.
50.
51:1000.
50.
51:2000.
50.
51:4000.
50.
51:8000.
50.
51:16000.
50.
51:32000.
50.
5盐水0.
50.
5免血清(1:50)0.
5结果(二)双向琼脂扩散沉淀反应1.
称取1g优质琼脂于l00mLpH7.
2生理盐水中,在沸水中水浴使琼脂溶化后,加入1%的硫柳汞lmL防腐.
每块载玻片(7.
5cm*4.
5cm)滴加4mL琼脂溶液,待凝固后用不锈钢吸管在两端(A、B端)打梅花形小孔,孔径和孔距均为3mm.
亦可直接用不锈钢管打孔,再用接种针挑去梅花形孔中的琼脂块.
2.
在A端梅花形孔中,用玻璃毛细吸管在中心孔中加入适当稀释的抗血清(抗体),注意要使孔加满,但不外溢;周围孔加入不同稀释度的抗原(例如1:10,1:20,1:40,1:80,1:160,1:320).
在B端梅花形孔中,同样在中央孔中加入适当稀释度的抗原,周围的孔中加入不同稀释度的抗体.
3.
把以上载玻片放入带盖的铝盒中,下面垫上3一4层湿纱布,置37℃扩散24~48h,可看见抗原和抗体反应处呈现的沉淀线.
4.
记录结果注意沉淀线数目及偏向.
四、注意事项1.
在进行环状沉淀反应试验时,一定要沿着管壁加入抗原,而且切勿摇动,否则影响沉淀环的形成.
2.
双向琼脂扩散试验时,抗原或抗体的稀释度多少才合适,教师必须进行预测,否则由于抗原、抗体比例不合适而造成假阴性.
五、演示1.
沿着管壁徐徐加入抗原的操作.
2.
在琼脂板上打梅花孔的操作.
六、实验报告记录环状沉淀反应的结果并确定抗体的效价.
按照表21-2和表21-3记录双向琼脂扩散结果,并分析寻找其规律性.
表21-2载玻片A端结果抗原稀释度1:101:201:401:801:1601:320沉淀线数目表21-3载玻片B端结果抗体稀释度1:101:201:401:801:1601:320沉淀线数目七、问题和思考1.
比较凝集反应与沉淀反应有何异同2.
双向琼脂扩散沉淀反应试验中,抗原或抗体浓度大于相应抗体或抗原时,沉淀线会出现何种现象为什么会出现多条沉淀线3.
如发现衣服上有一血迹,怀疑是人血,你能用简单的方法进行鉴定吗并叙述其方法步骤.
第二部分实际应用实验实验22乳酸发酵与乳酸菌饮料一、实验目的和内容目的:学习乳酸发酵和制作乳酸菌饮料的方法,了解乳酸菌的生长特性.
内容:1.
从新鲜酸乳中进行乳酸菌的分离纯化.
2.
乳酸发酵及检测.
3.
乳酸菌饮料制作.
4.
自制乳酸质量品尝.
二、实验材料和用具嗜热乳酸链球菌(Streptococcusthermophilus)、保加利亚乳酸杆菌(Lactobacillusbulgaricus),乳酸菌种也可以从市场销售的各种新鲜酸乳或酸乳饮料中分离;BCG牛乳培养基、乳酸菌培养基、脱脂乳试管(见注)、脱脂乳粉或全脂乳粉、鲜牛奶、蔗糖、碳酸钙;恒温水溶锅、酸度计、高压蒸汽灭菌锅、超净工作台、培养箱、酸乳瓶(200~280mL,)、培养皿、试管、300mL三角瓶.
三、操作步聚(一)乳酸菌的分离纯化1.
分离取市售新鲜酸乳或泡制酸菜的酸液稀释至10-5,,取其中的10-4、10-52个稀释度的稀释液各0.
1~0.
2mL,分别接入BCG牛乳培养基琼脂平板上,用无菌涂布器依次涂布;或者直接用接种环蘸取原液平板划线分离,置40℃培养48h,如出现圆形稍扁平的黄色菌落及其周围培养基变为黄色者初步定为乳酸菌.
2.
鉴别选取乳酸菌典型菌落转至脱脂乳试管中,40℃培养8~24h若牛乳出现凝固,无气泡,呈酸性,涂片镜检细胞杆状或链球状(两种形状的菌种均分别选入),革兰氏染色呈阳性,则可将其连续传代4~6次,最终选择出在3~6h能凝固的牛乳管,作菌种待用.
(二)乳酸发酵及检测1.
发酵在无菌操作下将分离的1株乳酸菌接种于装有300mL乳酸菌培养液的500mL三角瓶中,40~42℃静止培养.
2.
检测为了便于测定乳酸发酵情况,实验分2组.
一组在接种培养后,每6~8h取样分析,测定pH值.
另一组在接种培养24h后每瓶加入CaCO33g(以防止发酵液过酸使菌种死亡),每6~8h取样,测定乳酸含量(方法见注),记录测定结果.
(三)乳酸菌饮料的制作1.
将脱脂乳和水以1:7~10(WW)的比例,同时加入5%--6%蔗糖,充分混合,于80~85℃灭菌10~5min,然后冷却至35~40℃,作为制作饮料的培养基质.
2.
将纯种嗜热乳酸链球菌、保加利亚乳酸杆菌及两种菌的等量混合菌液作为发酵剂,均以2%~5%的接种量分别接入以上培养基质中即为饮料发酵液,亦可以市售鲜酸乳为发酵剂.
接种后摇匀,分装到已灭菌的酸乳瓶中,每一种菌的饮料发酵液重复分装3~5瓶,随后将瓶盖拧紧密封.
3.
把接种后的酸乳瓶置于40--42℃恒温箱中培养3~4h.
培养时注意观察,在出现凝乳后停止培养.
然后转入4~5℃的低温下冷藏24h以上.
经此后熟阶段,达到酸乳酸度适中(pH4~4.
5),凝块均匀致密,无乳清析出,无气泡,获得较好的口感和特有风味.
4.
以品尝为标准评定酸乳质量采用乳酸球菌和乳酸杆菌等量混合发酵的酸乳与单菌株发酵的酸乳相比较,前者的香味和口感更佳.
品尝时若出现异味,表明酸乳污染了杂菌.
比较项目按表22-1.
四、注意事项1.
采用BCG牛乳培养基琼脂平板筛选乳酸菌时,注意挑取典型特征的黄色菌落,结合镜检观察,有利高效分离筛选乳酸菌.
2.
制作乳酸菌饮料,应选用优良的乳酸菌,采用乳酸球菌与乳酸杆菌等量混合发酵,使其具有独特风味和良好口感.
3.
牛乳的消毒应掌握适宜温度和时间,防止长时间采用过高温度消毒而破坏酸乳风味.
4.
作为卫生合格标准还应按卫生部规定进行检测,如大肠菌群检测等.
经品尝和检验,合格的酸乳应在4℃条件下冷藏,可保存6~7d.
五、实验报告1.
乳酸发酵过程、检测结果及结果分析.
表22—1乳酸菌单菌及混合菌发酵的酸乳品评结果品评项目乳酸菌类凝乳情况口感香味异味pH值结论球菌杆菌球菌杆菌混合(1:1)2.
将发酵的酸乳品评结果记录于表22—1中;六、问题和思考1、发酵酸乳为什么能引起凝乳2.
为什么采用乳酸菌混合发酵的酸乳比单菌发酵的酸乳口感和风味更佳3.
试设计一个从市售鲜酸乳中分离纯化乳酸菌的制作乳酸菌饮料的程序.
注:(一)脱脂乳试管直接选用脱脂乳液或按脱脂乳粉与5%蔗糖水为1:10的比例配制,装量以试管的1/3为宜,115℃灭菌15min.
(二)乳酸检测方法1.
定性测定取酸乳上清液的10mL于试管中,加入10%H2SO41mL,再加2%KMnO41mL,此时乳酸转化为乙醛,把事先在含氨的硝酸溶液中浸泡的滤纸条搭在试管口上,微火加热试管至沸,若滤纸变黑,则说明有乳酸存在,这里因为加热使乙醛挥发的结果.
2.
定量测定:(1)测定方法:取稀释10倍的酸乳上清液0.
2mL,加至3mLpH9.
0的缓冲液中,再加入0.
2mLNAD溶液,混匀后测定OD340nm值为A1,然后加入0.
02mLL(+)LDH,0.
02D(一)LDH,25℃保温lh后测定OD340nm值为A2.
同时用蒸馏水代替酸乳上清液作对照,测定步骤及条件完全相同,测出的相应值为Bl和B2.
(2)计算公式:乳酸/g·(100mL)-1=(V*M*ε*D)÷1000*ε*1*VsV:比色液最终体积(3.
44mL)M:乳酸的克分子重量(lmol/l=90g)ε:(A2-A1)-(B2-B1)D:稀释倍数(10)ε:NADH在340nm吸光系数(6.
3*103*l*mol-1*cm-l)1:比色皿的厚度(0.
1cm)Vs:取样体积(0.
2mL)(3)测定乳酸试剂的配制(见附录)3.
酸乳的检查指标①感观指标:酸乳凝块均匀细腻,色泽均匀无气泡,有乳酸特有的悦味;②合格的理化指标:如脂肪≥3%,乳总干物质≥11.
5%,蔗糖≥5.
00%,酸度70~110T,Hg﹤0.
01*10-6mg/mL等;③无致病菌,大肠菌群≤40个/100mL.
实验23酒精发酵及糯米甜酒的酿制一、实验目的和内容目的:学习和掌握酵母菌发酵糖产生酒精和酒曲发酵糯米配制糯米甜酒的方法.
内容:1.
酵母菌的酒精发酵.
2.
糯米甜酒的酿制.
二、实验材料和用具培养的酿酒酵母(Saccharomycescerevisiae)斜面菌种.
酒精发酵培养基、甜酒曲、蒸馏水、无菌水、糯米.
铝锅、电炉、三角瓶、牛皮纸、棉绳、蒸馏装置、水浴锅、振荡器、酒精比重计.
三、操作步骤(一)酵母菌的酒精发酵1.
培养基配制好的发酵培养基分装人300min三角瓶中,每瓶100mL,121℃湿热灭菌20~30min.
2.
接种和培养于培养24h的酿酒酵母斜面中加入无菌水5mL,制成菌悬液.
并吸取lmL,接种于装有100mL培养基的三角瓶中,一共接2瓶,其中1瓶于30℃恒温静止培养,另1瓶置30℃恒温振荡培养.
3.
酵母菌数目的计数每隔24h取样,经10倍稀释后进行细胞计数(方法参阅"细菌数量测定").
4.
酒精蒸馏及酒精度的测定取60mL已发酵培养3d的发酵液加至蒸馏装置的圆底烧瓶中,在水浴锅中85~95℃下蒸馏.
当开始流出液体时,准确收集40mL于量筒中,用酒精比重计测量酒精度.
5.
品尝取少量一定浓度(30~40度)的酒品尝,体会口感.
(二)糯米甜酒的配制1.
甜酒培养基制作称取一定量优质糯米(糙糯米更好).
用水淘洗干净后,加水量为米水比1:1,加热煮熟成饭.
或者糯米洗净后,用水浸透,沥干水后,加热蒸熟成饭,即为甜酒培养基.
2.
接种糯米冷却至35℃以下,加入适量的甜酒曲(用量按产品说明书)并喷洒一些清水拌匀,然后装入到干净的三角瓶中或装入聚丙烯袋中.
装饭量为容器的l/3~2/3,中央挖洞,饭面上:再撒一些酒曲,塞上棉塞或扎好袋口,置25~30℃下培养发酵.
3.
培养发酵发酵2d便可闻到酒香味,开始渗出清液,3~4d渗出液越来越多,此时,把洞填平,让其继续发酵.
4.
产品处理培养发酵至第7d取出,把酒槽滤去,汁液即为糯米甜酒原液,加入一定量的水.
加热煮沸便是糯米甜酒,即可品尝.
四、注意事项酿制糯米甜酒时糯米饭一定要煮熟煮透,不能太硬或夹生;米饭一定要凉透至35℃以下才能拌酒曲,否则会影响正常发酵.
五、演示酒精蒸馏过程六、实验报告记录酵母酒精发酵过程,比较两种培养方法结果的不同,并解释其原因.
记录糯米配制糯米甜酒的发酵过程,以及糯米甜酒的外观、色、香、味和口感.
七、问题和思考1.
为什么糯米饭温度要降至35℃以下拌酒曲,发酵才能正常进行糯米饭一开始发酵时要挖个洞,后来又填平,这有什么作用2.
酒精发酵培养基配方中如去掉KH2PO4,同样接人酒精酵母菌进行发酵,将出现何种结果为什么实验24微生物菌种保藏一、实验目的和内容目的:了解并掌握菌种保藏的常用方法及其优缺点.
内容:1、学习斜面传代保藏方法.
2、学习液体石蜡保藏方法.
3、学习沙土管保藏方法.
4、学习冷冻干燥保藏方法.
二、实验材料和用具细菌、酵母菌、放线菌和霉菌斜面菌;牛肉膏蛋白胨培养基斜面(培养细菌),麦芽汁培养基斜面(培养酵母菌),高氏1号培养基斜面(培养放线菌),马铃薯蔗糖培养基斜面(培养丝状真菌).
无菌水、液体石蜡、P2O5、脱脂奶粉、10%HCl、干冰、95%乙醇、食盐、河沙、瘦黄土(有机物含量少的黄土);无菌试管、无菌吸管(1mL及5mL)、无菌滴管、接种环、40目及100目筛子、干燥器、安瓿管、冰箱、冷冻真空干燥装置、酒精喷灯、三角烧瓶(250mL).
三、操作步骤下列各方法可根据实验室具体条件与需要选做.
(一)斜面传代保藏法l.
贴标签取各种无菌斜面试管数支,将注有菌株名称和接种日期的标签贴上,贴在试管斜面的正上方,距试管口2~3cm处.
2.
斜面接种将待保藏的菌种用接种环以无菌操作法移接至相应的试管斜面上,细菌和酵母菌宜采用对数生长期的细胞,而放线菌和丝状真菌宜采用成熟的袍子.
3.
培养细菌37℃恒温培养18~24h,酵母菌于28~30℃培养36~60h,放线菌和丝状真菌置于28℃培养4~7d.
4.
保藏斜面长好后,可直接放入4℃冰箱保藏.
为防止棉塞受潮长杂菌,管口棉花应用牛皮纸包扎,或换上无菌胶塞,亦可用熔化的固体石蜡熔封棉塞或胶塞.
保藏时间依微生物种类而不同,酵母菌、霉菌、放线菌及有芽抱的细菌可保存2~6个月,移种一次;而不产芽孢的细菌最好每月移种一次.
此法的缺点是容易变异,污染杂菌的机会较多.
(二)液体石蜡保藏法l.
液体石蜡灭菌在250mL三角烧瓶中装入100mL液体石蜡,塞上棉塞,并用牛皮纸包扎,12l℃湿热灭菌30min,然后于40℃温箱中放置l4d(或置于105~110℃烘箱中lh),以除去石蜡中的水分,备用.
2.
接种培养同斜面传代保藏法.
3.
加液体石蜡用无菌滴管吸取液体石蜡以无菌操作加到已长好的菌种斜面上,加入量以高出斜面顶端约1cm为宜.
4.
保藏棉塞外包牛皮纸,将试管直立放置于4℃冰箱中保存.
利用这种保藏方法,霉菌、放线菌、有芽孢细菌可保藏2年左右,酵母菌可保藏1~2年,一般无芽孢细菌也可保藏1年左右.
5.
恢复培养用接种环从液体石蜡下挑取少量菌种,在试管壁上轻靠几下,尽量使油滴净,再接种于新鲜培养基中培养.
由于菌体表面粘有液体石蜡,生长较慢且有粘性,故一般须转接2次才能获得良好菌种.
(三)沙土管保藏法l.
沙土处理(1)沙处理:取河沙经40目过筛,去除大颗粒,加10%HCl浸泡(用量以浸没沙面为宜)2~4h(或煮沸30min),以除去有机杂质,然后倒去盐酸,用清水冲洗至中性,烘干或晒干,备用.
(2)土处理:取非耕作层瘦黄土(不含有机质),加自来水浸泡洗涤数次,直至中性,然后烘干,粉碎,用100目过筛,去除粗颗粒后备用.
2.
装沙土管将沙与土按2:1,3:1或4:1(W/W)比例混合均匀装入试管中(10mm*100mm,装置约7cm高,加棉塞,并外包牛皮纸,12l℃湿热灭菌30min,然后烘干.
3.
无菌试验每10支沙土管任抽一支,取少许沙土接入牛肉膏蛋白胨或麦芽汁培养液中,在最适的温度下培养2~4d,确定无菌生长时才可使用.
若发现有杂菌,经重新灭菌后,再作无菌试验,直到合格.
4.
制备菌液用5mL无菌吸管分别吸取3mL无菌水至待保藏的菌种斜面上,用接种环轻轻搅动,制成悬液.
5.
加样用1mL吸管吸取上述菌悬液0.
1~0.
5mL加入沙土管中,用接种环拌匀.
加入菌液量以湿润沙土达2/3高度为宜.
6.
干燥将含菌的沙土管放入干燥器中,干燥器内用培养皿盛P2O5作为干燥剂,可再用真空泵连续抽气3~4h,加速干燥.
将沙土管轻轻一拍,沙土呈分散状即达到充分干燥.
7.
保藏沙土管可选择下列方法之一来保藏:(1)保存于干燥器中;(2)用石蜡封住棉花塞后放入冰箱保存;(3)将沙土管取出,管口用火焰熔封后放入冰箱保存;(4)将沙土管装入有CaCl2等干燥剂的大试管中,塞上橡皮塞或木塞,再用蜡封口,放入冰箱中或室温下保存.
8.
恢复培养使用时挑取少量混有孢子的沙土,接种于斜面培养基上,或液体培养基内培养即可,原沙土管仍可继续保藏.
此法适用于保藏能产生芽孢的细菌及形成孢子的霉菌和放线菌,可保存2年左右.
但不能用于保藏营养细胞.
(四)冷冻干燥保藏法1.
准备安瓿管选用内径5mm,长10.
5cm的硬质玻璃试管,用10%HCl浸泡8~10h后用自来水冲洗多次,最后用去离子水洗1~2次,烘干,将印有菌名和接种日期的标签放人安瓿管内,有字的一面朝向管壁.
管口加棉塞,121℃灭菌30min.
2.
制备脱脂牛奶将脱脂奶粉配成20%乳液,然后分装,121℃灭菌30min,并作无菌试验.
3.
准备菌种选用无污染的纯菌种,培养时间,一般细菌为24~48h,酵母菌为3d,放线菌与丝状真菌7~10d.
4.
制备菌液及分装吸取3mL无菌牛奶直接加入斜面菌种管中,用接种环轻轻搅动菌落,再用手摇动试管,制成均匀的细胞或孢子悬液.
用无菌长滴管将菌液分装于安瓿管底部,每管装0.
2mL.
5.
预冻将安瓿管外的棉花剪去并将棉塞向里推至离管口约15mm处(图24—2A),再通过乳胶管把安瓶管连接于总管的侧管上,总管则通过厚壁橡皮管及三通短管与真空表及干燥瓶、真空泵相连接(图24—1),并将所有安瓶管浸入装有干冰和95%乙醇的预冷槽中,(此时槽内温度可达-40~-50℃),只需冷冻1h左右,即可使悬液冻结成固体.
图24—1真空冷冻干燥装置6.
真空干燥完成预冻后,升高总管使安瓿管仅底部与冰面接触,(此处温度约-10℃),以保持安韶管内的悬液仍呈固体状态.
开启真空泵后,应在5~15min内使真空度达66.
7Pa以下,使被冻结的悬液开始升华,当真空度达到26.
7~13.
3Pa时,冻结样品逐渐被干燥成白色片状,此时使安瓿管脱离冰浴,在室温下(25~30℃)继续干燥(管内温度不超过30C),升温可加速样品中残余水分的蒸发.
总干燥时间应根据安瓿管的数量,悬浮液装量及保持剂性质来定,一般3~4h即可.
7.
封口样品干燥后继续抽真空达1.
33Pa时,在安瓿管棉塞的稍下部位用酒精喷灯火焰灼烧,拉成细颈并熔封(图24-2B、C),然后置4℃冰箱内保藏.
8.
恢复培养用75%乙醇消毒安瓿管外壁后,在火焰上烧热安瓿管上部,然后将无菌水滴在烧热处,使管壁出现裂缝,放置片刻,让空气从裂缝中缓慢进入管内后,将裂口端敲断,这样可防止再用无菌的长颈滴管吸取菌液至合适培养基中,放置在最适温度下培养.
冷冻干燥保藏法综合利用了各种有利于菌种保藏的因素(低温、干燥和缺氧等),是目前最有效的菌种保藏方法之一.
保存时间可长达10年以上.
图24—2安瓿管的处理A.
棉塞推向管内的位置;B.
拉细颈;C.
熔封四、注意事项1.
从液体石蜡封藏的菌种管中挑菌后,接种环上带有油和菌,故接种环在火焰上灭菌时要先在火焰边烤干再直接灼烧,以免菌液四溅,引起污染.
2.
在真空干燥过程中安瓿管内样品应保持冻结状态,以防止抽真空时样品产生泡沫而外溢.
3.
熔封安瓿管时注意火焰大小要适中,封口处灼烧要均匀,若火焰过大,封品处易弯斜,冷却后易出现裂缝而造成漏气.
五、演示1.
冷冻真空干燥装置的连接及使用.
2.
熔封安瓿管操作.
六、实验报告1.
按以下项目列表记录菌种保藏方法和结果:菌种名称培养条件接种日期中文名学名培养基培养温度保藏方法保藏温度操作要点2.
试述各种菌种保藏方法的优、缺点.
七、问题和思考1.
如何防止菌种管棉塞受潮和杂菌污染2.
冷冻干燥装置包括哪几个部件各个部件起什么作用3.
现有一个纤维素酶的高产霉菌菌株,你选用什么方法保存试设计一个实验方案.
实验25食用菌培养I食用菌组织分离一、目的和要求掌握了解食用菌组织分离的方法和实际操作技术,明确食用菌组织分离在食用菌生产中的重要性.
二、材料和用具培养皿、试管斜面培养基、平菇,金针菇或蘑菇较成熟的子实体、酒精灯、接种针、75%酒精,火柴、甲醛、高锰酸钾、新洁尔灭消毒液以及温箱、冰箱等.
三、说明在食用菌生产中采用组织分离的方法繁殖母种是大多数菌类普遍采用的方法,而组织分离成功与否是与种菇子实体的选择、分离过程中的操作方法等分不开的.
这直接关系到所繁菌种的优劣.
因此食用菌组织分离是食用菌生产中的重要环节之一.
四、方法与步骤每班同学分为二大组4小组,(以每大组为单位进行培养基制备工作)组织分离接种以小组为单位进行,每个同学接种8支试管母种(平菇4支、金针菇4支).
在未感染病虫和杂菌的菇瓶或菇床上选择种菇,各类食用菌种菇均须选具有本品种特征特性的较成熟的第一、二批菇作种菇.
平菇选朵大肉厚的作种菇.
金针菇则选择朵大,菇柄长的且黄白色部分较长的菇作种菇.
蘑菇选择菇形圆整、洁白、肉厚较成熟未开伞的作种菇.
将选好的种菇剪去过长的菌柄,放入接种箱内进行消毒,种菇均用75%的酒精擦洗菌盖、菌柄.
然后用无菌小刀从菌柄中部纵向切开,或把种菇撕开,在菌盖与菌柄交界处或菌盖带菌褶部分挑取一小块组织,移接到试管培养基上.
平菇也可不用酒精擦洗直接将种菇撕开,挑取一小块组织移接到培养基上.
置于22~26℃左右温度下培养3~5天就可看到组织上产生白色绒毛状菌丝,并向培养基上生长.
菌丝长满斜面后,管口用塑料薄膜或防潮纸包扎,即可放入5℃电冰箱中保藏.
第一大组采用菌盖与菌柄交界处组织进行分离,第二大组采用菌盖带菌褶部分进行组织分离.
五、作业认真按操作规程进行工作,根据观察结果比较两菌种间菌丝生长情况和同一菌种不同部位组织分离后菌丝生长情况,评价何种部位更适宜该菌种的组织分离繁殖,并对操作的各个环节提出改进建议.
II食用菌孢子分离一、目的要求:了解食用菌孢子分离的方法,操作技术以及应用.
二、材料和用具孢子收集器、75%酒精、0.
25%的新洁尔灭、蘑菇、平菇子实体、接种针等.
三、方法和步骤在无菌操作操作下使孢子在适宜的培养基上萌发,长成菌丝体而获得纯菌种的方法称为孢子分离法.
其特点是:菌丝菌龄短,因是有性繁殖产物,其菌丝生命力强.
侵染病毒的菌类可用孢子分离法脱毒.
在一般菌种分离中,为了避免异宗接合的菌类如香菇、平菇产生单孢子不孕现象,一般都采用多孢分离法.
单孢分离法主要应用于食用菌的杂交育种.
但双孢蘑菇、草菇等同宗接合菌类可采用单孢分离法.
1.
种菇的选择在生产中必须选择优良品系中的优良个体作分离材料.
2.
孢子采集方法(1)孢子弹射分离法它是利用孢子能自动弹射出子实体层的特性来收集孢子.
收集有几种不同的装置.
①整菇插种法,需用一套孢子收集器(图25-1)来收集孢子,将钟罩上的孔加上棉塞或包上6~8层纱布,放在垫有4~6层纱布(浸过0.
1%升汞液)的塘瓷盘上,纱布上放一培养器,内放一个不锈钢支架.
把收集器包装好,灭菌备用.
将菌幕未破裂的成熟子实体洗干净,用0.
1%升汞溶液或0.
25%的新洁尔灭浸泡2~3min,以杀死表面的杂菌.
对于菌幕破裂、子实层已外露的子实体或无菌幕包裹的子实体,可用棉花蘸75%酒精涂擦子实体表面消毒.
按无菌操作要求移入孢子收集器,插在支架上,在适宜的温度中培养.
2~3天后孢散落在培养皿中,加入无菌水,用针筒吸取孢子液,接种在斜面培养基中央,置于22~26℃恒温箱中培养即可.
②钩悬法(图25—2),在生产上,采集木耳、银耳孢子常用此法,伞菌也可采用此法.
先将新鲜成熟的耳片用无菌水冲洗,然后用无菌纱布将水吸干,取一小片挂在灭菌的钩子上(伞菌则消毒后挂上),钩子的另一端挂在三角瓶口,瓶内装有培养基,在25℃下培养24h.
孢子落到培养基上后,取出耳片,塞上棉塞继续培养,然后再转入试管中培养.
③贴附法,取一小块成熟的菌褶或小块菌盖,用溶化的琼脂或胶水、浆糊(需先灭菌)贴附在试管斜面的上方或培养皿皿盖上,经6-12h,待孢子落下后,立即将试管或培养皿中的培养基移到另一消毒过的空试管或培养皿中进行培养.
图25—1孢子收集器图25—2钩悬法采集孢子1-消毒棉塞;2-玻璃钟罩;3-种菇1-棉花塞;2-铁丝钩;3-种菇;4-培养基4-培养皿;5-瓷盘;6-浸过升汞水的纱布(2)菌褶上涂抹法将伞菌手实体用75%酒精表面消毒,按无菌操作用接种环直接插入两片菌褶之间,轻轻地抹过褶片表面,然后用划线法涂抹于试管培养基上.
(3)孢子印分离法取成熟子实体经表面消毒后,切去菌柄,将菌褶向下放置于灭过菌的有色纸上,在20~24℃静置一天,大量孢子落下形成孢子印,然后移少量孢子在试管培养基上培养.
(4)单孢子分离法进行单孢子分离后,在人工控制的条件下,便两个优良品系的单孢子进行杂交,从而培育出新品种.
①平板稀释法,挑取少许孢子在无菌水中形成孢子悬浮液,取几滴涂于培养基上,用无菌玻璃三角架推平.
经48~72h后,镜检孢子萌发情况.
在单个孢子旁做好标记,然后将其转接到斜面培养基上,待菌落长到1cm左右时进行镜检,观察有无锁状联合,初步确定是否是单核菌丝.
②连续稀释法,挑取一定量孢子,经连续稀释后,直到每滴稀释液中只有一个孢子,然后滴入试管中保温培养.
当发现单个菌落时,转到新试管中继续培养,并通过镜检以确定是否为单孢菌落.
III食用菌一级种制作一、目的要求通过母种(一级种)的制作,掌握其制种的技术.
二、方法与步骤母种培养基制作流程:设计培养基配方→材料煮汁或药品溶化→琼脂溶化→混合定容→调节pH值→分装→灭菌→倒斜面→接种→培养→母种(一级种)l.
一级种常用培养基配方(1)马铃薯葡萄糖琼脂培养基(PDA培养基)马铃薯(去皮)200mg,葡萄糖20.
0g,琼脂2.
0g,水l000mL.
(2)马铃薯硫酸铵培养基马铃薯200g,硫酸铵2g,蛋白胨1g,葡萄糖20g,磷酸二氢钾1g,硫酸镁1g,琼脂20g,水1000mL(3)马铃薯葡萄糖蛋白胨培养基马铃薯200g,葡萄糖20g,蛋白胨2g,硫酸镁0.
5g,磷酸氢二钾1g,维生素B10.
5mg,琼脂20g,水1000mL.
2.
培养基分装培养基配制完毕应即时分装,否则琼脂凝固,无法分装,一级种最常用玻璃试管;要安装好分装装置,常用玻璃漏斗套接乳胶管和尖嘴玻璃接液管,乳胶管上配以止流夹.
分装时左手抓握2~3支试管,右手控制接液管插入试管,注入培养基,装培养基量为总试管容量的1/5.
分装时应注意不要将培养液沾到试管管口,避免将来发生污染.
若有沾粘,则应用干净纱布及时擦净.
分装的试管直接加棉花塞封口,棉花应用普通棉花,不能用脱脂棉,棉花塞起到过滤空气的作用,不宜过松或过紧,以封口后手持棉塞轻轻摇动试管不脱落,且旋转拨出顺利为度.
棉塞外观要求光滑,不能塞过浅或过深,否则造成操作困难.
3.
培养基灭菌和冷却成斜面一般分装好的试管应当天灭菌,使之呈无菌状态,以免杂菌自繁,造成培养基变质、酸败.
灭菌时将试管扎成捆,用牛皮纸或其它防潮纸将整捆试管的棉塞包好,直接放入底部盛水的高压灭菌锅内,加热到压力为l.
05kg/cm2,灭菌30min.
然后趁热取出试管,斜卧放置,使之自然冷却,凝固成斜面,斜面为试管长的1/2,冷却后即成斜面培养基.
4.
一级种的接种培养将试管中的菌种移接至另外的试管培养基上称为转管,其步骤为:(1)将待接的斜面试管以及一级种、接种针等放入已消毒的接种箱内.
(2)用75%的酒精溶液棉球擦双手消毒.
(3)左手持住空白斜面试管和一级种,右手夹持棉塞,火焰封口.
(4)将接种针顶端烧红,并将整支接种棒在火焰上过火.
(5)挑取黄豆大小的菌丝琼脂块,迅速移接到空白斜面中央,将棉塞塞回试管.
(6)将已接种好的试管放入恒温培养箱,在22~26℃下培养,长满试管即可作为一级种(母种)使用.
IV、原种及栽培种的制作一、目的要求通过原种和栽培种的制作,熟悉掌握食用菌生产用种的制备过程和操作技术二、方法与步骤结合栽培季节和平菇栽培的内容,进行原种和栽培种的制作(一)原种(二级种)制作原种选用玉米粒作培养基,以750毫升玻璃瓶或250mL三角瓶作容器,按每瓶装干玉米0.
1~0.
3公斤计算.
其配方为:玉米粒98%石膏1%,碳酸钙1%;将玉米粒浸泡数小时,再煮软但不能过软(即玉米粒中央还有一点白色),然后捞出晾干,加入石膏和碳酸钙,装瓶,加棉塞,用牛皮纸将瓶口包扎,以免消毒时将棉塞弄湿.
消毒在高压蒸汽消毒锅内进行.
当压力达0.
5公斤/厘米2时,排去冷空气.
压力升至1.
5公斤/厘米2时开始计时,消毒50分钟.
消毒结束后让压力自然降至零后,揭盖将瓶子取出,贴上标签,写明所接品种名称、接种日期、接种人姓名.
然后放入接种箱内进行接种,采用低温型平菇菌种,一支试管母种(一级种)接四瓶原种,原母种试管培养基中央的老菌块除去不用.
(二)栽培种(三种种)制作栽培种以棉籽壳为培养料,聚丙烯塑料袋(17*34*0.
05厘米)为容器,其配方为:棉籽壳99%石膏1%棉籽壳按1:1.
1—1.
2的料水比加入清水,使之用手捏料指缝间见水但不滴下为宜,此时即为65%的含水量.
塑料袋装料以每袋0.
3公斤干棉籽壳计算配料.
装袋后将袋口套上塑料环,并加棉塞,环口用牛皮纸复盖,用胶圈或绳子将牛皮纸捆紧.
然后将塑料袋装入常压消毒锅中进行消毒.
消费时间为上汽后(即灶内水开有蒸汽冒出)10--12小时,冷却后在塑料袋上贴上胶布作为标签,再将塑料袋放入接种箱内消毒接种.
每瓶玉米原种接种30袋左右.
接种后放入22~26℃条件下进行培养.
三、时间安排以一天时间配制培养料、消毒,接种.
以组为单位进行配料装瓶装袋,全班统一进行消毒灭菌,分组接种.
V食用菌加工技术一、目的要求了解食用菌常规加工技术.
二、方法与步骤食用菌的常规加工技术主要有盐渍、干制、罐头等(一)干制技术食用菌的干制也称烘干、干燥、脱水等,它是在自然条件或人工控制条件下,促使新鲜食用菌子实体中水分蒸发的工艺过程.
经过干制的食用菌称为干品.
干制设备要求不高,技术不复杂,易掌握;干制品耐贮藏,不易腐败变质,可长期保藏.
有的食用菌(如香菇)经干制后可增加风味,改善色泽,提高了商品价值.
但干制过程会引起营养成分及品质的变化,菇体中了些生理活性物质以及一些维生素类物质(维生素C)往往不耐高温,在烘干过程中易受破坏,菇体中的可溶性糖在较高的烘干温度下容易焦化而损失,并且使菇体颜色变黑.
l.
干制原理由于干制品所含可溶性固形物浓度相对提高,因而具有很高的渗透压,能使附在其上的腐败菌产生生理干旱,无法活动.
菇体所含的游离水在干燥过程中容易排除,但化合水结合于组织内的化合物质中,干燥过程中难以排除.
菇体脱水是靠菇体表面水分汽化和菇体内水分的向外扩散而实现的.
由于水分下降,酶的活性也受到抑制,这就是食用菌干制品能长期保藏的原理.
2.
干制方法菌类的干制分为晒干、烘干和冷冻干燥等方法.
(1)晒干是一种自然干制的方式,包括晾干和晒干.
晒干后,不仅有利于保存,还能改善菌类品质和提高营养价值,晒制还能促使香菇中所含的维生素D原转化成维生素D2.
晒干过程一般为2-3天,对后熟作用强的菇类务必于采收当日以蒸煮方式作灭活处理后再晒.
(2)烘干是食用菌干制的主要方法.
它是将鲜菇置于烘房、烘笼、烘干机中用炭火、电热或远红外线等作热源进行干燥的过程.
烘干不受气候条件影响,干燥快,省工,省时,产品质量有保证.
(3)冷冻干燥先将菇体中的水分冻成冰晶,然后在较高真空下将冰直接汽化而除去.
为了做到长期保藏,最好采用真空包装并在包装袋内充氮.
如双孢蘑菇的冷冻干燥工艺是:将蘑菇放入密闭容器中,在-20℃下冷冻,然后在较高真空条件下缓缓升温,经10—12h,因升华作用而使蘑菇脱水干燥.
经过这种处理的蘑菇具有良好的复原性,只要在热水中浸泡数分钟便可恢复原有形状,除硬度略逊于鲜菇外,其风味与鲜菇几乎没有差别.
3.
烘干工艺:适宜于脱水干燥的食用菌如口蘑、香菇、猴头菌、木耳、银耳、灵芝、竹荪等,干燥后不影响品质,有的还能增加风味与适口性.
但是有些菇如草菇、金针菇、平菇等干制后,其风味、适口性变差.
在脱水前可对菇体进行预处理,其方法之一为杀青,就是把菇体投入沸水中煮透,一般为2-8min,然后迅速冷却,但此法易造成菇体软化,影响形态.
也可用预热处理的方法,如草菇需纵剖,然后切口向上摆在烤筛上,勿重叠;金针菇扎成小捆整捆放在烤筛上.
放入烘箱后,使温度升高到(64±2)℃,处理20—30min,然后再进行常规烘烤.
烘房或脱水机的烘烤温度控制较为关键,温度过低易使产品腐烂变色,过高又会将产品烤焦.
烘烤温度从35℃开始,每小时升高1~2℃,经7~8h后鲜菇水分散发30%,12~13h后散发50%.
当温度升至60~65℃(勿超过75℃)时,水分已散发70%,然后将温度降至50~55℃,继续烘烤2~3h即可.
在烘烤过程中,要调整好通风口和排风口的开启程度,保持一定的换气量,加速鲜菇脱水.
干制的菇体在空气中易吸湿而回潮,引起霉变和生虫,因此,干品应贮藏于密封的塑料袋或容器中,放到清洁、干爽、低温的房间贮藏.
(二)盐渍技术1.
盐渍原理盐渍是让食盐渗入到菇体组织内,降低其水活度,提高菇体的渗透压,以控制微生物的生长活性,抑制腐败菌的生长,从而防止食用菌腐败变质,保持其商品价值.
其制品称为盐水菇.
食盐属高渗透压物质,质量浓度为l0g/L的食盐溶液可以产生610kPa的渗透压.
生产盐水菇用的食盐溶液质量浓度可达350g/L,能产生20MPa以上的渗透压,菇体组织中的水分和可溶性物质外渗,盐水渗入,最后达到平衡,使菇体组织也有很高的渗透压.
一般微生物细胞液的渗透压在350~1670kPa之间,一般细菌则为300~600kPa.
食盐溶液的渗透压则高得多,使附着在菇体表面的有害微生物细胞内的水分外渗,原生质收缩,质壁分离,造成生理干燥,迫使微生物处于假死状态或休眠状态,甚至死亡,从而达到防止腐烂变质的目的.
食盐溶解后就会离解,并在每一离子的周围聚集着一群水分子,也就是离子水化.
水化离子周围的水分聚集量占总水分量的百分率随着盐分浓度的提高而增加,水分活度则随之降低,也抑制了微生物的生长;而高浓度食盐离解产生高浓度的钠离子和氯离子,造成微生物所需的离子不平衡,产生单盐毒害,同样也抑制了微生物的活动.
食盐对微生物分泌的酶活力也有破坏.
由于氧很难溶解在盐水中,在盐液中形成了缺氧环境,需氧菌是难以生长的.
2.
盐渍工艺(1)选料选择好原料菇,当天采收,当天加工.
(2)漂洗用质量浓度为6g/L的盐水洗去菇体的杂质,接着用0.
05mol/L柠檬液(pH值4.
5)漂洗,能显著改变菇色.
因为菇体内的多酚氧化酶能利用酪氨酸形成黑色素的前体物质,经氧化作用形成黑色素.
而用低pH值的柠檬酸溶液可有效地抑制多酚氧化酶的活性,防止菇色变深和变黑.
(3)杀青指在稀盐水中煮沸、杀死菇体细胞的过程.
其作用是进步抑制酶活性;防止子实体开伞,防止褐变,破坏细胞膜结构,增加细胞透气性,排出菇体内的水分,以便盐水能很快进入菇体,然后依菌盖直径进行分级.
(4)制备饱和食盐水和调酸剂准备10:4的水与食盐,将盐溶化,直到盐不能溶解为止,用波美比重计测其浓度为23°Be′左右,再放大少量明矾静置,冷却后取其上清液用8层脱脂纱布过滤,使盐水达到清澈透明,即为饱和食盐水,备用.
配制调酸剂,其中柠檬酸占50%,偏磷酸钠占42%,明矾占8%,混合均匀后,加入饱和食盐水中,用柠檬酸调pH值至3~3.
5即可.
(5)盐渍将杀青、分级后沥去水分的菇按每l00kg加25—30kg食盐(精盐)的比例逐层盐渍.
先在缸底放一层盐,接着放一层菇(8-9cm厚),依次一层盐一层菇,直至满缸.
缸内注入煮沸后冷却的饱和食盐水.
表面加盖帘(竹片或木条制成),并压上鹅卵石,使菇浸没在盐水内.
3天需倒缸一次.
以后5-7天倒缸一次.
盐渍过程中,要经常用波美比重计测盐水浓度,使其保持在23°Be′左右,低了就应及时倒缸.
(6)装桶盐渍20天以上即可装桶.
装桶前先将盐渍好的菇捞出控尽盐水.
一般用塑料桶分装,加入新配制的调酸剂至菇面,用精盐封口,排除桶内空气,盖紧内外盖.
(三)罐头加工将新鲜食用菌经过一系列处理之后,装入特制的容器内,经过抽气密封、隔绝外界空气和微生物,再经过加热杀菌,便能在较长时间内保藏食用菌,其保藏的产品称为食用菌罐头.
按罐藏内容物的组成和制造目的的不同,食用菌罐头可分为两大类.
以食用菌整菇、片菇或碎菇为主要原料,注入适当浓度的盐水作填充液,称为清水罐头,主要用于菜肴的烹调加工,是当前食用菌罐头生产的主要类型.
将菇类和肉、鸡、鸭等原料配制,经烹调加工制成的罐头,如蘑菇猪肚汤等复合式食用菌罐头,可直接食用.
食用菌罐头厂一般采用马口铁罐和玻璃瓶罐,也有采用复合塑料薄膜袋包装.
我国食用菌罐头生产大约从本世纪50年代开始,一直发展至今.
目前,蘑菇罐头已成为中国出口罐头的拳头产品,除此之外,还有草菇罐头、香菇罐头、金针菇罐头等新品种,并已批量出口.
l.
罐头加工原理食用菌罐藏品能较长时间保藏的主要原理是:罐藏容器是密封的,隔绝了外界的空气和各种微生物.
制罐过程中,密闭在容器里的食用菌及制品经过高温灭菌,罐内微生物的营养体被完全杀死,但可能有极少数微生物孢子体没有被杀死.
如果是好气性的,由于罐内形成一定的真空而无法活动;如果是厌气性的,罐藏品仍有变质的危险,所以,罐藏品有一定的保藏期限,通常为两年.
由于高温灭菌也破坏了菇体的一切酶系统,使菇体内的一切生理生化反应不能进行,防止了菇体变质.
2.
罐头生产工艺(1)原料准备①选择好原料菇它必须符合制罐等级标准并应及时加工处理②漂白护色将菇体置于质量浓度为0.
3g/L的焦亚硫酸钠溶液中浸2-3min,再倒人质量浓度为lg/L的焦亚硫酸钠溶液中漂白为止,然后用清水洗净.
③预煮将菇体放入已烧开的2%食盐水中煮熟但不烂,可抑制酶活性,防止酶引起的化学变化;排除菇体组织内滞留的气体,使组织收缩、软化,减少脆性,便于切片和装罐,也可减少铁皮罐的腐蚀.
④冷却将煮过的原料迅速放人流水中冷却.
采用滚筒式分级机或机械振荡式分级机进行分级.
(2)装罐空罐使用前用80℃热水消毒.
装罐用手工或罐机装罐,因为成罐后内容物重量减少,一般装罐时应增加规定量的10%~15%.
(3)注液注入汤液可增加风味,排除空气,有利于在灭菌、冷却时加快热的传递速度.
汤液一般含2%--3%的食盐或0.
12%的柠檬酸,有的还加0.
1%的抗坏血酸.
(4)排气抽真空排气最重要的目的是除去罐头内所有空气.
空气中氧气会加速铁皮腐蚀.
排气后可以使罐头的底盖维持一种平坦或略向内凹陷的状态;这是正常良好罐头食品的标志.
排气有两种方法:一种是原料装罐注液后不封盖,通过加热排气后封盖,另一种是在真空室内抽气后,再封盖.
(5)封罐主要防止腐败性细菌侵入.
较早是手工焊合封盖.
现在普遍使用双滚压缝线封罐机;有手摇、半自动、全自动和真空封罐机.
(6)灭菌其目的是使罐头内容物不致受微生物的破坏,一般采用高压蒸汽灭菌.
采用高温短时间灭菌对保持产品的质量有好处.
蘑菇罐头灭菌温度为113-121℃,灭菌时间为15-60min.
(7)冷却灭菌后的罐头应立即放入冷水中迅速冷却,以免色泽、风味和组织结构遭受大的破坏.
玻璃罐冷却时,水温要逐步降低,以免玻璃罐破裂.
冷却到35-40℃时,则可取出罐头擦干;抽样检验,打印标识并包装贮藏.
VI平菇的栽培一、目的要求熟悉平菇栽培的技术.
二、方法与步骤(一)室内栽培栽培平菇的房间要有一定的散射光,能保温保湿,可通风换气,地面平整光滑,周围环境清洁卫生;门窗装有防虫的尼龙纱.
1.
品种选择应根据接种季节、栽培场所、培养料种类、栽培方式及市场要求等选择适宜品种.
秋冬宜用中、低温型品种,早春宜用中温型品种,春末夏初宜周中、高温型品种,夏秋宜用高温型品种.
2.
生产季节利用自然气温生产平菇,一般中、低温型品种在7月下旬至8月上中旬制原种,8月中下旬至9月上中旬制生产种;中温型品种在11~l2月制原种,次年1~2月制生产种;高温型品种在3~4月制原种,4~5月制生产种.
平菇可利用不同温型的品种,实现周年生产.
3.
培养料的选择、配方与处理1)培养料的选择培养料可以就地取材,采用棉籽壳、玉米芯、豆秆粉、锯木屑、稻草、麦秆等,其中以棉籽壳最好.
使用前,棉籽壳应在日光下晒1-2天,不能使用霉烂变质的.
生料栽培拌料时,可加入多菌灵或高锰酸钾等药剂防污染,但加入的药剂浓度过高,可能会对平菇菌丝造成药害.
实验表明,在平菇生料中加入0.
1%的多菌灵、0.
1%的托布津或0.
1%-5%的高锰酸钾溶液可较好地防治杂菌污染,而且对菌丝无不良的影响,但在培养料中加入过氧乙酸和甲醛溶液防污染效果差,且对平菇菌丝生长有抑制作用.
2)培养料的配方由于平菇培养料的来源很广,因此,主料与辅料的配法也多种多样.
(1)棉籽壳培养料①棉籽壳100%;②棉籽壳95%,豆饼粉(菜饼粉)5%;③棉籽壳95%,过磷酸钙2%,石膏3%;④棉籽壳80%,麸皮或米糠20%.
培养料含水量为65%--70%.
(2)废棉培养料废棉营养含量丰富且较全面,一般不必添加其它材料.
废棉pH值为5.
5左右,应加消石灰调节.
废棉因附着的棉纤维较多,吸水困难,需先将废棉放在清水中浸泡6-12h,浸透后用手捏干,或用压榨机压干,其含水量为65%-70%.
(3)稻草培养料①稻草粉80%-90%,米糠或麦麸10%-20%;②稻草粉98%,糖1%,石膏1%;③稻草95%,豆饼粉(菜籽饼)5%.
稻草中含有很多鬼伞菌等杂菌,可用开水煮20-30min,也可用1%-3%石灰水浸泡1-2天,然后用清水冲洗便其pH值为8,沥干,加大其它材料.
(4)玉米芯培养料玉米芯碎块60%,米糠或麦麸36%,石膏1%,尿素0.
2%,过磷酸钙2%.
(5)锯木屑培养料锯木屑78%,麦麸或米糠20%,蔗糖1%,石膏1%.
(6)甘蔗渣培养料甘蔗渣70%,麦麸或米糖28%,石膏2%(7)其它稿杆培养料可采用小麦秆、玉米秆、麦壳、向日葵秆、花生壳及山茅草等稿秆中的一种或两种,甚至多种材料组成,并制成糠粉或切成4~8cm长的材料.
其中稿秆糠75%~85%,麦麸或米糠10%~20%,蔗糖1%,尿素0.
5%,过磷酸钙2%,石膏1%.
(8)废纸培养料废纸(印刷厂切边纸等)90%,麦麸9%,碳酸钙或石灰粉1%.
将废纸切碎,用水浸泡6~l2h,捞出沥干,加入麦麸等材料.
4.
上料、播种:1)床栽一般床架式栽培可采用生料栽培,将配制好的培养料铺上菇床,逐层铺料,料厚10~15cm,可采用穴播,穴距为8~12cm,在料表面层应撒一层菌种,然后弄平料面,加盖薄膜.
2)块栽菌砖用长方形的木模制成,砖大小为90cm*50cm*l2cm.
具体操作方法为:在模子下铺塑料薄膜,在模子内铺人培养料和菌种,可采用层播法,一层料再铺上一层菌种,可铺多层.
也可混播,将料与菌种混合后铺入模子.
通常用种量常为干料质量的10%~15%.
每个菌砖之间应留有5~8cm的距离,以利于通风透气,使菌丝易萌发并吃料生长.
3)塑料袋栽适于熟料栽培.
若采用高压灭菌刚采用聚丙烯塑料袋,常压灭菌可用聚乙烯薄膜.
塑料袋长49cm,宽15~16cm,装料可采用装袋机.
袋两头开口的,应套塑料环,用棉花塞封口,然后用牛皮纸、防水纸或塑料薄膜包扎系紧,灭菌后接种,在菌丝培养室培养.
用塑料袋进行生料栽培,以两头开口为好,便于通风透气,定点出菇.
装袋先从一端开始,封口后先放一层菌种,再放一层培养料并压实.
装料达袋的一半时,又放一层菌种,再装满培养料,再播一层菌种压实,用木棒在料中央插一空洞,袋口用塑料环套好,封口.
气温高时,则松散直立放置,切勿堆积,以防发热高温烧坏菌种.
待袋温稳定后,再多层叠放呈墙形.
平菇袋栽可采用覆土栽培,覆土可减少虫害,提高产量和品质.
土质可选择微酸性的砂壤土,土壤要求疏松、肥沃、通气,使用前可用甲醛消毒,闷一天后再用.
当菌丝长满菌袋,培养料变紧实后脱袋覆土,或在菌袋出2-3批菇后脱袋覆土.
4)箱栽可采用清洁的塑料箱、旧木箱、包装纸箱、竹箱或其它材料编制的筐子来栽培.
先在箱内铺塑料薄膜,再装入调配好的培养料并播种,采用穴播或分层播种,播后用薄膜保湿.
采用此法栽培,便于搬动,可放到菌丝体或子实体生长适宜的温湿度场所.
工厂化生产宜用箱式栽培,可先将箱子放入温度适宜的房间进行菌丝培养,然后再移入湿度较高、温度较低的人防地道或岩洞中,让子实体发育.
箱筐在菌丝生长阶段可在地面上重叠放置,也可放在床架上,以充分利用空间.
5)瓶栽可采用750mL的玻璃菌种瓶或500mL的玻璃罐头瓶栽培.
采用此法出菇快,出菇前可拔去棉塞,子实体从瓶口长出;但此法所用玻璃瓶的成本高,生产工艺比较繁琐,适用于菌种场的少量生产试验或家庭小规模栽培.
5.
发菌管理播种后如料温持续上升,超过30℃,应加强通风降温,同时,要抖动盖在菌床和菌砖上的薄膜散热或将菌袋翻堆降温.
还要经常检查培养料有无杂菌虫害.
若发现有杂菌虫害,要及时处理;严重者,应将其移出培养室,喷施药剂,隔离培养.
发菌后期,若温度过低,还应保温、升温,以保证菌丝的正常生长.
经过20-30天培养后,菌丝长满培养料,提供适宜的外界环境条件,以刺激菌丝体扭结形成子实体原基.
6.
出菇管理平菇现蕾后,应注意通风换气和增加湿度.
采用菌砖、菌床等栽培的要掀开薄膜,采用菌袋的则要敞开两头,以利通风换气;可向地面、墙壁、空间喷水或采用增湿机以增加湿度,保持相对湿度80%-90%,切勿直接向幼小菌蕾喷水.
随着子实体的长大,应增加菇房湿度,喷水应勤喷、轻喷并加强通风换气,保持空气新鲜、湿润.
7.
采收当平菇菌盖充分展开,颜色由深逐渐变浅,但孢子尚未弹射时,即可采收.
适时采收,则菇体柔嫩,品质好,味道佳,产量也高;采收过早,菇体发育不足,产量低;采收过迟,菌盖干缩,菇柄坚硬,质量下降.
采收后的平菇要去除菌柄基部的草屑或棉渣,分装运往市场销售.
(二)室外阳畦栽培室外阳畦栽培只要少量薄膜、棚席等即可栽培,成本低,而产量不低.
该法因受外界气候影响较大,一般适于冬、春季栽培.
在室外做成宽70~100cm、深10~20cm的畦,长度可根据需要而定,畦底夯实,平整成龟背形.
先沿畦壁16cm处垫一圈薄膜,再装料分层播种.
为使培养料通气好,避免畦中央部位因通气不良,菌丝生长差,特别是当培养料过湿时,应每隔33cm留出3cm空位;这样过多水分也可流入小沟中.
播种后将所垫薄膜向畦内将培养料包住,并覆盖稻草,这样气温低时可起到保温的作用,过20天左右,菌丝长满后快现蕾时,将稻草和薄膜去掉,畦上用竹支架薄膜小拱棚,并盖草帘以阻挡阳光的直接照射,畦上还可搭一荫棚.
其它管理方法与室内栽培相似.
也可用大田畦式覆土栽培,其方法为:将畦土揭去一层,堆放在畦两旁,即成畦坑,然后将菌简脱袋,紧密排放于畦坑中,再将畦两边的细土覆盖在菌筒上,以盖没为度.
在覆土上洒一次水,使土湿润;再撒一层0.
5—1cm厚的细土,使菌筒盖严,加盖农用薄膜,以保温保湿.
菌筒覆土7-10天后,菌蕾开始拱土.
现蕾后注意通风换气,干燥时喷水,每采收一批菇后,要喷一次水,一般可出菇3-4批.
平菇露地栽培与阳畦栽培相似,只是不用搭荫棚而利用果园、竹林遮荫,也可与蔬菜高秆作物隔畦间作,如凤尾菇与白花豆间作效果好.
由于露地栽培保湿困难,培养料上宜覆盖厚度为1cm左右的细土.
VII灵芝的栽培一、目的要求熟悉灵芝的栽培二、方法与步骤(一)瓶栽和袋栽1.
栽培季节灵芝在自然气候条件下,一般春、秋两季栽培,春季栽培在3--4月接种;秋季栽培在9--10月接种,如果有空调等设备,一年四季均可栽培.
2.
菌种的制作灵芝菌丝在黄豆芽黄豆粉培养基中生长最好,而在PDA培养基中生长最慢.
紫芝菌丝在胡萝卜蛋白胨培养基中生长最好.
而作为原种或栽培种,要求纯净无杂菌,品种优良,生命力强,菌龄适当.
3.
栽培材料配方(1)棉籽壳麦麸培养料棉籽壳77%,麦麸20%,糖1%,石膏1%,过磷酸钙1%.
(2)棉籽壳木屑培养料棉籽壳50%,木屑32%,麦麸15%,石膏1%,过磷酸钙1%,糖1%.
(3)木屑培养料木屑77%,麦载20%,石膏1%,过磷酸钙1%,糖1%.
(4)甘蔗渣培养料甘蔗渣75%,麦麸22%,糖1%,石膏1%,过磷酸钙1%.
(5)花生壳、豆秸、棉秆培养料花生壳(豆秸,棉秆等)77%,麸皮20%,糖1%,石膏1%,过磷酸钙1%.
(6)玉米芯培养料玉米芯74%,麸皮25%,石膏粉10%,草木灰0.
5%.
据1993年我们的栽培试验表明,采用(1)号配方培养灵芝,其产量较高可达74.
45g/瓶.
4.
栽培管理将已接种的瓶子或袋子搬人培养室,在条件适宜时,菌丝3-4天即萌发;1星期左右开始吃料并迅速生长.
当菌丝已全部长满斜面,向料内深入2-3cm时,即可松动棉塞但不拉出,以便增加瓶(袋)内的空气.
l个月左右子实体原基开始形成并逐渐发育为菌蕾.
菌蕾形成后,及时拔去棉塞,瓶栽的应将瓶倒放成卧式横排培养,也可转至另一间专用栽培室培养.
卧排的瓶子每排可重叠10~12瓶,以充分利用培养室空间,便于管理.
室内温度控制在25~28℃,空气相对湿度90%~95%,每天向空中喷雾4~5次,经常使地面保持湿润,地面若积一层水更好.
但喷水不可直接喷到子实体上和瓶(袋)内,以免菌体霉变腐烂.
此时应加强通风换气,给菇体充足的氧气,每天早、中、晚开窗通风1~2h.
若CO2积累过多,子实体就不能很好地生长,菌柄长,菌盖小,甚至完全不分化菌盖,呈鹿角状或棍棒状.
同时要做到室内有较充足的光线.
在正常情况下,从菌蕾形成到拔塞卧放约需25天,即可开始采收.
(二)阳畦栽培1.
建阳畦选择坐北朝南,东西作畦,畦宽1.
5m,长4~5m,深30~35cm,畦周围设置水沟,畦上搭棚架,覆盖塑料薄膜和草帘遮荫.
2.
菌丝培养采用聚丙烯塑料袋,按前述培养料配方装袋、灭菌、接入灵芝原种,于25~28℃培养,经25~30天菌丝长满全袋.
3.
出芝管理将长满菌丝、脱去塑料袋的菌筒平铺于阳畦内,每个菌筒之间相距6—10cm,中间填入菜园土,然后向畦内喷水.
自5月中旬入阳畦,经5-10天左右出现原基,每天需打开阳畦两头的塑料薄膜通风,时常喷水,以保持畦土湿润.
于6月中旬采头潮灵芝,再过20天可采第二潮.
经试验表明,阳畦栽培灵芝不仅管理方便,产量较高,且菌盖大,柄短,形状近似野生灵芝,商品性状好,经济效益高.
(三)应用1.
药用灵芝菌体内含有多种有效成分,如灵芝多糖、灵芝酸(灵芝三萜类化合物)、皂甙、麦角甾醇、腺苷、嘌呤、嘧啶、生物碱、内酯等,具有很高的药用价值.
这几种成分大多数能溶解于热水,但是灵芝酸、皂甙、麦角甾醇等成分在热水中的溶解度较低,在乙醇中的溶解度较高,可用乙醇提取,灵芝的其它有效成分都可用热水提取.
下面介绍灵芝有效成分的提取方法.
(1)灵芝的热水提取将灵芝子实体用破碎机破碎成块,投入提取锅,加入去离子水.
加热使水沸腾并保温2h,流出煎液.
残渣用同法再提取,放出第二次煎液.
将两次煎液合并,输入贮液槽,静置l0h,吸取清液,弃去槽底泥浆状物,将清液浓缩,制成灵芝制品.
(2)灵芝的乙醇提取将灵芝子实体破碎,投入提取锅,加入95%食用乙醇,78℃下回流lh,放出提取液,残渣留在锅中.
再用95%食用乙醇用同法提取3次,将3次乙醇提取液合并,在贮液槽中静置10h,取出上清液,弃去底部沉淀物,将上清液中的乙醇回收,去乙醇后的浓缩物可制成灵芝制品.
现在,灵芝制品剂型很多,有糖浆、片剂、胶囊、冲剂、粉剂、丸剂、酒剂、注射剂、水煎剂、酊剂等剂型,对多种疾病具有良好的疗效.
今后随着研究的不断深入,其药用价值的迸一步认定,将生产出更多的疗效显著的灵芝制品供应市场.
2.
食用由于灵芝具有丰富的营养,含有人体必需氨基酸、维生素、矿物质、多糖等多种成分,是理想的保健食品.
可以直接食用灵芝菌体,也可制成多种类型的加工食品,如灵芝口服液、灵芝乳酸浓缩液、灵芝茶、灵芝可乐、灵芝猴头膏、灵芝糖、灵芝蜂王浆等.
3.
美容据研究,灵芝具有抗衰老作用,有抗皱、消炎、清除色斑、保护皮肤、增加头发光泽的美容效果.
灵芝的护肤、养发、沫浴制品也已面市,如灵芝特效营养增白露、灵芝润肤露、灵芝爽肤沐浴露、灵芝防皱露等.
4.
盆景灵芝子实体形态奇特,富有光泽,坚硬不腐,可作为造型材料制成可供观赏的艺术品,即灵芝盆景.
灵芝盆景的制作,首先要根据灵芝生长发育的规律,采用生物技术,调控光、温、水、氧气、二氧化碳等条件,也可采用接合、药物刺激等手段,人工培养出形态各异的子实体.
如在高温或缺氧下,可培育出菌柄细长或分校呈珊瑚状的灵芝;控制通气状态,可培育出双层菌盖的子实体;根据其向光性,可改变菌柄、菌盖生长的方向;选用不同口径的容器,可控制朵型的大小;用紫外线照射,可使子实体变形.
培育个体较大的树舌可用来绘制山水风景、人物或雕刻各种图案,然后进行造型设计,通过修剪、晒干、防腐对子实体进行处理,防腐可采用3:1的75%酒精甲醛溶液擦拭子实体,晾干后,连续涂两次光油,使之有光泽,并有防腐防虫作用.
将处理后的子实体打磨、粘合,用石米或塑料泡沫作填充材料,煮熔石蜡固定在花盆、花盘或玻璃框内,并配以花石、假山、树根、人物、小型动物以及绒毛制成的小草等,便制作出寓意深远的灵芝盆景.
VIII金针菇的栽培一、目的要求:了解金针菇的栽培二、方法与步骤古代,人们常采用段木栽培生产金针菇,但段木栽培的金针菇产量低,形状不好,色泽深,常为黑褐色,商品价值低,不受消费者喜爱,因此,现在几乎不再采用段木栽培方式.
随着代料栽培技术的发展,目前金针菇主要有瓶栽、袋栽、大麻栽培等方式.
(一)瓶栽l.
栽培容器可采用750mL、800mL或l000mL的无色玻璃瓶或塑料瓶,瓶口径约7cm为宜,可使菇蕾大量发生,同时,瓶口较大,通气较好,菇质量也高.
目前国内也常采用750mL的菌种瓶或500mL的罐头瓶作为栽培容器,菌种瓶口径太小,菇蕾发生个数少,菇体较密,通气差,所以近瓶口一段菌柄色泽特别深,影响菇体质量.
而罐头瓶装料有限,水分容易蒸发且易污染杂菌,长出的菌蕾细弱,产量不高.
2.
工厂化瓶栽设施工厂化周年瓶栽金针菇需有如下设施:(1)接种室要求为无菌状态.
由于灭菌后培养料温度高,需降温,因此要设置翅片冷却器,将培养温度降到15--l8℃.
(2)菌丝培养室利用控温设备,保持温度20℃左右,并安装定时换气阀或全热交换器,每2--3h强制通风15min,排除呼吸产生的过多的二氧化碳.
(3)催蕾室要求控温13--14℃,空气相对湿度85%--90%,黑暗.
在催蕾室两侧壁的墙脚处设吸气孔,在两墙上方设排气孔,用于通风换气.
室内有不排风的翅片冷却器和加湿器.
菌蕾培养成整齐、圆整而结实的金针菇菇房的室温要求4℃左右,空气湿度80%--85%.
安装由上往下吹风的冷风机组、换气阀或全热交换器.
(5)套纸筒生育室为便金针菇菌柄伸长,子实体需干燥发白,套上纸筒,同时室温要求在6~7℃,室内安装横向吹风的冷风机组.
工厂化生产金针菇可采用800—1000mL、口径7cm的聚丙烯塑料瓶,瓶盖采用无棉盖体.
3.
培养料可选用阔叶树或针叶树的木屑,需在室外堆积,让木屑中的树脂、挥发油及水溶性有害物散失.
棉籽壳、废棉、甘蔗渣、稻草粉均可作为原料.
常用的配方有:(1)棉籽壳95%,玉米粉3%,糖1%,石灰1%.
(2)废棉99%,石膏1%.
(3)甘蔗渣73%,米糠25%,糖1%,碳酸钙1%.
(4)木屑73%,米糠25%,糖1%,碳酸钙1%.
(5)稻草粉73%,米糠25%,糖1%,碳酸钙1%.
4.
配料装瓶将主料棉籽壳、甘蔗渣、废棉等浸水6--12h后捞起沥干,木屑过筛,与其它辅料混合,调节含水量为65%-70%.
装瓶时下部可装松些,以缩短发菌时间;上部要装紧些,否则易干燥.
装料应至瓶肩.
装完用木棒在瓶中部插一个直通瓶底的接种孔,使菌丝在上、中、下部同时生长,塞入棉花,外包防水纸或报纸或聚丙烯薄膜封口.
5.
灭菌、接种与培养采用高压蒸汽灭菌,在147kPa压力下灭菌1~1.
5h,常压灭菌是在100℃下灭菌8~10h.
接种需按无菌操作进行,接种量以塞满接种孔为宜.
接种后立即将接种瓶移入培养室,在20℃左右培养.
因菌丝生长进行呼吸作用,会发热,瓶内温度一般比室温高2~4℃.
气温低时,关闭门窗,每隔5-6h通风换气一次.
一般菌丝经20~30天可长满全瓶.
6.
出菇管理(1)催蕾将长满菌丝的瓶子移到出菇室,去掉瓶口上的棉塞,进行搔菌.
所谓搔菌就是用镊子等工具将老菌种扒掉,去掉白色菌膜,并刮平、按平培养料表面,使其平整.
也有不搔菌的,但搔菌后效果好.
然后用报纸覆盖瓶口,每日在报纸上喷水2--3次.
几天后培养基上部就会形成琥珀色的水珠,有时还会形成一层白色棉状物,这是现蕾的前兆,再过13-15天就会出现菇蕾.
喷水过程中,不能把水喷在菇蕾上,否则菌柄基部就会变成黄棕色至咖啡色,影响出菇的质量,同时会产生根腐病.
催蕾期温度控制在12~13℃,湿度85%~90%,每天通风.
3~4次,每次15min左右.
(2)抑制现蕾后2-3天,菌柄伸长到3-5mm,菌盖呈米粒大时,应抑制生长快的,促使生长慢的菇体生长,使菇体整齐一致.
在5-7天内,减少喷水或停水,湿度控制在75%,温度控制在5℃左右.
(3)套筒为了防止金针菇下垂散乱,减少氧气供应,防止强光加深颜色,抑制菌盖生长,促进菌柄伸长,常采用套筒措施.
可用牛皮纸、塑料薄膜,蜡纸作高度10~15cm的筒,呈喇叭形.
当金针菇伸出瓶口2~3cm时套筒;若套筒过早,只有瓶中间的菇生长且不容易形成菌盖;若套筒过迟,子实体矮小,没有商品价值.
为使空气能从筒下部进入,常在筒下部打数个少圆孔;套筒后每天在纸简上喷少量水,保持湿度90%左右,早晚通风15~20min,温度保持在6~8℃.
在金针菇生产中,常选用浅色或白色品系,采用套筒、遮光、吹风等技术手段,以抑制金针菇色素的形成和菌盖的展开,并促进菌柄的伸长,得到质地柔软、白色或浅白色的金针菇子实体,这一栽培方法称为金针菇白色软化栽培.
7.
采收鲜销的菇体在菌盖六七分开伞时采收,不宜太迟,以免菌柄基部呈褐色,绒毛增加而影响外观和质量.
采收时一手拿住瓶,另一手轻轻把菇丛拔下,采收一批后进行搔菌,重新盖报纸保湿培养,以便第二次出菇.
一般金针菇可采收2-3批,但产量主要集中在第一、二批,其中第一批产量占总产量的60%左右.
从出菇到收获完毕需40~60天.
(二)袋栽袋栽由于袋口直径大,菌蕾可大量发生,通气好,菇的色泽较好.
用于栽培的塑料袋的上端可用来遮光、保湿,从装料到采收等栽培管理过程,操作简便,原基形成后只需拉直袋口,免去了套筒的手续.
我们的研究发现,袋栽金针菇的子实体个数比用750mL菌种瓶、500mL罐头瓶栽多出60%和48%,而袋栽的菌柄长度可增加9mm和33mm.
一般来说,袋栽比用3.
5cm口径的瓶栽产量高出30%左右.
但因塑料袋口大,培养基水分易蒸发干燥,同时塑料袋破裂时易引发杂菌污染,造成损失.
1.
塑料袋规格可采用聚丙烯塑料袋,长40cm,宽17cm或长38cm,宽l6cm,厚度0.
05—0.
06mm.
塑料袋宽度不宜过大,否则易感染杂菌,且菌柄易倒伏.
2.
配料装袋培养料配方和配制与瓶栽相同,但因袋口较大,水分会有散失,培养料含水量可调高些,为70%~75%.
为了使原料充分混合均匀,可采用原料搅拌机混合搅拌.
装袋时,注意袋底两个角压人袋内,袋内放一圆形木棒,边装边压紧,袋上端留15cm以上的长度,装入塑料环,用棉塞塞入,外包牛皮纸或防水纸封口.
也可采用装瓶、装袋机,以提高工效.
3.
灭菌、接种与培养由于塑料袋装量多,灭菌时间比瓶栽要长一些,高压灭菌l.
5-2h,常压l00℃灭菌8-l0h.
接种、培养与瓶栽相同,但需注意用玉米菌种接种栽培的,需防老鼠咬穿塑料袋.
4.
出菇管理当菌丝长满袋后,将棉塞或套环去掉,拉直袋口,在上面覆盖一层报纸,每日喷水于报纸上,可保持较高的湿度(85%-90%),防止水分蒸发.
同时增加CO2的浓度,抑制菌盖生长,待其菌柄变长时,取掉报纸.
其它管理与瓶栽相同.
IX双孢蘑菇的栽培一、目的:熟悉双孢蘑菇的栽培技术二、方法及步骤A.
床式栽培(一)培养料配制培养料的好坏直关系到蘑菇栽培的成败和产量高低.
蘑菇培养料目前有粪草培养料和合成培养料两大类.
l.
培养料的基本材料稻草和麦秆富含半纤维素、纤维素及木质素等有机碳,且质地疏松,具有弹性,通气良好,是堆制培养料的好材料.
稻草的茎秆易吸水,腐熟快,堆积两用后就会腐熟,但粘性较大;小麦的茎秆硬,外被腊质,不易吸水,腐熟慢,堆积3~4周才能腐熟,但质地疏松.
生产上常将稻、麦草混合使用.
堆制对应将麦秆及稻草先后加大,或将麦草充分浸透后和干稻淋一起堆制.
总之,要减少稻草的堆制时间,特别是早稻草的堆制时间要减少,以免过分腐熟.
其它如粉碎的玉米秆、玉米芯及甘蔗渣等也能用来配制培养料.
畜禽粪是蘑菇需要的营养物质,都可用来配制培养料.
猪粪的有机物含最较少,氮、磷、钾含量高,用作堆料出菇快,菇较小而密,前期产量高,后期产量低.
牛粪中有机物及氮、磷、钾的含量稍低,若将牛粪晒干弄碎后堆料,则发酵快,堆温高.
用牛粪堆料种植的蘑菇粗壮,出菇期较长,但出菇较稀.
马粪含丰富的有机物,氮、磷、钾的含量也较高,质地疏松,具有较高的发酵能力,其出菇产量和质量与牛、猪粪栽培相似.
几种畜粪可混合使用.
鸡、鸭粪养分充足,发热快,温度高,但碱性重,粘性大,可与畜粪混合堆制.
2.
培养料配方(1)粪草培养料我国目前栽培的蘑菇多数采用粪草培养料,铺料厚度以15cm计,则每l00m2的栽培面积需要4500kg培养料,可采用粪草比例1.
5:1或1:1两种配方.
①干牛粪58%,干稻麦草39%,过磷酸钙1%,尿素0.
5%,硫酸铵0.
5%,石膏1%.
按此配方约需干牛粪2600kg,稻麦草各半共l800kg,过磷酸钙45kg,尿素23kg,硫酸铵23kg,石膏45kg,C/N约为31.
6:1.
②干牛粪47.
5%,干稻麦草47.
5%,菜籽饼4.
5%,尿素0.
5%;石膏1%、按此配方需干牛粪约2l00kg,干稻麦草各半共2100kg,菜籽饼200kg,尿素25kg,100石膏45kg,C/N为33:l.
下面介绍几种国外的粪草培养料配方.
①美国马厩肥堆料配方:马厩肥80kg,鸡粪7.
5kg,啤酒糟2.
5kg,石膏1.
25kg.
②荷兰马厩肥堆料配方:马厩肥l000kg,鸡粪l00kg,石膏25kg.
(2)合成培养料合成培养料是不用粪肥或少用粪肥配制的培养料.
目前,合成培养料在日本、美国、南韩、英国及我国台湾已相当普及,成为蘑菇生产的主要培养料.
合成培养料以稻草或麦秆为主要材料,配以含氮量高的尿素、硫酸铵或饼肥等.
在配制合成培养料时,不宜只采用一种氮肥,因为堆肥的腐熟是多种微生物共同发酵的结果,不同种微生物需要不同的氮源.
在配制培养料时还需添加一定量的磷、钾、钙等营养元素.
由于合成培养料的腐熟比粪草培养料慢,尤其是小麦秆、玉米芯等不易腐熟,还需添加微量元素加速麦秆等的腐熟,也为培养料增加营养成分.
我国采用合成培养料的配方较多,下面举例说明.
①上海农科院的配方:每l00m2栽培面积用稻草2250kg,尿素18.
5kg,过磷酸钙22.
5kg,石膏粉45kg,碳酸钙22.
5kg,C/N为33:1,经二次发酵后,播种前C/N为18:1,pH值由8.
3左右降至7.
3左右.
②我国台湾配方:稻草l00kg,尿素1kg,硫酸铵2kg,过磷酸钙3kg,碳酸钙2.
5kg国外的合成培养料配方也很多,现举例如下.
①日本配方:稻草l000kg,石灰氮10kg,尿素5kg,硫酸铵13kg,硫酸钙30kg,过磷酸钙30kg.
②美国兰伯特式合成培养料的配方:小麦秆或黑麦秆1000kg,血粉40kg,马粪l00kg,尿素l0kg,过磷酸钙40kg,碳酸钙20kg,细土500kg,水2500kg.
③美国辛登式配方:麦秆l000kg,豆稿l000kg,干啤酒槽75kg,石膏50kg,硝酸铵30kg,氯化钾25kg④南韩配方:稻草1000kg,鸡粪l00kg,尿素12--15kg,石膏10—20kg.
(二)培养料堆积发酵堆积发酵将配方中的各种材料混合在一起,让其腐熟发酵的过程.
其目的为:使各种好热性微生物在堆料中繁殖,把培养材料中的纤维素、半纤维素、木质素分解为蘑菇菌丝可以利用的化合物;所加人的氮素营养物质被各种微生物利用后,变成微生物的蛋白质,当微生物死亡后,菌体也就成了蘑菇可利用的有机氮;发酵过程中释放的热可以杀死料中的病虫杂菌;经过发酵,堆料变得柔软、疏松、通气,具有优良的物理状态.
l.
堆料前的准备粪肥应晒干,不要淋雨,若来不及晒干,则可挖坑倒入,拍紧,密封.
用干粪堆积效果好,牛粪最好晒干至半干时粉碎成粉状,再晒干透.
稻草、麦秆等材料需选用新鲜、无霉烂的,使用前须切割成20--30cm长的小段,以便其吸水,也便于翻堆.
2.
培养料的二次发酵蘑菇培养料堆积腐熟发酵一般分两个阶段进行,前发酵,又称一次发酵或室外发酵;后发酵,或称第二次发酵,因其通常在室内进行,又称为室内发酵.
(1)前发酵采用粪草培养料的,前发酵时间较长,需15~20天;采用以稻草为主的合成培养料的,前发酵时间需10~15天:以麦秆为主的发酵时间较长.
麦草吸水力差,应浸泡2~3天,稻草吸水快,只浸泡l天即可.
干粪在堆制时用水调湿润.
使用的粪和草均需先预湿.
堆料时,先铺一层厚20cm的草料,草上铺5—6cm厚的粪肥,其上再铺20cm厚的草,再铺5~6cm厚的粪.
这样一层草一层粪层层相间地堆积起来.
第一层粪草不需浇水,以后每铺一层粪一层草后,补浇清水或人畜粪尿.
下层少浇,上层多浇.
料堆不要过宽,否则操作不便,且透气性差,料温难以提高;料堆过窄,则可能使料温过高,将一些微生物杀死,对发酵不利.
堆料最好在阴棚下,免受日晒雨淋.
培养料堆积后也应覆盖草帘,以利于保温保湿.
但一般不宜用塑料薄膜紧贴培养料覆盖,否则,料堆通气不良,会造成厌氧状态,使堆内材料变粘,在露天堆料,下雨前需用薄膜作为临时避雨棚.
培养料堆积发酵后,需经几次翻堆.
翻堆是定时将堆积的粪草抖松拌和,把位于料上面的和周围的粪草翻到下面或中间去,而把下面或中间的材料翻到上面或外围来,使堆积的培养料发酵均匀、一致.
有条件的地方也可采用翻堆机翻堆.
在不同部位的粪草发酵很不均匀,料堆最外层氧气虽然充足,但水分散失多,培养料分解较差;在料堆中心部位,由于缺氧,培养料不能很好地分解;在料堆底层的培养料积有较多的CO2,培养料呈酸性,会发粘发臭.
只有外层至中心部分发酵最好.
因此,通常应进行3次以上的翻堆.
翻堆的作用是:改善料堆各部位的发酵条件,防止料堆中央部位特别是中央底层长期处于厌氧状态;排除堆内废气,增加新鲜氧气,缩短发酵时间;调节水分;检查发酵状况;便于分次加入添加材料.
堆料后,次日堆温便开始上升,开始40~50℃,是一些嗜温性微生物(主要是一些细菌)活动;4~5天后温度上升到65~75℃时,此时是一些嗜热性微生物(主要是嗜热性放线菌)活动.
一般当堆温上升到最高点并开始下降时,即应进行一次翻堆.
堆温由微生物分解物质时释放出来的热能维持,如果堆温开始下降,说明堆内物质的分解作用已减弱,此时翻堆能及时补充堆内的氧气和水分,使微生物的分解作用在新的条件下继续进行,加速培养料分解和腐熟.
高温能杀死粪草料中的病菌孢子和虫卵,但长时间高温,一些嗜热性放线菌也会旺盛地繁殖起来,就会耗损大量可溶性养分.
每次翻堆的时间随着材料的发酵腐熟逐渐递减,通常进行第一次翻堆时间是上堆后的6~8天,进行第二次翻堆时间是第一次翻堆后的5~7天,第三次翻堆是第二次翻堆后的4~5天.
第一次翻堆加足水分;并加尿素和石膏粉;第二次翻堆只对料干部分适当加水,不宜加水太多,此次加入硫酸铵及过磷酸钙;第三次翻堆调节水分及酸碱度.
(2)后发酵国内目前后发酵方法有两种,即固定床架式后发酵和就地式后发酵,后者就是将前发酵的料就地建堆后发酵,但以前者为主,将培养料移人菇房后再一次发酵.
通常前发酵以化学反应为主,要求高温快速;后发酵则是生物活动过程占优势,要求控温、控湿、通气.
后发酵过程分两个步骤进行,将经前发酵好的培养料搬人菇房床架上,关闭门窗,升温至58~60℃,维持6-8h,即巴斯德消毒,以进一步杀死料中的虫、卵和病害、杂菌.
然后通风降温,在12h内逐步将料温降至48~53C,维持3~5天,促使一些有益微生物生长,将培养料转化为易被蘑菇菌丝吸收和利用的物质;同时便能刺激竞争性杂菌生长而抑制蘑菇菌丝生长的氨气挥发.
因为氨气在50℃以上或40℃以下挥发速度明显减慢.
控温发酵还可减缓易被细菌和真菌利用的碳水化合物的降解,而不至于降低培养料的活性.
后发酵过程中的有益微生物大体可分为嗜热细菌(最适生长温度50~60℃)、嗜热放线菌(最适生长温度50~55℃)和嗜热霉菌(最适生长温度45~53℃)三类.
它们在料内繁殖的顺序为:细菌——放线菌——真菌.
首先是细菌大量繁殖,利用培养料中易降解的碳水化合物,产生粘滑的物质即多糖类,这是蘑菇生长所需要的重要碳源.
接着放线菌繁殖,降解纤维素和半纤维素,并利用氨、胺和酞胺作为合成细胞物质的营养,同时释放出蘑菇菌丝生长所需的生长因子如维生素等.
最后是一些非分解纤维素的霉菌协同放线菌进行氨的转化,有些还利用细菌作养料,合成自身物质.
其中以放线菌最具活性.
通过后发酵,培养料由棕色变成深褐色,料松软,不粘稠,含水量65%~68%,含氮量1.
8%~2%,C/N为18~20;pH值7-7.
5,含氨量为0.
04%或更少.
影响后发酵的主要因素是温度、培养料含水量、氧气等.
温度是后发酵过程中的首要因子,必须设法达到所要求的温度,以培养料的温度为标准.
由于后发酵需消耗和散失较多的水分,故培养料含水量应较高,为70%左右,在前发酵最后一次翻堆时调节.
用蒸汽加热,培养料含水量为71%~73%,后发酵结束时其含水量为67%~71%.
采用室内炭火直接加温法,后发酵时培养料含水量应为70%~72%;采用炭火及蒸汽加温法,则料含水量宜为65%~68%;采用塑料棚保温法,培养料含水量以65%为宜.
后发酵中料内的有益微生物一般好氧,室内应有空气,因此后发酵时期应适当开启门窗或敞开薄膜通风,以促进有益微生物活动,抑制厌氧细菌繁殖,制成有选择性的培养料.
后发酵的关键措施是加温和控温.
将经过前发酵的培养料调节到一定温度后,搬入室内,然后通入蒸汽,进行加温和控温.
我国目前许多地区在生产上进行后发酵的加温方法,大体可有:室内炭火加温式控温;室外薄膜覆盖升温,对于室内炭火直热式的后发酵,菇房应密闭不漏风,菇房大小以111m2一间为宜,在室内设置10~20个无烟煤炉加热升温,菇房过大不易升温.
炉火烧旺后将门窗紧闭密封,使温度逐渐上升.
达到60℃时维持6~8h,然后拿掉部分炉子并适当开窗,将温度降到48~53℃,保持4~6天.
每天在高温时进行2~3次通风换气,每次10~15min.
通风换气避免了二氧化碳以及其它有害气体过多,影响发酵.
采用这种方法进行后发酵,成本低,效果好.
露天式后发酵是利用堆肥在完成前发酵后,再建后发酵堆.
建堆时,在料堆底部中心建一道通气小道,料堆上面用草片覆盖,夜间、雨天再在料堆顶部加盖塑料薄膜,其内用竹片支撑,使其与料面有15-20cm的距离.
在建堆的第二天,料的中心温度达的60~65℃,保持2h,揭开覆被草片,并在料上按15cm*15cm距离,打一个直径5cm的小孔,用来掌握通气量,以便调节温度,使温度维持在5℃左右.
蘑菇培养料后发酵的优点是:提高了蘑菇产量和质量,一般可增产20%~40%,有时可增产l倍以上.
生产的子实体品质好,菇形正,肉厚,柄粗,不易开伞,一级菇比例大.
采用培养料后发酵,由于高温放线菌等有益微生物的活动,可形成多种可供蘑菇菌丝直接吸收利用的维生素和氨基酸;后发酵将培养料在60℃下处理2h,可以把料中的虫卵、幼虫等害虫杀死,使病虫来源大大减少,可不用或少用农药防治,减轻了农药污染;用后发酵技术可推迟堆料期7~10天,这样缓和了双夏劳力矛盾;后发酵堆料比一次发酵少两次翻堆,可减少用工,也可减少费用,降低生产成本.
(三)菇房的消毒灭菌将适度腐熟的培养料尽快搬入菇房,先填入最上层床架,从上到下,逐床填入,填料的厚度为16~20cm.
填料完毕,即关闭门窗,用甲醛、敌敌畏各lkg熏蒸消毒24h,操作方法与空菇房消毒相同.
(四)培养料的翻料当培养料经后发酵消毒或用农药熏蒸消毒后,要进行一次翻料,即将铺在菇床上的培养料上下翻动一次,把料抖松,同时将料中发黄绿色的生粪块及杂物等均除去,并打开门窗,进行大通风一次.
通风及抖松料的目的是为了将料在消毒发酵过程中产生的二氧化碳、乙醛、乙烯等各种有害气体彻底排除,使料内进人较多的新鲜空气,有利于接种后菌丝在料中迅速生长,同时翻匀后可使料层厚薄一致,保持15--18cm厚,这样料面平整,床面喷水时受水量也均匀,避免床面凹陷处积水.
(五)播种1.
播种前的准备菇房熏蒸消毒或经室内发酵后,打开门窗及排风筒,排除药液气味或热气,及时进行翻料.
若培养料偏湿或料内氨气过浓时,在料面喷2%~3%的甲醛溶液,随后密闭一夜,次日打开门窗通风后再翻料一次加以清除.
播种前需先测量料温,温度超过30℃,可再翻料一次降温,待培养料温度下降至28℃以下时才可播种.
播种前要对菌种质量进行检查,选用优质菌种.
优质菌种的标准是纯度高,菌丝浓密、旺盛,生命力强,粪草种的培养基里红棕色,有浓厚的蘑菇香味,不吐黄水,无杂菌虫害.
2.
播种时间目前,我国蘑菇栽培主要是利用自然气温进行生产,因此播种时间的选择十分重要.
由于蘑菇菌丝生长阶段要求较高温度,子实体发生要求较低温度,因此我国各地一般都进行秋播或深秋播,长江流域各省多数在9月上中旬温度在28℃以下时播种,10月中下旬开始采收,12月秋菇采收结束,至次年3月气温回升,又可出菇,至5月春菇结束.
珠江流域各省秋季气温较高,冬季不冷,一般在秋末播种,初冬开始采菇,冬春季连续出菇,没有间歇.
如福建在10月下旬播种,11月中下旬开始采菇,4月至5月上旬采菇结束.
华北地区一般在8月下旬播种.
3.
播种规格播种量因菌种培养料不同而有较大差异.
每瓶(750mL蘑菇菌种瓶)粪草菌种播0.
28--0.
33m2;麦粒菌种播1.
33--1.
67m2.
为了使菌种尽量全面萌发,菌丝在培养料表面应占有优势,减少杂菌污染.
一般穴播采取"小株密植"方式,行株距由l0cm见方改为8cm梅花形,深度5cm.
目前新法播种采用混播加撒播方式,即先以三分之二的菌种撒在培养料表面后,将菌种翻入料中5cm与培养料混合,再将剩下的三分之一菌种撒在料面上.
无论选用哪种方法播种,为防止杂菌污染,所用工具及操作人员的手都要严格消毒,菌种瓶表面及瓶口均用0.
1%高锰酸钾溶液消毒,近瓶口一层菌种不用.
4.
播种后的管理播种3天后,为使菌种与湿料接触,易于萌发,一般情况下关闭门窗,仅有背风地窗少量通风,潮湿天气可打开门窗通风.
3天以后,当菌丝已经萌发,并开始长出培养料时,菇房通风应逐渐加大.
如气温在28℃以上、为防止高温影响室内温度,可在中午关闭门窗,只开北面地窗,同时注意夜间通风,雨天多开门窗通风.
播种5--7天后,菌丝已经长大培养料;为了促进菌丝向料内生长,抑制杂菌发生,需加强通风,降低空气湿度.
在无风情况下;多开窗,南北地窗昼夜全部打开;有风时只开背风门窗.
在气候干燥而培养料又偏干时,可在料面覆盖一层报纸,保持料面湿润.
培养料过干时,可在报纸上喷水,增加料面湿度,使菌丝长入料内.
播种7天后要进行检查,如发现杂菌及病虫害,应及时处理.
如发现培养料过湿或料内有氨气,为了使菌丝长入料内,可在床架反面打洞,加强通风,散发水分和氨.
荷兰菇农是从合作社购买菌种和原料,进行混合播种,这可由一种小型的铺料机完成.
播种后用空调调节温度,保持20--25℃.
(六)覆土蘑菇培养料经过发菌,床而有时高低不平,覆土前要把料面抹匀拍平.
覆土对蘑菇的发育有重要的作用.
首先,覆土能改变培养料中二氧化碳的浓度,便蘑菇的菌丝从营养生长期转入到生殖生长期,形成子实体,并保持培养料的水分,有利于子实体的发育;其次,覆土层中含有许多有益的微生物如臭味假单孢杆菌等,它们的代谢产物含有多种激素,能促进蘑菇子实体的形成;第三,覆土层对子实体有支撑作用,能防止培养料温、湿度的急剧变化,保护料层中菌丝的生长发育,并有机械刺激作用,能促进结菇.
及时覆土是夺取蘑菇高产的重要措施.
由于菇房的覆土量大,且对覆土的质量要求较高,如在覆土期遇到长期下雨等不良天气,往往延误覆土,影响产量.
因此,蘑菇菌床所需要的覆土必须在覆土前及早准备,并晒干贮藏备用.
l.
覆土的选择覆土的性质往往影响到出菇的迟早与产量的高低.
澳大利亚的蘑菇农场目前多采用泥炭土作覆土材料.
泥炭苔藓是最理想的覆土材料,与土壤河泥等材料相比,泥炭苔藓的吸水量要高得多.
目前,我国蘑菇栽培上所用的覆土,根据土粒的大小,分为粗土与细土.
粗土直径2cm左右,其质地以壤土为好,要选毛细孔多、有机质含量高、团粒结构好、持水量大、且含有一定的营养成分的土壤作覆土材料,以利于蘑菇菌丝穿透泥层生长.
菇房每平方米床面约需粗土35kg.
细土直径约为0.
5cm,如黄豆大小,每平方米床面需细土20kg左右,其质地以稍带粘性的壤土为宜,因床面的泥层上经常喷水,稍带粘性的土粒喷水后不会松散,也不会造成床面板结的现象,如细土选用砂性土,床面喷水后泥粒变得松散,造成床面泥层板结,直接影响到土层的通气性,不利于菌丝的生长,也不利于子实体的形成.
2,覆土的时期与方法适宜的覆土时期是根据料层菌丝的深度来决定的,当菌丝大部分都已伸展到床底时,便是覆土的适期.
先覆粗土,隔7-10天再覆细土.
根据一般高产菇房的经验,覆粗土7天左右便应及时覆细土.
覆细土后10天左右,便能见到菌蕾,所以覆粗土后约经20天便可出菇.
覆土的厚度,如采用粗土加细土的方法,则粗土覆2.
5~3cm厚,细土覆lcm厚;如采用全部覆细土的方法,则覆土厚度在3.
3cm左右.
覆土的具体方法是:先覆粗土一层,铺满料面,以不见料为标准,并用中土(介乎粗土与细土之间的土粒)填满粗土的缝隙,以防止调水时水分渗入培养料内,造成料内菌丝萎缩,最后铺上一层薄细土.
3.
覆土的杀虫灭菌处理.
为了防止覆土中带入病虫,可采用下列处理方法.
①用10%甲醛溶液及1%的敌敌畏溶液洒在土粒上,1000kg土用以上两种农药各2--4kg,喷洒后拌匀,用塑料薄膜严密覆盖两天,利用农药挥发出的气体杀死病菌与虫卵.
②用泥土质量1%--2%的石灰拌人泥中,杀死线虫等害虫.
4.
覆土层的调水用干的粗土,覆土3天内调足粗土水分,但在杭州地区多采用先将粗土预湿,然后在2-3天内调粗土水分.
方法是将干粗土盛入竹制的土箕内,将竹土箕连同粗土浸没水中,并立即取出,等待5~10min,让水分吸入土粒中,再将土粒撒在床上,此时土粒不会粘结成团.
因此,一般覆粗土1~2天内开始调水,连续调水3天.
在用水量上掌握两头轻、中间重的原则,即第一天调水2.
5~3.
5kg/m2,第二天调水4.
5kg/m2,第三天调水2.
5~3kg/m2,3天内共调水l0—11kg/m2.
如土料干的调水量还可增加到13.
5k/m2.
喷水的方法采用轻喷勤喷、循环喷水的方法,不可一次喷水过多,防止水分流大料中,妨碍菌丝生长.
调水的具体标准是粗土已无白心,质地疏松,手能捏扁土粒,手捏粘手,此时粗土的含水量在20%左右.
(七)出菇管理蘑菇从播种到开始采收,一般需要35~40天.
长江流域各省于9月上旬播种后,从10月中下旬开始采收到12月下旬秋菇期间一般可收5批(潮),第一、二、三批出菇集中,两批菇间隔期为7天左右,第四、五批及春菇出菇不集中,产量减少.
秋菇产量占总产量的70%左右.
出菇期间的管理工作主要有水分管理、通风换干、挑根补上及追肥等.
l.
水分管理(1)床面喷水覆细土后10天左右,扒开上层细土,看到许多绿豆大小白色小菌蕾时,就要及时喷一次"重水",称为"结菇水",每天喷水1次,每次喷用1kg/m2,连续2~3天,总的用水量2.
5~3.
2kg.
喷水增加细土湿度,同时也使粗土上半部得到水分,促使菌蕾迅速形成和长大,并使粗土层的菌丝粗壮有力.
当菌蕾普遍形成并已长到黄豆大小时,需及时喷第二次"重水",称为"出菇水",方法与第一次"重水"相同,用量较第一次稍重,总的用水量2.
7~3.
6kg/m2.
再次加大细土的湿度并使粗土得到水分,促使子实体迅速长大出上,这样出菇多、均匀,转潮(批)快,除了喷"重水"期间外,其余时间喷水每天1次,气候干燥时可喷两次,每次0.
25~0.
36kg/m2.
前三批菇出菇间隔期间,一般称为"落潮",此时应减少喷水,每天喷水l次,每次喷0.
2kg/m2.
前三批菇生育期间气温较高,喷水时间最好在早晚进行.
秋菇后期即第三批采收后,蘑菇不再明显地成批生长,春菇出菇也不集中,喷水要轻喷、勤喷,减少喷水量,每天喷水0.
15~0.
45kg/m2.
喷水力求均匀,雾点要小,喷头要提高一些,并稍有倾斜,以减少对小菇的冲击.
喷水后尽量多开门窗,不喷"关门水",避免菇房闷热,使菌丝老化或者孽生杂菌.
采菇前喷水,防止手捏处菌丝发红,影响质量.
生产上欲采收春菇,在冬季停产期间,仍需加以管理,保护菌丝生长.
由于冬季气温低,蒸发量小,可适当减少喷水,一般5-7天喷水l次,每次喷水0.
5kg/m2.
要防止土面过于、过湿,以免菌丝萎缩.
春季3月上中旬气温回升后,适当增加喷水,一般每天或隔天喷l次,每次0.
15~0.
36kg/m2,以促进菌丝萌发生长.
3月下旬至4月出菇期间增加喷水量,每天喷水1~2次,每次喷水0.
36~0.
5kg/m2,4~5月份温度较高,气候干爆,适当增加喷水次数,霉天2~3次.
(2)空气湿度的调节秋菇前期温度较高,出菇多,空气相对湿度应达到90~95%.
如气候干燥,除床面适当多喷水外,需要在走道空间、墙壁和地面喷水,以增加空气相对湿度.
菇房内空气相对湿度过低,子实体生长缓慢并容易产生鳞片和"空根白心"现象.
但也不宜超过95%;否则影响菌丝生长,并容易产生杂菌、锈斑等病害.
采菇高峰过后,气温渐低,空气相对湿度可低一些,达85%~90%,空中、地面不再喷水.
春菇后期温度较高,蒸发量大,应增加菇房内相对湿度.
如气候干燥,仍需在走道空间、墙壁和地面喷水,并加强通风,降低室内温度.
也可采用喷水机来完成喷水.
2.
通风换气秋菇前期菌丝生长旺盛,出菇多,放出大量的二氧化碳,需要加强通风,保持菇房内空气新鲜;但此时期气温较高,又需保持较高的空气湿度.
因此;菇房主要在早晚或夜间通风.
春季气温尚低时,通风在中午气温较高时进行,以利提高菇房温度.
4~5月份气温上升,宜早、晚和夜间通风,以免热空气进人室内,增加菇房温度.
3.
清除老根、死菇,及时补土每次采收以后,菌床上遗留下的老根、死菇,要及时清除干净,因老根已失去吸收养分和出菇的能力,且占据位置,使下面的菌丝生长受到影响,有碍出菇.
如果时间长腐烂后,容易引起病虫危害.
同时要把采菇时带走的泥土用较湿润的细土重新补平,保持原来的厚度.
4.
追肥在出菇旺盛期需肥最大,一时供应不上时容易出现柄细长、薄皮开伞菇;发育后期营养不足时产菇减少,小菇、薄皮菇多,显著地影响蘑菇的产量和质量.
适当地分次追肥是提高产量和质量的一项措施.
常用的种类和浓度如下:(1)葡萄糖常用的葡萄糖液浓度为10-20g/L,必要时可用30g/L,也可用200g.
/L蔗糖液.
(2)胡萝卜汁先将胡萝卜切成小薄片,加水2倍,煮烂后过滤,取出原液,再稀释3倍使用.
(3)黄豆浆用黄豆1kg浸水后磨成浆汁,过滤后加清水50kg使用.
(4)化学肥料尿素用2-4g/L,硫酸铵用5g/L,磷酸二氢钾用2-3g/L,过磷酸钙用5g/L(取澄清液)的液肥.
(5)蘑菇健壮素l号比久0.
5g,硫酸镁40g,硼酸10g,硫酸锌20g,尿素l00g,维生素B140mg,加水l00kg.
可供300m2面积上喷2~3次,对菌丝复壮有效.
(6)蘑菇健壮素II号比久1g,硫酸镁50g,磷酸二氢钾100g,维生素Bl100mg,加水l00kg.
对促进子实体形成和肥大有效,用量与I号相同.
蘑菇追肥对增加产量和提高质量有一定的效果,但只能作为一项辅助措施.
蘑菇只有在配制质量好的培养料的基础上,适当追肥,才能获得更好的收成.
(八)采收当蘑菇长到符合标准大小时,应及时采收.
如果采收过晚,影响质量,同时会影响下面小菇的生长.
蘑菇旺盛期,应该采取菇多采小、温高采小、质差采小的方法,才能保证蘑菇质量.
作鲜销的蘑菇,可以采得稍大些,但也不能开伞,否则降低其商品价值.
旺产期一般每天采收两次,以保证质量.
采菇前不能喷水,否则采时手捏菇盖造成发红.
采收方法不当也会影响蘑菇的产量和质量.
菇密时,采菇要用拇指、食指、中指捏住菇盖,轻轻旋转采下,以免带动周围的小菇.
多个菇丛生在一起的球菇,采收时要用刀小心地切下大菇留小菇,不能整个搬动,否则其它小菇都会死掉.
秋菇采收第二批后,床面菇稀时,采菇可以直接将菇拔起,这样能同时带出一部分老根.
采菇时经常用湿手巾将手指上的泥土擦掉,来下的蘑菇应整齐地放人篮中,以免损伤.
蘑菇采收后,随即用小刀把菇柄下端带有泥土的部分削去,加工蘑菇菇柄长短,按收购标准要求切削.
在削菇时,动作要轻,避免机械损伤,刀要锋利,这样菇柄平整,质量好.
削菇后进行分级,将不同等级的蘑菇分别放置于垫有纱布、棉垫或薄膜的筛或篮中,上面盖上纱布,及时送到收购站交售.
B.
箱式栽培箱栽培适合于机械化的三区制周年栽培.
培养料的配方、堆制发酵工艺均与床架式栽培法相同.
栽培箱的规格要根据机械化的程度、菇房大小及便于操作进行设计,常用的有40cm*60cm*20cm和50cm*80cm*20cm两种规格.
栽培箱可用木、铝合金或硬质塑料等制作,为便于贮藏、运输和消毒灭菌,一般都制成统一规格的活动箱.
把发酵并经处理的培养料装入栽培箱,料厚15cm,播上蘑菇菌种,移人发菌培养室.
培养15--17天后,覆上消毒处理过的土粒,调水后再培养15~17天,此时蘑菇菌丝已基本发满培养料,移进出菇室.
出菇室温度控制在(14±2)℃,空气相对湿度90%~95%.
5~8天后蘑菇菌丝开始扭结出菇,采收约60天结束.
采收结束后将箱子移到室外,倒掉废料,消毒菇室,再从发菌室移进一批已经培养好菌丝的栽培箱,降温使其出菇,周而复始地连续生产.
这种箱式栽培的三区制菇房,一间发菌室配两间出菇室,还需要装空调等制冷设备,一般每年可种5期蘑菇.
C.
畦式栽培畦式栽培一般多利用冬闲田进行.
在干稻田中,整地作畦,畦宽1.
5m,高15--20cm,长则根据地形而定,在畦面上撒一层生石灰粉进行消毒.
把堆制发酵成熟的培养料铺放于畦上,料厚约l0cm,整平后稍压实即可播蘑菇菌种.
播种后用竹木材料做成框架,罩在菇畦上,覆盖黑色或深蓝色塑料薄膜.
为了保湿和遮光,薄膜上再覆盖一层用稻草、茅草、蔗叶编织成的草帘.
在栽培管理过程中,要定期掀开部分薄膜进行通风换气,并根据天气情况而定,可选在中午或下午,清晨或夜间.
换气时间的长短应根据菌丝的生长量或畦上蘑菇子实体的多少,以及当天的天气情况灵活掌握.
X草菇的栽培一、目的:掌握草菇的栽培技术二、方法和步骤(一)栽培季节当气温在25℃以上、空气相对湿度在80%以上时,即可栽培草菇.
如北京、河北可从6月下旬至8月上旬,广西、福建4~9月气温高,适合草菇的生长发育.
广东栽培草菇的季节比其它省长,如在珠江三角洲,从3月下旬开始栽培,一直到11月上旬止,其平均气温在23℃以上,因此一般从4~10月均可在自然条件下连续生产,但有春菇、夏菇、秋菇之分.
近年来,由于栽培技术的进步,可人工调节温度,即使在冬季低温季节也能生产,草菇已实现周年栽培.
(二)培养料配制适合草菇生长的培养料很多,各地可因地制宜,就地取材.
l.
培养料配方(1)废棉培养料废棉96%,石灰4%.
(2)甘蔗渣培养料甘蔗渣86%,麦敖9%,石灰3%,石膏2%(3)稻草培养料稻草81%,肥泥16%,石灰3%(4)稻草与棉籽屑培养料稻草48%,棉籽屑48%,石灰4%(5)棉籽屑培养料棉籽屑71%,干牛粪9%,稻草粉11%,麦秩7%,磷肥1%,石灰1%.
(6)棉纺屑培养料棉纺屑75%,火土灰15%,麦麸8%,石灰1%,石膏1%.
2.
培养料处理有两种培养料处理法:①塑料薄膜堆制,培养草菇的棉籽屑、稻草或废棉等需先用水浸透,浸制时间一般为6~l2h,然后捞出沥干,将辅料拌和均匀,使含水量为60%~65%.
然后建堆,堆宽1.
2m,高60~70cm,长依用料数量而定,在料推上覆盖薄膜保温.
经2~3天,待堆温升高到60℃时翻堆,翻堆后2~3天,堆温再升高到60℃时,维持l天,第二天可拆堆,准备运入菇房.
②前后发酵堆制,前发酵:将稻草切成5~l0cm的小段,浸水后加大辅料拌匀,含水量60%~70%,堆成宽lm、高lm、长度不限的发酵堆.
发酵2~3天后,翻堆检查干湿度,再堆1~2天,调好水分和pH值,然后进人栽培室,进行室内后发酵.
后发酵:完成前发酵后趁料温在40~50℃时将料搬人菇房,关闭菇房门窗,当菇床上的培养料因发酵而温度逐渐上升时,通入蒸汽或加热,将料温升到60℃保持2h,然后微微通风,逐步降温到50℃左右保持1~2天.
待床内料温降至30~35℃时,立即轻压实、拍平播种.
(三)栽培场所l.
室内栽培室内栽培需要有菇房,要求菇房能保温保湿,通气透光.
草菇房内的床架与蘑菇栽培的床架相同,通常为4~5层,床架宽1.
2m,床架间走道宽60cm.
有条件的情况下,可在菇房内安装温湿度自动调节器以及通风系统.
草菇的室内栽培能人工控制其生长发育所需的温度、湿度、通气、光照及营养等条件,避免低温、干旱、大风、暴雨等自然条件的影响,全年均可栽培,一年四季均有鲜菇供应市场,可向工业化、专业化、自动化生产的方向发展.
2.
室外栽培华南地区由于温差较小、气温较高,可在室外稻田中栽培;河北地区可采用冷床(阳畦)上盖薄膜栽培.
夏初气温低时,畦地应选择向阳的地方;夏季气温较高时,应选择较阴凉的地方.
但是室外栽培草菇除了华南地区外,只能在高温的夏秋季节进行.
由于是在室外栽培,受气候影响较大,产量不稳定.
况且室外栽培用草量多,生产成本高,有的占用耕地,其生产技术也复杂,不容易掌握.
(四)栽培方式(1)床式栽培l.
波浪式将经过发酵的培养料移到菇床上,按照菇床排列的纵向方向,做成波浪式短小的小埂菌床.
小埂高15cm,两小埂之间为5--7cm.
该方式可增加出菇面积,通风较好,菌丝生长快,出菇早,菇体整齐.
但是如果管理不好,喷水不当,小埂中部常被水渍,会影响菌丝生长和出菇.
2.
平铺式把发酵好的培养料搬人菇床,均匀铺在床架上,除中间略呈龟背式外,其余部分平整.
培养料的厚度依气温高低而有所区别,如气温30℃时,棉籽屑培养料厚l0cm,稻草培养料厚l7cm;气温升高达33C时,棉籽屑厚7cm,稻草厚l3cm;气温降至25℃时,棉籽屑厚l3cm,稻草厚20cm.
培养料在菌床上整理好后即可播种,播种方法可用穴播或撒播,接种量为4%--6%.
草菇菌种满瓶后15天以内的菌种,其生命力强,易萌发吃料,产量较高.
(2)堆式栽培一般指在大田以稻草为培养料的栽培方式.
l.
选地作畦在旱地、水田均可栽培,其土质应为疏松的砂壤土,可保湿保肥,又通气,有利于草菇生长.
如土质粘性太重或沙石太多,应添加一层砂壤土.
畦应于种菇前5~7天做成,先用杀虫药消灭蚯蚓及其它害虫.
水田应犁翻浸水4天,然后犁耙,再浸水4天,之后排水晒干.
旱或水田晒干后,即可做成畦.
一般畦宽l00~120cm,南北向,东西延长,畦高20~33cm,畦面呈龟背形,每畦相距50~60cm.
2.
备料稻草要求无霉烂,金黄色.
若用已潮湿发霉的稻草,则堆温低,发热期短,而且容易感染病虫杂菌,产量也低.
新鲜稻草含水多,发热较低,须经充分曝晒干燥后,才能使用.
早、中、晚稻草均可采用,其中以中稻草较好.
种植l公顷地草菇需500~667kg稻草.
低温季节,用草量及用种量可适当增加.
3.
浸草将稻草扎成把,每把0.
5~1kg.
2.
5~5kg捆成一捆,于堆草前一天放入水中浸10~14h,使稻草充分浸湿,早稻草浸水时间可短些.
也有人采取将稻草放入水中,边浸边踩,可使稻草充分吸水,缩短浸水时间,待稻草变软时即可使用.
浸草完毕即捞起运到栽培场备用.
4.
踩草堆(1)轧草式将湿草从中间用轧刀切成两段,齐头放在畦的两边,草头草尾在畦中间,两边对放,一把紧靠一把,用脚踩紧.
堆中间空低处填入稻草,即填心草.
一般堆4层,每层周围均比第一层缩进3cm左右,菌堆呈梯形.
播种后,菌堆顶上层盖一层薄稻草并踩紧.
(2)折尾式长稻草用此法.
将干稻草齐好,重0.
5kg蛙左右,在近草头1/3处折转扎把.
踩堆时,把已浸湿的稻草把一把紧靠一把,横放在畦上.
踩第二层时,草头的方向压在第一层草尾之上,如此一层层堆好.
(3)扭把式将稻草扭成"8"字形,依序紧密地横放在畦上,草头和草尾朝内.
两边同时进行,叠草的宽度比畦窄7--10cm.
叠完第一层后,普遍踩一次,边踩边淋水,这样菌堆易于发热.
叠第二层草时向内收缩7--10cm,叠法与第一层相同.
层层相叠,直到第四层.
菌堆做完后,还要踩一次,也要淋水,直至菌堆四边有黄水流出为止.
菌堆踩好后,用薄膜覆盖,以保温保湿,有利于草菇菌丝的生长发育.
室内栽培的,因为温湿度较稳定,3-4天后可不再覆盖.
露地栽培还须在雨季来临前用薄膜覆盖防雨.
通常踩菌堆与播种是交错进行的,菌堆第一层踩完后,在四周7-l0cm范围内播一层草菇纯种,然后踩第二层,草把刚好压住菌种.
第二、三层播种方法同第一层,在第四层草上全面播种.
5.
复踩与盖土复踩是菌堆原来踩得不紧或水分不足的辅助措施.
菌堆顶部盖土,能保温保湿,为出菇创造条件.
一般这两项措施在踩堆后第三天进行.
如果堆内稻草过干,则应在复踩时淋水以补足水分,用水量以菌堆流出黄水为度.
需淋水的草堆只适宜在建堆后第三天进行,过迟淋水引起堆温骤然降低,易损伤菌丝,影响产量.
如果草堆中稻草含水量己足,仅在菌堆顶部反复踩紧一次,然后用火烧土或较肥沃的菜园土薄盖一层.
(五)栽培管理(1)控制菌堆温度菌堆内温度经历由低到高,再由高到低的变化过程.
踩菌堆后,堆内温度逐渐升高,4~6天后达到最高温度,再过1~2天后开始缓慢下降.
一般播种后6~7天,即可出现幼菇.
菌堆内水分不足,稻草较干,易引起高温,可采用踩紧菌堆和淋水的方法.
降低堆温.
温度过高时,应掀开草被或全部撤掉草被,加强室内通风,并用竹棍在堆内打洞,散发堆温.
当温度下降到45℃左右时,再用稻草将洞塞好保温.
(2)调节水分在踩菌堆4天后要定时掀开薄膜通风换气.
若气温较高,菌床外表干燥,可直接向菌堆喷水,以后每天可以喷水1--2次,喷后盖薄膜.
如果气候特别干燥,还要在草堆覆盖物上浇水,经常保持草被有适当的湿度.
当堆上出现白色原基时,宜轻喷、少喷,以保湿为主.
随着菌蕾长大,逐渐加大喷水量.
每采完一批草菇后,应踩堆或压实一次,草堆两侧也需压实,使保温保湿良好,以利再次出菇.
(3)通风换气草菇为好气性真菌,应注意通风换气,通常每天开窗多次,以排除室内的二氧化碳,增加新鲜空气,这样有利于菌蕾的形成.
(六)采收室外种菇一般播种后6~10天即可见菌蕾,11~15天可以开始采菇.
商品草菇采收适期是菇体由基部较宽、顶部稍尖的宝塔形变为卵形,质地由硬变软,颜色由深变浅,在外菌幕未被突破之前采收,这时的菇体味道鲜美,蛋白质含量较高,质量最佳.
菌幕将破末破,菌柄还未露出的质量次之,开伞的菇质量较差.
草菇生长迅速,有时往往一夜之间全部开伞,因此,采收必须及时,最好早晚各采收一次.
室内栽培草菇6~7天可见菌蕾,10天左右收菇.
当第一潮草菇采完后,隔1~2天第二潮菇蕾便出现,约5-6天后又可采收.
每个草堆可收草菇4~5次,采收期30~40天.
室内栽培的草菇第一潮菇产量可占整个收菇期产量的70%~80%.
采收草菇的方法为:一手按住菇体周围的培养料,另一手握住菇体左右旋转,轻轻摘下,切忌用力拔起,以免牵动菌丝,弄乱草堆,影响以后出菇.
如遇密集丛的草菇,应在大部分适合采收时,一齐采摘,以免因采收个别草菇的翻动而造成大量未成熟的草菇死亡.
第三部分专题实验实验26水中细菌学检查I水中细菌总数的测定一、目的要求l.
学习水样的采取方法和水样细菌总数测定的方法.
2.
了解水源水的平板菌落计数的原则.
二、基本原理本实验应用平板菌落计数技术测定水中细菌总数.
由于水中细菌种类繁多,它们对营养和其他生长条件的要求差别很大,不可能找到一种培养基在一种条件下,使水中所有的细菌均能生长繁殖,因此,以一定的培养基平板上生长出来的菌落,计算出来的水中细菌总数仅是一种近似值.
目前一般是采用普通肉膏蛋白胨琼脂培养基.
三、器材l.
培养基肉膏蛋白胨琼脂培养基,无菌水.
2.
仪器或其他用具灭菌三角烧瓶,灭菌的带玻璃塞瓶,灭菌培养皿,灭菌吸管,灭菌试管等.
四、操作步骤l.
水样的采取(1)自来水先将自来水龙头用火焰烧灼3min灭菌,再开放水龙头使水流5min后,以灭菌三角烧瓶接取水样,以待分析.
(2)池水、河水或湖水应取距水面l0~15cm的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存.
2.
细菌总数测定(1)自来水①用灭菌吸管吸取lml水样,注入灭菌培养皿中.
共做两个平皿.
②分别倾注约15mL己溶化并冷却到45℃左右的肉膏蛋白胨琼脂培养基,并立即在桌上作平面旋摇,使水样与培养基充分混匀.
③另取一空的灭菌培养皿,倾注肉膏蛋白胨琼脂培养基15mL作空自对照.
④培养基凝固后,倒置于37℃温箱中,培养24h,进行菌落计数.
⑤两个平板的平均菌落数即为lml水样的细菌总数.
(2)池水、河水或湖水等①稀释水样取3个灭菌空试管,分别加入9ml灭菌水.
取lml水样注入第一管9ml灭菌水内、摇匀,再自第一管取1ml至下一管灭菌水内,如此稀释到第三管,稀释度分别为10-1、10-2与10-3.
稀释倍数看水样污浊程度而定,以培养后平板的菌落数在30~300个之间的稀释度最为合适,若三个稀释度的菌数均多到无法计数或少到无法计数,则需继续稀释或减小稀释倍数.
一般中等污秽水样,取10-1、10-2、10-3三个连续稀释度,污秽严重的取10-2、10-3、10-4三个连续稀释度.
②自最后三个稀释度的试管中各取lmL稀释水加入空的灭菌培养皿中,每一稀释度做两个培养皿.
③各倾注15ml已溶化并冷却至45℃左右的肉膏蛋白胨琼脂培养基,立即放在桌上摇匀.
④凝固后倒置于37℃培养箱中培养24h.
3.
菌落计数方法(1)先计算相同稀释度的平均菌落数.
若其中一个平板有较大片状菌苔生长时,则不应采用,而应以无片状菌苔生长的平板作为该稀释度的平均菌落数.
若片状菌苔的大小不到平板的一半,而其余的一半菌落分布又很均匀时,则可将此一半的菌落数乘2以代表全平板的菌落数,然后再计算该稀释度的平均菌落数.
(2)首先选择平均菌落数在30~300之间的,当只有一个稀释度的平均菌落数符合此范围时,则以该平均菌落数乘其稀释倍数即为该水样的细菌总数(见表26-1,例1).
(3)若有两个稀释度的平均菌落数均在30~300之间,则按两者菌落总数之比值来决定.
若其比值小于2,应采取两者的平均数;若大于2,则取其中较小的菌落总数(见表26-l,例2及例3).
(4)若所有稀释度的平均菌落数均大于300,则应按稀释度最高的平均菌落数乘以稀释倍数(见表26-l,例4).
(5)若所有稀释度的平均菌落数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数(见表26-l,例5).
(6)若所有稀释度的平均菌落数均不在30~300之间,则以最近300或30的平均菌落数乘以稀释倍数(见表26-1,例6).
表26—1计算菌数落总数方法举例不同稀释的平均菌落数例次10-110-210-3两个稀释度菌落数之比菌落总烽(个/ml)备注1136516420--16400或1.
6*10422760295461.
637750或3.
8*10432890271602.
227100或2.
7*1044无法计数1650513--513000或5.
1*105527115--270或2.
7*1046无法计数30512--30500或3.
1*104两位以后的数字采取四舍五入的方法去掉五、实验报告1.
结果(1)自来水平板菌落数1ml自来水中细菌总数12(2)池水、河水或湖水等稀释度10-110-210-3平板121212菌落数平均菌落数计算方法细菌总数/mL2.
思考题(1)从自来水的细菌总数结果来看,是否合乎饮用水的标准(2)你所测的水源水的污秽程度如何(3)国家对自来水的细菌总数有一标准,那么各地能否自行设计其测定条件(诸如培养温度,培养时间等)来测定水样总数呢为什么II水中大肠菌群的检测一、实验目的和内容目的:学习检测水中大肠菌群的方法,了解大肠菌群数量与水质状况的关系.
内容:1.
用滤膜法检测大肠菌群.
2.
用多管发酵法检测大肠菌群.
二、实验材料和用具复红亚硫酸钠培养基(远藤氏培养基)、乳糖蛋白胨半固体培养基、乳糖蛋白胨培养液、三倍浓乳糖蛋白胨培养液、伊红美蓝培养基(EMB培养基).
微孔滤膜(孔径0.
45m)、滤器(容量500mL)、抽气设备、镊子、发酵用试管、杜氏小管、培养皿、刻度吸管或移液管、接种环、酒精灯.
三、操作步骤(一)水样的采集1.
自来水将自来水龙头用火焰烧灼3min灭菌,再拧开水龙头流水5min,以排除管道内积存的死水,随后用已灭菌的三角瓶接取水样,以供检测.
2.
池水、河水或湖水将无菌的带玻塞的小口瓶浸入距水面10~15cm深的水层中,瓶口朝上,除去瓶塞,待水流入瓶中装满后,盖好瓶塞,取出后立即进行检测,或临时存于冰箱,但不能超过24h.
(二)滤膜法检测大肠菌群l.
用无菌镊子将一无菌滤膜置于滤器的承受器当中,将过滤杯装于滤膜承受器上,旋紧,使接口处能密封,将真空泵与滤器下部的抽气口连接(图26-1).
图26—1微孔滤膜滤器1.
滤杯;2.
滤杯和接瓶接合处(内装有滤膜);3.
接瓶;4.
抽滤系统(可接针筒);5.
硅树脂垫圈;6.
微孔滤膜(0.
45m);7.
膜承受部分2.
加水样100mL于滤杯中,启动抽真空系统,使水通过滤膜流到下部,水中的菌细胞被截留在滤膜上.
水样用量可适当增减使获得菌落适量.
3.
用无菌镊子小心将截留有细菌的滤膜取出,平移贴于复红亚硫酸钠固体培养基上(注意无菌操作,滤膜与培养基间贴紧,无气泡),37℃培养16~l8h.
挑选深红色或紫红色、带有或不带金属光泽的菌落,或淡红色、中心色较深的菌落进行涂片和革兰氏染色观察.
4.
经染色证实为革兰氏阴性无芽孢杆菌者,再接种在乳糖蛋白胨半固体培养基上,37℃培养6~8h后观察,产气者证实为大肠菌群阳性.
培养中应及时观察,时间过长则气泡可能消失.
5.
结果计算水样中总大肠菌群数/个·L-1=(滤膜生长的菌落数/过滤水样量/mL)*100(滤膜上菌落数以20~60个/片较为适宜)(三)多管发酵法检测大肠菌群1.
取5支装有3倍浓乳糖蛋白胨培养基的初发酵管,每管分别加入水样10mL.
另取5支装有乳糖蛋白胨培养基的初发酵管,每管分别加入水样lmL.
再取5支装有乳糖蛋白胨培养基的初发酵管,每管分别加入按1:10稀释的水样lmL(即相当于原水样0.
1mL),均贴好标签.
此即为15管法,接种待测水样量共计55.
5mL.
各管摇匀后在37℃恒温箱中培养24h.
若待测水样污染严重,可按上述3种梯度将水样稀释10倍(即分别接种原水样1mL、0.
lmL、0.
01mL)、甚至100倍(即分别接种原水样0.
lmL、0.
01mL、0.
001mL),以提高检测的准确度.
此时,不必用3倍浓乳糖蛋白胨培养基,全用乳糖蛋白胨培养基.
2.
取出培养后的发酵管,观察管内发酵液颜色变为黄色者记录为产酸,杜氏小管内有气泡者记录为产气.
将产酸产气和只产酸的两类发酵管分别划线接种于伊红美蓝培养基上,在37℃恒温箱中培养18~24h.
挑选深紫黑色和紫黑色带有或不带有金属光泽的菌落、或淡紫红色和中心色较深的菌落,将其一部分分别取样进行涂片和革兰氏染色观察.
3.
经镜检证实为革兰氏阴性无芽孢杆菌,则将此菌落的另一部分接种于装有倒置杜氏小管的乳糖蛋白胨培养液的复发酵管中,每管可接种同一发酵管的典型菌落1~3个,37℃培养24h若为产酸产气者表明试管内有大肠菌群菌存在,记录为阳性管.
4.
根据3个梯度(10mL、1ml、0.
1mL)每5支管中出现的阳性管教(即为数量指标),查附注的"15管发酵法水中大肠菌群5次重复测数统计表"(表26-2)的细菌最可能数,再乘以100即换算成1升水样中的总大肠菌群数.
四、注意事项认真配制不同类型培养基.
检测中应合理控制所加的水样量.
在滤膜法中每片滤膜的菌落数以20~60个为宜.
多管发酵法中水样稀释比例要适宜.
挑选菌落时认真选择大肠菌群典型菌落.
五、演示1.
具有大肠菌群的发酵管中产酸与产气特征的观察.
2.
在复红亚硫酸钠培养基和伊红美蓝培养基上大肠菌群典型菌落的色泽及特征的识别.
六、实验报告(一)实验结果记录1.
微孔滤膜法过滤水样量(mL):,37℃培养后特征菌落数:,接种乳糖培养基后的阳性管数:.
总大肠菌群数(个/L):.
2.
多管发酵法检测结果(1)根据实验数据查表26—2:表26—215管发酵法水中大肠菌群5次重复测数统计表数量指标*细菌最可能数数量指标细菌最可能数数量指标细菌最可能数数量指数细菌最可能数0000.
02031.
24001.
35138.
50010.
22100.
74011.
75205.
00020.
42110.
94022.
05217.
00100.
22121.
24032.
55229.
50110.
42200.
94101.
752312.
00120.
62211.
24112.
052415.
00200.
42221.
44122.
552517.
50210.
62301.
24202.
05308.
00300.
62311.
44212.
553111.
01000.
22401.
54223.
053214.
01010.
43000.
84302.
553317.
51020.
63011.
14313.
053420.
01030.
83021.
44324053525.
01100.
13101.
14403.
554013.
01110.
33111.
14414.
954117.
01120.
53121.
74504.
054225.
01200.
33132.
04515.
054330.
31210.
53201.
45002.
554435.
01221.
03211.
75013.
054545.
01300.
53222.
05024.
055025.
01311.
03301.
75036.
055135.
01401.
13312.
05047.
555260.
02000.
23402.
05103.
555390.
02010.
73412.
55114.
5554160.
02020.
93502.
55126.
0555180.
0*数量指标示意:如"203",表示5个10mL初发酵管中有阳性管2个;5个1mL初发酵管中有阳性管0个;5个0.
1mL初发酵管中有阳性管3个;又如"555",则表示15个初发酵管均为阳性管.
(2)多管发酵法结果填于下表中:初发酵管初发酵管数每管取样数/mL产酸产气管数复发酵管数阳性管数5105150.
1(3)多管发酵法检测结果:查表结果及总大肠菌群数(个/L)(二)试图解说明检测水样中大肠菌群的操作过程.
七、问题和思考1.
检查饮用水的中大肠菌群有何意义比较本实验中两种检测方法的优缺点.
2.
试设计一个监测某自来水厂水质卫生状况的方案.
实验27实验室环境和人体表面微生物的检查一、目的要求1.
证明实验室环境与体表存在微生物.
2.
比较来自不同场所与不同条件下细菌的数量和类型.
3.
观察不同类群微生物的菌落形态特征.
4.
体会无菌操作的重要性.
二、基本原理平板培养基含有细菌生长所需要的营养成分,当取自不同来源的样品接种于培养基上,在适宜温度下培养1~2d内每一菌体即能通过很多次细胞分裂而进行繁殖,形成一个可见的细胞群体集落,称为菌落.
每一种细菌所形成的菌落都有它自己的特点,例如菌落的大小,表面干燥或湿润、隆起或扁平、粗糙或光滑,边缘整齐或不整齐,菌落透明或半透明或不透明,颜色以及质地疏松或紧密等.
因此,可通过平板培养来检查环境中细菌的数量和类型.
三、器材l.
培养基肉膏蛋白胨琼脂平板.
2.
仪器或其他用具无菌水,灭菌棉签(装在试管内),接种环,试管架,酒精灯或煤气灯,记号笔,废物缸.
四、操作步骤每组在"实验室"和"人体"两大部分中各选择一个内容做实验,或由教师指定分配,最后结果供全班讨论.
l.
写标签任何一个实验,在动手操作前均需首先将器皿用记号笔做上记号,写上班级、姓名、日期,本次实验还要写上样品来源(如实验室空气或无菌室空气或头发等),字尽量小些,写在皿底的一边,不要写在当中,以免影响观察结果.
培养皿的记号一般写在皿底上.
如果写在皿盖上,同时观察两个以上培养皿的结果,打开皿盖时,容易混淆.
2.
实验室细菌检查(1)空气将一个肉膏蛋白胨琼脂平板放在当时做实验的实验室,移去皿盖,使琼脂培养基表面暴露在空气中;将另一肉膏蛋白胨琼脂平板放在无菌室或无人走动的其他实验室,移去皿盖.
lh后盖上两个皿盖.
(2)实验台和门的旋钮①用记号笔在皿底外面中央画一直线,再在此线中间处画一垂直线,如图27-l.
图27—1培养皿底外面画记号图形②取棉签左手拿装有棉签的试管,在火焰旁用右手的手掌边缘和小指、无名指夹持棉塞(或试管帽),将其取出(图27-2,B),将管口很快地通过煤气灯(或酒精灯)的火焰,烧灼管口;轻轻地倾斜试管,用右手的拇指和食指将棉签小心地取出(图27-2,C).
塞回棉塞(或试管帽)(27-2,D),并将空试管放在试管梁上.
图27—2灭菌棉签的取出与放入试管A.
盛灭菌棉签的灭菌试管;B.
取出管帽与烧灼管口;C.
取出棉签;D.
放回管帽;E.
棉签接种后放回试管前,拔出管帽,烧灼管口;F.
用过的棉签插入试管后,放回至试管架③弄湿棉签左手取灭菌水试管,如上法拨出棉塞(或试管帽)并烧灼管口,将棉签插入水中,再提出水面,在管壁上挤压一下以除去过多的水分,小心将棉签取出,烧灼管口,塞回棉塞(或试管帽),并将灭菌水试管放在试管梁上.
④取样将湿棉签在实验台面或门旋钮上擦拭约2cm2的范围.
⑤接种在火焰旁用左手拇指和食指或中指使平皿开启成一缝.
再将棉签伸人,在琼脂表面顶端接种,即滚动一下,立即闭合皿盖.
并按图27-2E和F,将原放棉签的空试管拨出棉塞(或试管帽),烧灼管口,插入用过的棉签,将试管放回试管架.
⑥划线另取接种环在火焰上灭菌,按图3—3方法进行划线,整个划线操作均要求无菌操作,即靠近火焰,而且动作要快.
3.
人体细菌的检查(1)手指(洗手前与洗手后)①分别在两个琼脂平板上标明洗手前与洗手后(班级、姓名.
日期).
②移去皿盖,将未洗过的手指在琼脂平板的表面,轻轻地来回划线,盖上皿盖.
③用肥皂和刷子,用力刷手,在流水中冲洗干净,干燥后,在另一琼脂平板表面来回移动,盖上皿盖.
(2)头发在揭开皿盖的琼脂平板的上方,用手将头发用力摇动数次,使细菌降落到玻脂平板表面,然后盖上皿盖.
A.
接种时,用左手将平皿开启一缝;B.
棉签伸入平板接种;C.
用己灭菌并冷却了的接种环划线;D.
第二部分划线;E.
最后部分划线(3)咳嗽将去皿盖的琼脂平板放在离口约6~8cm处,对着琼脂表面用力咳嗽,然后盖上皿盖.
(4)鼻腔①按照实验台检查法的步骤②和③,取出棉签,并将其弄湿.
②用湿棉签在鼻腔内滚动数次.
③按实验台检查法的步骤⑤和⑥,接种与划线,然后盖上皿盖.
4.
将所有的琼脂平板翻转,使皿底朝上,放37℃培养箱,培养1~2d.
五.
结果记录方法(1)菌落计数在划线的平板上,如果菌落很多而重叠,则数平板最后1/4面积内的菌落数.
不是划线的平板,也一分为四,数l/4面积的菌落数.
(2)根据菌落大小、形状、高度、干湿等特征观察不同的菌落类型.
但要注意,如果细菌数量太多,会使很多菌落生长在一起,或者限制了菌落生长而变得很小,因而外观不典型,故观察菌落的特点时,要选择分离得很开的单个菌落.
菌落特征描写方法如下:①大小大、中、小、针尖状.
可先将整个平板上的菌落粗略观察一下,再决定大、中、小的标准,或由教师指出一个大小范围.
②颜色黄色、金黄色、灰色、乳白色、红色、粉红色等.
③干湿情况干燥、湿润、粘稠.
④形态圆形、不规则等.
⑤高度扁平、隆起、凹下.
⑥透明程度透明、半透明、不透明.
⑦边缘整齐、不整齐.
五、实验报告1.
结果(1)将你自已的平板结果记录于下表中.
特征描写样品来源菌落数(近似值)菌落类型大小形态干湿高度透明度颜色边缘123415123425(2)与其他同学所做的结果进行比较样品来源菌落数(1/4平板)菌落类型数(近似值)2.
思考题(1)比较各种来源的样品,哪一种样品的平板菌落数与菌落类型最多(2)人多的实验室与无菌室(或无人走动的实验室)相比,平板上的菌落数与菌落类型有什么区别你能解释一下造成这种区别的原因吗(3)洗手前后的手指平板,菌落数有无区别(4)通过本次实验,在防止培养物的污染与防止细菌的扩散方面,你学到些什么有什么体会.
实验28微生物的诱变育种一、实验目的和内容目的:以紫外线诱变获得用于酱油生产的高产蛋白酶菌株为例,学习微生物诱变育种的基本操作方法.
内容:1.
对米曲霉(Aspergillsoryzae)出发菌株进行处理,制备孢子悬液.
2.
用紫外线进行诱变处理.
3.
用平板透明圈法进行两次初筛.
4.
用摇瓶法进行复筛及酶活性测定.
二、实验材料和用具米曲霉斜面菌种;豆饼斜面培养基、酪素培养基、蒸馏水、0.
5%酪蛋白;三角瓶(300mL、500mL)、试管、培养皿(9cm)、恒温摇床、恒温培养箱、紫外照射箱、磁力搅拌器、脱脂棉、无菌漏斗、玻璃珠、移液管、涂布器、酒精灯.
三、操作步骤(一)出发菌株的选择及菌悬液制备1.
出发菌株的选择可直接选用生产酱油的米曲霉菌株,或选用高产蛋白酶的米曲霉菌株.
2.
菌悬液制备取出发菌株转接至豆饼斜面培养基中,30℃培养3~5d活化.
然后孢子洗至装有1mL0.
lmol/LpH6.
0的无菌磷酸缓冲液的三角瓶中(内装玻璃珠,装量以大致铺满瓶底为宜),30℃振荡30min,用垫有脱脂棉的灭菌漏斗过滤,制成把子悬液,调其浓度为106~108个/mL,冷冻保藏备用.
(二)诱变处理用物理方法或化学方法,所用诱变剂种类及剂量的选择可视具体情况决定,有时还可采用复合处理,可获得更好的结果.
本实验学习用紫外线照射的诱变方法.
1.
紫外线处理打开紫外灯(30W)预热20min.
取5mL菌悬液放在无菌的培养皿(9cm)中,同时制作5份.
逐一操作,将培养皿平放在离紫外灯30cm(垂直距离)处的磁力搅拌器上,照射lmin后打开培养皿盖,开始照射,与照射处理开始的同时打开磁力搅拌器进行搅拌,即时计算时间,照射时间分别为15s、30s、lmin、2min、5min.
照射后,诱变菌液在黑暗冷冻中保存1~2h然后在红灯下稀释涂菌进行初筛.
2.
稀释菌悬液按10倍稀释至10-6,从10-5和10-6中各取出0.
lmL加入到酪素培养基平板中(每个稀释度均做3个重复),然后涂菌并静置,待菌液渗入培养基后倒置,于30℃恒温培养2~3d.
(三)优良菌株的筛选1.
初筛首先观察在菌落周围出现的透明圈大小,并测量其菌落直径与透明圈直径之比,选择其比值大且菌落直径也大的菌落40~50个,作为复筛菌株.
2.
平板复筛分别倒酪素培养基平板,在每个平皿的背面用红笔划线分区,从圆心划线至周边分成8等份,1~7份中点种初筛菌株,第8份点种原始菌株,作为对照.
培养48h后即可见生长,若出现明显的透明圈,即可按初筛方法检测,获得数株二次优良菌株,进大摇瓶复筛阶段.
3.
摇瓶复筛将初筛出的菌株,接入米曲霉复筛培养基中进行培养,其方法是,称取麦秩85g,豆饼粉(或面粉)15g,加水95~110mL(称为润水),水含量以手捏后指缝有水而不下滴为宜,于500mL三角瓶中装入15~20g(料厚为1~1.
5cm),121℃湿热灭菌30min,然后分别接入以上初筛获得的优良菌株,30℃培养,24h后摇瓶一次并均匀铺开,再培养24~48h,共培养3~5d后检测蛋白酶活性.
4.
蛋白酶的测定方法(1)取样:培养后随机称取以上摇瓶培养物1g,加蒸馏水100mL,(或200mL),40℃水浴,浸酶1h,取上清浸液测定酶活性.
另取lg培养物于105℃烘干测定含水量.
(2)酶活性测定:30℃pH7.
5条件下水解酪蛋白(底物为0.
5%酪蛋白),每分钟产酪氨酸1μg为一个酶活力单位.
计算公式为:(A样品OD680nm值-A对照OD680nm值)*K*V/t*NK:标准曲线中光吸收为"1"时的酪氨酸微克数;V:酶促反应的总体积;t:酶促反应时间(min);N:酶的稀释倍数.
5.
谷氨酸的检测此项检测也是酱油优良菌株的重要指标之一.
检测培养基:豆饼粉:麸夫=6:4,润水75%,121℃湿热灭菌30min.
谷氨酸测定:于以上培养基中加入7%盐水(W/V),40~45℃水浴,水解9d后过滤,以滤液检测谷氨酸含量(测压法).
四、注意事项1.
紫外线照射时注意保护眼睛和皮肤.
2.
诱变过程及诱变后的稀释操作均在红灯下进行,并在黑暗中培养.
五、实验报告1.
试列表说明高产蛋白酶菌株的筛选过程和结果.
2.
你认为以上的筛选方法有什么优缺点,如何改进六、问题和思考1.
试述紫外线诱变的作用机理及其在具体操作中应注意的问题.
2.
为什么在诱变前要把菌悬液打散和培养一段时间注:筛选菌株数的计算若按突变率为0.
01计算,则一次筛选可取250—300个菌落,第一次筛选后可多选几株高产株,而二级筛选为重点阶段,其最适量可参考以下计算方法:如初筛菌株数为200株,二次筛选欲选株数为2株,则二级应选(200*2)1/2,为20株,这样的数量选择,使有可能从较少的数量中获得相对较多的优良菌株.
第四部分微生物实验技能的测评微生物学实验是微生物学教学的重要组成部分,对学生实验基本技能的培养,在教学中占有重要的位置.
为了检验学生在经过微生物实验课学习后,对微生物实验基本技术和知识的掌握程度,并对学生学习效果进行评定.
测评内容包括对微生物学实验基本知识和技能的掌握,应用所学知识进行实验设计及系统地完成实验的实际工作能力.
实验44和实验45是为此而设计的两种测评方式,可选择其中的一种进行检测.
实验29基本实验技能的检测一、实验目的和内容目的:掌握微生物学的基本实验技能并进行测试.
内容:1.
复习全部基本实验操作.
2.
教师对基本实验技能进行全面辅导,并接受学生的提问.
3.
开放实验室(固定开放时间,学生可自由进入实验室,自己复习和操作).
二、实验材料和用具细菌、放线菌、酵母菌、霉菌菌种,细菌形态装片;培养基(液体、斜面、平板)、染色液;载玻片、盖玻片、接种针、接种环、酒精灯、移液管、试管、培养皿、包装纸、线绳、高压蒸汽灭菌锅、显微镜.
三、基本步骤(一)复习的主要内容1.
实验的基本操作方法(1)培养基的配制.
(2)试管、培养皿、移液管等的包扎.
(3)物品的高压蒸汽灭菌和干热灭菌.
(4)细菌制片、单染色、革兰氏染色及染色原理.
(5)铺平板、制斜面.
(6)从试管斜面菌种划线接种至平板.
(7)从试管斜面菌种转接到试管斜面.
(8)从试管斜面菌种转接至液体培养基.
2.
微生物的分离纯化(1)四大类群微生物的常用培养基及其pH范围.
(2)涂布法和混菌法的平板接种方法.
(3)穿刺接种.
(4)菌悬液的梯度稀释.
(5)划线分离纯化微生物.
(6)从土壤中分离出细菌、放线菌、酵母菌和霉菌.
3.
微生物的形态(1)油镜使用中的注意事项.
(2)辨认细菌形态、鞭毛、荚膜、细胞壁、异染颗粒、伴孢晶体、芽孢.
(3)辨认酵母的形态(液泡、内含物等)、出芽、细胞核、假菌丝.
(4)区分常见霉菌(根霉、毛霉、青霉、曲霉、木霉).
(5)细菌、放线菌、酵母菌、霉菌菌落特征的分辨.
(6)细菌大小和数量的测定.
4.
生理生化测定(1)VP反应和MR反应原理及方法.
(2)判定某种细菌是否发酵糖,能否产气、产酸的方法.
(3)如何初步鉴定一种细菌是好氧、厌氧、兼性厌氧.
(4)如何初步判定一种细菌是否运动.
(5)理化因素(如温度、pH、紫外线、抗生素等)对微生物生长的影响.
5.
免疫学测定(1)凝集反应的原理和方法.
(2)沉淀反应的原理和方法.
(3)如何用免疫学方法检测螺旋体等病原菌的存在6.
其他(1)抗生素效价的测定(原理和方法).
(2)噬菌体效价的测定(原理和方法).
(3)水体中大肠菌群的检测方法.
(4)细菌转导频率的检测方法.
(二)检测方式教师按上述测评内容和要求,事先搭配好分组出好题,到考试时由学生抽取考题3个(第1部分1题,第2部分1题,第3部分1题),在教师面前当场回答完成,教师当场评定打分.
(三)评定标准1.
熟练完成操作,正确回答原理,能迅速判断微生物形态及结构.
(优)2.
正确回答原理,操作正确,能判断微生物形态及结构.
(良)3.
基本正确地回答原理,操作正确,能判断微生物形态及结构.
(中)4.
能基本正确回答原理,操作不够熟练,但基本正确,微生物形态和结构的判断不够准确.
(及格)5.
未达到以上的最起码要求者为不及格,不及格者可通过复习要求重考.
(四)注意间题1.
要当场完成,不能换考题.
2.
要给学生准备考题的时间.
3.
学生单独操作考试,与其他学生分开.
4.
当场评分.
实验30实验设计及实施能力的测评一、实验目的和内容目的:了解学生对实验的知识内容的灵活应用能力.
内容:1.
分析实验设计.
2.
学生自行设计实验.
3.
学生独立完成自行设计的实验,并基本达到预期结果.
二、学会进行实验设计(一)实验设计的基本要求1.
写出实验目的相基本原理.
2.
写出实验的基本要求.
3.
详细写出实验的每一个步骤和注意问题.
(二)考试前的准备指导学生选定实验题目,或由老师指定题目,提供参考书目.
(三)考试方式学生在规定时间内递交实验设计.
(四)评分标准1.
具有科学性和可行性,有一定创新.
(优)2.
无科学性错误,设计不够细致,基本可行.
(良)3.
无明显科学性错误,设计有部分不够合理.
(中)4.
无明显科学性错误,设计不够合理.
(及格)5.
有明显科学性错误,设计不合理.
(不及格)三、自行设计实验独立完成的考核(一)考前准备1.
教师帮助学生修改和完善实验设计.
2.
为学生提供必要的仪器药品.
(二)考试方式在一定时间里,实验室开放,学生在规定时间内,将实验设计完成,并提交实验报告.
(三)评分标准1.
顺利完成实验,得到合理结果,实验中操作正确,熟练.
(优)2.
完成实验,得到较合理结果,实验中操作正确.
(良)3.
完成实验,得到较合理结果,实验操作基本正确.
(中)4.
完成实验,末得到合理结果,实验操作基本正确.
(及格)5.
未得到合理结果,末完成实验,实验中操作不熟练,不正确.
(不及格)(四)注意事项1.
注意实验室安全,老师要现场监督和检查.
2.
如果条件不允许单个学生完成考试实验,可分组进行.
附录:附录1实验室意外事故的处理险情紧急处理火险酒精、乙醚或汽油等着火衣服着火破伤火伤灼伤强酸、溴、氯、磷等酸性药品的灼伤强碱、氢氧化钠、金属钠、钾等碱性药品的灼伤石炭酸灼伤眼灼伤眼为碱伤眼为酸伤食入腐蚀性物质食入酸食入碱食入石炭酸或来苏水吸入菌液吸入非致病性菌液吸入致病性菌液吸入葡萄球菌、链球菌、肺炎球菌液吸入白喉菌液吸入伤寒、霍乱、痢疾、布氏等菌液立刻关闭电门、煤气,使用灭火器,沙土和湿布灭火使用灭火器或沙土或湿布覆盖,慎勿以水灭火可就地或靠墙滚转先除尽外物,用蒸馏水洗净,涂以碘酒或红汞可涂5%鞣酸、2%苦味酸或苦味酸铵茉甲酸丁酯油膏,或龙胆紫液等先以大量清水冲洗,再用5%重碳酸钠或氢氧化铵溶液擦洗以中和酸先以大量清水冲洗,再用5%硼酸溶液或醋酸冲洗以中和碱以浓酒精擦洗先以大量清水冲洗以5%硼酸溶液冲洗然后于滴入橄榄油或液体石蜡1—2滴以滋润之以5%重碳酸钠溶液冲洗,然后再滴入橄榄油或液体石蜡1—2滴以滋润之立即以大量清水漱口,并服镁乳或牛乳等,勿服催吐药立即以大量清水漱口,并服5%醋酸、食蜡、柠檬汁或油类、脂肪用40%乙醇漱口,并喝大量烧酒,再服用催吐剂使其吐出立即大量清水漱口,再以1:1000高锰酸钾溶液漱口立即以大量热水漱口,再以消毒液1:5000米他芬,3%过氧化氢或1:1000高锰酸钾溶液漱口经上法处理后,并注射1000单位的白喉抗毒素以预防经上法处理后,并注射疫菌及抗生素以预防患病附录2实验用培养基配制1.
牛肉膏蛋白胨培养基(用于细菌培养)牛肉膏3g,蛋白胨10g,NaCl5g,水1000mL,pH7.
4~7.
62.
高氏1号培养基(用于放线菌培养)可溶性淀粉20g,KNO31g,NaCl0.
5g,K2HPO4-·3H2O0.
5g,MgSO4·7H2O0.
5g,FeSO4·7H2O0.
01g,水1000mL,pH7.
4~7.
6.
配制时注意,可溶性淀粉要先用冷水调匀后再加入到以上培养基中.
3.
马丁氏(Martin)培养基(用于从土壤中分离真菌)K2HPO41g,MgSO4·7H2O0.
5g,蛋白胨5g,葡萄糖10g,1/3000孟加拉红水溶液100mL,水900mL,自然pH,121℃湿热灭菌30min.
待培养基融化后冷却55~60℃时加入链霉素(链霉素含量为30μg/mL).
4.
马铃薯培养基(PDA)(用于霉菌或酵母菌培养)马铃薯(去皮)200g,蔗糖(或葡萄糖)20g,水1000mL,配制方法如下:将马铃署去皮,切成约2cm2的小块,放入1500mL的烧杯中煮沸30min,注意用玻棒搅拌以防糊底,然后用双层纱布过滤,取其滤液加糖,再补足至1000mL,自然pH.
霉菌用蔗糖,酵母菌用葡萄糖.
5.
察氏培养基(蔗糖硝酸钠培养基)(用于霉菌培养)蔗糖30g,NaNO32g,K2HPO41g,MgSO4·7H2O0.
5g,KCl0.
5g,FeSO4·7H2O0.
1g,水1000mL,pH7.
0~7.
26.
Hayflik培养基(用于支原体培养)牛心消化液(或浸出液)1000mL,蛋白胨10g,NaCl5g,琼脂15g,pH7.
8~8.
0,分装每瓶70mL,121℃湿热灭菌15min,待冷却至80℃左右,每70mL中加入马血清20mL,25%鲜酵母浸出液10mL,15醋酸铊水溶液2.
5mL,青霉素G钾盐水溶液(20万单位以上)0.
5mL,以上混合后倾注平板.
注意:醋酸铊是极毒的药品,需特别注意安全操作.
7.
麦氏(McCLary)培养基(醋酸钠培养基)葡萄糖0.
1g,KCl0.
18g,酵母膏0.
25g,醋酸钠0.
82g,琼脂l.
5g,蒸馏水l00mL.
溶解后分装试管,1l5℃湿热灭菌15min.
8.
葡萄糖蛋白胨水培养基(用于V.
P.
反应和甲基红试验)蛋白胨0.
5g,葡萄糖0.
5g,K2HPO40.
2g,水100mL,pH7.
2,1l5℃湿热灭菌20min.
9.
蛋白胨水培养基(用于吲哚试验)蛋白胨10g,NaCl5g,水1000mL,pH7.
2~7.
4,121℃湿热灭菌20min.
10.
糖发酵培养基(用于细菌糖发酵试验)蛋白胨0.
2g,NaCl0.
5g,K2HPO40.
02g,水100mL,溴麝香草酚蓝(1%水溶液)0.
3mL,糖类lg.
分别称取蛋白胨和NaCl溶于热水中,调pH至7.
4,再加入溴麝香草酚蓝(先用少量95%乙醇溶解后,再加水配成1%水溶液),加入糖类,分装试管,装量4~5cm高,并倒放入一杜氏小管(管口向下,管内充满培养液).
115℃湿热灭菌20min.
灭菌时注意适当延长煮沸时间,尽量把冷空气排尽以使杜氏小管内不残存气泡.
常用的糖类,如葡萄糖、蔗糖、甘露糖、麦芽糖、乳糖、半乳糖等(后两种糖的用量常加大为1.
5%).
11.
RCM培养基(强化梭菌培养基)(用于厌氧菌培养)酵母膏3g,牛肉膏l0g,蛋白胨10g,可溶性淀粉lg,葡萄糖5g,半胱氨酸盐酸盐0.
5g,NaCl3g,NaAc3g,水l000mL,pH8.
5,刃天青3mg/L,l2l℃湿热灭菌30min.
12.
TYA培养基(用于厌氧菌培养)葡萄糖40g,牛肉膏2g,酵母膏2g,胰蛋白胨(bacto-typetone)6g,醋酸铵3g,KH2PO40.
5g,MgSO4·7H2O0.
2g,FeSO4·7H2O0.
01g,水1000mL,pH6.
5,121℃湿热灭菌30min.
13.
玉米醪培养基(用于厌氧菌培养)玉米粉65g,自来水1000mL,混匀,煮10min成糊状,自然pH,121℃湿热灭菌30min.
14.
中性红培养基(用于厌氧菌培养)葡萄糖40g,胰蛋白胨6g,酵母膏2g,牛肉膏2g,醋酸铵3g,KH2PO45g,中性红0.
2g,MgSO4·7H2O0.
2g,FeSO4·7H2O0.
01g,水1000ml,pH6.
2,121℃湿热灭菌30min.
15.
CaCO3明胶麦芽汁培养基(用于厌氧菌培养)麦芽汁(6波美)1000mL,水1000mL,CaCO310g,明胶10g,pH6.
8,121℃湿热灭菌30min.
16.
BCG牛乳培养基(用于乳酸发酵)(A)溶液:脱脂乳粉100g,水500mL,加入1.
6%溴甲酚绿(B.
C.
G)乙醇溶液1mL,80℃灭菌20min.
(B)溶液:酵母膏10g,水500mL,琼脂20g,pH6.
8,121℃湿热灭菌20min.
以无菌操作趁热将(A)、(B)溶液混合均匀后倒平板.
17.
乳酸菌培养基(用于乳酸发酵)牛肉膏5g,酵母膏5g,蛋白胨10g,葡萄糖10g,乳糖5g,NaCl5g,水1000mL,pH6.
8,121℃湿热灭菌20min.
18.
酒精发酵培养基(用于酒精发酵)蔗糖10g,MgSO4·7H2O0.
5g,NH4NO30.
5g,20%豆芽汁2mL,KH2PO40.
5g,水100mL,自然pH.
19.
柯索夫培养基(用于钩端螺旋体培养)优质蛋白胨0.
4g,NaCl0.
7g,KCl0.
02g,NaHCO30.
01g,CaCl0.
02g,KH2PO40.
09g,NaH2PO40.
48g,蒸馏水500mL,无菌兔血清40mL.
制法:除兔血清外的其余各成分混合,加热溶解,调pH至7.
2,121℃湿热灭菌20min,待冷却后,加入无菌兔血清,制成8%血清溶液,然后分装试管(5~10mL/管),56℃水浴灭活lh后备用.
20.
豆芽汁培养基黄豆芽500g,加水1000mL,煮沸lh,过滤后补足水分,121℃湿热灭菌后存放备用,此即为50%的豆芽汁,用于细菌培养:10%豆芽汁200mL,葡萄糖(或蔗糖)50g,水800mL,pH7.
2~7.
4.
用于霉菌或酵母菌培养:10%豆芽汁200mL,糖50g,水800mL,自然pH.
霉菌用蔗糖,酵母菌用葡萄糖.
21.
LB(Luria—Bertani)培养基(细菌培养,常在分子生物学中应用)双蒸馏水950mL,胰蛋白胨l0g,NaCll0g,酵母提取物(bacto-yeastextract)5g,用lmol/LNaOH(约lmL)调节pH值至7.
0,加双蒸馏水至总体积为1L,121℃湿热灭菌30min.
含氨苄青霉素LB培养基:待LB培养基灭菌后冷至50℃左右加入抗生素,至终浓度为80~100mg/L.
22.
复红亚硫酸钠培养基(远藤氏培养基)(用于水体中大肠菌群测定)蛋白胨10g,牛肉浸膏5g,酵母浸膏5g,琼脂20g,乳糖10g,K2HPO40.
5g,无水亚硫酸钠5g,5%碱性复红乙醇溶液20mL,蒸馏水1000mL.
制作过程:先将蛋白胨、牛肉浸膏、酵母浸膏和琼脂加入到900mL水中,加热溶解,再加入K2PO4,溶解后补充水至l000mL,调pH至7.
2~7.
4.
随后加入乳糖,混匀溶解后,于115℃湿热灭菌20min.
再称取亚硫酸钠至一无菌空试管中,用少许无菌水使其溶解,在水浴中煮沸10min后,立即滴加于20mL5%碱性复红乙醇溶液中,直至深红色转变为淡粉红色为止.
将此混合液全部加入到上述已灭菌的并仍保持融化状态的培养基中,混匀后立即倒平板,待凝固后存放冰箱备用,若颜色由淡红变为深红,则不能再用.
23.
乳糖蛋白胨半固体培养基(用于水体中大肠菌群测定)蛋白胨10g,牛肉浸膏5g,酵母膏5g,乳糖10g,琼脂5g,蒸馏水1000mL,pH7.
2~7.
4,分装试管(l0mL/管),115℃湿热灭菌20min.
24.
乳糖蛋白胨培养液(用于多管发酵法检测水体中大肠菌群)蛋白胨10g,牛肉膏3g,乳糖5g,NaCl5g,蒸馏水l000mL,1.
6%溴甲酚紫乙醇溶液lmL.
调pH至7.
2,分装试管(l0mL/管),并放入倒置杜氏小管,l15℃湿热灭菌20min.
25.
三倍浓乳糖蛋白胨培养液(用于水体中大肠菌群测定)将乳糖蛋白胨培养液中各营养成分以扩大3倍加入到l000mL水中,制法同上,分装于放有倒置杜氏小管的试管中,每管5mL,1l5℃湿热灭菌20min.
26.
伊红美蓝培养基(EMB培养基)(用于水体中大肠菌群测定和细菌转导)蛋白胨l0g,乳糖10g,K2HPO42g,琼脂25g,2%/伊红Y(曙红)水溶液20mL,0.
5%美蓝(亚甲蓝)水溶液l3mL,pH7.
4.
制作过程:先将蛋白胨、乳糖、K2HPO4和琼脂混匀,加热溶解后,调pH至7.
4,1l5℃湿热灭菌20min,然后加入已分别灭菌的伊红液和美蓝液,充分混匀,防止产生气泡.
待培养基冷却到50℃左右倒平皿.
如培养基太热会产生过多的凝集水,可在平板凝固后倒置存于冰箱备用.
在细菌转导实验中用半乳糖代替乳糖,其余成分不变.
27.
加倍肉汤培养基(用于细菌转导)牛肉膏6g,蛋白胨20g,NaCL10g,水1000mL,pH7.
4~7.
6.
28.
半固体素琼脂(用于细菌转导)琼脂1g,水100mL,121℃湿热灭菌30min.
29.
豆饼斜面培养基(用于产蛋白酶霉菌菌株筛选):豆饼100g加水5~6倍,煮出滤汁100mL,汁内加入KH2PO40.
1%,MgSO40.
05%,(NH4)2SO40.
05%,可溶性淀粉2%,pH6,琼脂2%~2.
5%.
30.
酪素培养基(用于蛋白酶菌株筛选)分别配制A液和B液.
A液:称取Na2HPO4·7H2O1.
07g.
干酪素4g,加适量蒸馏水,并加热溶解.
B液:称取KH2PO40.
36g,加水溶解.
A、B液混合后,加入酪素水解液0.
3mL,加琼脂20g,最后用蒸馏水定容至1000mL.
酪素水解液的配制:1g酪蛋白溶于碱性缓冲液中,加入1%的枯草芽孢杆菌蛋白酶25mL加水至100mL,30℃水解lh.
用于配制培养基时,其用量为1000mL培养基中加入100mL以上水解液.
31.
细菌基本培养基(用于筛选营养缺陷型)Na2HPO4·7H2O1g,MgSO4·7H2O0.
2g,葡萄糖5g,NaCl5g,K2HPO4lg,水l000mL,pH7.
0,1l5℃湿热灭菌30min.
32.
YEPD培养基(用于酵母原生质体融合)酵母粉10g,蛋白胨20g,葡萄糖20g,蒸馏水1000mL,pH6.
0,115℃湿热灭菌20min.
33.
YEPD高渗培养基(用于酵母原生质体融合)在YEPD培养基中加入0.
6mol/L的NaCL,3%琼脂.
34.
YNB基本培养基(用于酵母原生质体融合)0.
67%酵母氮碱基(YNB,不含氨基酸,Difco),2%葡萄糖,3%琼脂,pH6.
2.
另一配方为:葡萄糖10g(NH4)2SO41g,K2HPO40.
125g,KHPO40.
875g,KI0.
0001g,MgSO4·7H2O0.
5g,CaCl2·2H2O0.
lg,NaCl0.
1g,维量元素母液lmL,维生素母液lmL(母液均按常规配制),水1000mL,pH5.
8~6.
0.
35.
YNB高渗基本培养基(用于原生质体融合)在YNB基本培养基中加入0.
6mol/LNaCl.
36.
酚红半固体柱状培养基(用于检查氧与菌生长的关系)蛋白胨1g,葡萄糖10g,玉米浆10g,琼脂7g,水1000mL,pH7.
2.
在调好pH后,加入1.
6%酚红溶液数滴,至培养基变为深红色,分装于大试管中,装量约为试管高度的1/2,1l5℃灭菌20min.
细菌在此培养基中利用葡萄糖生长产酸,使酚红从红色变成黄色,在不同部位生长的细菌,可使培养基的相应部位颜色改变.
但注意培养时间太长,酸可扩散以致不能正确判断结果.
以上各种培养基均可配制成固体或半固体状态,只需改变琼脂用量即可,前者为1.
5%~2.
0%,后者为0.
3%~0.
8%.
附录3酸碱指示剂的配制(按笔画顺序排列)中文名称英文名称应加的NaOH/mL*酸性颜色碱性颜色pH范围甲基红methylred37.
0红黄4.
2~6.
3甲酚红cresolred26.
2黄红7.
2~8.
8甲酚红cresolred0.
1%乙醇(90%)红黄0.
2~1.
8间甲酚紫(酸域)meta-cresopurple26.
2红黄1.
2~2.
8间甲酚紫(碱域)meta-cresolpurple26.
2黄紫7.
4~9.
0茜素黄-Ralizarinyellow-R0.
1%水溶液黄红10.
1~12.
0氯酚红chlorophenolred23.
6黄红4.
8~6.
4溴酚蓝bromophenolblue14.
9黄蓝3.
0~4.
6溴酚红bromophenolred19.
5黄红5.
2~6.
8溴甲酚绿bromecresolgreen14.
3黄红3.
8~5.
4溴甲酚紫bromoocresolpurple18.
5黄紫5.
2~6.
8溴麝香草酚蓝bromothymolboue16.
0黄蓝6.
0~7.
6酚红Phenolred28.
2黄红6.
8~8.
4酚酞Phenolphthalein1%乙醇(90%)无色红8.
2~9.
8麝香草酚蓝(碱域)thymolblue21.
5黄蓝8.
0~9.
6麝香草酚蓝(酸域)thymolblue21.
5红黄1.
2~2.
8麝香草酚酞(百里酚酞)thymol-phthalein0.
1%乙醇(90%)无色蓝9.
3~10.
5*精确称取指示剂粉末0.
1g,移至研钵中,按上表分数次加入0.
01mol/LNaOH溶液,仔细研磨直至溶解为止,最终用蒸馏水稀释至250mL,从而配成0.
04%指示剂溶液.
但甲基红及酚红溶液应稀释至500mL,故最终浓度为0.
02%.
附录4实验用染色液及试剂的配制(一)实验用染色液的配制1.
黑色素液水溶性黑素10g,蒸馏水100mL,甲醛(福尔马林)0.
5mL.
可用作荚膜的背景染色.
2.
墨汁染色液国产绘图墨汁40mL,甘油2mL,液体石炭酸2mL.
先将墨汁用多层纱布过滤,加甘油混匀后,水浴加热,再加石炭酸搅匀,冷却后备用.
用作荚膜的背景染色.
3.
吕氏(Loeffier)美蓝染色液A液:美蓝(methyleneblue,又名甲烯蓝)0.
3g,95%乙醇30mL;B液:0.
0l%KOHl00mL.
混合A液和B液即成,用于细菌单染色,可长期保存.
根据需要可配制成稀释美蓝液,按1:10或1:100稀释均可.
4.
革兰氏染色液(1)结晶紫(crystalviolet)液:结晶紫乙醇饱和液(结晶紫2g溶于20mL95%乙醇中)20mL,1%草酸铵水溶液80mL将两液混匀置24h后过滤即成.
此液不易保存,如有沉淀出现,需重新配制.
(2)卢戈(Lugol)氏碘液:碘1g,碘化钾2g,蒸馏水300mL.
先将碘化钾溶于少量蒸馏水中,然后加入碘使之完全溶解,再加蒸馏水至300mL即成.
配成后贮于棕色瓶内备用,如变为浅黄色即不能使用.
(3)95%乙醇:用于脱色,脱色后可选用以下(4)或(5)的其中一项复染即可.
(4)稀释石炭酸复红溶液:碱性复红乙醇饱和液(碱性复红1g,95%乙醇l0mL,5%石炭酸90mL混合溶解即成碱性复红乙醇饱和液),取石炭酸复红饱和液l0mL加蒸馏水90mL即成.
(5)番红溶液:番红O(safranine,又称沙黄O)2.
5g,95%乙醇100mL,溶解后可贮存于密闭的棕色瓶中,用时取20mL与80mL蒸馏水混匀即可.
以上染液配合使用,可区分出革兰氏染色阳性(G+)或阴性(G-)细菌,G-被染成蓝紫色,G+被染成淡红色5.
鞭毛染色液A液:丹宁酸5.
0g,FeCl31.
5g,15%甲醛(福尔马林)2.
0mL,l%NaOH1.
0mL,蒸馏水l00mL;B液:AgNO32.
0g,蒸馏水100mL.
待AgNO3溶解后,取出l0mL备用,向其余的90mLAgNO3中滴加NH4OH,即可形成很厚的沉淀,继续滴加NH4OH至沉淀刚刚溶解成为澄清溶液为止,再将备用的AgNO3慢慢滴入,则溶液出现薄雾,但轻轻摇动后,薄雾状的沉淀又消失,继续滴入AgNO3,直到摇动后仍呈现轻微而稳定的薄雾状沉淀为止,如雾重,说明银盐沉淀出,不宜再用.
通常在配制当天便用,次日效果欠佳,第3天则不能使用.
6.
0.
5%沙黄(Safranine)液:2.
5%沙黄乙醇液20mL,蒸馏水80mL.
将2.
5%沙黄乙醇液作为母液保存于不透气的棕色瓶中,使用时再稀释.
7.
5%孔雀绿水溶液:孔雀绿5.
0g,蒸馏水100mL.
8.
0.
05%碱性复红:碱性复红0.
05g,95%乙醇100mL.
9.
齐氏(Ziehl)石炭酸复红液:碱性复红0.
3g溶于95%乙醇l0mL中为A液:0.
01%KOH溶液l00mL为B液.
混合A、B液即成.
10.
姬姆萨(Giemsa)染液(1)贮存液:称取姬姆萨粉0.
5g,甘油33mL,甲醇33mL.
先将姬姆萨粉研细,再逐滴加入甘油,继续研磨,最后加入甲醇,在56℃放置1~24h后即可使用.
(2)应用液(临用时配制):取1mL贮存液加19mLpH7.
4磷酸缓冲液即成.
亦可取贮存液:甲醇=1:4的比例配制成染色液.
11.
乳酸石炭酸棉蓝染色液(用于真菌固定和染色)石炭酸(结晶酚)20g,乳酸20mL,甘油40mL,棉蓝0.
05g,蒸馏水20mL.
将棉蓝溶于蒸馏水中,再加入其他成分,微加热使其溶解,冷却后用.
滴少量染液于真菌涂片上,加上盖玻片即可观察.
霉菌菌丝和孢子均可染成蓝色.
染色后的标本可用树脂封固,能长期保存.
12.
1%瑞氏(Wright's)染色液:称取瑞氏染色粉6g,放研钵内磨细,不断滴加甲醇(共600mL)并继续研磨使溶解.
经过滤后染液须贮存一年以上才可使用,保存时间愈入,则染色色泽愈佳.
13.
阿氏(Albert)异染粒染色液:A液:甲苯胺蓝(toluidineblue)0.
15g,孔雀绿0.
2g,冰醋酸lmL,95%乙醇2mL,蒸馏水100mL;B液:碘2g,碘化钾3g,蒸馏水300ml.
先用A液染色1min,倾去A液后,用B液冲去A液,并染1min.
异染粒呈黑色,其他部分为暗绿或浅绿.
(二)实验用试剂的配制l.
乳酸苯酚固定液乳酸10g,结晶苯酚10g,甘油20g,蒸馏水10mL.
2.
1.
6%溴甲酚紫溴甲酚紫1.
6g溶于100mL乙醇中,贮存于棕色瓶中保存备用.
用作培养基指示剂时,每1000mL培养基中加入lmL1.
6%溴甲酚紫即可.
3.
V.
P.
试剂CuSO41g,蒸馏水l0mL,浓氨水40mL,10%NaOH950mL.
先将CuSO4溶于蒸馏水中,然后加浓氨水,最后加入10%NaOH.
4.
0.
02%甲基红试剂甲基红0.
1g,95%乙醇760mL,蒸馏水100mL.
5.
吲哚反应试剂对二甲基氨基苯甲醛8g,95%乙醇760mL,浓HCl160mL.
6.
Alsever's血细胞保存液葡萄糖2.
05g,柠橡酸钠0.
8g,NaCl0.
42g,蒸馏水l00mL.
以上成分混匀后,微加温使其溶解后,用柠檬酸调节pH6.
1,分装于三角瓶中(30~50mL/瓶),113℃湿热灭菌15min,备用.
7.
Hank's液(l)贮存液A液:(I)NaCl80g,KCl4g,MgSO4·7H2O1g,MgCl2·6H2O1g,用双蒸馏水定容至450mL:(II)CaCl21.
4g(或CaCl2·2H2O1.
85g)用双蒸馏水定容至50mL.
将I和II液混合,加氯仿1mL即成A液.
(2)贮存液B液:Na2HPO4·12H2O1.
52g,KH2PO40.
6g,酚红0.
2g,葡萄糖10g,用双蒸馏水定容至500mL,然后加氯仿1mL,酚红应先置研钵内磨细,然后按配方顺序一一溶解.
(3)应用液:取上述贮存液的A和B液各25mL,加双蒸馏水定容至450mL,113℃湿热灭菌20min.
置4℃下保存.
使用前用无菌的3%NaHCO3调至所需pH.
注意:药品必须全部用A.
R试剂,并按配方顺序加入,用适量双蒸馏水溶解,待前一种药品完全溶解后再加入后一种药品,最后补足水到总量.
(4)10%小牛血清的Hank's液:小牛血清必须先经56℃、30min灭活后才可使用,应小瓶分装保存,长期备用.
用时按10%用量加至应用液中.
8.
0.
1mol/LCaCl2溶液双蒸馏水900mL,CaCl211g,定容至lL,可用孔径为0.
22μm的滤器过滤除菌或12l℃湿热灭菌20min.
9.
0.
05mol/LCaCl2溶液双蒸馏水900mL,CaCl25.
5g,定容至lL,可用孔径为0.
22μm的滤器过滤除菌或12l℃湿热灭菌20min.
10.
α淀粉酶活力测定试剂(1)碘原液:称取碘11g,碘化钾22g,加水溶解定容至500mL.
(2)标准稀碘液:取碘原液15mL,加碘化钾8g,定容至500mL.
(3)比色稀碘液:取碘原液2mL,加碘化钾20g,定容至500mL.
(4)2%可溶性淀粉:称取干燥可溶性淀粉2g,先以少许蒸馏水混合均匀,再徐徐倾入煮沸的蒸馏水中,继续煮沸2min,待冷却后定容至100mL(此液当天配制使用).
(5)标准糊精液:称取分析纯糊精0.
3g,用少许蒸馏水混匀后倾入400mL水中,冷却后定容至500mL,加入几滴甲苯试剂防腐,冰箱保存.
11.
pH6.
0磷酸氢二钠-柠檬酸缓冲液称取Na2HPO4·12H2O45.
23g,柠檬酸(C6H8O7·H20)8.
07g,加蒸馏水定容至1000mL.
12.
0.
lmol/L磷酸缓冲液(pH7.
0)称取Na2HPO4·12H2O35.
82g,溶于1000mL蒸馏水中,为A液:称取NaH2PO4·2H2O15.
605g,溶于l000mL蒸馏水中,为B液.
取A液61mL,B液39mL,可得到100mL0.
lmol/LpH7.
0的磷酸缓冲液.
13.
测定乳酸的试剂(l)pH9.
0缓冲液:在300mL容量瓶中加入甘氨酸11.
4g,24%NaOH2mL,加275mL蒸馏水.
(2)NAD溶液:NAD600mg溶于20mL蒸馏水中.
(3)L(+)LDH:加5mgL(+)LDH于lmL蒸馏水中.
(4)D(-)LDH:加2mgD(-)LDH于lmL蒸馏水中.
14.
Taq缓冲液(10*)Tris-HCl(pH8.
4)100mmol/L,KCl500mmol/L,MgCl215mmol/L,BSA(牛血清清蛋白)或明胶lmg/mL15.
dNTP混合液dATP50mmol/L,dCTP50mmol/L,dGTP50mmol/L,dTTP50mmol/L.
16.
1%琼脂糖琼脂糖lg,TAE100mL,100℃融化后待凉至40℃倒胶,胶厚度约0.
4~0.
6.
17.
TAETris碱4.
84mL,冰乙酸1.
l4mL,0.
5mol/LpH8.
0的EDTA-Na2·2H2O(乙二胺四乙酸钠盐)2mL18.
0.
5mol/LEDTA(pH8.
0)在800mL蒸馏水中加186.
lgEDTA,剧烈搅拌,用NaOH调pH至8.
0(约20g颗粒),定容至lL,分装后121℃湿热灭菌备用.
19.
硝酸盐还原试剂(1)格里斯氏(Griess)试剂A液:对氨基苯磺酸0.
5g,稀醋酸(10%左右)150mLB液:α萘胺0.
1g,蒸馏水20mL,稀醋酸(10%左右)150mL(2)二苯胺试剂:二苯胺0.
5g溶于l00mL浓硫酸中,用20mL蒸馏水稀释.
在培养液中滴加A、B液后溶液如变为粉红色、玫瑰红色、橙色或棕色等表示有亚硝酸盐还原,反应为阳性,如无色出现则可加1~2滴二苯胺试剂:如溶液呈蓝色则表示培养液中仍存在有硝酸盐,从而证实该菌无硝酸盐还原作用:如溶液不呈蓝色,则表示形成的亚硝酸盐已进一步还原成其他物质,故硝酸盐还原反应仍为阳性.
附录5微生物学实验中一些常用数据表(一)常用消毒剂名称浓度使用范围注意问题名称浓度使用范围注意问题升汞0.
05%~0.
1%植物组织和虫体外部消毒腐蚀金属器皿硫柳汞0.
01%~0.
1%生物制品防腐,皮肤消毒多用于抑菌甲醛(福尔马林)10mL/m3接种室消毒用于熏蒸石炭酸(苯酚)3%~5%接种室消毒(喷雾)器皿消毒杀菌力强来苏水(煤酚皂液)3%~5%接种室消毒,擦洗桌面及器械杀菌力强漂白粉2%~5%皮肤消毒腐蚀金属伤皮肤新洁尔灭0.
25%皮肤及器皿消毒对芽孢无效乙醇70%~75%皮肤消毒对芽孢无效高锰酸0.
1%皮肤及器应随用随硫磺15g/m2熏蒸,腐蚀钾皿消毒配空气消毒*金属生石灰1%~3%消毒地面及排泄物腐蚀必强*10mL/m3加热熏蒸,或迅速加入甲醛10份高锰酸钾中,使其产生黄色浓烟,立即密闭房间,熏蒸6—24h.
(二)比重糖度换算表波尔度(Baume)比重糖度(Brix)波尔度(Baume)比重糖度(Brix)11.
0071.
8241.
20043.
921.
0153.
7251.
21045.
831.
0025.
5261.
22047.
741.
0287.
2271.
23149.
651.
0369.
0281.
24151.
561.
04310.
8291.
25253.
571.
05112.
6301.
26355.
481.
05914.
5311.
27457.
391.
06716.
2321.
28659.
3101.
07418.
0331.
269761.
2111.
08219.
8341.
30963.
2121.
09121.
7351.
32165.
2131.
09923.
5361.
33367.
1141.
10725.
3371.
34468.
9151.
11627.
2381.
35670.
8161.
12529.
0391.
36872.
7171.
13430.
8401.
38074.
5181.
14332.
7411.
39276.
4191.
15234.
6421.
40478.
2201.
16136.
4431.
41780.
1211.
17138.
3441.
42982.
0221.
18040.
1451.
44283.
8231.
19042.
0461.
45585.
7(三)常用干燥剂用途常用干燥剂名称气体的干燥石灰,无水CaCl2,P2O5,浓H2SO4,KOH流体的干燥P2O5,浓H2SO4,无水CaCl2,无水K2CO3KOH,无水Na2SO4,无水MgSO4,无水CaSO4,金属钠干燥剂中的吸水P2O5,浓H2SO4,无水CaCl2,硅胶有机溶剂蒸汽干燥石蜡片酸性气体的干燥石灰,KOH,NaOH碱性气体的干燥浓H2SO4,P2O5附录6玻璃器皿及玻片洗涤法(一)玻片洗涤法细菌染色的玻片,必须清洁无油,清洗方法如下:1.
新购置的载片,先用2%盐酸浸泡数小时,冲去盐酸.
再放浓洗液中浸泡过液,用自来水冲净洗液,浸泡在蒸馏水中或擦干装盒备用.
2.
用过的载片,先用纸擦去石蜡油,再放入洗衣粉液中煮沸,稍冷后取出.
逐个用清水洗净,放浓洗液中浸泡24h,控去洗液,用自来水冲洗.
蒸馏水浸泡.
3.
用于鞭毛染色的玻片,经以上步骤清洗后,应选择表面光滑无伤痕者,浸泡在95%的乙醇中暂时存放,用时取出,用干净纱布擦去酒清,并经过火焰微热,使残余的酒精挥发,再用水滴检查,如水滴均散开,方可使用.
4.
洗净的玻片,最好及时使用,以免空气中飘浮的油污沾染,长期保存的干净玻片,用前应再次洗涤后方可使用.
5.
盖片使用前,可用洗衣粉或洗液浸泡,洗净后再用95%乙醇浸泡,擦干备用,用过的盖片也应及时洗净擦干保存.
(二)玻璃器皿洗涤法清洁的玻璃器皿是得到正确实验结果的重要条件之一,由于实验目的不同,对各种器皿的清洁程度的要求也不同.
l.
一般玻璃器皿(如锥形瓶、培养皿、试管等)可用毛刷及去污粉或肥皂洗去灰尘、油垢、无机盐类等物质,然后用自来水冲洗干净.
少数实验要求高的器皿,可先在洗液中浸泡数10min,再用自来水冲洗.
最后用蒸馏水洗2~3次.
以水在内壁能均匀分布成一薄层而不出现水珠,为油垢除尽的标准.
洗刷干净的玻璃仪器烘干备用.
2.
用过的器皿应立即洗刷,放置太久会增加洗刷的困难.
染菌的玻璃器皿,应先经121℃高压蒸汽灭菌20~30min后取出,趁热倒出容器内之培养物,再用热肥皂洗刷干净,用水冲洗.
带菌的移液管和毛细吸管,应立即放大5%的石炭酸溶液中浸泡数小时,先灭菌,然后再用水冲洗,有些实验,还需要用蒸馏水迸一步冲洗.
3.
新购置的玻璃器皿含有游离碱,一般先用2%盐酸或洗液浸泡数小时后.
再用水冲洗干净,新的载玻片和盖玻片先浸入肥皂水(或2%盐酸)内lh,再用水洗净.
以软布擦干后浸入滴有少量盐酸的95%乙醇中,保存备用.
已用过的带有活菌的载玻片或盖玻片可先浸在5%石炭酸溶液中消毒,再用水冲洗干净,擦干后,浸入95%乙醇中保存备用.
(三)洗液的配制通常用的洗液是重铬酸钾(或重铬酸钠)的硫酸溶液.
称为铬酸洗液,其成分是:重铬酸钾60g,浓硫酸460mL,水300mL.
配制方法为:重铬酸钾溶解在温水中,冷却后再徐徐加大浓硫酸(比重为l.
.
84左右.
可以用废硫酸),配制好的溶液呈红色.
并有均匀的红色小结晶,稀重铬酸钾溶液可如下配制:重铬酸钾60g,浓硫酸60mL,水1000mL.
铬酸洗液是一种强氧化剂,去污能力很强.
常用它来洗去玻璃和瓷质器皿的有饥物质,切不可用于洗涤金属器皿.
铬酸洗液加热后,去污作用更强,一般可加热到45~50℃,稀铬酸洗液可煮沸,洗液可反复使用,直到溶液呈青褐色为止.
附录7各国主要菌种保藏机构单位名称单位缩写单位名称单位缩写中国微生物菌种保藏管理委员会CCCM中国科学院微生物研究所菌种保藏中心中国科学院武汉病毒所菌种保藏中心轻工部食品发酵工业科学研究所卫生部药品生物检定所中国医学科学院皮肤病研究所中国医学科学院病毒研究所国家医药总局四川抗生素研究所华北制药厂抗生素研究所农业部兽医药品监察所世界菌种保藏联合会WFCC日本微生物菌种保藏联合会JFCC美国标准菌株保藏中心ATCC北海道大学农学部应用微生物教研室AHU美国农业部北方研究利用发展部NRRL东京大学农学部发酵教研室ATU美国农业研究服务处菌中收藏馆ARS东京大学应用微生物研究所IAM美国Upjohn公司菌种保藏部UPJOHN东京大学医学科学研究所IID加拿大Alberta大学霉菌标本室UAMH东京大学医学院细菌学教研室MTU加拿大国家科学研究委员会NRC大阪发酵研究所IFO法国典型微生物保藏中心CCTM广岛大学工业学部发酵工业系AUT捷克和斯洛伐克国家菌保会CNCTC新西兰植物病害真菌保藏部PDDCC荷兰真菌中心收藏所CBS德国科赫研究所RKI英国国立典型菌种收藏馆NCTC德国发酵红叶研究所微生微生物收藏室MIG英联邦真菌研究所CMI德国微生物研究所菌种收藏室KIM英国国立工业细菌收藏所NCIB附录8实验用缩写名称对照表Ala丙氨酸alanineGln谷氨酰胺glutamineArg精氨酸arginineGlu谷氨酸glutamicacidAsn天冬酰胺asparagineGly甘氨酸glycineAsp天冬氨酸asparticacidHis组氨酸histidineBSA牛血清清清蛋白bovineserumalbuminIle异亮氨酸isoleucineeDNA互补DNAcomplementaryDNALeu亮氨酸leucineCys半胱氨酸cysteineLDH乳酸脱氢酶lactatedehydrogenasedATP脱氧腺苷三磷酸deoxyadenosinetriphosphateLys赖氨酸lysinedCTP脱氧胞苷三磷酸deoxycytidinetriphosphateMet蛋氨酸(甲硫氨酸)methioninedGTP脱氧鸟苷三磷酸deoxyguanosinetriphosphateNAD烟酰胺腺嘌呤二核苷酸(辅酶I)dNTP脱氧核苷三磷酸deoxynucleosidetriphosphatenicotinamideadeninedinucleotidedTTP脱氧胸苷三磷酸deoxythymidinetriphosphateNADH还原型烟酰胺腺嘌呤二核苷酸(还原型辅酶I)DTT二硫苏糖醇dithiothreitolreducednicotinamideadeninedinucleotideEB(EtBr)溴化乙锭ethidiumbromidePAGE聚丙烯酰胺凝胶电泳EDTA乙二胺四乙酸ethylenediaminetetraaceticacidPolyacrylamidegelelectrophoresisEtOH乙醇ethanolPCR聚合酶链式反应polymerasechainreactionPEG聚乙二醇polyethyleneglycolTETris-EDTA缓冲液Tris-EDTAbufferPfu噬菌斑形成单位plaque-formingunitThr苏氨酸threoninePhe苯丙氨酸phenylalaninetRNA转移RNAtransferRNAPro脯氨酸prolineTrp色氨酸tryptophantRNA核蛋白体RNAribosomalRNATyr酪氨酸tyrosineSDS十二烷基磺酸钠sodiumdodecylsulfateVal颉氨酸valineSer丝氨酸serine附录9实验常用中英名词对照表EMB培养基eosinmethylenebluemedium发酵液fermentationsolutionV.
P.
试验Voges-Proskauertest四环素tetracycline三画对流免疫电泳counterimmuoelectrophoresis子囊ascus(复:asci)平板Plate子囊孢子ascospore平板划线streakplate小梗sterigma平板菌落计数法enumerationbyplatecountmethod干热灭菌hotovensterilization灭菌sterilization干燥箱dryingoven生长曲线growthcurve马丁培养基Martin'smedium甲基红(M.
R.
)试验Methylredtest马铃薯葡萄糖培养基Potatoextractglucosemedium目镜测微尺Ocularmicrometer四画石炭酸(酚)Phenol专性厌氧菌obligateanaerobe立克次氏体Rickettsia中性红neutralred节孢子arthrospore分生孢子conidium(复:conidia)六画分生孢子梗conidiophore产氨试验Productionofammoniatest分离isolation伊红美蓝培养基eosinmethylenebluemedium分辨率(清晰度)Resoivingpower(resolution)划线培养streakculture双筒显微镜biocularmicroscope厌氧细菌anaerobicbacteria孔雀绿malachitegreen厌氧培养法anaerobicculturemethod巴斯德消毒法Pasteurization吕氏美蓝液Loeffler'smethyleneblue支原体mycoplasma多粘菌素Polymyxin无性繁殖vegetativepropagation好氧细菌aerobicbacterium(复:bacteria)无菌水sterilewater异养微生物heterotrophicmicrobe无菌移液管sterilepipette异染粒metachromaticgranule无菌操作(无菌技术)aseptictechnique有性繁殖sexualreproduction比浊法turbidimetry血细胞计数板haemocytometer气生菌丝aerialhypha(复:hyphae)衣原体Chlamydia水浸法wet-mountmethod负染色negativestain牛肉膏蛋白胨培养基beefextractpeptonemedium齐氏石炭酸复红染液Ziehl'scarbolfuchsin计算室countingchamber七画五画伴孢晶体parasporalcrystal卡那霉素kanamycin免疫血清Immuneserum利夫森氏鞭毛染色Leifson'sflagellastain九画吲哚试验indoletest匍匐枝stolon局限性转导specializedtransduction厚垣孢子chalmydospore抑制剂indhibitor垣酸teichoicacid抑菌圈zoneofinhibition复染counterstain抗生素antibiotics恒温箱incubator抗生素发酵antiboticfermentation挑菌落colonyselection抗血清antiserum抗体antibody柠檬酸盐培养基citratemedium抗原antigen测微尺micrometer抗菌谱antibioticspectrum相差显微镜phasecontrastmicroscope杜氏小管Durbamtube穿刺培养stabculture来苏尔lysol细晶紫crystalviolet沉淀反应precipitationreaction耐氧细菌aerotolerantbacteria沉淀原precipinogen荚膜染色capsulestain沉淀素precipitin诱变剂mutagenicagent纯化purification诱变效应mutageniceffect芽孢spore革兰氏阳性菌Gram-positivebacteria,G+芽孢染色sporestain革兰氏阴性菌Gram-negativebacteria,G-豆芽汁葡萄糖培养基soybeansproutextractglucosemedium革兰氏染色Gramstain阿须贝无氮培养基Ashbymedium革兰氏碘液Gram'siodinesolution麦芽汁培养基maltextractmedium香柏油cedaroil八画十画乳酸石炭酸液lactophenolsolution倾注法pour-platemethod乳糖发酵lactosefermentation兼性厌氧菌faculativeanaerobe乳糖蛋白胨培养基lactosepeptonemedium原生质体protoplast单菌落singlecolony振荡培养shakeculture单筒显微镜monocularmicroscope根瘤菌nodulebacteria固氮作用nitrogenfixation氨苄青霉素ampicillin国际单位制internationalsystemofunits,SI涂抹培养smearingculture奈氏试剂Nessler'sreagent涂布器(刮刀)scraper孢子囊sporangium(复:sporangia)清毒desomfectopm孢子囊柄sporangiophore消毒剂disinfectant孢囊孢子sporangiospore真菌fungi明胶液化试验gelatinliguefactiontest胰蛋白胨bacto-tryptone杯碟法cylinder-platemethod载片slide油镜oilimmersion酒精发酵alcoholicfermentation物镜objective,objectivelens高氏1号合成培养基Gause'sNo.
1syntheticmedium细调节器fineadjustment高压蒸汽灭菌highpressuresteamsterilization肽聚糖peptidoglycan十一画苯胺黑(黑色素)nigrosin假根rhizine转导tramsduction假菌丝pseudohypha转导子transductant培养皿petridish培养基medium链霉素streptomycin培养液culturesolution十三画悬液suspension微生物发酵microbialfermentation悬滴法hangingdropmethod摇床rotatingshaker接合conjugation数值孔径numericalaperture(N.
A)接合孢子zygospore暗视野显微镜darkfieldmicroscope接种针inoculatingneedle溶菌酶lysozyme接种环inoculatingloop滤膜法membranefiltertechnique斜面slant简单染色simplestain斜面接种inoculationofanagarslant蓝细菌cyanobacteria液体接种brothtransfer酪蛋白水解培养基caseinhydrolysatemedium淀粉水解试验hydrolysisofstrarchtest十四画以上球形体sphaeroplast察氏培养基Czapek'smedium盖片coverglass碱性复红basicfuchsin硅胶silicagel碱性染料basicdye移液管Breedpipette稳定期stationaryphase脱色剂decolourisingagent聚-β-羟丁酸poly-β-hydroxybutyrate,PHB菌丝hypha(复:hyphae)酵母甘露醇培养基yeastextractmannitolmedium菌丝体mycelium(复:mycelia)酵母菌yeast菌落colony蕃红(沙黄、藏花红)safranin营养菌丝vegetativehypha佳性没食子酸pyrogallicacid十二画霉菌mould,mold媒染剂mordant凝胶扩散geldiffusion普遍性转导generaltransduction凝集反应agglutinationreaction棉塞cottonpluge凝集原agglutinogen氯霉素chloramphenicol凝集素bacteriophage琼脂扩散法agardiffusionmethod噬菌体agglutinate琼脂糖凝胶agarosegel噬菌体裂解phagelysis稀释分离法isolationbydilutionmethod噬菌斑plaque稀释液diluent(dilutedsolution)镜台测微尺stagemicrometer紫外线ultravioletrays螺旋体spirochaeta葡萄糖蛋白胨培养基glucosepeptonemedium鞭毛flagellum(复:flagella)主要参考书1、沈萍、范秀容、李广斌,微生物学实验(第三版)北京:高等教育出版社,20012、黄秀梨主编,微生物学实验指导,北京:高等教育出版社,施普林格出版社,19993、杨新美,中国食用菌栽培学,北京:农业出版社,19884、张松,食用菌学,广州;华南理工大学出版社,2000
内容:1.
牛肉膏蛋白陈培养基的配制.
2.
高氏1号培养基的配制.
3.
马丁氏培养基的配制.
二、实验材料和用具牛肉膏、蛋白胨、琼脂、可溶性淀粉、葡萄糖、孟加拉红、链霉素、1mol/LNaOH、lmol/LHCl、KNO3、NaCl、K2HPO4·3H2O、MgSO4·7H2O、FeSO4·7H2O.
试管、三角瓶、烧杯、量筒、玻璃棒、天平、牛角匙、pH试纸、棉花、牛皮纸、记号笔、线绳、纱布、漏斗、漏斗架、胶管、止水夹等.
三、操作步骤(一)牛肉膏蛋白胨培养基的配制牛肉膏蛋白胨培养基是一种应用最广泛和最普通的细菌基础培养基.
其配方如下:牛肉膏3g,蛋白胨10g,Nacl5g,琼脂15~20g,水1000mL,PH7.
4~7.
61.
称药品按实际用量计算后,按配方称取各种药品放入大烧杯中.
牛肉膏可放在小烧杯或表面皿中称量,用热水溶解后倒入大烧杯;也可放在称量纸上称量,随后放入热水中,牛肉膏使与称量纸分离,立即取出纸片.
蛋白胨极易吸潮,故称量时要迅速.
2.
加热溶解在烧杯中加入少于所需要的水量,然后放在石棉网上,小火加热,并用玻棒搅拌,待药品完全溶解后再补充水分至所需量.
若配制固体培养基,则将称好的琼脂放入己溶解的药品中,再加热融化,此过程中,需不断搅拌,以防琼脂糊底或溢出,最后补足所失的水分.
3.
调pH检测培养基的pH,若pH偏酸,可滴加lmol/LNaOH,边加边搅拌,并随时用pH试纸检测,直至达到所需pH范围.
若偏碱,则用lmol/LHCl进行调节.
pH的调节通常放在加琼脂之前.
应注意pH值不要调过头,以免回调而影响培养基内各离子的浓度.
4.
过滤液体培养基可用滤纸过滤,固体培养基可用4层纱布趁热过滤,以利培养的观察.
但是供一般使用的培养基,这步可省略.
5.
分装按实验要求,可将配制的培养基分装入试管或三角瓶内.
分装时可用漏斗以免使培养基沾在管口或瓶口上而造成污染.
分装量:固体培养基约为试管高度的l/5,灭菌后制成斜面.
分装入三角瓶内以不超过其容积的一半为宜.
半固体培养基以试管高度的1/3为宜,灭菌后垂直待凝.
6.
加棉塞试管口和三角瓶口塞上用普通棉花(非脱脂棉)制作的棉塞.
棉塞的形状、大小和松紧度要合适,四周紧贴管壁,不留缝隙,才能起到防止杂菌侵入和有利通气的作用.
要使棉塞总长约3/5塞入试管口或瓶口内,以防棉塞脱落.
有些微生物需要更好的通气,则可用8层纱布制成通气塞.
有时也可用试管帽或塑料塞代替棉塞.
7.
包扎加塞后,将三角瓶的棉塞外包一层牛皮纸或双层报纸,以防灭菌时冷凝水沾湿棉塞.
若培养基分装于试管中,则应以5支或7支在一起,再于棉塞外包一层牛皮纸,用绳扎好.
然后用记号笔注明、培养基名称、组别、日期.
8.
灭菌将上述培养基于121.
3℃湿热灭菌20min.
如因特殊情况不能及时灭菌,则应故人冰箱内暂存.
9.
摆斜面灭菌后,如制斜面,则需趁热将试管口端搁在一根长木条上,并调整斜度,便斜面的长度不超过试管总长的1/2.
10.
无菌检查将灭菌的培养基放入37℃温箱中培养24~48h,无菌生长即可使用,或贮存于冰箱或清洁的橱内,备用.
(二)高氏l号培养基的配制高氏1号培养基是用于分离和培养放线菌的合成培养基.
其配方如下:可溶性淀粉20g,KNO31g,NaCl0.
5g,K2HPO4·3H2O0.
5g,MgSO4·7H2O0.
5g,FeSO4·7H2O0.
01g,琼脂15~20g,水1000mL,pH7.
4~7.
6.
l.
称量和溶解先计算后称量,按用量先称取可溶性淀粉,放入小烧杯中,并用少量冷水将其调成糊状,再加至少于所需水量的水,继续加热,边加热边搅拌,至其完全溶解.
再加入其他成分依次溶解.
对微量成分FeSO4·7H2O可先配成高浓度的贮备液后再加入,方法是先在1000mL中加入1g的FeSO4·7H2O,配成浓度为0.
01g/mL的贮备液,再在1000mL培养基中加入以上贮备液1mL即可.
待所有药品完全溶解后,补充水分到所需的总体积.
如要配制固体培养基,其琼脂溶解过程同牛肉膏蛋白胨培养基配制.
2.
pH调节、分装、包扎及无菌检查同牛肉膏蛋白胨培养基配制.
(三)马丁氏培养基的配制马丁氏培养基是用于分离真菌的选择培养基.
其配方如下:K2HPO41g,MgSO4·7H2O0.
5g,蛋白胨5g,葡萄糖l0g,琼脂15~20g,水1000mL,自然pH.
1.
称量和溶解先计算后称量,按用量称取各成分,并将其溶解在少于所需的水中.
待各成分完全溶解后,补充水分到所需体积.
再将孟加拉红配成1%的水溶液,在1000mL培养液中加入以上孟加拉红溶液3.
3mL,混匀后,加入琼脂加热融化,方法同牛肉膏蛋白胨培养基配制.
2.
分装、包扎、灭菌及无菌检查同牛肉膏蛋白膝培养基配制.
3.
链霉素的加入链霉素受热容易分解,所以临用时,将培养基融化后待温度降至45℃左右时才能加入.
可先将链霉素配成1%的溶液(配好的链霉素溶液保存于-20℃),在100mL培养基中加1%链霉素0.
3mL,使每毫升培养基中合链霉素30μg.
四、注意事项称药品用的牛角匙不要混用,称完药品应及时盖紧瓶盖.
调pH时要小心操作,避免回调.
不同培养基各有配制特点,要注意具体操作.
五、实验报告记录本实验配制培养基的名称、数量,并图解说明其配制过程,指明要点.
六、问题和思考l.
配制培养基有哪几个步骤在操作过程中应注意些什么问题为什么2.
培养基配制完成后,为什么必须立即灭菌若不能及时灭菌应如何处理已灭菌的培养基如何进行无菌检查3.
试设计实验对饮料进行无菌检查.
实验2消毒与灭菌一、干热灭菌(一)目的要求1.
了解干热灭菌的原理和应用范围.
2.
学习干热灭菌的操作技术.
(二)基本原理干热灭菌是利用高温使微生物细胞内的蛋白质凝固变性而达到灭菌的目的.
细胞内的蛋白质凝固性与其本身的含水量有关,在菌体受热时,当环境和细胞内含水量越大,则蛋白蛋凝固就越快,反之含水量越少,凝固缓慢.
因此,与湿热灭菌相比,干热灭菌所需温度要高(160~170℃),时间要长(1~2h),但干热灭菌温度不能超过180℃,否则,包器皿的纸或棉塞就会烧焦,甚至引起燃烧.
干热灭菌使用的电烘箱的结构如图2-1.
图2-1电烘箱的外观和结构A.
外观B.
结构1.
温度计;2.
排气阀;3.
箱体;4.
控温器旋钮;5.
箱门;6.
指示灯;7.
加热开关;8.
温度控制阀;9.
控制室;10.
侧门;11.
工作室;12.
保温室;13.
电热器;14.
散热板;15.
搁板(三)器材培养皿、试管、吸管、电烘箱等.
(四)操作步骤1.
装入待灭菌物品将包好的待灭菌物品(培养皿、试管,吸管等)放入电烘箱内,关好箱门.
物品不要摆得太挤,以免妨碍空气流通,灭菌物品不要接触电烘箱内壁的铁板,以防包装纸烤焦起火.
2.
升温接通电源,拨动开关,打开电烘箱排气孔,旋动恒温调节器至绿灯亮,让温度逐渐上升.
当温度升至100℃时,关闭排气孔.
在升温过程中,如果红灯熄灭,绿灯亮,表示箱内停止加温,此时如果还未达到所需的160—170℃温度,则需转动调节器使红灯再亮,如此反复调节,直至达到所需温度.
3.
恒温当温度升达到160~170℃时,恒温调节器会自动控制调节温度,保持此温度2h.
干热火菌过程.
严防恒温调节的自动控制失灵而造成安全事故.
4.
降温切断电源、自然降温.
5.
开箱取物待电烘箱内温度降到70℃以下后,打开箱门,取出灭菌物品.
电烘箱内温度末降到70℃,切勿自行打开箱门以免骤然降温导致玻璃器皿炸裂.
(五)实验报告思考题l.
在干热灭菌操作过程中应注意哪些问题,为什么2.
为什么干热火菌比湿热灭菌所需要的温度要高,时间要长请设计干热灭菌和湿热灭菌效果比较实验方案.
二高压蒸气灭菌(一)目的要求1.
了解高压蒸气灭菌的基本原理及应用范围.
2.
学习高压蒸气灭菌的操作方法.
(二)基本原理高压蒸气灭菌是将待灭菌的物品放在一个密闭的加压灭菌锅内,通过加热,使灭菌锅隔套间的水沸腾而产生蒸气.
待水蒸气急剧地将锅内的冷空气从排气阀中驱尽,然后关闭排气阀,继续加热,此时由于蒸气不能溢出,而增加了灭菌锅内的压力,从而使沸点增高,得到高于100℃的温度.
导致菌体蛋白质凝固变性而达到灭菌的目的.
在同一温度下,湿热的杀菌效力比干热大.
其原因有三:一是湿热中细菌菌体吸收水分,蛋白质较易凝固,因蛋白质含水量增加,所需凝固温度降低(表2—1),二是湿热的穿透力比干热大(表2—2),三是湿热的蒸气有潜热存在.
1g水在100℃时,由气态变为液态时可放出2.
26kJ(千焦)的热量.
这种潜热,能迅速提高被灭菌物体的温度,从而增加灭菌效力.
表2—1蛋白质含水量与凝固所需温度的关系卵白蛋白含水量/%30分钟内凝固所需温度/℃50562574~801880~9061450160~170在使用高压蒸气灭菌锅灭菌时,灭菌锅内冷空气的排除是否完全极为重要,因为空气的膨胀压大于水蒸气的膨胀压,所以,当水蒸气中含有空气时,在同一压力下,含空气蒸气的温度低于饱和蒸气的温度.
灭菌锅内留有不同分量空气时,压力与温度的关系见(表2—3)表2-2干热温热穿透力及灭菌效果比较透过布层的温度/℃温度/℃时间/h20层10层100层灭菌干热130-1404867270.
5不完全湿热105.
33101101101完全表2—3灭菌锅留有不同分量空气时,压力与温度的关系压力数MpaKg/cm2Ib/in2全部空气排出时的温度/℃2/3空气排出时的温度/℃1/2空气排出时的温度/℃1/3空气排出时的温度/℃空气全不排出时的温度/℃0.
030.
355108.
81009490720.
070.
7010115.
6109105100900.
1010.
515121.
31151121091000.
141.
4020126.
21211181151090.
171.
7525130.
01261241211150.
212.
1030134.
6130128126121现在法定压力单位己不用磅和kg/cm2表示,而是用Pa或bar表示,其换算关系为:1kg/cm2=98066.
5Pa;1Ib/in2=6894.
76Pa.
一般培养基用0.
1Mpa(相当于15Ib/in2或1.
05kg/cm2),121.
5℃,15~30min可达到彻底灭菌的目的.
灭菌的温度及维持的时间随灭菌物品的性质和容量等具体情况而有所改变.
例如含糖培养基用0.
06Mpa(8Ib/in2或0.
59kg/cm2)112.
6℃灭菌,然后以无菌操作手续加入灭菌的糖溶液.
又如盛于试管内的培养基以0.
1Mpa,121.
5℃灭菌20min即可,而盛于大瓶内的培养基最好以0.
1Mpa,122℃灭菌30min.
实验中常用的非自控高压蒸气灭菌锅有卧式(图2-2,A)和手提式(图2—2,B)二种,其结构和工作原理相同,本实验以手提式高压蒸气灭菌锅为例,介绍其使用方法,有关自控高压蒸气灭菌锅(autoclave)的使用可参照厂家说明书.
图2—2A卧式灭菌锅图2—2B手提式灭菌锅1.
安全阀;2.
压力表;3.
放气阀;4.
软管;5.
紧固螺栓;6.
灭菌桶;7.
筛架;8.
水(三)器材牛肉膏蛋白胨培养基,培养皿(6套一包),手提式高压蒸气灭菌锅等.
(四)操作步骤1.
首先将内层锅取出,再向外层锅内加入适量的水,使水面与三角搁架相平为宜.
切勿忘记加水,同时水量不可过少,以防灭菌锅烧干而引起炸裂事故.
2.
放回内层锅,并装入待灭菌物品.
注意不要装得太挤,以免防碍蒸气流通而影响灭菌效果.
三角烧瓶与试管口端均不要与锅壁接触,以免冷凝水淋湿包口的纸而透入棉塞.
3.
加盖,并将盖上的排气软管插入内层锅的排气槽内.
再以两两对称的方式同时旋紧相对的两个螺栓,使螺栓松紧一致,勿使漏气.
4.
用电炉或煤气加热,并同时打开排气阀,使水沸腾以排除锅内的冷空气.
待冷空气完全排尽后,关上排气阀,让锅内的温度随蒸气压力增加到逐渐上升.
当锅内压力升到所需压力时,控制热源,维持压力至所需时间.
本实验用0.
1Mpa,121.
5℃,20min灭菌.
灭菌的主要因素是温度而不是压力.
因此锅内冷空气必须完全排尽后,才能关上排气阀,维持所需压力.
5.
灭菌所需时间到后,切断电源或关闭煤气,让灭菌锅内温度自然下降,当压力表的压力降至"0"时,打开排气阀,旋松螺栓,打开盖子,取出灭菌物品.
压力一定要降到"0"时,才能打开排气阀,开盖取物.
否则就会因锅内压力突然下降,使容器内的培养基由于内外压力不平衡而冲出烧瓶口或试管口,造成棉塞沾染培养基而发生污染,甚至灼伤操作者.
6.
将取出的灭菌培养基,需摆斜面的则摆成斜面,然后放入37℃温箱培养24h,经检查若无杂菌生长,即可待用.
(五)实验报告l.
结果检查培养基灭菌是否彻底.
2.
思考题(1)高压蒸气灭菌开始之前,为什么要将锅内冷空气排尽灭菌完毕后,为什么待压力降低"0"时才能打开排气阀,开盖取物(2)在使用高压蒸气灭菌锅灭菌时,怎样杜绝一切不安全的因素(3)灭菌在微生物实验操作中有何重要意义(4)黑曲霉的孢子与芽孢杆菌的孢子对热的抗性哪个最强为什么三、紫外线灭菌(一)目的要求了解紫外线灭菌的原理和方法(二)基本原理紫外线灭菌是用紫外线灯进行的.
波长为200~300nm的紫外线都有杀菌能力,其中以260nm的杀菌力最强.
在波长一定的条件下,紫外线的杀菌效率与强度和时间的乘积成正比.
紫外线杀菌机理主要是因为它诱导了胸腺嘧啶二聚体的形成和DNA链的交联,从而抑制了DNA的复制.
另一方面,由于辐射能使空气中的氧电离成[O],再使O2氧化生成臭氧(O3)或使水(H2O)氧化生成过氧化氢(H2O2).
O3和H2O2均有杀菌作用.
紫外线穿透力不大,所以,只适用于无菌室,接种箱,手术室内的空气及物体表面的灭菌.
紫外线灯距照射物以不超过1.
2m为宜.
此外,为了加强紫外线灭菌效果,在打开紫外灯以前;可在无菌室内(或接种箱内)喷洒3%~5%石炭酸溶液,一方面使空气中附着有微生物的尘埃降落,另一方面也可以杀死一部分细菌.
无菌室内的桌面、凳子可用2%~3%的来苏尔擦洗,然后再开紫外灯照射,即可增强杀菌效果,达到灭菌目的.
(三)器材1.
培养基牛肉膏蛋白胨平板.
2.
溶液或试剂3%~5%石炭酸或2%~3%来苏尔溶液.
3.
仪器或其他用具紫外线灯.
(四)操作步骤l.
单用紫外线照射(1)在无菌室内或在接种箱内打开紫外线灯开关,照射30min,将开关关闭.
(2)将牛肉膏蛋白胨平板盖打开15min,然后盖上皿盖.
置37℃培养24h.
共做三套.
(3)检查每个平板上生长的菌落数.
如果不超过4个,说明灭菌效果良好,否则,需延长照射时间或同时加强其他措施.
2.
化学消毒剂与紫外线照射结合使用(1)在无菌室内,先喷洒3%~5%的石炭酸溶液,再用紫外线灯照射15imn.
(2)无菌室内的桌面,凳子用2%~3%来苏尔擦洗,再打开紫外线灯照射15min.
(3)检查灭菌效果[方法同"单用紫外线照射"(3)].
因紫外线对眼结膜及视神经有损伤作用,对皮肤有刺激作用,故不能直视紫外线灯光下工作.
(五)实验报告1.
结果记录两种灭菌效果于下表中处理方法平板菌落数123灭菌效果比较紫外线照射3%~5%石炭酸+紫外线照射2%~3%来苏尔+紫外线照射2.
思考题.
(1)细菌营养体细胞和细菌芽孢对紫外线和的抵抗力会一样吗,为什么(2)你知道紫外线灯管是用什么玻璃制作的为什么不用普通灯用玻璃(3)在紫外灯下观察实验结果时,为什么要隔一块普通玻璃四微孔滤膜过滤除菌(一)目的要求1.
了解过滤除菌的原理.
2.
掌握微孔滤膜过滤除菌的方法.
(二)基本原理过滤除菌是通过机械作用滤去液体或气体中细菌的方法.
根据不同的需要选用不同的滤器和滤板材料.
微孔滤膜过滤器是由上下二个分别具有出口和入口连接装置的塑料盖盒组成,出口处可连接针头,人口处可连接针筒,使用时将滤膜装入两塑料盖盒之间,旋紧盖盒,当溶液从针筒注入滤器时,此滤器将各种微生物阻留在微孔滤膜上面,从而达到除菌的目的.
根据待除菌溶液量的多少,可选用不同大小的滤器.
此法除菌的最大优点是可以不破坏溶液中各种物质的化学成分,但由于滤量有限,所以一般只适用于实验室中小量溶液的过滤除菌.
(三)器材1.
培养基2%的葡萄糖溶液,肉汤蛋白胨平板.
2.
仪器或其他用具注射器,微孔滤膜过滤器,0.
22μm滤膜,无菌试管,镊子,玻璃刮棒.
(四)操作步骤l.
组装、灭菌将0.
22μm孔径的滤膜装入清洗干净的塑料滤器中,旋紧压平,包装灭菌后待用(0.
lMPa,121.
5℃灭菌20min).
2.
连接将灭菌滤器的入口在无菌条件下,以无菌操作方式连接于装有待滤溶液(2%葡萄糖溶液)的注射器上,将针头与出口处连接并插入带橡皮塞的无菌试管中.
见图2—3.
3.
压滤将注射器中的待滤溶液加压缓缓挤入过滤到无菌试管中,滤毕,将针头拨出.
压滤时,用力要适当,不可太猛太快,以免细菌被挤压通过淀胶.
4.
无菌检查无菌操作吸取除菌滤液0.
1ml于肉汤蛋白胨平板上,涂布均匀,置37℃温室中培养24h,检查是否有菌生长.
5.
清洗弃去塑料滤器上的微孔滤膜,将塑料滤器清洗干净,并换上一张新的微孔滤膜,组装包扎,再经无菌后使用.
整个过程应在无菌条件下严格无菌操作,以防污染,过滤时应避免各连接处出现渗漏现象.
(五)实验报告l.
结果记录无菌检查结果2.
思考题(1)你做的过滤除菌实验效果如何如果经培养检查有杂菌生长,你认为是什么原因造成的(2)如果你需要配制一种含有某抗生素的牛肉膏蛋白胨培养基,其抗生素的终浓度(或工作浓度)为50μg/ml,你将如何操作(3)过滤除菌应注意哪些问题实验3土壤的稀释分离、纯化微生物及无菌操作技术一、实验目的和内容目的:学习从土壤中分离微生物的方法,学习无菌操作技术.
内容:l.
用稀释法分离细菌、放线菌和霉菌.
2.
用平板划线方法分离微生物.
3.
学习斜面接种及穿刺接种等无菌操作技术.
二、实验材料和用具金黄色葡萄球菌(Staphylococcusaureus)和普通变形菌(Proteusvulgaris)斜面菌种.
已灭菌的牛肉膏、高氏1号、土豆蔗糖固体培养基各1瓶,49.
5mL无菌水(带玻璃珠)1瓶,4.
5mL无菌水6管,80%乳酸,10%酚液,95%乙醇.
无菌培养皿12套,1mL无菌移液管10支,土壤样品及天平、称量纸、药勺、试管架、玻璃铅笔、橡皮头(用75%乙醇浸泡)、玻璃刮.
三、操作步骤(一)土壤稀释分离1.
取土壤取表层以下5—10cm处的土样,放入无菌的袋中备用,或放在4℃冰箱中暂存.
2.
制备稀释液(要无菌操作)(1)制备土壤悬液:称土样0.
5g,迅速倒入带玻璃珠的49.
5mL无菌水瓶中(玻璃珠用量以充满瓶底力最好),振荡5~10min,使土样充分打散,即成为10-2的土壤悬液.
(2)稀释:用无菌移液管吸10-2的土壤悬液0.
5mL,放入4.
5mL无菌水中即为10-3稀释液,如此重复,可依次制成10-3~10-8的稀释液(图3-1).
注意:操作时管尖不能接触液面,每一个稀释度换用一支移液管,每次吸入土液后,要将移液管插入液面,吹吸3次,每次吸上的液面要高于前一次,以减少稀释中的误差.
]图3—1稀释法分离土壤微生物操作过程图解3.
混菌法测定菌落数的方法(1)细菌:取10-7、10-6两管稀释液各1mL,分别接人相应标号的平皿中,每个稀释度接两个平皿.
然后取冷却至50℃的牛肉膏琼脂培养基,分别倒入以上培养皿中(装量以铺满皿底高1.
5~2mm为宜),迅速轻轻摇动平皿,使菌液与培养基充分混匀,但不沾湿皿的边缘,待琼脂凝固即成细菌平板.
倒平板时要注意无菌操作,见图3-2.
图3—2倒平板的方法(2)放线菌:取10-5、10-4两管稀释液,在每管中加入10%酚液5~6滴,摇匀,静置片刻,然后分别从两管中吸出1mL加入相应标号的平皿中,选用高氏1号培养基,用与细菌相同的方法倒入平皿中,便可制成放线菌平板.
(3)霉菌:取10-2、10-3两管稀释各1mL,分别接入相应标号的平皿中,每个稀释度接两个平皿.
在融化的土豆蔗糖培养基中,每100mL加入灭菌的乳酸1mL,轻轻摇匀,然后用与细菌相同的方法倒入平皿中,便可制成霉菌的平板.
4.
培养将接种好的细菌、放线菌、霉菌平板倒置,即皿盖朝下放置,于28~30℃中恒温培养,细菌培养1~2d,放线菌培养5~7d,霉菌培养3~5d.
观察生长的菌落,用于进一步纯化分离或直接转接斜面.
(二)平板制作及划线分离方法.
1.
倒平板按无菌操作要求,在火焰旁操作(图3—2),做法如3(1).
2.
划线分离使用接种环,从待纯化的菌落或待分离的斜面菌种只沾取少量菌样,在相应培养基平板中划线分离,划线的方法多样,目的是获得单个菌落,主要方法参见图3—3.
图3—3平板划线方法示意图A.
划线分离操作;B.
用于稀释液中,可连接划线;C.
用于较浓的菌样,分数次划线,每次划线后要烧接种环,然后再划下一区.
3.
培养方法同"土壤稀释分离".
(三)斜面接种和穿刺接种1.
斜面接种(1)取新鲜固体斜面培养基,分别做好标记(写上菌名、接种日期、接种人等),然后用无菌操作方法,把待接菌种接入以上新鲜培养基斜面上.
(2)接种的方法是,用接种环沾取少量待接菌种,然后在新鲜斜面上"之"字形划线,方向是从下部开始,一直划至上部(图3—4A).
注意划线要轻,不可把培养基划破.
图3—4斜面接种(A)及穿刺接种(B)示意图(3)接种后30℃恒温培养,细菌培养48h,放线菌、霉菌培养至孢子成熟方可取出保存.
2.
穿刺接种(1)取两支新鲜半固体牛肉膏蛋白胨柱状培养基,做好标记(写上菌名)、接种日期,接种人等).
(2)接种的方法是,用接种针沾取少量待接菌种,然后从柱状培养基的中心穿入其底部(但不要穿透),然后沿原刺入路线抽出接种针,注意接种针不要移动.
(3)接种后30℃恒温培养,24h后观察,比较两种菌的生长结果.
四、注意事项1.
一般土壤中,细菌最多,放线菌及霉菌次之,而酵母菌主要见于果园及菜园土壤中,故从土壤中分离细菌时,要取较高的稀释度,否则菌落连成一片不能计数.
2.
在土壤稀释分离操作中,每稀释10倍,最好更换一次移液管,使计数准确.
3.
放线菌的培养时间较长,故制平板的培养基用量可适当增多.
五、实验报告1.
记录土壤稀释分离结果,并计算出每克土壤中的细菌、放线菌和霉菌的数量.
计算方法:选择长出菌落数30~300之间的培养皿进行计数,按以下公式:总菌数/g=同一稀释度几次重复的菌落平均数*稀释倍数2.
分别记录平板划线、斜面接种的结果,并自我评价.
3.
比较两种细菌穿刺接种的结果,并进行分析.
七、问题和思考1.
在测定土壤微生物含量中,除混菌法外还可用什么方法2.
试设计实验,从土壤中分离出酵母菌,并进行计数.
实验4微生物菌落的观察一、实验目的和内容目的:识别细菌、酵母菌、放线菌和霉菌四大类微生物的菌落特征.
内容:1.
观察已知菌的菌落的形态、大小、色泽、透明度、致密度和边缘等特征.
2.
根据菌落的形态特征判断未知菌的类别.
二、实验材料和用具大肠杆菌(E.
coli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)、粘红酵母(Rhodotorulagracitis)、热带假丝酵母(Candidatropicalis)、细黄链霉菌(Streptomycesmicroflavus,又称"5406"抗生菌)、灰色链霉菌(Streptomycesgriseus)、黑曲霉(Aspergillusniger)、产黄青霉(Penicilliumchrysogenum)、球孢白伍菌(Beauveriabassiana)等细菌的斜面菌种.
牛肉膏蛋白胨培养基、马铃薯培养基、高氏1号培养基、无菌水.
接种环、接种针、酒精灯、无菌培养皿多套、电热恒温箱.
三、操作步骤(一)制备已知菌的单菌落1.
制备平板将已融化的无菌培养基待冷却至50℃左右,分别制备牛肉膏蛋白胨培养基平板、马铃薯蔗糖培养基平板和高氏1号培养基平板各一皿.
2.
制备菌悬液或孢子悬液在培养好的斜面菌种管内加入5mL无菌水,制成菌悬液后备用.
3.
制备单菌落通过平板划线法获得细菌、酵母菌和放线菌的单菌落.
用三点接种法获得霉菌的单菌落.
细菌于37℃恒温培养24~48h,酵母菌于28℃培养2~3d,霉菌和放线菌置28℃培养5~7d,待长成菌落后,仔细观察四大类微生物菌落的形态特征,并将观察结果记录于表4-1中.
(二)制备未知菌落l.
倒平板2.
接种可用弹土法接种,其要点为:采集校园土壤,待风干磨碎后,可将细土撒在无菌的硬板纸表面,先弹去纸面浮土,然后打开皿盖,便含土的纸面对着平板培养基的表面,用手指在硬板纸背面轻轻一弹即可接种上各种微生物.
3.
培养将牛肉膏蛋白胨培养基平板倒置于37℃培养箱中恒温培养2~3d,将马铃薯蔗糖培养基倒置于28℃培养箱中恒温培养3~5d,即可获得未知菌的单菌落.
4.
编号从培养好的未知平板中,挑选8个不同的单菌落,逐个编号,根据菌落识别要点区分未知菌落类群,并将判断结果填入表4~2中.
(三)直接观察菌落直接用实验3中的"土壤稀释分离"获得的单菌落进行观察识别,并将结果填入表4-2中.
四、注意事项观察菌落特点时,要选择分离得很开的单个较大菌落;已知菌落和未知菌落要编好号,请勿随意移动开盖,以免搞混菌号.
五、实验报告1.
已知菌落的形态特征记录于表4~1中.
2.
将未知菌落的辨别结果记录于表4~2中.
七、问题和思考1.
试比较细菌、放线菌、酵母菌和霉菌菌落形态的差异2.
设计一个实验,检测实验室空气环境中的微生物类别表4—1已知菌菌落的形态辩别要点菌落描述湿干颜色微类生物数菌名厚薄大小松密大小表面边缘隆起形状正面反面水溶性色素透明度大肠杆菌金黄色葡萄球菌细菌枯草杆菌酿酒酵母粘红酵母酵母菌热带假丝酵母细黄链霉菌放线菌灰色链霉菌产黄青霉黑曲霉霉菌球孢白僵菌表4—2未知菌菌落的形态湿干菌落描述颜色判断结果菌落号厚薄大小松密大小表面边缘隆起形状正面反面水溶性色素透明度1212345678注:四大类微生物菌落的识别要点如下:大而扁平…………小小而扁平……细菌大而扁平……湿润:正反面颜色一致大大而隆起……酵母菌小小而致密大而致密……菌落干燥,正反面,中央与边缘颜色不一致大大而疏松……霉菌实验5显微镜油浸系物镜的使用一、实验目的和内容目的:复习显微镜低倍镜和高倍镜的使用技术,了解油浸系物镜的基本原理,掌握油浸系物镜的使用方法.
内容:1.
学习油浸系物镜的使用方法.
2.
用油镜观察枯草芽孢杆菌和金黄色葡萄球菌染色装片.
二、实验材料和用具枯草芽孢杆菌(Bacillussubitilis)、金黄色葡萄球菌(Staphylococcusaureus)的染色装片.
香柏油、二甲苯、显微镜、擦镜纸.
三、操作步骤(一)观察前的准备1.
将显微镜置于平稳的实验台上,镜座距实验台边沿约为4cm.
坐正,练习用左眼观察.
2.
调节光源:将低倍物镜转到工作位置,把光圈完全打开,聚光器升至与载物台相距约1mm左右.
转动反光镜采集光源,光线较强的天然光源宜用平面镜,光线较弱的天然光源或人工光源宜用凹面镜,对光至视野内均匀明亮为止.
观察染色装片时,光线宜强;观察末染色装片时,光线不宜太强.
(二)低倍镜观察染色装片首先上升镜简,将枯草芽孢杆菌染色装片置于载物台上,用标本夹夹住,将观察位置移至物镜正下方,物镜降至距装片0.
5cm处,适当缩小光圈然后两眼从目镜观察,转动粗调节器使物镜逐渐上升(或使镜台下降)至发现物像时,改用细调节器调节到物像清楚为止.
移动装片,把合适的观察部位移至视野中心.
(三)高倍镜观察眼睛离开目镜从侧面观察,旋转转换器,将高倍镜转至正下方,注意避免镜头与玻片相懂.
再由目镜观察,仔细调节光圈,使光线的明亮度适宜.
用细调节器校正焦距使物镜清晰为止.
将最适宜观察部位移至视野中心,绘图.
不要移动装片位置,准备用油镜观察.
(四)油镜观察1.
提起镜筒约2cm,将油镜转至正下方.
在玻片标本的镜检部位(镜头的正下方)滴一滴香柏油.
2.
从侧面注视,小心慢慢降下镜筒,使油镜浸在油中至油圈不扩大为止,镜头几乎与装片接触,但不可压及装片,以免压碎玻片,损坏镜头.
3.
将光线调亮,左眼从目镜观察,用粗调节器将镜筒徐徐上升(切忌反方向旋转),当视野中有物像出现时,再用细调节器校正焦距.
如因镜头下降未到位或镜头上升太快末找到物像,必须再从侧面观察,将油镜降下,重复操作直至物像看清为止.
仔细观察并绘图.
4.
再次观察提起镜筒,换上金黄色葡萄球菌染色装片,依次用低倍镜、高倍镜和油镜观察,绘图.
重复观察时可比第一次少加香柏油.
(五)镜检完毕后的工作1.
移开物镜镜头.
2.
取出装片.
3.
清洁油镜,油镜使用完毕后,须用擦镜纸擦去镜头上的香柏油,再用擦镜纸沾少许二甲苯擦掉残留的香柏油,最后再用干净的擦镜纸擦干残留的二甲苯.
4.
擦净显微镜,将各部分还原.
将接物镜呈"八"字形降下,不可使其正对聚光器,同时降下聚光器,转动反光镜使其镜面垂直于镜座.
最后套上镜罩,对号放入镜箱中,置阴凉干燥处存放.
四、注意事项1.
使用油镜必须按先用低倍镜和高倍镜观察,再用油镜观察2.
下降镜头时,一定要从侧面注视,切忌用眼睛对着目镜,边观察边下降镜头的错误操作,以免压碎玻片而损坏镜头.
3.
使用二甲苯擦镜头时,注意二甲苯不能过多,以防溶解固定透镜的树脂.
4.
注意保持显微镜的洁净,对金属部分要用软布擦拭,擦镜头必须用擦镜纸,切勿用手或用普通布、纸等,以免损坏镜头.
五、实验报告分别绘出在高倍镜和油镜下观察到的枯草芽孢杆菌及金黄色葡萄球菌的形态,注明物镜放大倍数和总放大率.
六、问题和思考1.
用油镜便于观察细菌的依据是什么2.
使用油镜应特别注意哪些问题3.
当物镜从低倍镜转到高倍镜和油镜时,对照明度有何要求应如何调节油镜的基本原理(一)油镜头的辨认油镜头上常刻有OI(oilimmersion)或HI(homogeneneousimmersion)字样,有的还刻有一圈红线或黑线标记,在低倍物镜、高倍物镜和油镜3物镜中,油镜的放大倍数和数值孔径(numericalaperture)最大,而工作距离最短(图5—1)图5—1显微镜物镜参数示意图(二)显微镜的分辨率显微镜性能的优劣不单是看它的总放大倍数,更重要的是看它分辩率的大小.
分辨率是指显微镜能分辨出物体两点间最小距离(D)的能力.
D值愈小表明分辨率愈高.
D值与光线的波长(λ)成正比,与物镜的数值孔径(NA)成反比.
从上式可看出,缩短光波长和增大数值孔径都可提高分辨率.
数值孔径指光线投射到物镜上的最大角度(称镜口角,α)的一半正弦与介质折射率(n)的乘积;影响数值孔径大小的因数,一是镜口角,二是介质的折射率.
当镜与装片之间的介质为空气时,由于空气(n=1.
52)的折射率不同,光线会发生折射,不仅使进入物镜的光线减少,降低了视野的照明度,而且会减少镜口角(图5—2A).
当以香柏油(n=1.
515)为介质时,由于它的折射率与玻璃相近,光线经过载玻片后可直接通过香柏油进入物镜而不发生折射(图5—2B),不仅增加了视野的照明度,更重要的是通过增加数值孔径达到提高分辨率的目的.
可见光的波长平均为0.
55μm.
当使用数值孔径为0.
65的高倍镜时,它能辨别两点之间的距离为0.
42μm;而使用数值孔径为1.
25的油镜时,能辨别两点之间的距离则为0.
22μm.
NAD2λ=2sinα*=nNA图5—2介质为空气(A)与介质为香柏油(B)时光线通过的比较实验6细菌形态的观察一、实验目的和内容目的:巩固油镜的使用;掌握细菌形态观察的基本方法,了解细菌的基本形态.
内容:1.
观察细菌的基本形态染色装片.
2.
观察枯草芽孢杆菌活菌.
3.
观察细菌细胞结构的染色装片.
二、实验材料和用具溶血链球菌(Streptococcushaemolyticus)、棒杆菌(Corymebacterium)、螺菌(Spirillum)、浮游球衣菌(Sphaerotilusnatans)、巨大芽孢杆菌(Bacillusmegaterium)、苏云金芽孢杆菌(Bacillusthuringiensis)、普通变形菌(Proteusvulgaris)、丙酮丁醇梭菌(Clostridumacetotylicum)、褐球固氮菌(Azotobacterchroococcum)等细菌的染色装片,枯草芽泡杆菌(Bacillussubis)的斜面菌种.
香柏油、二甲苯、无菌水;显微镜、擦镜纸、接种环、酒精灯、载玻片、盖玻片、吸水纸、小滴管.
三、操作步骤(一)观察细菌的基本形态用低倍镜、高倍镜和油镜观察溶血链球菌、棒杆菌、螺菌、浮游球衣菌的染色装片,并分别在油镜下绘图.
(二)观察细菌的细胞结构用低倍镜、高倍镜和油镜观察巨大芽孢杆菌(示细胞壁)、巨大芽孢杆菌(示异染粒)、苏云金芽孢杆菌(示伴胞晶体)、普通变形菌(示鞭毛)、丙酮丁醇梭菌(示芽孢)、褐球固氮菌(示荚膜)等细菌的染色装片,并分别在油镜下绘图.
(三)观察枯草杆菌活菌,常用压滴法观察.
1.
将洁净无油腻的载片放于自己右边前方,在中央放一小滴无菌水.
2.
将酒精灯放于自己正前方,点燃.
3.
用无菌操作方法从枯草芽孢杆菌斜面中沾取少量菌体,与载片上的水滴充分混匀,把接种环上残留的菌体杀灭后,放回试管架.
4.
用镊子夹一洁净的盖玻片,使其一边先接触菌液,然后将整个盖玻片慢慢放下,注意不要产生气泡.
如菌液过多,可用吸水纸适当吸去一部分.
5.
先用低倍镜然后转用高倍镜观察,观察时光线要适当调暗些.
四、注意事项1.
注意擦镜头时,只能用擦镜纸.
2,观察完毕,必须将镜筒上升,才能取下装片,放入另一装片后,要按使用油镜要求,重新操作,不能在油镜下直接取下和替换装片,切记!
3.
无菌操作过程中,接种环灭菌后不能触及其他物品,挑菌不能过多.
五、实验报告(一)绘图l.
给出你所观察到的几种细菌的个体形态视野图.
2.
给出你所观察到的细菌细胞结构视野图,并注明各部分.
(二)试指出在制备活菌装片时,应注意什么问题七、问题和思考1.
用明视野显微镜观察细菌的形态时,你认为用染色装片好,还是用非染色的活体装片好,为什么观察活体装片与染色装片,光线调节各有什么不同2.
无菌操作过程中,可否将棉塞放在桌面上为什么3试设计一个准备本实验的工作方案.
实验7细菌单染色法及口腔微生物的观察一、实验目的和内容目的:巩固无菌操作技术,掌握细菌的涂片和单染色技术,了解口腔中的微生物及其观察方法.
内容:1.
学习细菌单染色操作技术.
2.
用单染色法或负染色法观察口腔中的微生物.
二、实验材料和用具大肠杆菌(E.
coli)、金黄色葡萄球菌(Staphylocosccusaureus)的斜面菌种.
吕氏美蓝染色液、石炭酸复红染色液、黑色素液或碳素墨水、香柏油、二甲苯、无菌水;显微镜、擦镜纸、接种环、酒精灯、载玻片、吸水纸、无菌牙签.
三、操作步骤(一)单染色法1.
涂片在洁净无脂的载玻片中央滴一小滴无菌水,用无菌操作方法从菌种斜面挑取少量菌体与水滴充分混匀,涂成薄膜,涂布面积约1~1.
5cm2(图7—1A、B).
2.
干燥将涂片于室温中自然干燥.
3.
固定手扶载片一端,使涂菌的一面向上,将载片通过微火2~3次.
在火上固定时,用手摸涂片反面,以不烫手为宜.
不能将载片在火上烤,否则细菌形态毁坏(图7—1C).
4.
染色将涂片置于水平位置,滴加染色液覆盖于涂菌处,染色约2min(图7—1D)5.
水洗倾去染色液,斜置载片,用自来水的细水流由载片上端流下,不得直接冲在涂菌处,直洗至从载片上流下的水中无染色液的颜色为止(图7—1E).
6.
干燥自然晾干或用吸水纸轻轻地吸干,注意不要擦掉菌体(图7—1F).
7.
待标本完全干燥后,先用低倍镜和高倍镜观察,将典型部位移至视野中央,再用油镜观察.
图7—1单染色的方法(二)口腔微生物的观察1.
单染色法(1)在洁净无油腻的载片中央滴一小滴无菌水,用牙签取牙垢少许与水滴充分混匀,涂成薄膜.
(2)将涂片于室温中自然干燥后,按上面单染色法的步骤,进行固定、染色、水洗,干燥后镜检.
2.
负染色法(1)在洁净无油腻的载片的一端滴一小滴无菌水,用牙签取牙垢少许与水滴充分混匀,然后加少许黑色素溶液,充分混匀.
(2)另取一载片将其边缘放在含菌载片的一端,然后推向另一端,则含菌载片上的混合液被推成薄膜.
(3)于室温中自然干燥.
(4)镜检:将光线调亮,先用低倍镜观察,再用高倍镜观察.
四、注意事项载玻片要洁净无脂,否则菌液涂不开.
涂片时,滴水不要过多,挑菌量宜少,菌膜宜薄.
五、实验报告(一)绘图1.
单染色后观察到的大肠杆菌和金黄色葡萄球菌的形态图.
2.
你所观察到的口腔微生物的形态图,并注明使用的染色方法,菌体和背景的颜色.
(二)单染色法和负染色法操作要点.
七、问题和思考1.
涂片在染色前为什么要先进行固定固定时应注意什么问题2.
制备染色装片时应注意哪些事项,为什么制片为什么要完全干燥后才能用油镜观察3.
你知道口腔中通常存在哪些微生物吗如何进行区分实验8细菌的革兰氏染色目的:初步掌握细菌涂片方法及革兰氏染色法步骤.
内容:1.
制作细菌染色装片.
2.
进行革兰氏染色法操作.
二、实验材料和用具苏云金杆菌或金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(E.
coli)菌液,待测菌菌液1~2种.
革兰氏染色液(结晶紫染液、卢戈氏碘液、95%乙醇、石炭酸复红液等)、香柏油、二甲苯;显微镜、擦镜纸、接种环、载玻片、吸水纸、试管、小滴管、酒精灯.
三、操作步骤(一)制片1.
涂菌用无菌操作方法从试管中沾取菌液一环,用接种环在洁净无脂的载玻片上做一薄而均匀、直径约lcm的菌膜.
涂菌后将接种环火焰灭菌.
2.
干燥于空气中自然干燥.
亦可把玻片置于火焰上部略加温加速干燥(温度不宜过高).
3.
固定目的是杀死细菌并使细菌粘附在玻片上,便于染料着色,常用加热法,即将细菌涂片膜向上,通过火焰3次,以热而不烫为宜,防止菌体烧焦、变形.
此制片可用于染色.
(二)染色l.
初染于制片上滴加结晶紫染液,染lmin后,用水洗去剩余染料.
2.
媒染滴加卢戈氏碘液,lmin后水洗.
3.
脱色滴加95%乙醇脱色,摇动玻片至紫色不再为乙醇脱退为止(根据涂片之厚薄需时30s至lmin),水洗.
4.
复染滴加石炭酸复红液复染lmin,水洗.
5.
滤纸吸干,油镜镜检.
(三)结果革兰氏阳性菌染成蓝紫色,革兰氏阴性菌染成淡红色.
(四)检测未知菌用以上方法对未知菌进行革兰氏染色,并绘图、记录染色结果.
四、注意事项1.
涂片务求均匀,切忌过厚.
2.
在染色过程中,不可使染液干涸.
3.
脱色时间十分重要,过长,则脱色过度,会使阳性菌被染成阴性菌;脱色不够,则会使阴性菌被染成阳性菌.
4.
老龄菌因体内核酸减少,会便阳性菌被染成阴性菌,故不能选用.
五、实验报吉(一)绘图1.
大肠杆菌革兰氏染色视野图.
2.
金黄色葡萄球菌或苏云金杆菌革兰氏染色视野图.
(二)记录革兰氏染色法法步骤,并进行结果分析.
(三)未知菌的检测结果.
六、问题和思考1.
涂片后为什么要进行固定固定时应注意什么2.
什么是革兰氏染色法染色过程应注意什么3.
试分析革兰氏染色法在细菌分类中的意义.
实验9细菌鞭毛染色及其运动的观察一、实验目的和内容目的:了解细菌鞭毛染色的原理,掌握鞭毛染色法;学习观察细菌运动的方法.
内容:1.
细菌的鞭毛染色法.
2.
用压滴法观察细菌的运动.
3.
用悬滴法观察细菌的运动.
二、实验材料和用具普通变形菌(Proteusvulgaris)、金黄色葡萄球菌(Staphylococcusaureus).
牛肉膏蛋白胨培养基斜面、鞭毛染色液、0.
01%美蓝水溶液、香柏油、二甲苯、无菌水、凡士林;显微镜、擦镜纸、接种环、酒精灯、载玻片、凹载玻片、盖玻片、镊子、细玻棒、吸水纸.
三、操作步骤(一)细菌鞭毛染色1.
活化菌种将保存的变形菌在新制备的普通牛肉膏蛋白胨斜面培养基上连续移种2~3次,每次于30℃培养10~15h.
活化后菌种备用.
2.
制片在干净载玻片的一端滴一滴蒸馏水,用无菌操作法,以接种环从活化菌种中取少许菌苔(注意不要带培养基),在载玻片的水滴中轻沾几下.
将载玻片稍倾斜,使菌液随水滴缓缓流到另一端,然后平放,于空气中干燥.
3.
染色(1)滴加鞭毛染色液A液,染3~5min.
(2)用蒸馏水充分洗净A液,使背景清洁.
(3)将残水沥干或用B液冲去残水.
(4)滴加B液,在微火上加热使微冒蒸汽,并随时补充染料以免干涸,染30~60S.
(5)待冷却后,用蒸馏水轻轻冲洗干净,自然干燥或滤纸吸干.
4.
镜检先用低倍镜和高倍镜找到典型区域,然后用油镜观察.
菌体为深褐色,鞭毛为褐色.
注意观察鞭毛着生位置(镜检时应多找几个视野,有时只在部分涂片上染出鞭毛).
(二)细菌运动的观察1.
压滴法(1)制备菌液:从幼龄菌斜面上,挑数环菌放在装有1~2mL无菌水的试管中,制成轻度混浊的菌悬液.
(2)取2~3环稀释菌液于洁净载玻片中央,再加入一环0.
01%的美蓝水溶液,混匀.
(3)用镊子夹一洁净的盖玻片,先使其一边接触菌液,然后慢慢地放下盖玻片,这样可防止产生气泡.
(4)镜检:将光线适当调暗,先用低倍镜找到观察部位,再用高倍镜观察.
要区分细菌鞭毛运动和布朗运动,后者只是在原处左右摆动,细菌细胞间有明显位移者,才能判定为有运动性.
2.
悬滴法(1)取洁净盖玻片,在四周涂少许凡士林.
(2)在盖玻片中央滴一小滴菌液(图9—1A)(3)将凹玻片的凹窝向下,使凹窝中心对准盖玻片中央的菌液(图9-1B),轻轻地盖在盖玻片上,便凹玻片与盖玻片粘在一起(注意液滴不得与凹玻片接触).
(4)小心将玻片翻转过来,使菌液正好悬在窝的中央.
再用火柴棒轻压盖玻片四周使封闭,以防菌液干燥.
(5)镜检:将光线适当调暗,先用低倍镜找到悬滴的边缘后(图9—1D),再将菌液移至视野中央,换用高倍镜观察,注意细菌是如何运动的,它与分子布朗运动的不同.
图9—1悬滴标本的制备四、注意事项1.
鞭毛染色液最好当日配置当日用,次日使用则鞭毛染色浅,观察效果差.
染色时一定要充分洗净A液后再加B液,否则背景不清晰.
2.
观察细菌的运动,载玻片和盖玻片都要洁净无油,否则会影响细菌的运动.
有些细菌,温度太低时不能运动.
五、实验报告1.
绘出你所观察到的细菌的形态及鞭毛着生情况.
2.
试描述你所观察的细菌有无运动性,是如何运动的六、问题和思考1.
鞭毛染色的菌种为什么要先连续传几代,并且要采用幼龄菌种2.
根据你的实验体会,哪些因素影响鞭毛染色的效果如何控制3.
试设计一实验,如何鉴别某种细菌是否能运动,是否有鞭毛,其鞭毛的着生位置.
实验10细菌芽孢、荚膜的染色及观察一、实验目的和内容目的:掌握细菌的芽孢及荚膜染色方法.
内容:1.
细菌的芽泡染色.
2.
细菌的荚膜染色.
二、实验材料和用具枯草芽孢杆菌、褐球固氮菌的斜面菌种.
二甲苯、香柏油、蒸馏水、5%孔雀绿水溶液、0.
5%沙黄水溶液(或0.
05%碱性复红)、绘图墨水(用滤纸过滤后备用)、95%乙醇、石炭酸复红染液;显微镜、接种环、酒精灯、载玻片、盖玻片、小试管(l*6.
5cm)、烧杯(300mL)、滴管、试管夹、擦镜纸、吸水纸.
三、操作步骤(一)芽孢染色法1.
方法1(1)取37℃培养18~24h的枯草芽孢杆菌作涂片,并干燥,固定(参见"细胞单染色法").
(2)于涂片上滴人3~5滴5%孔雀绿水溶液.
(3)用试管夹夹住载玻片在火焰上用微火加热,自载玻片上出现蒸汽时,开始计算时间约4~5min.
加热过程中切勿使染料蒸干,必要时可添加少许染料.
(4)倾去染液,待玻片冷却后,用自来水冲洗至孔雀绿不再褪色为止.
(5)用0.
5%沙黄水溶液(或0.
05%碱性复红)复染lmin,水洗.
(6)制片干燥后用油镜观察.
芽孢呈绿色,菌体红色.
2.
方法2(1)加1~2滴自来水于小试管中,用接种环从斜面上挑取2~3环培养18~24h的枯草芽孢杆菌菌苔于试管中,并充分混匀打散,制成浓稠的菌液.
(2)加5%孔雀绿水溶液2~3滴于小试管中,用接种环搅拌使染料与菌液充分混合.
(3)将此试管浸于沸水浴(烧杯)中,加热15~20min.
(4)用接种环从试管底部挑数环菌于洁净的载玻片上,并涂成薄膜,将涂片通过微火3次固定.
(5)水洗,至流出的水中无孔雀绿颜色为止.
(6)加沙黄水溶液,染2~3min后,倾去染液,不用水洗,直接用吸水纸吸干.
(7)干燥后用油镜观察.
芽孢绿色,菌体红色.
(二)荚膜染色法1.
石炭酸复红染色(1)取培养了72h的褐球固氮菌制成涂片,自然干燥(不可用火焰烘干).
(2)滴入1~2滴95%乙醇固定(不可加热固定).
(3)加石炭酸复红染液染色1~2min,水洗,自然干燥.
(4)在载玻片一端加一滴墨汁,另取一块边缘光滑的载玻片与墨汁接触,再以匀速推向另一端,涂成均匀的一薄层,自然干燥.
(5)干燥后用油镜观察.
菌体红色,荚膜无色,背景黑色.
2.
背景染色(1)先加1滴墨水于洁净的玻片上,并挑少量褐球固氮菌与之充分混合均匀.
(2)放一清洁盖玻片于混合液上,然后在盖玻片上放一张滤纸,向下轻压,吸收多余的菌液.
(3)干燥后用油镜观察.
背景灰色,菌体较暗,在其周围呈现一明亮的透明圈即荚膜.
四、注意事项1.
荚膜染色涂片不要用加热固定,以免荚膜皱缩变形.
2.
供芽孢染色用的菌种应控制菌龄,使大部分芽孢仍保留在菌体上为宜.
五、实验报告(一)绘图1.
枯草芽孢杆菌及巨大芽孢杆菌的菌体及芽孢形态,芽孢的着生位置.
2.
褐球固氮菌菌体及荚膜的形态.
(二)试制片,但不进行染色,观察是否能看到芽孢和荚膜七、问题和思考1.
为什么芽孢染色要加热为什么芽孢及营养体能染成不同的颜色2.
组成荚膜的成分是什么涂片一般用什么固定方法,为什么3.
试设计实验如何鉴定某一产芽孢菌株的芽孢形态、着生位置及所属分类地位.
实验11放线菌的形态观察一、实验目的和内容目的:辨认放线菌的营养菌丝、气生菌丝、孢子丝、孢子的形态;学习放线菌的观察方法.
内容:用水封计法、玻璃纸法、印片法观察放线菌的形态特征.
二、实验材料和用具细黄链霉菌(streptomycsmicuoflavus)又称5406的培养平皿,棘孢小单孢菌(Micromonosporaechinospora)的玻璃纸培养平皿.
0.
1%美蓝染色液、石炭酸复红染色液;盖玻片、载玻片、镊子、接种环、显微镜、涂布器、玻璃纸、打孔器.
三、操作步骤(一)观察自然生长状态的放线菌用镊子小心取出用插片法培养的5406菌培养皿中的一张盖玻片,将其背面附着的菌丝体擦净.
然后将长有菌的一面向上放在洁净的载玻片上,用低倍镜、高倍镜观察.
找出3类菌丝及其分生孢子,并绘图.
注意放线菌的基内菌丝、气生菌丝的粗细和色泽差异.
(二)水封片观察取一滴美蓝染色液置于载玻片中央,将用搭片法培养棘孢小单孢菌培养皿中的盖玻片取出,并将有菌面朝下,放在载玻片上,浸在染色液中,制成水封片,用高倍镜观察其单个分生孢子及其基内菌丝,并绘图.
(三)玻璃纸法的镜检观察l.
直接玻璃纸观察分别用5406和棘孢小单孢菌的玻璃纸制片观察.
制片时,于载玻片上放一小滴蒸馏水,将含菌玻璃纸片小心剪下一小块,移至载玻片上,并使有菌面向上.
在玻璃纸与载玻片间不能有气泡,以免影响观察.
将制片于显微镜下观察,先用低倍镜观察菌的立体生长状况,再用高倍镜仔细观察.
注意区分5406菌的基内菌丝、气生菌丝和弯曲状或螺旋状的孢子丝.
观察棘孢小单孢菌时注意把视野调暗,其基内菌丝纤细发亮,其单个分生孢子发暗,直接生长在基内菌丝长出的小梗上.
绘图.
2.
印片染色法观察用镊子取洁净载玻片并微微加热,然后用这微热载玻片盖在长有5406或棘孢小单孢菌的平皿上,轻轻压一下,注意将载玻片垂直放下和取出,以防载玻片水平移动而破坏放线菌的自然形态.
反转有印痕的载玻片微微加热固定.
用石炭酸复红染色lmin,水洗,晾干.
用油镜观察.
绘图.
注意比较两种菌的形态特征有何不同.
四、注意事项1.
培养放线菌中要注意,放线菌的生长速度较慢,培养期较长,在操作中应特别注意无菌操作,严防杂菌污染.
2.
玻璃纸法培养接种时注意玻璃纸与平板琼脂培养基间不宜有气泡,以免影响其表面放线菌的生长,3.
不同观察方法中严格按要求进行,注意菌体的上下位置.
五、实验报告1.
绘图玻璃纸法、水封片法、印片法及自然生长状态下观察的放线菌形态.
2.
试比较5406菌与棘孢小单孢菌特征的异同.
六、问题和思考1.
在高倍镜或油镜下如何区分放线菌的基内菌丝和气生菌丝2.
用插片法和搭片法如何制备放线菌标本,其主要优点是什么可否用此法观察其他微生物为什么3.
以玻璃纸覆盖法培养和观察放线菌有何优点试用此法设计一个观察青霉菌形态的实验.
注:(一)插片法和搭片法培养放线菌1.
插片法(1)制平板、接种:用冷却至约50℃的高氏1号琼脂培养基倒平板(每皿约20mL),可用两种方法接菌:1、先接种后插片:冷凝后用接种环挑取少量斜面上的5406菌孢子,用平板培养基的一半面积作来回划线接种(接种量可适当加大);2、先插片后接种:用平板培养基的另一半面积进行.
(2)插片及培养:用无菌镊子取无菌盖玻片,在已接种平板上以45°角斜插入培养基内,插人深度约占盖玻片1/2长度(图11-1A).
同时,在另一半未经接种的部位以同样方式插入数块盖玻片,然后接种少量5406菌孢子至盖玻片一侧的基部,且仅接种于其中央位置约占盖玻片长度的一半左右,以免菌丝蔓延至盖玻片的另一侧.
将插片平板倒置于28℃,培养3~7d.
2.
搭片法(1)开槽及接种:用无菌打孔器在凝固后的平板培养基上打洞数个,并将棘孢小单孢菌孢子划线接种至洞内边缘.
(2)搭片及培养:在接种后的洞面上放一无菌盖玻片,平板倒置于28℃,培养3~7d(图11—1B).
(二)玻璃纸法固体培养5406菌和棘孢小单孢菌1.
玻璃纸灭菌将玻璃纸剪成比培养皿直径略小的片状,将滤纸剪成培养皿大小的圆形纸片并稍润湿,然后把滤纸和玻璃纸交互重叠地放在培养皿中,借滤纸将玻璃纸隔开.
然后进行湿热灭菌,备用.
图11—1放线菌的插片与搭片培养示意图A.
插片法;B.
搭片法2.
制平板及铺玻璃纸取冷凝后的高氏1号琼脂培养基,用无菌镊子将预先灭菌的块状玻璃纸平铺至平板培养表面,铺玻璃纸时可用无菌涂布器将玻璃纸与培养基之间的气泡除去.
3.
涂布菌液及培养取0.
lmL的孢子悬液涂布在铺有玻璃纸的平板培养基表面.
接种平板倒置于28℃,培养5~7d.
实验12酵母菌的形态观察一、实验目的和内容目的:了解自然存在的酵母菌及其形态结构.
了解酵母菌产生子囊孢子的条件及其形态.
内容:1.
观察酵母菌个体形态.
2.
观察酵母菌的假菌丝和繁殖过程.
3.
观察自然状态的酵母菌.
二、实验材料和用具酿酒酵母(Saccharomyescerevisiae)、热带假丝酵母(Candidatropicalis)斜面菌种.
PDA培养基、麦氏(McCLary)培养基(醋酸钠培养基)、0.
05%美蓝染色液(以pH6.
0的0.
02mol/L磷酸缓冲液配制)、碘液、0.
04%的中性红染色液%孔雀绿,0.
5%沙黄液、95%乙醇;显微镜、载玻片、擦镜纸、盖玻片、接种环、V形玻璃棒、放置一个三角形玻璃棒支架的培养皿.
三、操作步骤(一)酵母菌形态观察1.
酵母菌的话体染色观察及死亡率的测定(1)以无菌水洗下PDA斜面培养的酿酒酵母菌苔,制成菌悬液.
(2)取0.
05%美蓝染色液1滴,置载玻片中央,并用接种环取酵母菌悬液与染色液混匀,染色2~3min,加盖玻片,在高倍镜下观察酵母菌个体形态,区分其母细胞与芽体,区分死细胞(蓝色)与活细胞(不着色).
(3)在一个视野里计数死细胞和活细胞,共计数5~6个视野.
酵母菌死亡率一般用百分数来表示,以下式来计算:死亡率=死细胞总数÷死活细胞总数*100%2.
酵母菌液泡系的话体观察于洁净载玻片中央加一滴中性红染色液,取少许上述酵母菌悬液与之混合,染色5min,加盖玻片在显微镜下观察.
细胞无色,液泡呈红色.
3.
酵母菌细胞中肝糖粒的观察将1滴碘液置于载玻片中央,接人上述酵母菌悬液,混匀,盖上盖玻片,显微镜观察,细胞内的贮藏物质肝糖颗粒呈深红色.
4.
酵母菌子囊孢子的观察(1)活化酿酒酵母:将酿酒酵母接种至新鲜的麦芽汁培养基上,置28C培养2~3d,然后再移植2~3次.
(2)转接产孢培养基:将活化的酿酒酵母转接至醋酸钠培养基上,置30℃恒温培养14d.
(3)观察:挑取少许产孢菌苔于载玻片的水滴上,经涂片、热固定后,加数滴孔雀绿,lmin后水洗,加95%乙醇30S,水洗,最后用0.
5%沙黄液复染30S,水洗去染色液,最后用吸水纸吸干.
制片干燥后,镜检,子囊孢子呈绿色,子囊为粉红色.
注意观察子囊孢子的数目、形状和子囊的形成率.
(4)计算子囊形成的百分率:计数时随机取3个视野,分别计数产子囊孢子的子囊数和不产孢子的细胞,然后按下列公式计算:子囊形成率(%)=3个视野中形成子囊的总数÷3个视野中(形成子囊的总数+不产孢子细胞总数)*100%5.
酵母菌假菌丝的观察取一无菌载玻片浸于溶化的PDA培养基中,取出放在温室培养的支架上,待培养基凝固后,进行酵母菌划线接种,然后将无菌盖玻片盖在接菌线上(图12—1),28℃培养2~3d后,取出载玻片,擦去载玻片下面的培养基,在显微镜下直接观察.
可见到芽殖酵母形成的藕节状假菌丝,裂殖酵母则形成竹节状假菌丝(图12—2).
图12—1酵母菌假菌丝的培养图12—2酵母菌的假菌丝形态A.
藕节状假菌丝;B.
竹节状假菌丝6.
自然状态下的酵母菌观察取一滴美蓝染色液于载玻片中央,春夏秋季取酱油或淹菜上的白膜,冬季取腌酸菜汤上的白膜,将其置于载玻片染色液中,盖上盖玻片,显微镜下仔细观察酵母菌形态,出芽生殖,假菌丝等.
四、注意事项1.
用于活化酵母菌的麦芽汁培养基要新鲜、表面湿润.
2.
在产孢培养基上加大移种量,可提高子囊形成率.
3.
通过微加热增加酵母的死亡率,易于观察死亡细胞.
五、实验报告(一)绘图1.
数个酵母菌细胞,示观察到的结构.
2.
数个子囊及子囊孢子形态图.
(二)记录并计数酵母菌的死亡率及子囊形成率(原始记录及计算结果).
六、问题和思考1.
酵母菌的假菌丝是怎样形成的与霉菌的真菌丝有何区别2.
如何区别营养细胞和释放出的子囊孢子3.
试设计一个从子囊中分离子囊孢子的试验方案.
注:酵母菌的简易培养配2%葡萄糖水(或自糖水),煮沸,装入三角瓶中(液面高度2~2cm),加HCl调至pH3~5放入几块葡萄皮(或其他糖分较高的果皮),置5~28℃温箱中培养2~3d,闻到酒香味后,即可取培养液镜检.
实验13霉菌的形态观察一、实验目的和内容目的:了解霉菌形态,掌握微生物载玻片湿室培养方法.
内容:1.
霉菌载玻片湿室培养.
2.
曲霉、青霉、根霉、毛霉形态观察.
3.
根霉假根的观察.
二、实验材料和用具产黄青霉(Penicfilliumchrysogenum)、黑曲霉(Aspergillusniger)、黑根霉(Rhizopusnigrians)、总状毛霉(Mucorracemosus)等斜面菌种.
半固体PDA培养基、乳酸苯酚固定液、棉蓝染色液、20%甘油;透明胶带、剪刀、培养皿、载玻片、口形玻棒搁架、盖玻片、圆形滤纸片、细口滴管、镊子、显微镜、接种环.
三、操作步骤(一)霉菌的载玻片湿室培养可4人合作,每人制作一霉菌的载玻片.
1.
准备湿室在培养皿底铺一张圆形滤纸片,其上放一"冂"形载玻片搁架,在搁梁上放一块载玻片和两块盖玻片,盖上皿盖,外用纸包扎,经12lC湿热灭菌30min后,置60℃烘箱中烘干,备用.
2.
接种用接种环挑取少量待观察的霉菌孢子至湿室内的载玻片上,每张载玻片可接同一菌种的孢子两处.
接种时只要将带菌的接种环在载玻片上轻轻碰几下即可(务必记住接种的位置).
3.
加培养基用无菌细口滴管吸取少量融化约60℃的培养基,滴加到载玻片的接种处,培养基应滴得圆而薄,其直径约为0.
5cm(滴加量一般以l/2小滴为宜).
4.
加盖玻片在培养基未彻底凝固前.
用无菌镊子将皿内盖玻片盖在琼脂块薄层上,用镊子轻压,使盖玻片和载玻片间的距离相当接近,但不能压扁,否则不透气.
5.
倒保湿剂每皿倒大约3mL20%的无菌甘油,使皿内的滤纸完全润湿,以保持皿内湿度,皿盖上注明菌名、组别和接种日期.
此为制成的载玻片湿室,置28℃恒温培养3~5d.
(二)黑根霉假根的培养将融化的PDA培养基,冷却至50℃倒入无菌平皿,其量约为平皿高度的l/2.
冷凝后,用接种环沾取根霉孢子,在平板表面划线接种.
然后将平皿倒置,在皿盖内放一无菌载玻片,于28℃培养2~3d后,可见根霉的气生菌丝倒挂成胡须状,有许多菌丝与载玻片接触,并在载玻片上分化出假根和匍匐菌丝等结构(图13—1).
图13—1根霉假根的培养(三)镜检观察1.
湿室培养霉菌镜检载玻片从培养16~20h开始,通过连续观察,可了解孢子的萌发、菌丝体的生长分化和子实体的形成过程.
将湿室内的载玻片取出,直接置于低倍镜和高倍镜下观察曲霉、青霉、毛霉、根霉等霉菌的形态,重点观察菌丝是否分隔,曲霉和青霉的分生孢子形成特点,曲霉的足细胞,根霉和毛霉的孢子囊和孢囊孢子.
绘图.
2.
粘片观察取一滴棉蓝染色液置于载玻片中央,取一段透明胶带,打开霉菌平板培养物,粘取菌体,粘面朝下,放在染液上.
镜检.
3.
假根观察将培养根霉假根的平皿打开,取出皿盖内的载玻片标本,在附着菌丝体的一面盖上盖玻片,置显微镜下观察.
只要用低倍镜就能观察到假根及从根节上分化出的孢子囊梗、孢子囊、孢囊孢子和两个假根间的匍匐菌丝,观察时注意调节焦距以看清各种构造.
4.
制成永久装片把观察到霉菌形态较清晰,完整的片子,制成标本作较长期保存.
制备方法是,轻轻揭去盖玻片,如果载玻片上有琼脂,仔细挑去,然后滴加少量乳酸苯酚固定液,盖上清洁盖玻片,在盖玻片四周滴加树胶封固.
四、注意事项载玻片湿室培养时,盖玻片不能紧贴载玻片,要彼此有极小缝隙,一是为了通气;二是使各部分结构平行排列,易于观察.
五、实验报告(一)绘制镜检形态图1.
毛霉和根霉形态图,示各部.
2.
青霉和曲霉形态图,示各部(二)载玻片观察记录各菌种的载玻片标本观察结果:菌种菌丝体(气生菌丝、营养菌丝的粗细、色泽、菌丝有隔或无隔等)无性孢子特征(孢子梗的分化特征,孢子着生特征等)其他特征结构(有无假根、足细胞匍匐菌丝、囊轴等)六、问题和思考1.
什么叫载玻片湿室培养它适用于观察怎样的微生物,有何优点2.
湿室培养时为何用20%甘油作保湿剂3.
本实验中观察假根的设计原理是什么此设计还适合于培养哪类菌.
实验14细菌大小的测定一、实验目的和内容目的:学会测微尺的使用和计算方法及对球菌和杆菌的测量.
内容:1.
认识测微尺,学习目镜测微尺的标定.
2.
测定金黄色葡萄球菌和大肠杆菌菌体的大小.
二、实验材料和用具金黄色葡萄球菌、大肠杆菌的玻片标本.
香柏油、二甲苯;显微镜、目镜测微尺、镜台测微尺、擦镜纸.
三、操作步骤l.
测微尺的构造显微镜测微尺是由目镜测微尺和镜台接物测微尺组成,目镜测微尺是一块圆形玻璃片,其中有精确的等分刻度,在5mm刻尺上分50份(图14一lC).
目镜测微尺每格实际代表的长度随使用接目镜和接物镜的放大倍数而改变,因此在使用前必须用镜台测微尺进行标定.
镜台测微尺为一专用中央有精确等分线的载玻片(图14—1A),一般将长为1mm的直线等分成100个小格,每格长0.
0lmm即10μm,是专用于校正目镜测微尺每格长度的.
2.
目镜测微尺的标定把目镜的上透镜旋开,将目镜测微尺轻轻放在目镜的隔板上,使有刻度的一面朝下.
将镜台测微尺放在显微镜的载物台上,使有刻度的一面朝上.
先用低倍镜观察,调焦距,待看清镜台测微尺的刻度后,转动目镜,使目镜测微尺的刻度与镜台测微尺的刻度相平行,并使两尺左边的一条线重合,向右寻找另外一条两尺相重合的直线(图15—lB).
3.
计算方法标定公式:目镜测微尺每格长度(μm)=两条重合线间镜台测微尺的格数*10÷两条重合线间目镜测微尺的格数例如,目镜测微尺20个小格等于镜台测微尺3小格,已知镜台测微尺每格为10μm,则3小格的长度为3*10=30μm,那么相应地在目镜测微尺上每小格长度为3*10÷20=1.
5μm.
用以上计算方法分别校正低倍镜、高倍镜及油镜下目镜测微尺每格实际长度.
4.
菌体大小的测定将镜台测微尺取下,分别换上大肠杆菌及金黄色葡萄球菌玻片标本,先在低倍镜和高倍镜下找到目的物,然后在油镜下用目镜测微尺测量菌体的大小.
先量出菌体的长和宽占目镜测微尺的格数,再以目镜测微尺每格的长度计算出菌体的长和宽.
并详细记录于表15—1中.
例如,目镜测微尺在这架显微镜下,每格相当于1.
5μm,测量的结果,若菌体的平均长度相当于目镜测微尺的2格,则菌体长应为3*1.
5μm=3.
0μm.
一般测量菌体的大小,应测定10~20个菌体,求出平均值,才能代表该菌的大小.
四、注意事项1.
镜台测微尺的玻片很薄,在标定油镜头时,要格外注意,以免压碎镜台测微尺或损坏镜头.
2.
标定目镜测微尺时要注意准确对正目镜测微尺与镜台测微尺的重合线.
五、演示1.
目镜测微尺、镜台测微尺的显微镜下示教.
2.
标定及测量方法示范.
六、实验报告1.
目镜测微尺标定结果:低倍镜下倍目镜测微尺每格长度是μm.
高倍镜下倍目镜测微尺每格长度是μm.
油镜下倍目镜测微尺每格长度是μm.
2.
菌体大小测定结果:大肠杆菌测定结果金黄色葡萄球菌的直径大小测定结果目镜测微尺格数实际长度菌号宽长宽长目镜测微尺格数实际直径/m12345678910均值试与己知的大肠杆菌和金黄色葡萄球菌的大小作一比较是否一致为何七、问题和思考1.
为什么更换不同放大倍数的目镜和物镜时必须重新用镜台测微尺对目镜微尺进行标定2.
若目镜不变,目镜测微尺也不变,只改变物镜,那么目镜测微尺每格所测量的镜台上的菌体细胞的实际长度(或宽度)是否相同为什么实验15微生物数量的测定细菌群体生长表现为细胞数目的增加或细胞物质的增加.
测定细胞数目的方法有显微镜直接计数法(directmicroscopiccount)、平板菌落计数法(platecount)、光电比油法(turbidityestimationbyspectrophotometer)、最大或然数法(mostprobablenumberMPN)以及膜过滤法(membranefiltration)等.
测定细胞物质的方法有细胞干重的测定,细胞某种成分如氮的含量、RNA和DNA的含量测定,代谢产物的测定等.
总之,测定微生物生长量的方法很多,各有优缺点,工作中应根据具体情况要求加以选择.
本实验主要介绍生产、科研工作中比较常用的显微镜直接计数法、平板菌落计数法和光电比浊计数法.
一显微镜直接计数法(一)目的要求1.
明确血细胞计数板计数的原理.
2.
掌握使用血细胞计数板进行微生物计数的方法.
(二)基本原理显微镜直接计数法是将小量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器),于显微镜下直接计数的一种简便、快速、直观的方法.
目前国内外常用的计菌器有:血细胞计数板、Peteroff-Hauser计菌器以及Hawksley计菌器等,它们都可用于酵母、细菌、霉菌孢子等悬液的计数,基本原理相同.
后两种计菌器由于盖上盖玻片后,总容积为0.
02mm3,而且盖玻片和载波片之间的距离只有0.
02mm,因此可用油浸物镜对细菌等较小的细胞进行观察和计数.
除了用这些计菌器外,还有在显微镜下直接观察涂片面积与视野面积之比的估算法,此法一般用于牛乳的细菌学检查.
显微镜直接计数法的优点是直观、快速、操作简单.
但此法的缺点是所测得的结果通常是死菌体和活菌体的总和.
目前已有一些方法可以克服这一缺点,如结合活菌染色微室培养(短时间)以及加细胞分裂抑制剂等方法来达到只计数活菌体的目的.
本实验以血球计数板为例进行显微镜直接计数.
另外两种计菌器的使用方法可参看各厂商的说明书.
用血细胞计数板在显微镜下直接计数是一种常用的微生物计数方法.
该计数板是一块特制的载玻片,其上由四条槽构成三个平台;中间较宽的平台又被一短横槽隔成两半,每一边的平台上各列有一个方格网,每个方格网共分为九个大方格,中间的大方格即为计数室.
血细胞计数板构造如图l5-1.
计数室的刻度一般有两种规格,一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格(图15—2);另一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格,但无论是哪一种规格的计数板,每一个大方格中的小方格都是400个.
每一个大方格边长为lmm,则每一个大方格的面积为lmm2,盖上盖玻片后,盖玻片与载玻片之间的高度为0.
lmm,所以计数室的容积为0.
lmm3(万分之一毫升).
图15—1血细胞计数板构造(一)图15—2血细胞计数板构造(二)A.
正面图;B.
纵切面图;放大后的方格网,中间大方格为计数室1.
血细胞计数板;2.
盖玻片;3.
计数室计数时,通常数五个中方格的总菌数,然后求得每个中方格的平均值,再乘上25或16,就得出一个大方格中的总菌数,然后再换算成lml菌液中的总菌数.
设五个中方格中的总菌数为A,菌液稀释倍数为B,如果是25个中方格的计数板,则1mL菌液中的总菌数=A/5*25*104*B=50000A·B(个)同理,如果是16个中方格的计数板,1mL菌液中的总菌数=A/5*16*104*B=32000A·B(个)(三)器材1.
菌种酿酒酵母2.
仪器或其他用具血细胞计数板,显微镜,盖玻片,无菌毛细滴管.
(四)操作步骤l.
菌悬液制备以无菌生理盐水将酿酒酵母制成浓度适当的菌悬液.
2.
镜检计数室在加样前,先对计数板的计数室进行镜检.
若有污物,则需清洗,吹干后才能进行计数.
3.
加样品将清洁干燥的血细胞计数板盖上盖玻片,再用无菌的毛细滴管将摇匀的酿酒酵母菌悬液由盖玻片边缘滴一小滴,让菌液沿缝隙靠毛细渗透作用自动进入计数室,一般计数室均能充满菌液.
取样时先要摇匀菌液;加样时计数室不可有气泡产生.
4.
显微镜计数加样后静止5min,然后将血细胞计数板置于显微镜载物台上,先用低倍镜找到计数室所在位置,然后换成高倍镜进行计数.
调节显微镜光线的强弱适当,对于用反光镜采光的显微镜还要注意光线不要偏向一边,否则视野中不易舌清楚计数室方格线,或只见竖线或只见横线.
在计数前若发现菌液太浓或太稀,需重新调节稀释度后再计数.
一般样品稀释度要求每小格内约有5~10个菌体为宜.
每个计数室选5个中格(可选4个角和中央的一个中格)中的菌体进行计数.
位于格线上的菌体一般只数上方和右边线上的.
如遇酵母出芽,芽体大小达到母细胞的一半时,即作为两个菌体计数.
计数一个样品要从两个计数室中计得的平均数值来计算样品的含菌量.
5.
清洗血细胞计数板使用完毕后,将血细胞计数板在水龙头用水冲洗干净,切勿用硬物洗刷,洗完后自行晾干或用吹风机吹干.
镜检,观察每小格内是否有残留菌体或其他沉淀物.
若不干净,则必须重复洗涤至干净为止.
(五)实验报告l.
结果将结果记录于下表中.
A表示五个中方格中的总菌数;B表示菌液稀释倍数.
各中格中菌数12345AB二室平均值菌数/ml第一室第二室2.
思考题(1)根据你的体会,说明用血细胞计数板计数的误差主要来自哪些方面应如何尽量减少误差.
力求准确(2)某单位要求知道一种干酵母粉中的活菌存活率,请设计1~2种可行的检测方法.
二平板菌落计数法(一)目的要求学习平板菌落计数的基本原理和方法.
(二)、基本原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞.
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数.
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可来自样品中的2~3或更多个细胞.
因此平板菌落计数的结果往往偏低.
为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(colony-formingunits,cfu)而不以绝对菌落数来表示样品的活菌含量.
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是,由于该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测.
(三)器材1.
菌种大肠杆菌菌悬液.
2.
培养基牛肉膏蛋白陈培养基.
3.
仪器或其他用具lm1无菌吸管,无菌平皿,盛有4.
5ml无菌水的试管,试管架,恒温培养箱等.
(四)操作步骤l.
编号取无菌平皿9套,分别用记号笔标明10-4、10-5、10-6.
(稀释度)各3套.
另取6支盛有4.
5mL无菌水的试管,依次标是10-1、10-2、10-3、10-4、10-5、10-6.
2.
稀释用lmL无菌吸管吸取lmL已充分混匀的大肠杆菌菌县液(待测样品),精确地放0.
5ml至10-1的试管中,此即为10倍稀释.
将多余的菌液放回原菌液中.
将10-1试管置试管振荡器上振荡,使菌液充分混匀.
另取一支lml吸管插入10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀.
吹吸菌液时不要太猛太快,吸时吸管伸人管底,吹时离开液面,以免将吸管中的过滤棉花浸湿或使试管内液体外溢.
用此吸管吸取10-1菌液lmL,精确地放0.
5mL至10-2试管中,此即为100倍稀释.
……其余依次类推,整个过程如图15-3所示.
放菌液时吸管尖不要碰到液面,即每一支吸管只能接触一个稀释度的菌悬液,否则稀释不精确,结果误差较大.
3,取样用三支1mL无菌吸管分别吸取10-4、10-5和10-6.
的稀释菌悬液各lmL,对号放入编好号的无菌平皿中,每个平皿放0.
2mL.
不要用lmL吸管每次只靠吸管尖部吸0.
2mL稀释菌液放入平皿臼,这样容易加大同一稀释度几个重复平板间的操作误差.
图15—3平板菌落计数操作步骤4.
倒平板.
尽快向上述盛有不同稀释度菌液的平皿中倒入融化后冷却至45℃左右的牛肉膏蛋白胨培养基约15毫升/平皿,置水平位置迅速旋动平皿,使培养基与菌液混合均匀,而又不使培养基荡出平皿或溅到平皿盖上.
由于细菌易吸附到玻璃器皿表面,所以菌液加入到培养皿后,应尽快倒入融化并于已冷却至45℃左右的培养基,立即摇匀,否则细菌将不易分散或长成的菌落连在一起,影响计数.
待培养基凝固后,将平板倒置于37℃恒温培养箱中培养.
5.
计数培养48h后,取出培养平板,算出同一稀释度三个平板上的菌落平均数,并按下列公式进行计算,每毫升中菌落形成单位(cfu)=同一稀释度三次重复的平均菌落数*稀释倍数*5一般选择每个平板上长有30~300个菌落的稀释度计算每毫升的含菌量较为合适.
同一稀释度的三个重复对照的菌落数不应相差很大,否则表示试验不精确.
实际工作中同一稀释度重复对照平板不能少于三个,这样便于数据统计,减少误差.
由10-4、10-5、10-6三个稀释度计算出的每毫升菌液中菌落形成单位数也不应相差太大.
平板菌落计数法,所选择倒平板的稀释度是很重要的.
一般以三个连续稀释度中的第二个稀释度倒平板培养后所出现的平均菌落数在50个左右为好,否则要适当增加或减少稀释度加以调整.
平板菌落计数法的操作除上述倾注倒平板的方式以外,还可以用涂布平板的方式进行.
二者操作基本相同,所不同的是后者先将牛肉膏蛋白胨培养基融化后倒平板,待凝固后编号,并于37℃左右的温箱中烘烤30min,或在超静工作台上适当吹干,然后用无菌吸管吸取稀释好的菌液对号接种于不同稀释度编号的平板上,并尽快用无菌玻璃涂棒将菌液在平板上涂布均匀,平放于实验台上20~30min,使菌液渗入培养基表层内,然后倒置37℃的恒温箱中培养24~48h.
涂布平板用的菌悬液量一般以0.
1ml较为适宜,如果过少菌液不易涂布开,过多则在涂布完后或在培养时菌液仍会在平板表面流动,不易形成单菌落.
五、实验报告1.
结果2.
将培养后菌落计数结果填入下表稀释度10-410-510-6Cfu数/平板123平均123平均123平均每毫升中的cfu2.
思考题(1)为什么融化后的培养基要冷却至45℃左右才能倒平板(2)要使平板菌落计数准确,需要掌握哪几个关键为什么(3)试比较平板菌落计数法和显微镜下直接计数法的优缺点及应用.
(4)当你的平板上长出的菌落不是均匀分散的而是集中在一起时,你认为问题出在哪里(5)用倒平板法和涂布法计数,其平板上长出的菌落有何不同为什么要培养较长时间(48h)后观察结果三光电比浊计数法一、目的要求1.
了解光电比浊计数法的原理.
2.
学习、掌握光电比浊计数法的操作方法.
二、基本原理当光线通过微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低.
在一定的范围内,微生物细胞浓度与透光度成反比,与光密度成正比,而光密度或透光度可以由光电池精确测出(图15-4).
因此,可用一系列已知菌数的菌悬液测定光密度,作出光密度—菌数标准曲线.
然后,以样品液所测得的光密度,从标准曲线中查出对应的菌数.
制作标准曲线时,菌体计数可采用血细胞计数板计数,平板菌落计数或细胞干重测定等方法.
本实验采用血细胞计数板计数.
光电比浊计数法的优点是简便、迅速,可以连续测定,适合于自动控制.
但是,由于光密度或透光度除了受菌体浓度影响之外,还受细胞大小、形态、培养液成分以及所采用的光波长等因素的影响.
因此,对于不同微生物的菌悬液进行光电比浊计数应采用相同的菌株和培养条件制作标准曲线.
光波的选择通常在400~700nm之间,具体到某种微生物采用多少还需要经过最大吸收波长以及稳定性试验来确定.
另外,对于颜色太深的样品或在样品中还含有其他干扰物质的悬液不适合用此法进行测定.
图15—4比浊法测定细胞浓度的原理(三)器材1.
菌种酿酒酵母培养液2.
仪器或其他用具721型分光光度计,血细胞计数板,显微镜,试管,吸水纸,无菌吸管,无菌生理盐水等.
(四)操作步骤1.
标准曲线制作(1)编号取无菌试管7支,分别用记号笔将试管编号为1、2、3、4、5、6、7.
(2)调整菌液浓度用血细胞计数板计数培养24小时的酿酒酵母菌悬液,并用无菌生理盐水分别稀释调整为每毫升1*106、2*106、4*106、6*106、8*106、10*106、12*106含菌数的细胞悬液.
再分别装入已编好号的1至7号无菌试管中.
(3)测OD值将1至7号不同浓度的菌悬液摇均匀后于560nm波长、1cm比色皿中测定OD值.
比色测定时,用无菌生理盐水作空白对照,并将OD值填入下表管号12345678细胞数106/ml光密度(OD)每管菌悬液在测定OD值时均必须先摇匀后再倒入比色皿中测定(4)以光密度(OD)值为纵坐标,以每毫升细胞数为横坐标,绘制标准曲线.
2.
样品测定将待测样品用无菌生理盐水适当稀释,摇均匀后,用560nm波长、lcm比色皿测定光密度.
测定时用无菌生理盐水作空白对照.
各种操作条件必须与制作标准曲线时的相同,否则,测得值所换算的含菌数就不准确.
3.
根据所测得的光密度值,从标准曲线查得每毫升的含菌数.
(五)实验报告l.
结果每毫升样品原液菌数=从标准曲线查得每毫升的菌数*稀释倍数2.
思考题(1)光电比浊计数的原理是什么这种计数法有何优缺点(2)光电比浊计数在生产实践中有何应用价值(3)本实验为什么采用560nm波长测定酵母菌悬液的光密度如果你在实验中需要测定大肠杆菌生长的OD值,你将如何选择波长四大肠杆菌生长曲线的测定(一)目的要求1.
通过细菌数量的测量了解大肠杆菌的生物特征和规律,绘制生长线.
2.
复习光电比浊法测量细菌数量的方法.
(二)基本原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次.
将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期,对数期、稳定期和衰亡期四个阶段.
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线.
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同.
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义.
用于测定细菌细胞数量的方法已在上述实验作了介绍.
本实验用分光光度计(spectrophotometer)进行光电比浊测定不同培养时间细菌悬浮液的OD值,绘制生长曲线.
也可以直接用试管或带有测定管的三角瓶(图15-5)测定"klettunits"值的光度计.
如图15—6所示,只要接种1支试管或1个带测定管的三角瓶,在不同的培养时间(横坐标)取样测定,以测得的klettunits为纵坐标,便可很方便地绘制出细菌的生长曲线.
如果需要,可根据公式1klettunits=OD/0.
002换算出所测菌悬液的OD值.
图15—5带侧臂试管的三角烧瓶(三)器材1.
菌种大肠杆菌2.
培养基LB液体培养基70ml,分装2支大试管(5ml/支),剩余60ml装入250ml的三角瓶.
3.
仪器或其他用具722型分光光度计,水浴振荡摇床,无菌试管,无菌吸管等.
图15—6直接用试管测OD值(四)操作步骤1.
标记取11支无菌大试管,用记号笔分别标明培养时间,即0、1.
5、3、4、6、8、10、12、14、16和20h.
2.
接种分别用5ml无菌吸管吸取2.
5ml大肠杆菌过夜培养液(培养10~12h)转入盛有50mlLB液的三角瓶内,混合均匀后分别取5ml混合液放入上述标记的11支无菌大试管中.
3.
培养将已接种的试管置摇床37℃振荡培养(振荡频率250r/min),分别培养0、1.
5、3、4、6、8、10、12、14、16和20h,将标有相应时间的试管取出,立即放冰箱中贮存,最后一同比浊测定其光密度值.
4.
比浊测定用未接种的LB液体培养基作空白对照,选用600nm波长进行光电比浊测定.
从早取出的培养液开始依次测定,对细胞密度大的培养液用LB液体培养基适当稀释后测定,使其光密度值在0.
1~0.
65之内(测定OD值前,将待测定的培养液振荡,使细胞均匀分布).
本操作步骤也可用简便的方法代替:1.
用1ml无菌吸管取0.
25ml大肠杆菌过夜培养液转入盛有3~5mlLB液的试管中、混匀后将试管直接插入分光光度计的比色糟中,比色糟上方用自制的暗盒将试管及比色暗室全部罩上,形成一个大的暗环境,另以1支盛有LB液但没有接种的试管调零点,测定样品中培养0h的OD值.
测定完毕后,取出试管置37℃继续振荡培养.
2.
分别在培养0、1.
5、3、4、6、8、10、12、14、16和20h,取出培养物试管按上述方法测定OD值.
该方法准确度高、操作简便.
但须注意的是使用的2支试管要很干净,其透光程度愈接近,测定的准确度愈高.
(五)实验报告1.
结果(1)将测定的OD600值填入下表:培养时间(h)对照01.
534681012141620光密度值OD600(2)绘制大肠杆菌的生长曲线.
2.
思考题(1)如果用活菌计数法制作生长曲线,你认为会有什么不同两者各有什么优缺点培养时间/hOD600值(2)细菌生长繁殖所经历的四个时期中,哪个时期其代时最短若细胞密度为103/ml,培养4.
5h后,其密度高达2*108/ml,计计算出其代时.
(3)次生代谢产物的大量积累在哪个时期根据细菌生长繁殖的规律,采用哪些措施可使次生代谢产物积累更多实验16微生物的生理生化反应微生物生理生化反应的多样性在自然界产生了两种结果:第一是使自然界的有机分子都有可能得到分解;第二是使不同微生物之间有了互相作用和互相依赖的基础.
例如,一种微生物能利用另一种微生物所分解的产物,或者一种微生物的产物可抑制或杀死另一种微生物.
所以微生物的生理生化反应也被作为细菌鉴定和分类的内容.
一大分子物质的水解试验(一)目的要求1.
证明不同微生物对各种有机大分子的水解能力不同,从而说明不同微生物有着不同的酶系统.
2.
掌握进行微生物大分子水解试验的原理和方法.
(二)基本原理微生物对大分子的淀粉、蛋白质和脂肪不能直接利用,必须靠产生的胞外酶将大分子物质分解才能被微生物吸收利用.
胞外酶主要为水解酶,通过加水裂解大的物质为较小的化合物,使其能被运输至细胞内.
如淀粉酶水解淀粉为小分子的糊精、双糖和单糖;脂肪酶水解脂肪为甘油和脂肪酸;蛋白酶水解蛋白质为氨基酸等.
这些过程均可通过观察细菌菌落周围的物质变化来证实:淀粉遇碘液会产生蓝色,但细菌水解淀粉的区域,用碘测定不再产生蓝色,表明细菌产生淀粉酶.
脂肪水解后产生脂肪酸可改变培养基的pH,使pH降低,加入培养基的中性红指示剂会使培养基从淡红色变为深红色,说明胞外存在着脂肪酶.
微生物可以利用各种蛋白质和氨基酸作为氮源外,当缺乏糖类物质时,亦可用它们作为碳源和能源.
明胶是由胶原蛋白经水解产生的蛋白质,在25℃以下可维持凝胶状态,以固体形式存在.
而在25℃以上明胶就会液化.
有些微生物可产生一种称作明胶酶的胞外酶,水解这种蛋白质,而使明胶液化,甚至在4℃仍能保持液化状态.
还有些微生物能水解牛奶中的蛋白质酪素,酪素的水解可用石蕊牛奶来检测.
石蕊培养基由脱脂牛奶和石蕊组成,是昏浊的蓝色.
酪素水解成氨基酸和肽后,培养基就会变得透明.
石蕊牛奶也常被用来检测乳糖发酵,因为在酸存在下,石蕊会转变为粉红色,而过量的酸可引起牛奶的固化(凝乳形成).
氨基酸的分解会引起碱性反应,使石蕊变为紫色.
此外,某些细菌能还原石蕊,使试管底部变为白色.
尿素是由大多数哺乳动物消化蛋白质后被分泌在尿中的废物.
尿素酶能分解尿素释放出氨,这是一个分辨细菌很有用的诊断实验.
尽管许多微生物都可以产生尿素酶,但它们利用尿素的速度比变形杆菌属(Proteus)的细菌要慢,因此尿素酶试验被用来从其他非发酵乳糖的肠道微生物中快速区分这个属的成员.
尿素琼脂含有蛋白胨,葡萄糖,尿素和酚红.
酚红在pH6.
8时为黄色,而在培养过程中,产生尿素酶的细菌将分解尿素产生氨,使培养基的pH升高,在pH升至8.
4时,指示剂就转变为深粉红色.
(三)器材1.
菌种枯草芽胞杆菌,大肠杆菌,金黄色葡萄球菌,铜绿假单胞菌(Pseudomonasaeruginosa),普通变形杆菌.
2.
培养基固体油脂培养基,固体淀粉培养基,明胶培养基试管,石蕊牛奶试管,尿素琼脂试管.
3.
溶液或试剂革兰氏染色用卢戈氏碘液(Lugol'siodinesolution).
4.
仪器或其他用具无菌平板,无菌试管,接种环,接种针,试管架.
(四)操作步骤l.
淀粉水解试验(1)将固体淀粉培养基溶化后冷却至50℃左右,无菌操作制成平板.
(2)用记号笔在平板底部划成四部分.
(3)将枯草芽孢杆菌,大肠杆菌,金黄色葡萄球菌,铜绿假单胞菌分别在不同的部分划线接种,在平板的反面分别在四部分写上菌名.
(4)将平板倒置在37℃温箱中培养24h.
(5)观察各种细菌的生长情况,将平板打开盖子,滴入少量Lugol's碘液于平皿中,轻轻旋转平板,使碘液均匀铺满整个平板.
如菌苔周围出现无色透明圈,说明淀粉己被水解,为阳性.
透明圈的大小可初步判断该菌水解淀粉能力的强弱,即产生胞外淀粉酶活力的高低.
2.
油脂水解试验(1)将溶化的固体油脂培养基冷却至50℃左右时,充分摇荡,使油脂均匀分布.
无菌操作倒入平板,待凝.
(2)用记号笔在平板底部划成四部分,分别标上菌名.
(3)将上述四种菌分别用无菌操作划+字接种于平板的相对应部分的中心.
(4)将平板倒置,于37℃温箱中培养24h.
(5)取出平板,观察菌苔颜色,如出现红色斑点说明脂肪水解,为阳性反应.
3.
明胶水解试验(1)取三支明胶培养基试管,用记号笔标明各管欲接种的菌名.
(2)用接种针分别穿刺接种(见图3—4B)枯草芽抱杆菌,大肠杆菌,金黄色葡萄球菌.
(3)将接种后的试管置20℃中,培养2~5d.
(4)观察明胶液化情况(图16-1).
图16—1明胶穿刺液化的形态4.
石蕊牛奶试验(1)取两支石蕊牛奶培养基试管,用记号笔标明各管欲接种的菌名.
(2)分别接种普通变形杆菌和金黄色葡萄球菌.
(3)将接种后的试管置35℃中,培养24~48h.
(4)观察培养基颜色变化.
石蕊在酸性条件下为粉红色,碱性条件下为紫色,而被还原时为白色.
5.
尿素试验(1)取两支尿素培养基斜面试管,用记号笔标明各管欲接种的菌名.
(2)分别接种普通变形杆菌和金黄色葡萄球菌.
(3)将接种后的试管置35℃中,培养24~48h.
(4)观察培养基颜色变化.
尿素酶存在时为红色,无尿素酶时应为黄色.
(五)实验报告1.
结果将结果填入下表,"+"表示阳性,"-"表示阴性.
菌名淀粉水解试验脂肪水解试验明胶液化试验石蕊牛奶试验尿素试验枯草芽孢杆菌大肠杆菌金黄色葡萄球菌铜绿假单胞菌普通变形杆菌2.
思考题(1)你怎样解释淀粉酶是胞外酶而非胞内酶(2)不利用碘液,你怎样证明淀粉水解的存在(3)接种后的明胶试管可以在35℃培养,在培养后你必须做什么才能证明水解的存在(4)解释在石蕊牛奶中的石蕊为什么能起到氧化还原指示剂的作用(5)为什么尿素试验可用于鉴定Proteus细菌二糖发酵试验(一)目的要求1.
了解糖发酵的原理和在肠道细菌鉴定中的重要作用.
2.
掌握通过糖发酵鉴别不同微生物的方法.
(二)基本原理糖发酵试验是常用的鉴别微生物的生化反应,在肠道细菌的鉴定上尤为重要.
绝大多数细菌都能利用糖类作为碳源和能源,但是它们在分解糖类物质的能力上有很大的差异.
有些细菌能分解某种糖产生有机酸(如乳酸、醋酸、丙酸等)和气体(如氢气、甲烷、二氧化碳等);有些细菌只产酸不产气.
例如大肠杆菌能分解乳糖和葡萄糖产酸并产气;伤寒杆菌分解葡萄糖产酸不产气,不能分解乳糖;普通变形杆菌分解葡萄糖产酸产气,不能分解乳糖.
发酵培养基含有蛋白胨,指示剂(溴甲酚紫),倒置的德汉氏小管和不同的糖类.
当发酵产酸时,溴甲酚紫指示剂可由紫色(pH6.
8)变为黄色(pH5.
2).
气体的产生可由倒置的德汉氏试管中有无气泡来证明.
如图16—2.
图16—2糖发酵试验A.
培养前的情况;B.
培养后产酸不产气;C.
培养后产酸产气(三)器材1.
菌种大肠杆菌,普通变形杆菌斜面各一支.
2.
培养基葡萄糖发酵培养基试管和乳糖发酵培养基试管各3支(内装有倒置的德汉氏小试管).
3.
仪器或其他用具试管架,接种环等.
(四)操作步骤1.
用记号笔在各试管外壁上分别标明发酵培养基名称和所接种的细菌菌名.
2.
取葡萄糖发酵培养基试管3支,分别接入大肠杆菌,普通变形杆菌,第三支不接种,作为照.
另取乳糖发酵培养基试管3支,同样分别接入大肠杆菌,普通变形杆菌,第三支不接种,作为对照.
在接种后,轻缓摇动试管,使其均匀,防止倒置的小管进入气泡.
3.
将接种过和作为对照的6支试管均置37℃培养24~48h.
4.
观察各试管颜色变化及德汉氏小管中有无气泡.
五、实验报告1.
结果将结果填入下表.
"+"表示产酸或产气,"-"表示不产酸或不产气.
糖类发酵大肠杆菌普通变形杆菌对照葡萄糖发酵乳糖发酵2.
思考题假如某种微生物可以有氧代谢葡萄糖,发酵试验应该出现什么结果三IMViC与硫化氢试验(一)目的要求了解IMViC与硫化氢反应的原理及其在肠道菌鉴定中的意义和方法.
(二)基本原理IMViC是吲哚(indoltest)、甲基红(methy1redtest)、伏一普(Voges-Prokauertest)和柠檬酸盐(citratetest)四个试验的缩写,I是在英文中为了发音方便而加上的.
这四个试验主要是用来快速鉴别大肠杆菌和产气肠杆菌(Enterobacteraerogenes),多用于水的细菌学检查.
大肠杆菌虽非致病菌,但在饮用水中若超过一定数量,则表示受粪便污染.
产气肠杆菌也广泛存在于自然界中,因此检查水时要将两者分开.
硫化氢试验也是检查肠道杆菌的生化试验.
吲哚试验是用来检测吲哚的产生.
有些细菌能产生色氨酸酶,分解蛋白胨中的色氨酸产生吲哚和丙酮酸.
吲哚与对二甲基氨基苯甲醛结合,形成红色的玫瑰吲哚.
但并非所有微生物都具有分解色氨酸产生吲哚的能力,因此吲哚试验可以作为一个生物化学检测的指标.
色氨酸水解反应:吲哚与对二甲基氨基苯甲醛反应:大肠杆菌吲哚反应阳性,产气肠杆菌为阴性.
甲基红试验是用来检测由葡萄糖产生的有机酸,如甲酸、乙酸、乳酸等.
当细菌代谢糖产生酸时,培养基就会变酸,使加入培养基的甲基红指示剂由橘黄色(pH6.
3)变为红色(pH4.
2),即甲基红反应.
尽管所有的肠道微生物都能发酵葡萄糖产生有机酸,但这个试验在区分大肠杆菌和产气肠杆菌上仍然是有价值的.
这两个细菌在培养的早期均产生有机酸,但大肠杆菌在培养后期仍能维持酸性pH4,而产气肠杆菌则转化有机酸为非酸性末端产物,如乙醇、丙酮酸等,使pH升至大约6.
因此大肠杆菌为阳性反应,产气肠杆菌为阴性反应.
伏-普试验是用来测定某些细菌利用葡萄糖产生非酸性或中性末端产物的能力,如丙酮酸.
丙酮酸进行缩合、脱羧生成乙酰甲基甲醇,此化合物在碱性条件下能被空气中的氧气氧化成二乙酰.
二乙酰与蛋白胨中精氨酸的胍基作用,生成红色化合物,即伏-普反应阳性;不产生红色化合物者为阴性反应.
有时为了使反应更为明显,可加入少量含胍基的化合物,如肌酸等.
其化学反应过程如下:柠檬酸盐试验是用来检测柠檬酸盐是否被利用.
有些细菌能够利用柠檬酸钠作为碳源,如产气肠杆菌;而另一些细菌则不能利用柠檬酸盐,如大肠杆菌.
细菌在分解柠檬酸盐及培养基中的磷酸铵后,产生碱性化合物,使培养基的pH升高,当加入1%溴麝香草酚蓝指示剂时,培养基就会由绿色变为深蓝色.
溴麝香草酚蓝的指示范围为:pH小于6.
0时呈黄色,pH在6.
0~7.
0时为绿色,pH大于7.
6时呈蓝色.
硫化氢试验是检测硫化氢的产生,也是用于肠道细菌检查的常用生化试验.
有些细菌能分解含硫的有机物,如胱氨酸、半胱氨酸、甲硫氨酸等产生硫化氢,硫化氢一遇培养基中的铅盐或铁盐等,就形成黑色的硫化铅或硫化铁沉淀物.
以半胱氨酸为例,其化学反应过程如下:CH2SHCHNH2COOH+H2O→CH3COCOOH+H2S↑+NH3↑H2S+Pb(CH3COO)2→PbS↓+2CH3COOH(黑色)大肠杆菌为阴性,产气肠杆菌为阳性.
(三)器材l.
菌种大肠杆菌,产气肠杆菌.
2.
培养基蛋白胨水培养基,葡萄糖蛋白胨水培养基,柠檬酸盐斜面培养基,醋酸铅培养基.
在配制柠檬酸盐斜面培养基时,其pH不要偏高,以浅绿色为宜,吲哚试验中用的蛋白胨水培养基中宜选用色氨酸含量高的蛋白胨,如用胰蛋白酶水解酪素得到的蛋白胨较好.
3.
溶液或试剂甲基红指示剂,40%KOH,5%α-萘蔡酚,乙醚,吲哚试剂等.
(四)操作步骤l.
接种与培养(1)用接种针将大肠杆菌、产气肠杆菌分别穿刺接入2支醋酸铅培养基中(硫化氢试验),置37C培养48h.
(2)将上述二菌分别接种于2支蛋白胨水培养基(吲哚试验),2支葡萄糖蛋白胨水培养基(甲基红试验和伏-普试验),2支柠檬酸盐斜面培养基和2支醋酸铅培养基中,置37℃培养2d.
2.
结果观察(1)硫化氢试验培养48h后观察黑色硫化铅的产生.
(2)吲哚试验于培养2d后的蛋白陈水培养基内加3~4滴乙醚,摇动数次,静置1~3min,待乙醚上升后,沿试管壁徐徐加入2滴吲哚试剂,在乙醚和培养物之间产生红色环状物为阳性反应.
配制蛋白胨水培养基,所用的蛋白胨最好用含色氨酸高的,如用胰蛋白酶水解酪素得到的蛋白胨中色氨酸含量较高.
(3)甲基红试验培养2d后,将l支葡萄糖蛋白胨水培养物内加入甲基红试剂2滴,培养基变为红色者为阳性,变黄色者为阴性.
注意甲基红试剂不要加得太多,以免出现假阳性反应.
(4)伏-普试验培养2d后,将另1支葡萄糖蛋白胨水培养物内加入5~10滴40%KOH,然后加入等量的5%α-萘酚溶液,用力振荡,再放入37℃温箱中保温15~30min,以加快反应速度.
若培养物呈红色者,为伏-普反应阳性.
(5)柠檬酸盐试验培养48h后观察柠檬酸盐叙面培养基上有无细菌生长和是否变色.
蓝色为阳性,绿色为阴性.
五、实验报告1.
结果将实验结果填入下表.
"+"表示阳性反应,"-"表示阴性反应.
IMViC试验菌名吲哚试验甲基红试验伏一普试验柠檬酸盐试验硫化氢试验大肠杆菌产气肠菌对照2.
思考题(1)讨论IMViC试验在医学检验上的意义.
(2)解释在细菌培养中吲哚检测的化学原理,为什么在这个试验中用吲哚的存在作为色氨酸活性的指示剂,而不用丙酮酸(3)为什么大肠杆菌是甲基红反应阳性,而产气肠杆菌为阴性这个试验与伏一普试验最初底物与最终产物有何异同处为什么会出现不同(4)说明在硫化氢试验中,醋酸铅的作用,可以用哪种化合物代替醋酸铅实验17微生物与氧关系的检测一、实验目的和内容目的:学会检测微生物与氧关系的方法,了解微生物与氧的关系.
内容:通过调整转速和瓶装量检测微生物生长与氧气的关系.
二、实验材料和用具大肠杆菌斜面菌种、牛肉膏蛋白胨培养基.
吸量管、三角瓶、恒温振荡器、721分光光度计、比色杯等.
三、操作步骤(一)LB培养基的制备1.
配制牛肉膏蛋白胨培养基.
2.
分装取4个300mL三角瓶,每瓶装入50mL培养基,编号为1、2、3、4;另取4个500mL三角瓶,每瓶分别装入50mL、l00mL、150mL和200mL培养基,编号为5、6、7、8.
再取一个100mL三角瓶,装入20mL培养基,剩余的培养基装入到两个500mL三角瓶中,所有三角瓶均用8层纱布和线绳包扎.
3.
灭菌将上述分装的培养基于121C湿热灭菌30min,冷却后备用.
(二)供试菌种的制备l.
菌种活化将冰箱中储藏的大肠杆菌斜面菌种转接至牛肉膏蛋白胨斜面培养基上,37℃培养18~20h备用.
2.
种子制备取上述活化的大肠杆菌一环接人盛有20mL牛肉膏蛋白胨培养基的100mL三角瓶中,37℃,200r/min摇床培养16~18h作为供试种子.
(三)不同转速对大肠杆菌生长的影响取1~4号三角瓶,每瓶接入lmL上述大肠杆菌种子,1号静置于温箱中,2号置75r/min摇床,3号置于150r/min摇床,4号置于225r/min摇床,在37℃下培养12~16h后取出,摇匀,经适当稀释后,测定每个瓶中的OD值(λ=600nm),并同时以原培养基不接种作对照测定.
记录结果于表17-1中.
(四)不同瓶装量对大肠杆菌生长的影响取上述5~8号三角瓶,按1%的接种量接人上述大肠杆菌种子,37C,200r/min培养12~16h后一并取出,用721分光光度计测定OD值(λ=600m),如密度太大可作适当稀释后再测OD值,记录实验结果于表17-2中.
四、注意事项1.
接种前要将种子充分摇匀,接种时要保证接种量一致.
严格无菌操作,以免污染.
2.
测定OD值时要摇匀后再取培养液.
若经稀释后测定,则各瓶培养物的稀释倍数要一致.
五、实验报告1.
将测定结果列于表17-1和表17-2中:表17-1不同转数对大肠杆菌生长量的影响OD值(λ=600nm)转数/r·min-112平均值075150225表17-2不同瓶装量对大肠杆菌生长量的影响OD值(λ=600nm)瓶装量(mL/500mL三角瓶)12平均值50751001502.
绘制曲线分别以转速或瓶装量为横坐标,以OD值为纵坐标绘制大肠杆菌生长与氧关系的曲线.
3.
试对以上曲线进行分析.
六、问题和思考1.
根据微生物与氧的关系,可将微生物分为哪几大类2.
专性厌氧微生物为什么在有氧的条件下不能生长3.
试设计一实验,如何测定酵母菌或放红菌及霉菌与氧的关系.
实验18厌氧微生物的培养一、实验目的和内容目的:学习培养厌氧微生物的方法,了解厌氧微生物生长的特性.
内容:1、深层穿刺法,厌氧培养丙酮丁醇梭菌.
2、真空干燥器厌氧培养丙酮丁醇梭菌及产气荚膜梭菌.
3、针筒厌氧法培养丙酮丁醇梭菌及产气荚膜梭菌.
4、厌氧罐培养法示范.
5、厌氧袋法培养丙酮丁醇梭菌.
二、实验材料和用具丙酮丁醇梭菌(Clostridiumacetobutylicum)、产气荚膜梭菌(Clostridiumperfringens).
RCM培养基(即强化梭菌培养基)、TYA培养基、玉米醪培养基、中性红培养基、明胶麦芽汁培养基.
CaCO3,焦性没食子酸(即邻苯三酚)、Na2CO3,10%NaOH溶液,0.
5%美蓝水溶液,6%葡萄糖水溶液,钯粒(A型),NaBH4,KBH4,NaHCO3,柠檬酸.
带塞或塑料帽玻璃管(直径18~20mm,长180~200mm),1mL血浆瓶,250mL血浆瓶,2OmL和50mL针简,250mL三角瓶,试管,厌氧罐,厌氧袋(不透气的无毒复合透明薄膜塑料袋,14cm*32cm),培养皿,真空泵,带活塞干燥器,氮气钢瓶.
三、操作步骤(一)真空干燥器厌氧培养法此法不适用于培养需要CO2的微生物.
该法是在干燥器内使焦性没食子酸与氢氧化钠溶液发生反应而吸氧,形成无氧的小环境而使厌氧菌生长.
1.
培养基准备与接种将3支装有玉米醪培养基或RCM培养基的大试管放在水浴中煮沸l0min,以赶出其中溶解的氧气,迅速冷却后(切勿摇动)将其中2支试管分别接种丙酮丁醇梭菌和产气荚膜梭菌.
2.
干燥器准备与抽气在带活塞的干燥器内底部,预先放入焦性没食子酸粉末20g和斜放盛有200mL10%NaOH溶液的烧杯.
将接种有厌氧菌的培养管放入干燥器内.
在干燥器口上涂抹凡士林,密封后接通真空泵,抽气3~5min,关闭活塞.
轻轻摇动干燥器,促使烧杯中的NaOH溶液倒入焦性没食子酸中,两种物质混合发生吸氧反应,使干燥器中形成无氧小环境(图18-lA)3.
观察结果将干燥器置于37℃恒温箱中培养约7d,取出培养管,分别制片观察菌体特征.
图18-1厌氧培养示意图A干燥器厌氧培养装置1、连接真空泵;2、干燥器;3、试管;4、10%NaOH溶液;5、焦性没食子酸粉末B深层穿刺分离培养法1、塑料盖;2、营养琼脂;3、无菌橡皮塞;4、接种针穿刺至底部;5、培养后长出菌落(二)深层穿刺厌氧培养法此法操作简单,适用于一般厌氧微生物的活化和分离培养,但不能用于扩大培养.
1.
接种培养将玻璃管一头塞上橡胶塞,装入培养基(RCM或TYA培养基)的高度为管长的2/3,套上塑料帽或橡皮塞,灭菌并凝固后,将丙酮丁醇梭菌用接种针穿刺接种(图18—lB),置37℃恒温箱中培养6~7d.
2.
观察结果观察菌落形态特征并制片于显微镜下观察菌体的细胞形态,并记录结果.
(三)针筒厌氧培养法此法适于活化厌氧菌和小体积的扩大培养.
1.
培养基准备将灭菌的装有RCM或TYA培养基的血浆瓶放在沸水浴中加热10min,在瓶口胶塞上插上2枚医用针头排气,以赶出残留在培养基内的氧气.
随后将血浆瓶从沸水浴中取出,再用氮气钢瓶中的高纯氮气(99.
99%)通过胶塞上的一枚针头引人血浆瓶中,使血浆瓶内充满氮气,瓶内培养基在冷却过程中保持无氧状态.
2.
针筒装灌培养基将灭菌的针筒接上针头经胶塞刺人血浆瓶中,先利用瓶内氮气的压力将针筒的推杆慢慢推开,待吸入一定体积的氮气后取下针筒,排尽针筒内的气体.
按此重复操作3次,以排尽针筒内的残留空气而维持无氧状态.
使血浆瓶口朝下倾斜,利用瓶内压力将培养液缓慢注入针筒内,然后取下针筒,用经灭菌的带孔橡皮塞迅速把针筒头部塞住(图18-2).
图18—2针筒培养基分装装置图18—3针筒间对接法接种3.
接种培养采用无菌操作以菌种液针筒将菌穿刺接入培养液针筒中(图18-3),置37℃恒温培养,用于菌种活化可培养16~18h,用于测定菌体生长可培养6~7d.
4.
观察结果取菌制片观察.
(四)厌氧罐培养法此法利用透明的聚碳酸酯硬质塑料制成的一种小型罐状密封容器,采用抽气换气法充入氢气,利用钯作催化剂与罐内氧气发生作用达到除氧的目的,同时充入10%(V/V)的CO2以促进某些革兰氏阴性厌氧菌的生长(图18-4).
图18—4厌氧罐厌氧培养装置其实验操作过程如下:1.
制备厌氧度指示剂取3mL0.
5%美蓝水溶液用蒸馏水稀释至100mL;6mL0.
1mol/LNaOH溶液用蒸馏水稀释至l00mL;6g葡萄糖加蒸馏水至l00mL.
将上述3种溶液等体积混合,并用针筒注入安瓿管内lmL,沸水浴加热至无色,立即封口即成.
取一根直径1cm、长8cm的无毒透明塑料软管,将装有美蓝指示剂的安瓿管置于软管中,制成美蓝厌氧度指示管.
2.
培养基准备与接种将制成无菌无氧的RCM或TYA培养基平板,在无菌操作下迅速划线接种丙酮丁醇梭菌或产气荚膜梭菌,并立即将平皿倒置放入已准备好的厌氧罐中,同时放入一支美蓝厌氧指示剂管.
随后及时旋紧罐盖,达到完全密封.
3.
抽气换气将真空泵接通厌氧罐抽气接口(图18-4),抽真空至表指针0.
09~0.
093MPa(680~700mmHg柱)时,关闭抽气口活塞,用止血钳夹住抽气橡皮管.
打开氮气钢瓶气阀向厌氧罐内充入氮气,当真空表指针返回到零位终止充氮.
再接上述步骤抽气和充入氮气,如此重复2~3次,使罐中氧的含量达最低度.
最后充入的氮气使真空表指针达0.
02MPa(l60mmHg)时停止充氮气.
再开启CO2钢瓶阀门,向罐内充入CO2直至真空表指针达到0.
011MPa(80mmHg)时停止.
为除尽罐内残留的氧,以氢气袋(用医用"氧气袋"灌满氢气)气管连接向厌氧罐内充入氢气直至真空表指针回到零位为止.
充气完毕,封闭厌氧罐.
4.
恒温培养将厌氧罐置于37℃恒温箱中培养6~7d,注意罐中厌氧指示剂的颜色变化.
5.
观察结果和镜检从罐内取出平皿,观察菌落特征.
并挑取菌落作涂片,用结晶紫染液染色,镜检,比较不同菌的菌体细胞形态特征,并作记录.
(五)厌氧袋培养法厌氧袋除氧是利用氢硼化钠与水反应产生氢,在催化剂钯的作用下,氢与袋中氧结合生成水达到除氧目的,除氧效果可从袋中厌氧度指示剂观察.
同时,利用柠檬酸与碳酸氢钠的作用产生CO2,以有利于需要CO2的厌氧菌的生长.
其反应过程为:1.
厌氧袋选用无毒复合透明薄膜塑料,采用塑膜封口机或电热法烫制成20*40cm塑料袋.
2.
产气管取一根无毒塑料软管(直径2.
0cm,长20cm),管壁制成小孔,一端封实.
天平称取0.
4gNaBH4和0.
4gNaHCO3,用擦镜纸包成小包,塞入软管底部,其上基入3层擦镜纸,将装有5%柠檬酸溶液3mL的安瓿管塞入塑料管中,管口塞上有缺口的泡沫塑料小塞,即制成产气管.
3.
厌氧度指示管取一根无毒透明塑料软管(直径2cm,长10cm).
量取0.
5%美蓝水溶液3mL,用蒸馏水稀释至100mL;取0.
lmol/LNaOH溶液6mL,用蒸馏水稀释至100mL;称取6g葡萄糖加蒸馏水稀释成100mL.
将上述3种溶液等量混合后取2mL装入安瓿管,经沸水浴加热至无色后立即封口,即为厌氧度指示管.
4.
催化剂和吸湿剂催化剂钯粒(A型)10~20粒加热活化,随后装入带孔的小塑料硬管内,制成钯粒催化管.
取变色硅胶少许,用滤纸包好塞入带孔塑料管内,为吸湿剂管.
5.
培养基准备和接种将灭菌的中性红培养基和CaCO3明胶培养基分别在沸水浴中煮沸10min,以赶出其中溶解的氧,冷却至50C左右倒平板,冷凝后接种丙酮丁醇梭菌.
随后立即将平皿放入厌氧袋中,每袋可倒置平放3个平皿.
6.
封袋除氧和培养将产气管、厌氧度指示管、钯粒催化剂管和吸湿剂管分别放入袋中平皿两边,尽量赶出袋中空气,用宽透明胶带将袋口封住,用一根lcm宽、与袋口宽等长的有机玻璃条或小木条将袋口卷折2~3层,用夹子夹紧,严防漏气(图18-5).
使袋口倾斜向上,随后隔袋折断产气管中的安瓿管颈,使试剂反应产生H2和CO2,H2在钯粒催化下与袋内O2化合生成水.
经5~l0min左右,钯粒催化管处升温发热,生成少量水蒸汽.
在折断产气管半小时后,隔袋折断厌氧度指示管中的安瓶管颈,观察指示剂不变蓝,表明袋内己形成厌氧环境.
此时将厌氧袋转入37℃恒温箱中培养6~7d.
7.
观察结果和镜检从袋中取出平皿观察菌落特征.
丙酮丁醇梭菌在中性红平板上显示黄色菌落,挑取典型单菌落涂片染色后进行镜检,观察菌体细胞形态特征,并作记录.
图18—5厌氧袋厌氧培养装置四、注意事项1.
培养需要CO2的厌氧菌时,须在厌氧小环境中供应CO2.
2.
氢气是危险易爆气体,使用氢气钢瓶充氢时,应严格按操作规程进行,切勿大意,严防事故.
3.
选用干燥器、针筒、厌氧罐或厌氧袋时,应事先仔细检查其密封性能,以防漏气.
4.
已制备灭菌的培养基在接种前应在沸水浴中煮沸10min,以消除溶解在培养基中的氧气.
5.
针筒培养液刃天青指示剂出现红色,表明有残留氧气.
厌氧袋和厌氧罐中美蓝厌气度指示剂变成蓝色,表明除氧不够.
6.
产气荚膜梭菌为条件致病菌,防止进入口中和沾上伤口.
五、演示1.
显示深层穿刺厌氧培养的厌氧菌菌落特征及生长情况.
2.
选用真空干燥器、针筒、厌氧罐或厌氧袋厌氧培养法,演示该方法的操作过程,特别是厌氧罐的抽气换气和厌氧袋的封袋除氧操作过程.
六、实验报告1.
实验中选用厌氧培养法的培养结果:菌落形态特征菌体形态特征培养方法菌种名称菌落大小、形状、颜色、光滑度、透明度、气味菌体形态有无芽孢、芽孢形状、碘液染色液体培养特征备注2.
试比较以上厌氧培养方法的优缺点,并分析其成功的关键.
七、问题和思考1.
请设计一个试验方案,如何从土壤中分离、纯化和培养出厌氧菌.
2.
试举例说明研究厌氧菌的实际意义.
实验19免疫血清的制备一、实验目的和内容目的:学习和掌握免疫血清的制备方法,为凝集反应和沉淀反应准备凝集素和沉淀素.
内容:1、抗大肠杆菌血清(凝集素)的制备.
2、牛血清白蛋白抗血清(沉淀素)的制备.
二、实验材料和用具体重2~3kg的健康雄家兔、大肠杆菌(E.
coli)斜面菌种;牛血清白蛋白(蛋白含量1.
5mg/mL)、牛肉膏蛋白胨斜面培养基、0.
3%甲醛液(用0.
85%生理盐水配制)、75%酒精棉球、碘酒棉球、消毒干棉球;细菌比浊标准管、无菌吸管、无菌注射器(5mL、20mL)、注射针头(5号,B19)、无菌试管、装有玻璃珠的无菌血清瓶、解剖用具(解剖台、兔头夹、止血钳、解剖刀、眼科剪刀、镊子、动脉夹等)、双面刀片、丝线、玻璃管、胶管、离心机及无菌离心管、普通冰箱、超净工作台、水浴箱.
三、操作步骤(一)凝集素的制备1.
凝集原(颗粒性抗原)的制备(1)取37C恒温培养24h的牛肉膏蛋白胨大肠杆菌斜面.
(2)每支斜面菌种中加入5mL0.
3%甲醛液,小心地把菌苔洗下制成菌液.
(3)用无菌清洁吸管,吸取以上菌液,注入装有玻璃珠的无菌血清瓶内,振荡10~25min,分散菌块制成菌悬液.
(4)将含菌悬液的血清瓶置于60℃的水浴箱中水浴1h,并不时摇动,把菌杀死.
(5)将菌悬液重新接种至牛肉膏蛋白胨斜面培养基中,37℃培养24~48h,如有菌生长,则要在60℃水温中再处理.
若无菌生长则进行比浊测定其含菌量.
(6)凝集素的制备(1)免疫方法:选择2~3kg健康雄免,从耳缘静脉采血2mL,分离出血清.
该血清与准备免疫用的抗原进行凝集反应,以检查有无天然凝集素.
如没有或只有极微量时,该动物便可用来免疫.
最常用的免疫途径是耳缘静脉注射.
将家兔放在家兔固定箱内,一手轻轻拿起耳朵,用碘酒棉花球在耳外侧边缘静脉处消毒,然后用酒精棉球涂擦,并用手指轻轻弹几下静脉血管,使其扩张.
消毒细菌悬液瓶塞后,用无菌注射器及5号针头吸取菌液,沿着静脉平行方向刺入静脉血管,并慢慢注入菌液,注射完毕,用干棉球按压住注射处,然后拨出针头,并压迫血管注射处片刻,以防止血液向外溢出.
注射时发现注射处隆起,不易推进时,表明针尖不在血管中,应拨出针头,重找位置再注射.
有时针尖口被堵塞,菌液推不进去,应及时更换针头.
注射途径、剂量和日程安排等视抗原和动物不同而有所不同.
大肠杆菌免疫家兔的抗原注射剂量和日程安排如下表:日期第1日第2日第3日第4日第5日注射剂量/mL0.
20.
40.
61.
02.
0(2)试血:通常于最后一次注射后7~11d,从兔耳缘静脉抽取2mL血,分离析出血清,用试管凝集反应测定抗血清效价.
效价合格即可大量采血,如效价不高,可继续注射抗原免疫,提高效价.
(3)采血:采血分为心脏采血和颈动脉放血.
心脏采血:使免疫家兔仰卧于台上,四肢固定.
用左手探明心脏博动最明显处,用碘酒棉球与酒精棉球消毒后,右手握消毒过的20mL注射器和B19号针头,在上述部位的肋骨间隙与胸部呈45°角刺入心脏,微微抽取针筒,此时可发现血液涌入注射器中便可徐徐抽取血液.
2.
5kg家兔一次可取血20~30mL.
取血完毕后,用消毒棉球按压进针处迅速拨出针头,进针处用棉球继续压住.
并马上将所采的血液注入无菌大试管内,斜放,待血液凝固后,置于37℃恒温箱中30min,使血清充分析出,然后放入4~6C冰箱中.
颈动脉采血:将免疫家兔固定于兔台上,用少量乙醚麻醉,剪去颈部的毛,然后用碘酒棉球和酒精棉球消毒.
沿正中线将颈部皮肤切开到锁骨间,拨开肌膜,暴露出气管,在气管深侧处找到搏动的颈动脉.
小心地将颈动脉和迷走神经剥离分开4~5cm.
用镊子拉出颈动脉,用丝线扎紧血管的离心端,在血管的向心端用止血钳夹住.
然后用眼科剪在丝线与止血钳之间的血管上剪一个V型小切口,将弯咀眼科镊自切口插入,使其张开,同时将一小玻管插入,用丝线扎紧,以防玻管脱漏.
玻管另一端接入一条胶管,胶管通入大试管(或大离心管)内,然后将止血钳慢慢松开,使血液流入试管,直至动物死亡,无血液流出为止.
(4)抗血清分离与保存:取凝固血液于4000r/min,离心20min,获得抗血清(即凝集素).
加入石炭酸或硫柳汞使其浓度分别达到0.
5%或0.
01%.
测定抗血清的效价后,封好瓶口,贴好标签,注明抗血清名称、效价及日期,置冰箱保存备用.
(二)沉淀素的制备抗原为可溶性抗原(如脂多糖、类毒素或可溶性蛋白等).
通常每kg兔体重注射2mg蛋白,牛血清白蛋白抗原浓度为1.
5mg/mL,则2.
5kg兔应注射5mg蛋白.
免疫方法、采血方法和抗血清(沉淀素)的分离可参照凝集素制备方法,但效价测定则用沉淀反应来测定.
四、注意事项由于每个动物对免疫反应不同,产生的抗体效份有高有低,所以在制备抗血清时至少免疫两只家兔.
如须保留该免疫动物,刚采取心脏直接取血,取血后应从静脉注射等体积的50%葡萄糖溶液,经过2~3个月的饲养,方可再次免疫.
若不保留动物须一次取大量血时,则采用颈动脉放血法.
五、演示1.
耳缘静脉注射抗原的方法.
2.
心脏取血的操作过程.
六、实验报告1.
记录免疫家兔的操作过程及免疫过程中兔的反应.
2.
实验操作过程的体会.
七、问题和思考1.
如果不用生理盐水来配制抗原,以这样的抗原免疫兔成不成为什么2.
现有一支苏云金杆菌(Bacillusthuringinesis)斜面菌种,你能否制备出相应的凝集素阐述其主要步骤.
实验20凝集反应一、实验目的和内容目的:学习和掌握用试管凝集反应测定抗血清效价的方法.
内容:1、玻片凝集试验.
2、试管凝集试验.
二、实验材料和用具含10亿个/mL大肠杆菌(E.
coli)的生理盐水菌悬液、大肠杆菌抗血清、生理盐水.
载玻片、小试管(1cm*6.
5cm)、试管架、移液管、吸管、水浴箱.
三、操作步骤(一)玻片凝集试验1.
在载玻片两端各滴一滴大肠杆菌悬液.
2.
在一端的菌悬液中加入一滴1:10稀释的大肠杆菌抗血清,另一端悬液加入一滴生理盐水.
3.
将载玻片小心地振动使混合液混匀后静置室温中,数分钟后便可观察到抗血清端产生凝集块,而另一端为生理盐水对照.
若反应不明显,可放入培养皿中(皿内放入湿滤纸,以保持一定湿度),37℃保温30min后观察结果.
亦可将载玻片放置显微镜下,凝集块明显可见.
(二)试管凝集试验1.
抗血清的稀释抗血清稀释采取对倍稀释法.
取干净小试管10支,排列在试管架上,依次注明号码,每支试管用移液管加入0.
5mL生理盐水.
用移液管吸取1:10稀释的大肠杆菌抗血清0.
5mL加入第1管,在管内连续吹吸3次,使血清与生理盐水充分混合,然后吸取0.
5mL加入第2管,同样混匀后吸取0.
5mL加入第3管,依次类推,直至第9管,混匀后从第9管中吸取0.
5mL弃去.
第10管不加血清作为对照.
此时从第1管到第9管的血清稀释倍数分别1:20,1:40,1:80,1:160,1:320,1:640,1:1280,1:2560,1:5120.
2.
加入抗原从第10支管开始,由后向前每支管依次加入0.
5mL大肠杆菌菌悬液.
此时血清稀释倍数相应加大一倍.
3.
抗原抗体反应把各管混合液振摇混匀,置37℃水浴箱中水浴4h或在室温中过夜,观察结果.
4.
结果观察与效价判断(1)生理盐水对照管中的抗原(细菌)应分散,无凝集块沉淀而呈混浊菌悬液.
(2)试验管如有凝集,管底可见到凝集块.
液体上部澄清、半澄清或混浊度降低,管底凝集块轻摇即浮起,呈片块状.
(3)凝集强弱的判断(以"+"表示)"++++":很强,表示细菌完全凝集,凝集块完全沉于管底,菌液澄清.
"+++":很强,表示细菌绝大部分凝集,凝集块小沉于管底,菌液有轻微混浊.
"++":中等强度,表示细菌部分凝集沉于管底,凝集块呈颗粒状,菌液半澄清.
"+":弱,表示细菌少数凝集,菌液混浊.
"-":不凝集,菌液混浊与生理盐水对照管同.
血清的效价就是呈现50%凝集(即"++"反应)的最高血清稀释倍数.
四、注意事项1.
所用载玻片、试管、移液管等用具均应干净.
2.
在血清对倍稀释过程中,力求准确.
一是防止液体溢出管外,二是在连续吸3次混匀液体时,第2次吸人移液管中的液体高度不能低于第1次,最好是每一稀释度换一支洗净的移液管.
3.
试管水浴或静置后,观察前不宜摇动振荡,以免影响实验结果的准确性.
五、演示1.
对倍稀释过程.
2.
玻片凝集的显微示范镜,观察凝集块.
六、实验报告(一)记录玻片凝集试验结果,试比较血清端与生理盐水端结果的不同,并解释其原因.
(二)抗血清的效价测定结果.
1.
抗血清效价测定结果:试管12345678910最后血清稀释倍数凝集强弱2.
确定抗血清的效价为.
七、问题和思考1.
为什么取"++"的抗血清最高稀释倍数作为抗血清的效价2.
在试管凝集试验中,有否出现不正常现象并分析其原因.
3.
现有枯草孢杆菌斜面菌种及未知效价的相应抗血清,你能否测定出其血清效价描述其操作过程.
实验21沉淀反应一、实验目的和内容目的:学习和掌握环状沉淀反应及双向琼脂扩散沉淀反应方法.
内容:1.
用牛血清白蛋白及兔抗牛血清白蛋白,进行环状沉淀反应.
2.
用以上抗原和抗体进行双向琼脂扩散沉淀反应试验.
二、实验材料和用具可溶性抗原(牛血清白蛋白)、兔抗牛血清白蛋白抗血清、生理盐水(0.
85%NaCl).
洗净载玻片、小试管、移液管、玻璃毛细吸管、不锈钢吸管.
三、操作步骤(一)环状沉淀反应1.
取1:25的牛血清白蛋白lmL,用生理盐水以对倍稀释法稀释成1:50,1:100,1:200,1:400,1:800,1:1600,1:3200的抗原溶液.
2.
取9支洁净干燥的小试管,每支小试管如入1:2的兔抗牛血清白蛋白抗血清0.
5mL.
3,用移液管吸取上面已稀释好的牛血清白蛋白(抗原),按表21—1要求,从最大稀释度开始,沿着管壁徐徐加入各小试管中,使与下层抗体之间形成交界面,切勿摇动混匀,第8管加入生理盐水及第9管加入兔抗血清以作对照.
4.
静置15~30min,观察在两液面交界处有无白色环状沉淀物出现.
5.
结果记录凡有白色环状沉淀物者记"+",没有沉淀者记"-".
最大稀释度的抗原与抗体交界面之间还出现白色环状沉淀者,此管的抗原稀释倍数即为抗体(沉淀素)的效价.
表21-1环状沉淀反应记录表试管123456789抗体(1:2)/mL抗原稀释度抗原用量/mL0.
51:500.
50.
51:1000.
50.
51:2000.
50.
51:4000.
50.
51:8000.
50.
51:16000.
50.
51:32000.
50.
5盐水0.
50.
5免血清(1:50)0.
5结果(二)双向琼脂扩散沉淀反应1.
称取1g优质琼脂于l00mLpH7.
2生理盐水中,在沸水中水浴使琼脂溶化后,加入1%的硫柳汞lmL防腐.
每块载玻片(7.
5cm*4.
5cm)滴加4mL琼脂溶液,待凝固后用不锈钢吸管在两端(A、B端)打梅花形小孔,孔径和孔距均为3mm.
亦可直接用不锈钢管打孔,再用接种针挑去梅花形孔中的琼脂块.
2.
在A端梅花形孔中,用玻璃毛细吸管在中心孔中加入适当稀释的抗血清(抗体),注意要使孔加满,但不外溢;周围孔加入不同稀释度的抗原(例如1:10,1:20,1:40,1:80,1:160,1:320).
在B端梅花形孔中,同样在中央孔中加入适当稀释度的抗原,周围的孔中加入不同稀释度的抗体.
3.
把以上载玻片放入带盖的铝盒中,下面垫上3一4层湿纱布,置37℃扩散24~48h,可看见抗原和抗体反应处呈现的沉淀线.
4.
记录结果注意沉淀线数目及偏向.
四、注意事项1.
在进行环状沉淀反应试验时,一定要沿着管壁加入抗原,而且切勿摇动,否则影响沉淀环的形成.
2.
双向琼脂扩散试验时,抗原或抗体的稀释度多少才合适,教师必须进行预测,否则由于抗原、抗体比例不合适而造成假阴性.
五、演示1.
沿着管壁徐徐加入抗原的操作.
2.
在琼脂板上打梅花孔的操作.
六、实验报告记录环状沉淀反应的结果并确定抗体的效价.
按照表21-2和表21-3记录双向琼脂扩散结果,并分析寻找其规律性.
表21-2载玻片A端结果抗原稀释度1:101:201:401:801:1601:320沉淀线数目表21-3载玻片B端结果抗体稀释度1:101:201:401:801:1601:320沉淀线数目七、问题和思考1.
比较凝集反应与沉淀反应有何异同2.
双向琼脂扩散沉淀反应试验中,抗原或抗体浓度大于相应抗体或抗原时,沉淀线会出现何种现象为什么会出现多条沉淀线3.
如发现衣服上有一血迹,怀疑是人血,你能用简单的方法进行鉴定吗并叙述其方法步骤.
第二部分实际应用实验实验22乳酸发酵与乳酸菌饮料一、实验目的和内容目的:学习乳酸发酵和制作乳酸菌饮料的方法,了解乳酸菌的生长特性.
内容:1.
从新鲜酸乳中进行乳酸菌的分离纯化.
2.
乳酸发酵及检测.
3.
乳酸菌饮料制作.
4.
自制乳酸质量品尝.
二、实验材料和用具嗜热乳酸链球菌(Streptococcusthermophilus)、保加利亚乳酸杆菌(Lactobacillusbulgaricus),乳酸菌种也可以从市场销售的各种新鲜酸乳或酸乳饮料中分离;BCG牛乳培养基、乳酸菌培养基、脱脂乳试管(见注)、脱脂乳粉或全脂乳粉、鲜牛奶、蔗糖、碳酸钙;恒温水溶锅、酸度计、高压蒸汽灭菌锅、超净工作台、培养箱、酸乳瓶(200~280mL,)、培养皿、试管、300mL三角瓶.
三、操作步聚(一)乳酸菌的分离纯化1.
分离取市售新鲜酸乳或泡制酸菜的酸液稀释至10-5,,取其中的10-4、10-52个稀释度的稀释液各0.
1~0.
2mL,分别接入BCG牛乳培养基琼脂平板上,用无菌涂布器依次涂布;或者直接用接种环蘸取原液平板划线分离,置40℃培养48h,如出现圆形稍扁平的黄色菌落及其周围培养基变为黄色者初步定为乳酸菌.
2.
鉴别选取乳酸菌典型菌落转至脱脂乳试管中,40℃培养8~24h若牛乳出现凝固,无气泡,呈酸性,涂片镜检细胞杆状或链球状(两种形状的菌种均分别选入),革兰氏染色呈阳性,则可将其连续传代4~6次,最终选择出在3~6h能凝固的牛乳管,作菌种待用.
(二)乳酸发酵及检测1.
发酵在无菌操作下将分离的1株乳酸菌接种于装有300mL乳酸菌培养液的500mL三角瓶中,40~42℃静止培养.
2.
检测为了便于测定乳酸发酵情况,实验分2组.
一组在接种培养后,每6~8h取样分析,测定pH值.
另一组在接种培养24h后每瓶加入CaCO33g(以防止发酵液过酸使菌种死亡),每6~8h取样,测定乳酸含量(方法见注),记录测定结果.
(三)乳酸菌饮料的制作1.
将脱脂乳和水以1:7~10(WW)的比例,同时加入5%--6%蔗糖,充分混合,于80~85℃灭菌10~5min,然后冷却至35~40℃,作为制作饮料的培养基质.
2.
将纯种嗜热乳酸链球菌、保加利亚乳酸杆菌及两种菌的等量混合菌液作为发酵剂,均以2%~5%的接种量分别接入以上培养基质中即为饮料发酵液,亦可以市售鲜酸乳为发酵剂.
接种后摇匀,分装到已灭菌的酸乳瓶中,每一种菌的饮料发酵液重复分装3~5瓶,随后将瓶盖拧紧密封.
3.
把接种后的酸乳瓶置于40--42℃恒温箱中培养3~4h.
培养时注意观察,在出现凝乳后停止培养.
然后转入4~5℃的低温下冷藏24h以上.
经此后熟阶段,达到酸乳酸度适中(pH4~4.
5),凝块均匀致密,无乳清析出,无气泡,获得较好的口感和特有风味.
4.
以品尝为标准评定酸乳质量采用乳酸球菌和乳酸杆菌等量混合发酵的酸乳与单菌株发酵的酸乳相比较,前者的香味和口感更佳.
品尝时若出现异味,表明酸乳污染了杂菌.
比较项目按表22-1.
四、注意事项1.
采用BCG牛乳培养基琼脂平板筛选乳酸菌时,注意挑取典型特征的黄色菌落,结合镜检观察,有利高效分离筛选乳酸菌.
2.
制作乳酸菌饮料,应选用优良的乳酸菌,采用乳酸球菌与乳酸杆菌等量混合发酵,使其具有独特风味和良好口感.
3.
牛乳的消毒应掌握适宜温度和时间,防止长时间采用过高温度消毒而破坏酸乳风味.
4.
作为卫生合格标准还应按卫生部规定进行检测,如大肠菌群检测等.
经品尝和检验,合格的酸乳应在4℃条件下冷藏,可保存6~7d.
五、实验报告1.
乳酸发酵过程、检测结果及结果分析.
表22—1乳酸菌单菌及混合菌发酵的酸乳品评结果品评项目乳酸菌类凝乳情况口感香味异味pH值结论球菌杆菌球菌杆菌混合(1:1)2.
将发酵的酸乳品评结果记录于表22—1中;六、问题和思考1、发酵酸乳为什么能引起凝乳2.
为什么采用乳酸菌混合发酵的酸乳比单菌发酵的酸乳口感和风味更佳3.
试设计一个从市售鲜酸乳中分离纯化乳酸菌的制作乳酸菌饮料的程序.
注:(一)脱脂乳试管直接选用脱脂乳液或按脱脂乳粉与5%蔗糖水为1:10的比例配制,装量以试管的1/3为宜,115℃灭菌15min.
(二)乳酸检测方法1.
定性测定取酸乳上清液的10mL于试管中,加入10%H2SO41mL,再加2%KMnO41mL,此时乳酸转化为乙醛,把事先在含氨的硝酸溶液中浸泡的滤纸条搭在试管口上,微火加热试管至沸,若滤纸变黑,则说明有乳酸存在,这里因为加热使乙醛挥发的结果.
2.
定量测定:(1)测定方法:取稀释10倍的酸乳上清液0.
2mL,加至3mLpH9.
0的缓冲液中,再加入0.
2mLNAD溶液,混匀后测定OD340nm值为A1,然后加入0.
02mLL(+)LDH,0.
02D(一)LDH,25℃保温lh后测定OD340nm值为A2.
同时用蒸馏水代替酸乳上清液作对照,测定步骤及条件完全相同,测出的相应值为Bl和B2.
(2)计算公式:乳酸/g·(100mL)-1=(V*M*ε*D)÷1000*ε*1*VsV:比色液最终体积(3.
44mL)M:乳酸的克分子重量(lmol/l=90g)ε:(A2-A1)-(B2-B1)D:稀释倍数(10)ε:NADH在340nm吸光系数(6.
3*103*l*mol-1*cm-l)1:比色皿的厚度(0.
1cm)Vs:取样体积(0.
2mL)(3)测定乳酸试剂的配制(见附录)3.
酸乳的检查指标①感观指标:酸乳凝块均匀细腻,色泽均匀无气泡,有乳酸特有的悦味;②合格的理化指标:如脂肪≥3%,乳总干物质≥11.
5%,蔗糖≥5.
00%,酸度70~110T,Hg﹤0.
01*10-6mg/mL等;③无致病菌,大肠菌群≤40个/100mL.
实验23酒精发酵及糯米甜酒的酿制一、实验目的和内容目的:学习和掌握酵母菌发酵糖产生酒精和酒曲发酵糯米配制糯米甜酒的方法.
内容:1.
酵母菌的酒精发酵.
2.
糯米甜酒的酿制.
二、实验材料和用具培养的酿酒酵母(Saccharomycescerevisiae)斜面菌种.
酒精发酵培养基、甜酒曲、蒸馏水、无菌水、糯米.
铝锅、电炉、三角瓶、牛皮纸、棉绳、蒸馏装置、水浴锅、振荡器、酒精比重计.
三、操作步骤(一)酵母菌的酒精发酵1.
培养基配制好的发酵培养基分装人300min三角瓶中,每瓶100mL,121℃湿热灭菌20~30min.
2.
接种和培养于培养24h的酿酒酵母斜面中加入无菌水5mL,制成菌悬液.
并吸取lmL,接种于装有100mL培养基的三角瓶中,一共接2瓶,其中1瓶于30℃恒温静止培养,另1瓶置30℃恒温振荡培养.
3.
酵母菌数目的计数每隔24h取样,经10倍稀释后进行细胞计数(方法参阅"细菌数量测定").
4.
酒精蒸馏及酒精度的测定取60mL已发酵培养3d的发酵液加至蒸馏装置的圆底烧瓶中,在水浴锅中85~95℃下蒸馏.
当开始流出液体时,准确收集40mL于量筒中,用酒精比重计测量酒精度.
5.
品尝取少量一定浓度(30~40度)的酒品尝,体会口感.
(二)糯米甜酒的配制1.
甜酒培养基制作称取一定量优质糯米(糙糯米更好).
用水淘洗干净后,加水量为米水比1:1,加热煮熟成饭.
或者糯米洗净后,用水浸透,沥干水后,加热蒸熟成饭,即为甜酒培养基.
2.
接种糯米冷却至35℃以下,加入适量的甜酒曲(用量按产品说明书)并喷洒一些清水拌匀,然后装入到干净的三角瓶中或装入聚丙烯袋中.
装饭量为容器的l/3~2/3,中央挖洞,饭面上:再撒一些酒曲,塞上棉塞或扎好袋口,置25~30℃下培养发酵.
3.
培养发酵发酵2d便可闻到酒香味,开始渗出清液,3~4d渗出液越来越多,此时,把洞填平,让其继续发酵.
4.
产品处理培养发酵至第7d取出,把酒槽滤去,汁液即为糯米甜酒原液,加入一定量的水.
加热煮沸便是糯米甜酒,即可品尝.
四、注意事项酿制糯米甜酒时糯米饭一定要煮熟煮透,不能太硬或夹生;米饭一定要凉透至35℃以下才能拌酒曲,否则会影响正常发酵.
五、演示酒精蒸馏过程六、实验报告记录酵母酒精发酵过程,比较两种培养方法结果的不同,并解释其原因.
记录糯米配制糯米甜酒的发酵过程,以及糯米甜酒的外观、色、香、味和口感.
七、问题和思考1.
为什么糯米饭温度要降至35℃以下拌酒曲,发酵才能正常进行糯米饭一开始发酵时要挖个洞,后来又填平,这有什么作用2.
酒精发酵培养基配方中如去掉KH2PO4,同样接人酒精酵母菌进行发酵,将出现何种结果为什么实验24微生物菌种保藏一、实验目的和内容目的:了解并掌握菌种保藏的常用方法及其优缺点.
内容:1、学习斜面传代保藏方法.
2、学习液体石蜡保藏方法.
3、学习沙土管保藏方法.
4、学习冷冻干燥保藏方法.
二、实验材料和用具细菌、酵母菌、放线菌和霉菌斜面菌;牛肉膏蛋白胨培养基斜面(培养细菌),麦芽汁培养基斜面(培养酵母菌),高氏1号培养基斜面(培养放线菌),马铃薯蔗糖培养基斜面(培养丝状真菌).
无菌水、液体石蜡、P2O5、脱脂奶粉、10%HCl、干冰、95%乙醇、食盐、河沙、瘦黄土(有机物含量少的黄土);无菌试管、无菌吸管(1mL及5mL)、无菌滴管、接种环、40目及100目筛子、干燥器、安瓿管、冰箱、冷冻真空干燥装置、酒精喷灯、三角烧瓶(250mL).
三、操作步骤下列各方法可根据实验室具体条件与需要选做.
(一)斜面传代保藏法l.
贴标签取各种无菌斜面试管数支,将注有菌株名称和接种日期的标签贴上,贴在试管斜面的正上方,距试管口2~3cm处.
2.
斜面接种将待保藏的菌种用接种环以无菌操作法移接至相应的试管斜面上,细菌和酵母菌宜采用对数生长期的细胞,而放线菌和丝状真菌宜采用成熟的袍子.
3.
培养细菌37℃恒温培养18~24h,酵母菌于28~30℃培养36~60h,放线菌和丝状真菌置于28℃培养4~7d.
4.
保藏斜面长好后,可直接放入4℃冰箱保藏.
为防止棉塞受潮长杂菌,管口棉花应用牛皮纸包扎,或换上无菌胶塞,亦可用熔化的固体石蜡熔封棉塞或胶塞.
保藏时间依微生物种类而不同,酵母菌、霉菌、放线菌及有芽抱的细菌可保存2~6个月,移种一次;而不产芽孢的细菌最好每月移种一次.
此法的缺点是容易变异,污染杂菌的机会较多.
(二)液体石蜡保藏法l.
液体石蜡灭菌在250mL三角烧瓶中装入100mL液体石蜡,塞上棉塞,并用牛皮纸包扎,12l℃湿热灭菌30min,然后于40℃温箱中放置l4d(或置于105~110℃烘箱中lh),以除去石蜡中的水分,备用.
2.
接种培养同斜面传代保藏法.
3.
加液体石蜡用无菌滴管吸取液体石蜡以无菌操作加到已长好的菌种斜面上,加入量以高出斜面顶端约1cm为宜.
4.
保藏棉塞外包牛皮纸,将试管直立放置于4℃冰箱中保存.
利用这种保藏方法,霉菌、放线菌、有芽孢细菌可保藏2年左右,酵母菌可保藏1~2年,一般无芽孢细菌也可保藏1年左右.
5.
恢复培养用接种环从液体石蜡下挑取少量菌种,在试管壁上轻靠几下,尽量使油滴净,再接种于新鲜培养基中培养.
由于菌体表面粘有液体石蜡,生长较慢且有粘性,故一般须转接2次才能获得良好菌种.
(三)沙土管保藏法l.
沙土处理(1)沙处理:取河沙经40目过筛,去除大颗粒,加10%HCl浸泡(用量以浸没沙面为宜)2~4h(或煮沸30min),以除去有机杂质,然后倒去盐酸,用清水冲洗至中性,烘干或晒干,备用.
(2)土处理:取非耕作层瘦黄土(不含有机质),加自来水浸泡洗涤数次,直至中性,然后烘干,粉碎,用100目过筛,去除粗颗粒后备用.
2.
装沙土管将沙与土按2:1,3:1或4:1(W/W)比例混合均匀装入试管中(10mm*100mm,装置约7cm高,加棉塞,并外包牛皮纸,12l℃湿热灭菌30min,然后烘干.
3.
无菌试验每10支沙土管任抽一支,取少许沙土接入牛肉膏蛋白胨或麦芽汁培养液中,在最适的温度下培养2~4d,确定无菌生长时才可使用.
若发现有杂菌,经重新灭菌后,再作无菌试验,直到合格.
4.
制备菌液用5mL无菌吸管分别吸取3mL无菌水至待保藏的菌种斜面上,用接种环轻轻搅动,制成悬液.
5.
加样用1mL吸管吸取上述菌悬液0.
1~0.
5mL加入沙土管中,用接种环拌匀.
加入菌液量以湿润沙土达2/3高度为宜.
6.
干燥将含菌的沙土管放入干燥器中,干燥器内用培养皿盛P2O5作为干燥剂,可再用真空泵连续抽气3~4h,加速干燥.
将沙土管轻轻一拍,沙土呈分散状即达到充分干燥.
7.
保藏沙土管可选择下列方法之一来保藏:(1)保存于干燥器中;(2)用石蜡封住棉花塞后放入冰箱保存;(3)将沙土管取出,管口用火焰熔封后放入冰箱保存;(4)将沙土管装入有CaCl2等干燥剂的大试管中,塞上橡皮塞或木塞,再用蜡封口,放入冰箱中或室温下保存.
8.
恢复培养使用时挑取少量混有孢子的沙土,接种于斜面培养基上,或液体培养基内培养即可,原沙土管仍可继续保藏.
此法适用于保藏能产生芽孢的细菌及形成孢子的霉菌和放线菌,可保存2年左右.
但不能用于保藏营养细胞.
(四)冷冻干燥保藏法1.
准备安瓿管选用内径5mm,长10.
5cm的硬质玻璃试管,用10%HCl浸泡8~10h后用自来水冲洗多次,最后用去离子水洗1~2次,烘干,将印有菌名和接种日期的标签放人安瓿管内,有字的一面朝向管壁.
管口加棉塞,121℃灭菌30min.
2.
制备脱脂牛奶将脱脂奶粉配成20%乳液,然后分装,121℃灭菌30min,并作无菌试验.
3.
准备菌种选用无污染的纯菌种,培养时间,一般细菌为24~48h,酵母菌为3d,放线菌与丝状真菌7~10d.
4.
制备菌液及分装吸取3mL无菌牛奶直接加入斜面菌种管中,用接种环轻轻搅动菌落,再用手摇动试管,制成均匀的细胞或孢子悬液.
用无菌长滴管将菌液分装于安瓿管底部,每管装0.
2mL.
5.
预冻将安瓿管外的棉花剪去并将棉塞向里推至离管口约15mm处(图24—2A),再通过乳胶管把安瓶管连接于总管的侧管上,总管则通过厚壁橡皮管及三通短管与真空表及干燥瓶、真空泵相连接(图24—1),并将所有安瓶管浸入装有干冰和95%乙醇的预冷槽中,(此时槽内温度可达-40~-50℃),只需冷冻1h左右,即可使悬液冻结成固体.
图24—1真空冷冻干燥装置6.
真空干燥完成预冻后,升高总管使安瓿管仅底部与冰面接触,(此处温度约-10℃),以保持安韶管内的悬液仍呈固体状态.
开启真空泵后,应在5~15min内使真空度达66.
7Pa以下,使被冻结的悬液开始升华,当真空度达到26.
7~13.
3Pa时,冻结样品逐渐被干燥成白色片状,此时使安瓿管脱离冰浴,在室温下(25~30℃)继续干燥(管内温度不超过30C),升温可加速样品中残余水分的蒸发.
总干燥时间应根据安瓿管的数量,悬浮液装量及保持剂性质来定,一般3~4h即可.
7.
封口样品干燥后继续抽真空达1.
33Pa时,在安瓿管棉塞的稍下部位用酒精喷灯火焰灼烧,拉成细颈并熔封(图24-2B、C),然后置4℃冰箱内保藏.
8.
恢复培养用75%乙醇消毒安瓿管外壁后,在火焰上烧热安瓿管上部,然后将无菌水滴在烧热处,使管壁出现裂缝,放置片刻,让空气从裂缝中缓慢进入管内后,将裂口端敲断,这样可防止再用无菌的长颈滴管吸取菌液至合适培养基中,放置在最适温度下培养.
冷冻干燥保藏法综合利用了各种有利于菌种保藏的因素(低温、干燥和缺氧等),是目前最有效的菌种保藏方法之一.
保存时间可长达10年以上.
图24—2安瓿管的处理A.
棉塞推向管内的位置;B.
拉细颈;C.
熔封四、注意事项1.
从液体石蜡封藏的菌种管中挑菌后,接种环上带有油和菌,故接种环在火焰上灭菌时要先在火焰边烤干再直接灼烧,以免菌液四溅,引起污染.
2.
在真空干燥过程中安瓿管内样品应保持冻结状态,以防止抽真空时样品产生泡沫而外溢.
3.
熔封安瓿管时注意火焰大小要适中,封口处灼烧要均匀,若火焰过大,封品处易弯斜,冷却后易出现裂缝而造成漏气.
五、演示1.
冷冻真空干燥装置的连接及使用.
2.
熔封安瓿管操作.
六、实验报告1.
按以下项目列表记录菌种保藏方法和结果:菌种名称培养条件接种日期中文名学名培养基培养温度保藏方法保藏温度操作要点2.
试述各种菌种保藏方法的优、缺点.
七、问题和思考1.
如何防止菌种管棉塞受潮和杂菌污染2.
冷冻干燥装置包括哪几个部件各个部件起什么作用3.
现有一个纤维素酶的高产霉菌菌株,你选用什么方法保存试设计一个实验方案.
实验25食用菌培养I食用菌组织分离一、目的和要求掌握了解食用菌组织分离的方法和实际操作技术,明确食用菌组织分离在食用菌生产中的重要性.
二、材料和用具培养皿、试管斜面培养基、平菇,金针菇或蘑菇较成熟的子实体、酒精灯、接种针、75%酒精,火柴、甲醛、高锰酸钾、新洁尔灭消毒液以及温箱、冰箱等.
三、说明在食用菌生产中采用组织分离的方法繁殖母种是大多数菌类普遍采用的方法,而组织分离成功与否是与种菇子实体的选择、分离过程中的操作方法等分不开的.
这直接关系到所繁菌种的优劣.
因此食用菌组织分离是食用菌生产中的重要环节之一.
四、方法与步骤每班同学分为二大组4小组,(以每大组为单位进行培养基制备工作)组织分离接种以小组为单位进行,每个同学接种8支试管母种(平菇4支、金针菇4支).
在未感染病虫和杂菌的菇瓶或菇床上选择种菇,各类食用菌种菇均须选具有本品种特征特性的较成熟的第一、二批菇作种菇.
平菇选朵大肉厚的作种菇.
金针菇则选择朵大,菇柄长的且黄白色部分较长的菇作种菇.
蘑菇选择菇形圆整、洁白、肉厚较成熟未开伞的作种菇.
将选好的种菇剪去过长的菌柄,放入接种箱内进行消毒,种菇均用75%的酒精擦洗菌盖、菌柄.
然后用无菌小刀从菌柄中部纵向切开,或把种菇撕开,在菌盖与菌柄交界处或菌盖带菌褶部分挑取一小块组织,移接到试管培养基上.
平菇也可不用酒精擦洗直接将种菇撕开,挑取一小块组织移接到培养基上.
置于22~26℃左右温度下培养3~5天就可看到组织上产生白色绒毛状菌丝,并向培养基上生长.
菌丝长满斜面后,管口用塑料薄膜或防潮纸包扎,即可放入5℃电冰箱中保藏.
第一大组采用菌盖与菌柄交界处组织进行分离,第二大组采用菌盖带菌褶部分进行组织分离.
五、作业认真按操作规程进行工作,根据观察结果比较两菌种间菌丝生长情况和同一菌种不同部位组织分离后菌丝生长情况,评价何种部位更适宜该菌种的组织分离繁殖,并对操作的各个环节提出改进建议.
II食用菌孢子分离一、目的要求:了解食用菌孢子分离的方法,操作技术以及应用.
二、材料和用具孢子收集器、75%酒精、0.
25%的新洁尔灭、蘑菇、平菇子实体、接种针等.
三、方法和步骤在无菌操作操作下使孢子在适宜的培养基上萌发,长成菌丝体而获得纯菌种的方法称为孢子分离法.
其特点是:菌丝菌龄短,因是有性繁殖产物,其菌丝生命力强.
侵染病毒的菌类可用孢子分离法脱毒.
在一般菌种分离中,为了避免异宗接合的菌类如香菇、平菇产生单孢子不孕现象,一般都采用多孢分离法.
单孢分离法主要应用于食用菌的杂交育种.
但双孢蘑菇、草菇等同宗接合菌类可采用单孢分离法.
1.
种菇的选择在生产中必须选择优良品系中的优良个体作分离材料.
2.
孢子采集方法(1)孢子弹射分离法它是利用孢子能自动弹射出子实体层的特性来收集孢子.
收集有几种不同的装置.
①整菇插种法,需用一套孢子收集器(图25-1)来收集孢子,将钟罩上的孔加上棉塞或包上6~8层纱布,放在垫有4~6层纱布(浸过0.
1%升汞液)的塘瓷盘上,纱布上放一培养器,内放一个不锈钢支架.
把收集器包装好,灭菌备用.
将菌幕未破裂的成熟子实体洗干净,用0.
1%升汞溶液或0.
25%的新洁尔灭浸泡2~3min,以杀死表面的杂菌.
对于菌幕破裂、子实层已外露的子实体或无菌幕包裹的子实体,可用棉花蘸75%酒精涂擦子实体表面消毒.
按无菌操作要求移入孢子收集器,插在支架上,在适宜的温度中培养.
2~3天后孢散落在培养皿中,加入无菌水,用针筒吸取孢子液,接种在斜面培养基中央,置于22~26℃恒温箱中培养即可.
②钩悬法(图25—2),在生产上,采集木耳、银耳孢子常用此法,伞菌也可采用此法.
先将新鲜成熟的耳片用无菌水冲洗,然后用无菌纱布将水吸干,取一小片挂在灭菌的钩子上(伞菌则消毒后挂上),钩子的另一端挂在三角瓶口,瓶内装有培养基,在25℃下培养24h.
孢子落到培养基上后,取出耳片,塞上棉塞继续培养,然后再转入试管中培养.
③贴附法,取一小块成熟的菌褶或小块菌盖,用溶化的琼脂或胶水、浆糊(需先灭菌)贴附在试管斜面的上方或培养皿皿盖上,经6-12h,待孢子落下后,立即将试管或培养皿中的培养基移到另一消毒过的空试管或培养皿中进行培养.
图25—1孢子收集器图25—2钩悬法采集孢子1-消毒棉塞;2-玻璃钟罩;3-种菇1-棉花塞;2-铁丝钩;3-种菇;4-培养基4-培养皿;5-瓷盘;6-浸过升汞水的纱布(2)菌褶上涂抹法将伞菌手实体用75%酒精表面消毒,按无菌操作用接种环直接插入两片菌褶之间,轻轻地抹过褶片表面,然后用划线法涂抹于试管培养基上.
(3)孢子印分离法取成熟子实体经表面消毒后,切去菌柄,将菌褶向下放置于灭过菌的有色纸上,在20~24℃静置一天,大量孢子落下形成孢子印,然后移少量孢子在试管培养基上培养.
(4)单孢子分离法进行单孢子分离后,在人工控制的条件下,便两个优良品系的单孢子进行杂交,从而培育出新品种.
①平板稀释法,挑取少许孢子在无菌水中形成孢子悬浮液,取几滴涂于培养基上,用无菌玻璃三角架推平.
经48~72h后,镜检孢子萌发情况.
在单个孢子旁做好标记,然后将其转接到斜面培养基上,待菌落长到1cm左右时进行镜检,观察有无锁状联合,初步确定是否是单核菌丝.
②连续稀释法,挑取一定量孢子,经连续稀释后,直到每滴稀释液中只有一个孢子,然后滴入试管中保温培养.
当发现单个菌落时,转到新试管中继续培养,并通过镜检以确定是否为单孢菌落.
III食用菌一级种制作一、目的要求通过母种(一级种)的制作,掌握其制种的技术.
二、方法与步骤母种培养基制作流程:设计培养基配方→材料煮汁或药品溶化→琼脂溶化→混合定容→调节pH值→分装→灭菌→倒斜面→接种→培养→母种(一级种)l.
一级种常用培养基配方(1)马铃薯葡萄糖琼脂培养基(PDA培养基)马铃薯(去皮)200mg,葡萄糖20.
0g,琼脂2.
0g,水l000mL.
(2)马铃薯硫酸铵培养基马铃薯200g,硫酸铵2g,蛋白胨1g,葡萄糖20g,磷酸二氢钾1g,硫酸镁1g,琼脂20g,水1000mL(3)马铃薯葡萄糖蛋白胨培养基马铃薯200g,葡萄糖20g,蛋白胨2g,硫酸镁0.
5g,磷酸氢二钾1g,维生素B10.
5mg,琼脂20g,水1000mL.
2.
培养基分装培养基配制完毕应即时分装,否则琼脂凝固,无法分装,一级种最常用玻璃试管;要安装好分装装置,常用玻璃漏斗套接乳胶管和尖嘴玻璃接液管,乳胶管上配以止流夹.
分装时左手抓握2~3支试管,右手控制接液管插入试管,注入培养基,装培养基量为总试管容量的1/5.
分装时应注意不要将培养液沾到试管管口,避免将来发生污染.
若有沾粘,则应用干净纱布及时擦净.
分装的试管直接加棉花塞封口,棉花应用普通棉花,不能用脱脂棉,棉花塞起到过滤空气的作用,不宜过松或过紧,以封口后手持棉塞轻轻摇动试管不脱落,且旋转拨出顺利为度.
棉塞外观要求光滑,不能塞过浅或过深,否则造成操作困难.
3.
培养基灭菌和冷却成斜面一般分装好的试管应当天灭菌,使之呈无菌状态,以免杂菌自繁,造成培养基变质、酸败.
灭菌时将试管扎成捆,用牛皮纸或其它防潮纸将整捆试管的棉塞包好,直接放入底部盛水的高压灭菌锅内,加热到压力为l.
05kg/cm2,灭菌30min.
然后趁热取出试管,斜卧放置,使之自然冷却,凝固成斜面,斜面为试管长的1/2,冷却后即成斜面培养基.
4.
一级种的接种培养将试管中的菌种移接至另外的试管培养基上称为转管,其步骤为:(1)将待接的斜面试管以及一级种、接种针等放入已消毒的接种箱内.
(2)用75%的酒精溶液棉球擦双手消毒.
(3)左手持住空白斜面试管和一级种,右手夹持棉塞,火焰封口.
(4)将接种针顶端烧红,并将整支接种棒在火焰上过火.
(5)挑取黄豆大小的菌丝琼脂块,迅速移接到空白斜面中央,将棉塞塞回试管.
(6)将已接种好的试管放入恒温培养箱,在22~26℃下培养,长满试管即可作为一级种(母种)使用.
IV、原种及栽培种的制作一、目的要求通过原种和栽培种的制作,熟悉掌握食用菌生产用种的制备过程和操作技术二、方法与步骤结合栽培季节和平菇栽培的内容,进行原种和栽培种的制作(一)原种(二级种)制作原种选用玉米粒作培养基,以750毫升玻璃瓶或250mL三角瓶作容器,按每瓶装干玉米0.
1~0.
3公斤计算.
其配方为:玉米粒98%石膏1%,碳酸钙1%;将玉米粒浸泡数小时,再煮软但不能过软(即玉米粒中央还有一点白色),然后捞出晾干,加入石膏和碳酸钙,装瓶,加棉塞,用牛皮纸将瓶口包扎,以免消毒时将棉塞弄湿.
消毒在高压蒸汽消毒锅内进行.
当压力达0.
5公斤/厘米2时,排去冷空气.
压力升至1.
5公斤/厘米2时开始计时,消毒50分钟.
消毒结束后让压力自然降至零后,揭盖将瓶子取出,贴上标签,写明所接品种名称、接种日期、接种人姓名.
然后放入接种箱内进行接种,采用低温型平菇菌种,一支试管母种(一级种)接四瓶原种,原母种试管培养基中央的老菌块除去不用.
(二)栽培种(三种种)制作栽培种以棉籽壳为培养料,聚丙烯塑料袋(17*34*0.
05厘米)为容器,其配方为:棉籽壳99%石膏1%棉籽壳按1:1.
1—1.
2的料水比加入清水,使之用手捏料指缝间见水但不滴下为宜,此时即为65%的含水量.
塑料袋装料以每袋0.
3公斤干棉籽壳计算配料.
装袋后将袋口套上塑料环,并加棉塞,环口用牛皮纸复盖,用胶圈或绳子将牛皮纸捆紧.
然后将塑料袋装入常压消毒锅中进行消毒.
消费时间为上汽后(即灶内水开有蒸汽冒出)10--12小时,冷却后在塑料袋上贴上胶布作为标签,再将塑料袋放入接种箱内消毒接种.
每瓶玉米原种接种30袋左右.
接种后放入22~26℃条件下进行培养.
三、时间安排以一天时间配制培养料、消毒,接种.
以组为单位进行配料装瓶装袋,全班统一进行消毒灭菌,分组接种.
V食用菌加工技术一、目的要求了解食用菌常规加工技术.
二、方法与步骤食用菌的常规加工技术主要有盐渍、干制、罐头等(一)干制技术食用菌的干制也称烘干、干燥、脱水等,它是在自然条件或人工控制条件下,促使新鲜食用菌子实体中水分蒸发的工艺过程.
经过干制的食用菌称为干品.
干制设备要求不高,技术不复杂,易掌握;干制品耐贮藏,不易腐败变质,可长期保藏.
有的食用菌(如香菇)经干制后可增加风味,改善色泽,提高了商品价值.
但干制过程会引起营养成分及品质的变化,菇体中了些生理活性物质以及一些维生素类物质(维生素C)往往不耐高温,在烘干过程中易受破坏,菇体中的可溶性糖在较高的烘干温度下容易焦化而损失,并且使菇体颜色变黑.
l.
干制原理由于干制品所含可溶性固形物浓度相对提高,因而具有很高的渗透压,能使附在其上的腐败菌产生生理干旱,无法活动.
菇体所含的游离水在干燥过程中容易排除,但化合水结合于组织内的化合物质中,干燥过程中难以排除.
菇体脱水是靠菇体表面水分汽化和菇体内水分的向外扩散而实现的.
由于水分下降,酶的活性也受到抑制,这就是食用菌干制品能长期保藏的原理.
2.
干制方法菌类的干制分为晒干、烘干和冷冻干燥等方法.
(1)晒干是一种自然干制的方式,包括晾干和晒干.
晒干后,不仅有利于保存,还能改善菌类品质和提高营养价值,晒制还能促使香菇中所含的维生素D原转化成维生素D2.
晒干过程一般为2-3天,对后熟作用强的菇类务必于采收当日以蒸煮方式作灭活处理后再晒.
(2)烘干是食用菌干制的主要方法.
它是将鲜菇置于烘房、烘笼、烘干机中用炭火、电热或远红外线等作热源进行干燥的过程.
烘干不受气候条件影响,干燥快,省工,省时,产品质量有保证.
(3)冷冻干燥先将菇体中的水分冻成冰晶,然后在较高真空下将冰直接汽化而除去.
为了做到长期保藏,最好采用真空包装并在包装袋内充氮.
如双孢蘑菇的冷冻干燥工艺是:将蘑菇放入密闭容器中,在-20℃下冷冻,然后在较高真空条件下缓缓升温,经10—12h,因升华作用而使蘑菇脱水干燥.
经过这种处理的蘑菇具有良好的复原性,只要在热水中浸泡数分钟便可恢复原有形状,除硬度略逊于鲜菇外,其风味与鲜菇几乎没有差别.
3.
烘干工艺:适宜于脱水干燥的食用菌如口蘑、香菇、猴头菌、木耳、银耳、灵芝、竹荪等,干燥后不影响品质,有的还能增加风味与适口性.
但是有些菇如草菇、金针菇、平菇等干制后,其风味、适口性变差.
在脱水前可对菇体进行预处理,其方法之一为杀青,就是把菇体投入沸水中煮透,一般为2-8min,然后迅速冷却,但此法易造成菇体软化,影响形态.
也可用预热处理的方法,如草菇需纵剖,然后切口向上摆在烤筛上,勿重叠;金针菇扎成小捆整捆放在烤筛上.
放入烘箱后,使温度升高到(64±2)℃,处理20—30min,然后再进行常规烘烤.
烘房或脱水机的烘烤温度控制较为关键,温度过低易使产品腐烂变色,过高又会将产品烤焦.
烘烤温度从35℃开始,每小时升高1~2℃,经7~8h后鲜菇水分散发30%,12~13h后散发50%.
当温度升至60~65℃(勿超过75℃)时,水分已散发70%,然后将温度降至50~55℃,继续烘烤2~3h即可.
在烘烤过程中,要调整好通风口和排风口的开启程度,保持一定的换气量,加速鲜菇脱水.
干制的菇体在空气中易吸湿而回潮,引起霉变和生虫,因此,干品应贮藏于密封的塑料袋或容器中,放到清洁、干爽、低温的房间贮藏.
(二)盐渍技术1.
盐渍原理盐渍是让食盐渗入到菇体组织内,降低其水活度,提高菇体的渗透压,以控制微生物的生长活性,抑制腐败菌的生长,从而防止食用菌腐败变质,保持其商品价值.
其制品称为盐水菇.
食盐属高渗透压物质,质量浓度为l0g/L的食盐溶液可以产生610kPa的渗透压.
生产盐水菇用的食盐溶液质量浓度可达350g/L,能产生20MPa以上的渗透压,菇体组织中的水分和可溶性物质外渗,盐水渗入,最后达到平衡,使菇体组织也有很高的渗透压.
一般微生物细胞液的渗透压在350~1670kPa之间,一般细菌则为300~600kPa.
食盐溶液的渗透压则高得多,使附着在菇体表面的有害微生物细胞内的水分外渗,原生质收缩,质壁分离,造成生理干燥,迫使微生物处于假死状态或休眠状态,甚至死亡,从而达到防止腐烂变质的目的.
食盐溶解后就会离解,并在每一离子的周围聚集着一群水分子,也就是离子水化.
水化离子周围的水分聚集量占总水分量的百分率随着盐分浓度的提高而增加,水分活度则随之降低,也抑制了微生物的生长;而高浓度食盐离解产生高浓度的钠离子和氯离子,造成微生物所需的离子不平衡,产生单盐毒害,同样也抑制了微生物的活动.
食盐对微生物分泌的酶活力也有破坏.
由于氧很难溶解在盐水中,在盐液中形成了缺氧环境,需氧菌是难以生长的.
2.
盐渍工艺(1)选料选择好原料菇,当天采收,当天加工.
(2)漂洗用质量浓度为6g/L的盐水洗去菇体的杂质,接着用0.
05mol/L柠檬液(pH值4.
5)漂洗,能显著改变菇色.
因为菇体内的多酚氧化酶能利用酪氨酸形成黑色素的前体物质,经氧化作用形成黑色素.
而用低pH值的柠檬酸溶液可有效地抑制多酚氧化酶的活性,防止菇色变深和变黑.
(3)杀青指在稀盐水中煮沸、杀死菇体细胞的过程.
其作用是进步抑制酶活性;防止子实体开伞,防止褐变,破坏细胞膜结构,增加细胞透气性,排出菇体内的水分,以便盐水能很快进入菇体,然后依菌盖直径进行分级.
(4)制备饱和食盐水和调酸剂准备10:4的水与食盐,将盐溶化,直到盐不能溶解为止,用波美比重计测其浓度为23°Be′左右,再放大少量明矾静置,冷却后取其上清液用8层脱脂纱布过滤,使盐水达到清澈透明,即为饱和食盐水,备用.
配制调酸剂,其中柠檬酸占50%,偏磷酸钠占42%,明矾占8%,混合均匀后,加入饱和食盐水中,用柠檬酸调pH值至3~3.
5即可.
(5)盐渍将杀青、分级后沥去水分的菇按每l00kg加25—30kg食盐(精盐)的比例逐层盐渍.
先在缸底放一层盐,接着放一层菇(8-9cm厚),依次一层盐一层菇,直至满缸.
缸内注入煮沸后冷却的饱和食盐水.
表面加盖帘(竹片或木条制成),并压上鹅卵石,使菇浸没在盐水内.
3天需倒缸一次.
以后5-7天倒缸一次.
盐渍过程中,要经常用波美比重计测盐水浓度,使其保持在23°Be′左右,低了就应及时倒缸.
(6)装桶盐渍20天以上即可装桶.
装桶前先将盐渍好的菇捞出控尽盐水.
一般用塑料桶分装,加入新配制的调酸剂至菇面,用精盐封口,排除桶内空气,盖紧内外盖.
(三)罐头加工将新鲜食用菌经过一系列处理之后,装入特制的容器内,经过抽气密封、隔绝外界空气和微生物,再经过加热杀菌,便能在较长时间内保藏食用菌,其保藏的产品称为食用菌罐头.
按罐藏内容物的组成和制造目的的不同,食用菌罐头可分为两大类.
以食用菌整菇、片菇或碎菇为主要原料,注入适当浓度的盐水作填充液,称为清水罐头,主要用于菜肴的烹调加工,是当前食用菌罐头生产的主要类型.
将菇类和肉、鸡、鸭等原料配制,经烹调加工制成的罐头,如蘑菇猪肚汤等复合式食用菌罐头,可直接食用.
食用菌罐头厂一般采用马口铁罐和玻璃瓶罐,也有采用复合塑料薄膜袋包装.
我国食用菌罐头生产大约从本世纪50年代开始,一直发展至今.
目前,蘑菇罐头已成为中国出口罐头的拳头产品,除此之外,还有草菇罐头、香菇罐头、金针菇罐头等新品种,并已批量出口.
l.
罐头加工原理食用菌罐藏品能较长时间保藏的主要原理是:罐藏容器是密封的,隔绝了外界的空气和各种微生物.
制罐过程中,密闭在容器里的食用菌及制品经过高温灭菌,罐内微生物的营养体被完全杀死,但可能有极少数微生物孢子体没有被杀死.
如果是好气性的,由于罐内形成一定的真空而无法活动;如果是厌气性的,罐藏品仍有变质的危险,所以,罐藏品有一定的保藏期限,通常为两年.
由于高温灭菌也破坏了菇体的一切酶系统,使菇体内的一切生理生化反应不能进行,防止了菇体变质.
2.
罐头生产工艺(1)原料准备①选择好原料菇它必须符合制罐等级标准并应及时加工处理②漂白护色将菇体置于质量浓度为0.
3g/L的焦亚硫酸钠溶液中浸2-3min,再倒人质量浓度为lg/L的焦亚硫酸钠溶液中漂白为止,然后用清水洗净.
③预煮将菇体放入已烧开的2%食盐水中煮熟但不烂,可抑制酶活性,防止酶引起的化学变化;排除菇体组织内滞留的气体,使组织收缩、软化,减少脆性,便于切片和装罐,也可减少铁皮罐的腐蚀.
④冷却将煮过的原料迅速放人流水中冷却.
采用滚筒式分级机或机械振荡式分级机进行分级.
(2)装罐空罐使用前用80℃热水消毒.
装罐用手工或罐机装罐,因为成罐后内容物重量减少,一般装罐时应增加规定量的10%~15%.
(3)注液注入汤液可增加风味,排除空气,有利于在灭菌、冷却时加快热的传递速度.
汤液一般含2%--3%的食盐或0.
12%的柠檬酸,有的还加0.
1%的抗坏血酸.
(4)排气抽真空排气最重要的目的是除去罐头内所有空气.
空气中氧气会加速铁皮腐蚀.
排气后可以使罐头的底盖维持一种平坦或略向内凹陷的状态;这是正常良好罐头食品的标志.
排气有两种方法:一种是原料装罐注液后不封盖,通过加热排气后封盖,另一种是在真空室内抽气后,再封盖.
(5)封罐主要防止腐败性细菌侵入.
较早是手工焊合封盖.
现在普遍使用双滚压缝线封罐机;有手摇、半自动、全自动和真空封罐机.
(6)灭菌其目的是使罐头内容物不致受微生物的破坏,一般采用高压蒸汽灭菌.
采用高温短时间灭菌对保持产品的质量有好处.
蘑菇罐头灭菌温度为113-121℃,灭菌时间为15-60min.
(7)冷却灭菌后的罐头应立即放入冷水中迅速冷却,以免色泽、风味和组织结构遭受大的破坏.
玻璃罐冷却时,水温要逐步降低,以免玻璃罐破裂.
冷却到35-40℃时,则可取出罐头擦干;抽样检验,打印标识并包装贮藏.
VI平菇的栽培一、目的要求熟悉平菇栽培的技术.
二、方法与步骤(一)室内栽培栽培平菇的房间要有一定的散射光,能保温保湿,可通风换气,地面平整光滑,周围环境清洁卫生;门窗装有防虫的尼龙纱.
1.
品种选择应根据接种季节、栽培场所、培养料种类、栽培方式及市场要求等选择适宜品种.
秋冬宜用中、低温型品种,早春宜用中温型品种,春末夏初宜周中、高温型品种,夏秋宜用高温型品种.
2.
生产季节利用自然气温生产平菇,一般中、低温型品种在7月下旬至8月上中旬制原种,8月中下旬至9月上中旬制生产种;中温型品种在11~l2月制原种,次年1~2月制生产种;高温型品种在3~4月制原种,4~5月制生产种.
平菇可利用不同温型的品种,实现周年生产.
3.
培养料的选择、配方与处理1)培养料的选择培养料可以就地取材,采用棉籽壳、玉米芯、豆秆粉、锯木屑、稻草、麦秆等,其中以棉籽壳最好.
使用前,棉籽壳应在日光下晒1-2天,不能使用霉烂变质的.
生料栽培拌料时,可加入多菌灵或高锰酸钾等药剂防污染,但加入的药剂浓度过高,可能会对平菇菌丝造成药害.
实验表明,在平菇生料中加入0.
1%的多菌灵、0.
1%的托布津或0.
1%-5%的高锰酸钾溶液可较好地防治杂菌污染,而且对菌丝无不良的影响,但在培养料中加入过氧乙酸和甲醛溶液防污染效果差,且对平菇菌丝生长有抑制作用.
2)培养料的配方由于平菇培养料的来源很广,因此,主料与辅料的配法也多种多样.
(1)棉籽壳培养料①棉籽壳100%;②棉籽壳95%,豆饼粉(菜饼粉)5%;③棉籽壳95%,过磷酸钙2%,石膏3%;④棉籽壳80%,麸皮或米糠20%.
培养料含水量为65%--70%.
(2)废棉培养料废棉营养含量丰富且较全面,一般不必添加其它材料.
废棉pH值为5.
5左右,应加消石灰调节.
废棉因附着的棉纤维较多,吸水困难,需先将废棉放在清水中浸泡6-12h,浸透后用手捏干,或用压榨机压干,其含水量为65%-70%.
(3)稻草培养料①稻草粉80%-90%,米糠或麦麸10%-20%;②稻草粉98%,糖1%,石膏1%;③稻草95%,豆饼粉(菜籽饼)5%.
稻草中含有很多鬼伞菌等杂菌,可用开水煮20-30min,也可用1%-3%石灰水浸泡1-2天,然后用清水冲洗便其pH值为8,沥干,加大其它材料.
(4)玉米芯培养料玉米芯碎块60%,米糠或麦麸36%,石膏1%,尿素0.
2%,过磷酸钙2%.
(5)锯木屑培养料锯木屑78%,麦麸或米糠20%,蔗糖1%,石膏1%.
(6)甘蔗渣培养料甘蔗渣70%,麦麸或米糖28%,石膏2%(7)其它稿杆培养料可采用小麦秆、玉米秆、麦壳、向日葵秆、花生壳及山茅草等稿秆中的一种或两种,甚至多种材料组成,并制成糠粉或切成4~8cm长的材料.
其中稿秆糠75%~85%,麦麸或米糠10%~20%,蔗糖1%,尿素0.
5%,过磷酸钙2%,石膏1%.
(8)废纸培养料废纸(印刷厂切边纸等)90%,麦麸9%,碳酸钙或石灰粉1%.
将废纸切碎,用水浸泡6~l2h,捞出沥干,加入麦麸等材料.
4.
上料、播种:1)床栽一般床架式栽培可采用生料栽培,将配制好的培养料铺上菇床,逐层铺料,料厚10~15cm,可采用穴播,穴距为8~12cm,在料表面层应撒一层菌种,然后弄平料面,加盖薄膜.
2)块栽菌砖用长方形的木模制成,砖大小为90cm*50cm*l2cm.
具体操作方法为:在模子下铺塑料薄膜,在模子内铺人培养料和菌种,可采用层播法,一层料再铺上一层菌种,可铺多层.
也可混播,将料与菌种混合后铺入模子.
通常用种量常为干料质量的10%~15%.
每个菌砖之间应留有5~8cm的距离,以利于通风透气,使菌丝易萌发并吃料生长.
3)塑料袋栽适于熟料栽培.
若采用高压灭菌刚采用聚丙烯塑料袋,常压灭菌可用聚乙烯薄膜.
塑料袋长49cm,宽15~16cm,装料可采用装袋机.
袋两头开口的,应套塑料环,用棉花塞封口,然后用牛皮纸、防水纸或塑料薄膜包扎系紧,灭菌后接种,在菌丝培养室培养.
用塑料袋进行生料栽培,以两头开口为好,便于通风透气,定点出菇.
装袋先从一端开始,封口后先放一层菌种,再放一层培养料并压实.
装料达袋的一半时,又放一层菌种,再装满培养料,再播一层菌种压实,用木棒在料中央插一空洞,袋口用塑料环套好,封口.
气温高时,则松散直立放置,切勿堆积,以防发热高温烧坏菌种.
待袋温稳定后,再多层叠放呈墙形.
平菇袋栽可采用覆土栽培,覆土可减少虫害,提高产量和品质.
土质可选择微酸性的砂壤土,土壤要求疏松、肥沃、通气,使用前可用甲醛消毒,闷一天后再用.
当菌丝长满菌袋,培养料变紧实后脱袋覆土,或在菌袋出2-3批菇后脱袋覆土.
4)箱栽可采用清洁的塑料箱、旧木箱、包装纸箱、竹箱或其它材料编制的筐子来栽培.
先在箱内铺塑料薄膜,再装入调配好的培养料并播种,采用穴播或分层播种,播后用薄膜保湿.
采用此法栽培,便于搬动,可放到菌丝体或子实体生长适宜的温湿度场所.
工厂化生产宜用箱式栽培,可先将箱子放入温度适宜的房间进行菌丝培养,然后再移入湿度较高、温度较低的人防地道或岩洞中,让子实体发育.
箱筐在菌丝生长阶段可在地面上重叠放置,也可放在床架上,以充分利用空间.
5)瓶栽可采用750mL的玻璃菌种瓶或500mL的玻璃罐头瓶栽培.
采用此法出菇快,出菇前可拔去棉塞,子实体从瓶口长出;但此法所用玻璃瓶的成本高,生产工艺比较繁琐,适用于菌种场的少量生产试验或家庭小规模栽培.
5.
发菌管理播种后如料温持续上升,超过30℃,应加强通风降温,同时,要抖动盖在菌床和菌砖上的薄膜散热或将菌袋翻堆降温.
还要经常检查培养料有无杂菌虫害.
若发现有杂菌虫害,要及时处理;严重者,应将其移出培养室,喷施药剂,隔离培养.
发菌后期,若温度过低,还应保温、升温,以保证菌丝的正常生长.
经过20-30天培养后,菌丝长满培养料,提供适宜的外界环境条件,以刺激菌丝体扭结形成子实体原基.
6.
出菇管理平菇现蕾后,应注意通风换气和增加湿度.
采用菌砖、菌床等栽培的要掀开薄膜,采用菌袋的则要敞开两头,以利通风换气;可向地面、墙壁、空间喷水或采用增湿机以增加湿度,保持相对湿度80%-90%,切勿直接向幼小菌蕾喷水.
随着子实体的长大,应增加菇房湿度,喷水应勤喷、轻喷并加强通风换气,保持空气新鲜、湿润.
7.
采收当平菇菌盖充分展开,颜色由深逐渐变浅,但孢子尚未弹射时,即可采收.
适时采收,则菇体柔嫩,品质好,味道佳,产量也高;采收过早,菇体发育不足,产量低;采收过迟,菌盖干缩,菇柄坚硬,质量下降.
采收后的平菇要去除菌柄基部的草屑或棉渣,分装运往市场销售.
(二)室外阳畦栽培室外阳畦栽培只要少量薄膜、棚席等即可栽培,成本低,而产量不低.
该法因受外界气候影响较大,一般适于冬、春季栽培.
在室外做成宽70~100cm、深10~20cm的畦,长度可根据需要而定,畦底夯实,平整成龟背形.
先沿畦壁16cm处垫一圈薄膜,再装料分层播种.
为使培养料通气好,避免畦中央部位因通气不良,菌丝生长差,特别是当培养料过湿时,应每隔33cm留出3cm空位;这样过多水分也可流入小沟中.
播种后将所垫薄膜向畦内将培养料包住,并覆盖稻草,这样气温低时可起到保温的作用,过20天左右,菌丝长满后快现蕾时,将稻草和薄膜去掉,畦上用竹支架薄膜小拱棚,并盖草帘以阻挡阳光的直接照射,畦上还可搭一荫棚.
其它管理方法与室内栽培相似.
也可用大田畦式覆土栽培,其方法为:将畦土揭去一层,堆放在畦两旁,即成畦坑,然后将菌简脱袋,紧密排放于畦坑中,再将畦两边的细土覆盖在菌筒上,以盖没为度.
在覆土上洒一次水,使土湿润;再撒一层0.
5—1cm厚的细土,使菌筒盖严,加盖农用薄膜,以保温保湿.
菌筒覆土7-10天后,菌蕾开始拱土.
现蕾后注意通风换气,干燥时喷水,每采收一批菇后,要喷一次水,一般可出菇3-4批.
平菇露地栽培与阳畦栽培相似,只是不用搭荫棚而利用果园、竹林遮荫,也可与蔬菜高秆作物隔畦间作,如凤尾菇与白花豆间作效果好.
由于露地栽培保湿困难,培养料上宜覆盖厚度为1cm左右的细土.
VII灵芝的栽培一、目的要求熟悉灵芝的栽培二、方法与步骤(一)瓶栽和袋栽1.
栽培季节灵芝在自然气候条件下,一般春、秋两季栽培,春季栽培在3--4月接种;秋季栽培在9--10月接种,如果有空调等设备,一年四季均可栽培.
2.
菌种的制作灵芝菌丝在黄豆芽黄豆粉培养基中生长最好,而在PDA培养基中生长最慢.
紫芝菌丝在胡萝卜蛋白胨培养基中生长最好.
而作为原种或栽培种,要求纯净无杂菌,品种优良,生命力强,菌龄适当.
3.
栽培材料配方(1)棉籽壳麦麸培养料棉籽壳77%,麦麸20%,糖1%,石膏1%,过磷酸钙1%.
(2)棉籽壳木屑培养料棉籽壳50%,木屑32%,麦麸15%,石膏1%,过磷酸钙1%,糖1%.
(3)木屑培养料木屑77%,麦载20%,石膏1%,过磷酸钙1%,糖1%.
(4)甘蔗渣培养料甘蔗渣75%,麦麸22%,糖1%,石膏1%,过磷酸钙1%.
(5)花生壳、豆秸、棉秆培养料花生壳(豆秸,棉秆等)77%,麸皮20%,糖1%,石膏1%,过磷酸钙1%.
(6)玉米芯培养料玉米芯74%,麸皮25%,石膏粉10%,草木灰0.
5%.
据1993年我们的栽培试验表明,采用(1)号配方培养灵芝,其产量较高可达74.
45g/瓶.
4.
栽培管理将已接种的瓶子或袋子搬人培养室,在条件适宜时,菌丝3-4天即萌发;1星期左右开始吃料并迅速生长.
当菌丝已全部长满斜面,向料内深入2-3cm时,即可松动棉塞但不拉出,以便增加瓶(袋)内的空气.
l个月左右子实体原基开始形成并逐渐发育为菌蕾.
菌蕾形成后,及时拔去棉塞,瓶栽的应将瓶倒放成卧式横排培养,也可转至另一间专用栽培室培养.
卧排的瓶子每排可重叠10~12瓶,以充分利用培养室空间,便于管理.
室内温度控制在25~28℃,空气相对湿度90%~95%,每天向空中喷雾4~5次,经常使地面保持湿润,地面若积一层水更好.
但喷水不可直接喷到子实体上和瓶(袋)内,以免菌体霉变腐烂.
此时应加强通风换气,给菇体充足的氧气,每天早、中、晚开窗通风1~2h.
若CO2积累过多,子实体就不能很好地生长,菌柄长,菌盖小,甚至完全不分化菌盖,呈鹿角状或棍棒状.
同时要做到室内有较充足的光线.
在正常情况下,从菌蕾形成到拔塞卧放约需25天,即可开始采收.
(二)阳畦栽培1.
建阳畦选择坐北朝南,东西作畦,畦宽1.
5m,长4~5m,深30~35cm,畦周围设置水沟,畦上搭棚架,覆盖塑料薄膜和草帘遮荫.
2.
菌丝培养采用聚丙烯塑料袋,按前述培养料配方装袋、灭菌、接入灵芝原种,于25~28℃培养,经25~30天菌丝长满全袋.
3.
出芝管理将长满菌丝、脱去塑料袋的菌筒平铺于阳畦内,每个菌筒之间相距6—10cm,中间填入菜园土,然后向畦内喷水.
自5月中旬入阳畦,经5-10天左右出现原基,每天需打开阳畦两头的塑料薄膜通风,时常喷水,以保持畦土湿润.
于6月中旬采头潮灵芝,再过20天可采第二潮.
经试验表明,阳畦栽培灵芝不仅管理方便,产量较高,且菌盖大,柄短,形状近似野生灵芝,商品性状好,经济效益高.
(三)应用1.
药用灵芝菌体内含有多种有效成分,如灵芝多糖、灵芝酸(灵芝三萜类化合物)、皂甙、麦角甾醇、腺苷、嘌呤、嘧啶、生物碱、内酯等,具有很高的药用价值.
这几种成分大多数能溶解于热水,但是灵芝酸、皂甙、麦角甾醇等成分在热水中的溶解度较低,在乙醇中的溶解度较高,可用乙醇提取,灵芝的其它有效成分都可用热水提取.
下面介绍灵芝有效成分的提取方法.
(1)灵芝的热水提取将灵芝子实体用破碎机破碎成块,投入提取锅,加入去离子水.
加热使水沸腾并保温2h,流出煎液.
残渣用同法再提取,放出第二次煎液.
将两次煎液合并,输入贮液槽,静置l0h,吸取清液,弃去槽底泥浆状物,将清液浓缩,制成灵芝制品.
(2)灵芝的乙醇提取将灵芝子实体破碎,投入提取锅,加入95%食用乙醇,78℃下回流lh,放出提取液,残渣留在锅中.
再用95%食用乙醇用同法提取3次,将3次乙醇提取液合并,在贮液槽中静置10h,取出上清液,弃去底部沉淀物,将上清液中的乙醇回收,去乙醇后的浓缩物可制成灵芝制品.
现在,灵芝制品剂型很多,有糖浆、片剂、胶囊、冲剂、粉剂、丸剂、酒剂、注射剂、水煎剂、酊剂等剂型,对多种疾病具有良好的疗效.
今后随着研究的不断深入,其药用价值的迸一步认定,将生产出更多的疗效显著的灵芝制品供应市场.
2.
食用由于灵芝具有丰富的营养,含有人体必需氨基酸、维生素、矿物质、多糖等多种成分,是理想的保健食品.
可以直接食用灵芝菌体,也可制成多种类型的加工食品,如灵芝口服液、灵芝乳酸浓缩液、灵芝茶、灵芝可乐、灵芝猴头膏、灵芝糖、灵芝蜂王浆等.
3.
美容据研究,灵芝具有抗衰老作用,有抗皱、消炎、清除色斑、保护皮肤、增加头发光泽的美容效果.
灵芝的护肤、养发、沫浴制品也已面市,如灵芝特效营养增白露、灵芝润肤露、灵芝爽肤沐浴露、灵芝防皱露等.
4.
盆景灵芝子实体形态奇特,富有光泽,坚硬不腐,可作为造型材料制成可供观赏的艺术品,即灵芝盆景.
灵芝盆景的制作,首先要根据灵芝生长发育的规律,采用生物技术,调控光、温、水、氧气、二氧化碳等条件,也可采用接合、药物刺激等手段,人工培养出形态各异的子实体.
如在高温或缺氧下,可培育出菌柄细长或分校呈珊瑚状的灵芝;控制通气状态,可培育出双层菌盖的子实体;根据其向光性,可改变菌柄、菌盖生长的方向;选用不同口径的容器,可控制朵型的大小;用紫外线照射,可使子实体变形.
培育个体较大的树舌可用来绘制山水风景、人物或雕刻各种图案,然后进行造型设计,通过修剪、晒干、防腐对子实体进行处理,防腐可采用3:1的75%酒精甲醛溶液擦拭子实体,晾干后,连续涂两次光油,使之有光泽,并有防腐防虫作用.
将处理后的子实体打磨、粘合,用石米或塑料泡沫作填充材料,煮熔石蜡固定在花盆、花盘或玻璃框内,并配以花石、假山、树根、人物、小型动物以及绒毛制成的小草等,便制作出寓意深远的灵芝盆景.
VIII金针菇的栽培一、目的要求:了解金针菇的栽培二、方法与步骤古代,人们常采用段木栽培生产金针菇,但段木栽培的金针菇产量低,形状不好,色泽深,常为黑褐色,商品价值低,不受消费者喜爱,因此,现在几乎不再采用段木栽培方式.
随着代料栽培技术的发展,目前金针菇主要有瓶栽、袋栽、大麻栽培等方式.
(一)瓶栽l.
栽培容器可采用750mL、800mL或l000mL的无色玻璃瓶或塑料瓶,瓶口径约7cm为宜,可使菇蕾大量发生,同时,瓶口较大,通气较好,菇质量也高.
目前国内也常采用750mL的菌种瓶或500mL的罐头瓶作为栽培容器,菌种瓶口径太小,菇蕾发生个数少,菇体较密,通气差,所以近瓶口一段菌柄色泽特别深,影响菇体质量.
而罐头瓶装料有限,水分容易蒸发且易污染杂菌,长出的菌蕾细弱,产量不高.
2.
工厂化瓶栽设施工厂化周年瓶栽金针菇需有如下设施:(1)接种室要求为无菌状态.
由于灭菌后培养料温度高,需降温,因此要设置翅片冷却器,将培养温度降到15--l8℃.
(2)菌丝培养室利用控温设备,保持温度20℃左右,并安装定时换气阀或全热交换器,每2--3h强制通风15min,排除呼吸产生的过多的二氧化碳.
(3)催蕾室要求控温13--14℃,空气相对湿度85%--90%,黑暗.
在催蕾室两侧壁的墙脚处设吸气孔,在两墙上方设排气孔,用于通风换气.
室内有不排风的翅片冷却器和加湿器.
菌蕾培养成整齐、圆整而结实的金针菇菇房的室温要求4℃左右,空气湿度80%--85%.
安装由上往下吹风的冷风机组、换气阀或全热交换器.
(5)套纸筒生育室为便金针菇菌柄伸长,子实体需干燥发白,套上纸筒,同时室温要求在6~7℃,室内安装横向吹风的冷风机组.
工厂化生产金针菇可采用800—1000mL、口径7cm的聚丙烯塑料瓶,瓶盖采用无棉盖体.
3.
培养料可选用阔叶树或针叶树的木屑,需在室外堆积,让木屑中的树脂、挥发油及水溶性有害物散失.
棉籽壳、废棉、甘蔗渣、稻草粉均可作为原料.
常用的配方有:(1)棉籽壳95%,玉米粉3%,糖1%,石灰1%.
(2)废棉99%,石膏1%.
(3)甘蔗渣73%,米糠25%,糖1%,碳酸钙1%.
(4)木屑73%,米糠25%,糖1%,碳酸钙1%.
(5)稻草粉73%,米糠25%,糖1%,碳酸钙1%.
4.
配料装瓶将主料棉籽壳、甘蔗渣、废棉等浸水6--12h后捞起沥干,木屑过筛,与其它辅料混合,调节含水量为65%-70%.
装瓶时下部可装松些,以缩短发菌时间;上部要装紧些,否则易干燥.
装料应至瓶肩.
装完用木棒在瓶中部插一个直通瓶底的接种孔,使菌丝在上、中、下部同时生长,塞入棉花,外包防水纸或报纸或聚丙烯薄膜封口.
5.
灭菌、接种与培养采用高压蒸汽灭菌,在147kPa压力下灭菌1~1.
5h,常压灭菌是在100℃下灭菌8~10h.
接种需按无菌操作进行,接种量以塞满接种孔为宜.
接种后立即将接种瓶移入培养室,在20℃左右培养.
因菌丝生长进行呼吸作用,会发热,瓶内温度一般比室温高2~4℃.
气温低时,关闭门窗,每隔5-6h通风换气一次.
一般菌丝经20~30天可长满全瓶.
6.
出菇管理(1)催蕾将长满菌丝的瓶子移到出菇室,去掉瓶口上的棉塞,进行搔菌.
所谓搔菌就是用镊子等工具将老菌种扒掉,去掉白色菌膜,并刮平、按平培养料表面,使其平整.
也有不搔菌的,但搔菌后效果好.
然后用报纸覆盖瓶口,每日在报纸上喷水2--3次.
几天后培养基上部就会形成琥珀色的水珠,有时还会形成一层白色棉状物,这是现蕾的前兆,再过13-15天就会出现菇蕾.
喷水过程中,不能把水喷在菇蕾上,否则菌柄基部就会变成黄棕色至咖啡色,影响出菇的质量,同时会产生根腐病.
催蕾期温度控制在12~13℃,湿度85%~90%,每天通风.
3~4次,每次15min左右.
(2)抑制现蕾后2-3天,菌柄伸长到3-5mm,菌盖呈米粒大时,应抑制生长快的,促使生长慢的菇体生长,使菇体整齐一致.
在5-7天内,减少喷水或停水,湿度控制在75%,温度控制在5℃左右.
(3)套筒为了防止金针菇下垂散乱,减少氧气供应,防止强光加深颜色,抑制菌盖生长,促进菌柄伸长,常采用套筒措施.
可用牛皮纸、塑料薄膜,蜡纸作高度10~15cm的筒,呈喇叭形.
当金针菇伸出瓶口2~3cm时套筒;若套筒过早,只有瓶中间的菇生长且不容易形成菌盖;若套筒过迟,子实体矮小,没有商品价值.
为使空气能从筒下部进入,常在筒下部打数个少圆孔;套筒后每天在纸简上喷少量水,保持湿度90%左右,早晚通风15~20min,温度保持在6~8℃.
在金针菇生产中,常选用浅色或白色品系,采用套筒、遮光、吹风等技术手段,以抑制金针菇色素的形成和菌盖的展开,并促进菌柄的伸长,得到质地柔软、白色或浅白色的金针菇子实体,这一栽培方法称为金针菇白色软化栽培.
7.
采收鲜销的菇体在菌盖六七分开伞时采收,不宜太迟,以免菌柄基部呈褐色,绒毛增加而影响外观和质量.
采收时一手拿住瓶,另一手轻轻把菇丛拔下,采收一批后进行搔菌,重新盖报纸保湿培养,以便第二次出菇.
一般金针菇可采收2-3批,但产量主要集中在第一、二批,其中第一批产量占总产量的60%左右.
从出菇到收获完毕需40~60天.
(二)袋栽袋栽由于袋口直径大,菌蕾可大量发生,通气好,菇的色泽较好.
用于栽培的塑料袋的上端可用来遮光、保湿,从装料到采收等栽培管理过程,操作简便,原基形成后只需拉直袋口,免去了套筒的手续.
我们的研究发现,袋栽金针菇的子实体个数比用750mL菌种瓶、500mL罐头瓶栽多出60%和48%,而袋栽的菌柄长度可增加9mm和33mm.
一般来说,袋栽比用3.
5cm口径的瓶栽产量高出30%左右.
但因塑料袋口大,培养基水分易蒸发干燥,同时塑料袋破裂时易引发杂菌污染,造成损失.
1.
塑料袋规格可采用聚丙烯塑料袋,长40cm,宽17cm或长38cm,宽l6cm,厚度0.
05—0.
06mm.
塑料袋宽度不宜过大,否则易感染杂菌,且菌柄易倒伏.
2.
配料装袋培养料配方和配制与瓶栽相同,但因袋口较大,水分会有散失,培养料含水量可调高些,为70%~75%.
为了使原料充分混合均匀,可采用原料搅拌机混合搅拌.
装袋时,注意袋底两个角压人袋内,袋内放一圆形木棒,边装边压紧,袋上端留15cm以上的长度,装入塑料环,用棉塞塞入,外包牛皮纸或防水纸封口.
也可采用装瓶、装袋机,以提高工效.
3.
灭菌、接种与培养由于塑料袋装量多,灭菌时间比瓶栽要长一些,高压灭菌l.
5-2h,常压l00℃灭菌8-l0h.
接种、培养与瓶栽相同,但需注意用玉米菌种接种栽培的,需防老鼠咬穿塑料袋.
4.
出菇管理当菌丝长满袋后,将棉塞或套环去掉,拉直袋口,在上面覆盖一层报纸,每日喷水于报纸上,可保持较高的湿度(85%-90%),防止水分蒸发.
同时增加CO2的浓度,抑制菌盖生长,待其菌柄变长时,取掉报纸.
其它管理与瓶栽相同.
IX双孢蘑菇的栽培一、目的:熟悉双孢蘑菇的栽培技术二、方法及步骤A.
床式栽培(一)培养料配制培养料的好坏直关系到蘑菇栽培的成败和产量高低.
蘑菇培养料目前有粪草培养料和合成培养料两大类.
l.
培养料的基本材料稻草和麦秆富含半纤维素、纤维素及木质素等有机碳,且质地疏松,具有弹性,通气良好,是堆制培养料的好材料.
稻草的茎秆易吸水,腐熟快,堆积两用后就会腐熟,但粘性较大;小麦的茎秆硬,外被腊质,不易吸水,腐熟慢,堆积3~4周才能腐熟,但质地疏松.
生产上常将稻、麦草混合使用.
堆制对应将麦秆及稻草先后加大,或将麦草充分浸透后和干稻淋一起堆制.
总之,要减少稻草的堆制时间,特别是早稻草的堆制时间要减少,以免过分腐熟.
其它如粉碎的玉米秆、玉米芯及甘蔗渣等也能用来配制培养料.
畜禽粪是蘑菇需要的营养物质,都可用来配制培养料.
猪粪的有机物含最较少,氮、磷、钾含量高,用作堆料出菇快,菇较小而密,前期产量高,后期产量低.
牛粪中有机物及氮、磷、钾的含量稍低,若将牛粪晒干弄碎后堆料,则发酵快,堆温高.
用牛粪堆料种植的蘑菇粗壮,出菇期较长,但出菇较稀.
马粪含丰富的有机物,氮、磷、钾的含量也较高,质地疏松,具有较高的发酵能力,其出菇产量和质量与牛、猪粪栽培相似.
几种畜粪可混合使用.
鸡、鸭粪养分充足,发热快,温度高,但碱性重,粘性大,可与畜粪混合堆制.
2.
培养料配方(1)粪草培养料我国目前栽培的蘑菇多数采用粪草培养料,铺料厚度以15cm计,则每l00m2的栽培面积需要4500kg培养料,可采用粪草比例1.
5:1或1:1两种配方.
①干牛粪58%,干稻麦草39%,过磷酸钙1%,尿素0.
5%,硫酸铵0.
5%,石膏1%.
按此配方约需干牛粪2600kg,稻麦草各半共l800kg,过磷酸钙45kg,尿素23kg,硫酸铵23kg,石膏45kg,C/N约为31.
6:1.
②干牛粪47.
5%,干稻麦草47.
5%,菜籽饼4.
5%,尿素0.
5%;石膏1%、按此配方需干牛粪约2l00kg,干稻麦草各半共2100kg,菜籽饼200kg,尿素25kg,100石膏45kg,C/N为33:l.
下面介绍几种国外的粪草培养料配方.
①美国马厩肥堆料配方:马厩肥80kg,鸡粪7.
5kg,啤酒糟2.
5kg,石膏1.
25kg.
②荷兰马厩肥堆料配方:马厩肥l000kg,鸡粪l00kg,石膏25kg.
(2)合成培养料合成培养料是不用粪肥或少用粪肥配制的培养料.
目前,合成培养料在日本、美国、南韩、英国及我国台湾已相当普及,成为蘑菇生产的主要培养料.
合成培养料以稻草或麦秆为主要材料,配以含氮量高的尿素、硫酸铵或饼肥等.
在配制合成培养料时,不宜只采用一种氮肥,因为堆肥的腐熟是多种微生物共同发酵的结果,不同种微生物需要不同的氮源.
在配制培养料时还需添加一定量的磷、钾、钙等营养元素.
由于合成培养料的腐熟比粪草培养料慢,尤其是小麦秆、玉米芯等不易腐熟,还需添加微量元素加速麦秆等的腐熟,也为培养料增加营养成分.
我国采用合成培养料的配方较多,下面举例说明.
①上海农科院的配方:每l00m2栽培面积用稻草2250kg,尿素18.
5kg,过磷酸钙22.
5kg,石膏粉45kg,碳酸钙22.
5kg,C/N为33:1,经二次发酵后,播种前C/N为18:1,pH值由8.
3左右降至7.
3左右.
②我国台湾配方:稻草l00kg,尿素1kg,硫酸铵2kg,过磷酸钙3kg,碳酸钙2.
5kg国外的合成培养料配方也很多,现举例如下.
①日本配方:稻草l000kg,石灰氮10kg,尿素5kg,硫酸铵13kg,硫酸钙30kg,过磷酸钙30kg.
②美国兰伯特式合成培养料的配方:小麦秆或黑麦秆1000kg,血粉40kg,马粪l00kg,尿素l0kg,过磷酸钙40kg,碳酸钙20kg,细土500kg,水2500kg.
③美国辛登式配方:麦秆l000kg,豆稿l000kg,干啤酒槽75kg,石膏50kg,硝酸铵30kg,氯化钾25kg④南韩配方:稻草1000kg,鸡粪l00kg,尿素12--15kg,石膏10—20kg.
(二)培养料堆积发酵堆积发酵将配方中的各种材料混合在一起,让其腐熟发酵的过程.
其目的为:使各种好热性微生物在堆料中繁殖,把培养材料中的纤维素、半纤维素、木质素分解为蘑菇菌丝可以利用的化合物;所加人的氮素营养物质被各种微生物利用后,变成微生物的蛋白质,当微生物死亡后,菌体也就成了蘑菇可利用的有机氮;发酵过程中释放的热可以杀死料中的病虫杂菌;经过发酵,堆料变得柔软、疏松、通气,具有优良的物理状态.
l.
堆料前的准备粪肥应晒干,不要淋雨,若来不及晒干,则可挖坑倒入,拍紧,密封.
用干粪堆积效果好,牛粪最好晒干至半干时粉碎成粉状,再晒干透.
稻草、麦秆等材料需选用新鲜、无霉烂的,使用前须切割成20--30cm长的小段,以便其吸水,也便于翻堆.
2.
培养料的二次发酵蘑菇培养料堆积腐熟发酵一般分两个阶段进行,前发酵,又称一次发酵或室外发酵;后发酵,或称第二次发酵,因其通常在室内进行,又称为室内发酵.
(1)前发酵采用粪草培养料的,前发酵时间较长,需15~20天;采用以稻草为主的合成培养料的,前发酵时间需10~15天:以麦秆为主的发酵时间较长.
麦草吸水力差,应浸泡2~3天,稻草吸水快,只浸泡l天即可.
干粪在堆制时用水调湿润.
使用的粪和草均需先预湿.
堆料时,先铺一层厚20cm的草料,草上铺5—6cm厚的粪肥,其上再铺20cm厚的草,再铺5~6cm厚的粪.
这样一层草一层粪层层相间地堆积起来.
第一层粪草不需浇水,以后每铺一层粪一层草后,补浇清水或人畜粪尿.
下层少浇,上层多浇.
料堆不要过宽,否则操作不便,且透气性差,料温难以提高;料堆过窄,则可能使料温过高,将一些微生物杀死,对发酵不利.
堆料最好在阴棚下,免受日晒雨淋.
培养料堆积后也应覆盖草帘,以利于保温保湿.
但一般不宜用塑料薄膜紧贴培养料覆盖,否则,料堆通气不良,会造成厌氧状态,使堆内材料变粘,在露天堆料,下雨前需用薄膜作为临时避雨棚.
培养料堆积发酵后,需经几次翻堆.
翻堆是定时将堆积的粪草抖松拌和,把位于料上面的和周围的粪草翻到下面或中间去,而把下面或中间的材料翻到上面或外围来,使堆积的培养料发酵均匀、一致.
有条件的地方也可采用翻堆机翻堆.
在不同部位的粪草发酵很不均匀,料堆最外层氧气虽然充足,但水分散失多,培养料分解较差;在料堆中心部位,由于缺氧,培养料不能很好地分解;在料堆底层的培养料积有较多的CO2,培养料呈酸性,会发粘发臭.
只有外层至中心部分发酵最好.
因此,通常应进行3次以上的翻堆.
翻堆的作用是:改善料堆各部位的发酵条件,防止料堆中央部位特别是中央底层长期处于厌氧状态;排除堆内废气,增加新鲜氧气,缩短发酵时间;调节水分;检查发酵状况;便于分次加入添加材料.
堆料后,次日堆温便开始上升,开始40~50℃,是一些嗜温性微生物(主要是一些细菌)活动;4~5天后温度上升到65~75℃时,此时是一些嗜热性微生物(主要是嗜热性放线菌)活动.
一般当堆温上升到最高点并开始下降时,即应进行一次翻堆.
堆温由微生物分解物质时释放出来的热能维持,如果堆温开始下降,说明堆内物质的分解作用已减弱,此时翻堆能及时补充堆内的氧气和水分,使微生物的分解作用在新的条件下继续进行,加速培养料分解和腐熟.
高温能杀死粪草料中的病菌孢子和虫卵,但长时间高温,一些嗜热性放线菌也会旺盛地繁殖起来,就会耗损大量可溶性养分.
每次翻堆的时间随着材料的发酵腐熟逐渐递减,通常进行第一次翻堆时间是上堆后的6~8天,进行第二次翻堆时间是第一次翻堆后的5~7天,第三次翻堆是第二次翻堆后的4~5天.
第一次翻堆加足水分;并加尿素和石膏粉;第二次翻堆只对料干部分适当加水,不宜加水太多,此次加入硫酸铵及过磷酸钙;第三次翻堆调节水分及酸碱度.
(2)后发酵国内目前后发酵方法有两种,即固定床架式后发酵和就地式后发酵,后者就是将前发酵的料就地建堆后发酵,但以前者为主,将培养料移人菇房后再一次发酵.
通常前发酵以化学反应为主,要求高温快速;后发酵则是生物活动过程占优势,要求控温、控湿、通气.
后发酵过程分两个步骤进行,将经前发酵好的培养料搬人菇房床架上,关闭门窗,升温至58~60℃,维持6-8h,即巴斯德消毒,以进一步杀死料中的虫、卵和病害、杂菌.
然后通风降温,在12h内逐步将料温降至48~53C,维持3~5天,促使一些有益微生物生长,将培养料转化为易被蘑菇菌丝吸收和利用的物质;同时便能刺激竞争性杂菌生长而抑制蘑菇菌丝生长的氨气挥发.
因为氨气在50℃以上或40℃以下挥发速度明显减慢.
控温发酵还可减缓易被细菌和真菌利用的碳水化合物的降解,而不至于降低培养料的活性.
后发酵过程中的有益微生物大体可分为嗜热细菌(最适生长温度50~60℃)、嗜热放线菌(最适生长温度50~55℃)和嗜热霉菌(最适生长温度45~53℃)三类.
它们在料内繁殖的顺序为:细菌——放线菌——真菌.
首先是细菌大量繁殖,利用培养料中易降解的碳水化合物,产生粘滑的物质即多糖类,这是蘑菇生长所需要的重要碳源.
接着放线菌繁殖,降解纤维素和半纤维素,并利用氨、胺和酞胺作为合成细胞物质的营养,同时释放出蘑菇菌丝生长所需的生长因子如维生素等.
最后是一些非分解纤维素的霉菌协同放线菌进行氨的转化,有些还利用细菌作养料,合成自身物质.
其中以放线菌最具活性.
通过后发酵,培养料由棕色变成深褐色,料松软,不粘稠,含水量65%~68%,含氮量1.
8%~2%,C/N为18~20;pH值7-7.
5,含氨量为0.
04%或更少.
影响后发酵的主要因素是温度、培养料含水量、氧气等.
温度是后发酵过程中的首要因子,必须设法达到所要求的温度,以培养料的温度为标准.
由于后发酵需消耗和散失较多的水分,故培养料含水量应较高,为70%左右,在前发酵最后一次翻堆时调节.
用蒸汽加热,培养料含水量为71%~73%,后发酵结束时其含水量为67%~71%.
采用室内炭火直接加温法,后发酵时培养料含水量应为70%~72%;采用炭火及蒸汽加温法,则料含水量宜为65%~68%;采用塑料棚保温法,培养料含水量以65%为宜.
后发酵中料内的有益微生物一般好氧,室内应有空气,因此后发酵时期应适当开启门窗或敞开薄膜通风,以促进有益微生物活动,抑制厌氧细菌繁殖,制成有选择性的培养料.
后发酵的关键措施是加温和控温.
将经过前发酵的培养料调节到一定温度后,搬入室内,然后通入蒸汽,进行加温和控温.
我国目前许多地区在生产上进行后发酵的加温方法,大体可有:室内炭火加温式控温;室外薄膜覆盖升温,对于室内炭火直热式的后发酵,菇房应密闭不漏风,菇房大小以111m2一间为宜,在室内设置10~20个无烟煤炉加热升温,菇房过大不易升温.
炉火烧旺后将门窗紧闭密封,使温度逐渐上升.
达到60℃时维持6~8h,然后拿掉部分炉子并适当开窗,将温度降到48~53℃,保持4~6天.
每天在高温时进行2~3次通风换气,每次10~15min.
通风换气避免了二氧化碳以及其它有害气体过多,影响发酵.
采用这种方法进行后发酵,成本低,效果好.
露天式后发酵是利用堆肥在完成前发酵后,再建后发酵堆.
建堆时,在料堆底部中心建一道通气小道,料堆上面用草片覆盖,夜间、雨天再在料堆顶部加盖塑料薄膜,其内用竹片支撑,使其与料面有15-20cm的距离.
在建堆的第二天,料的中心温度达的60~65℃,保持2h,揭开覆被草片,并在料上按15cm*15cm距离,打一个直径5cm的小孔,用来掌握通气量,以便调节温度,使温度维持在5℃左右.
蘑菇培养料后发酵的优点是:提高了蘑菇产量和质量,一般可增产20%~40%,有时可增产l倍以上.
生产的子实体品质好,菇形正,肉厚,柄粗,不易开伞,一级菇比例大.
采用培养料后发酵,由于高温放线菌等有益微生物的活动,可形成多种可供蘑菇菌丝直接吸收利用的维生素和氨基酸;后发酵将培养料在60℃下处理2h,可以把料中的虫卵、幼虫等害虫杀死,使病虫来源大大减少,可不用或少用农药防治,减轻了农药污染;用后发酵技术可推迟堆料期7~10天,这样缓和了双夏劳力矛盾;后发酵堆料比一次发酵少两次翻堆,可减少用工,也可减少费用,降低生产成本.
(三)菇房的消毒灭菌将适度腐熟的培养料尽快搬入菇房,先填入最上层床架,从上到下,逐床填入,填料的厚度为16~20cm.
填料完毕,即关闭门窗,用甲醛、敌敌畏各lkg熏蒸消毒24h,操作方法与空菇房消毒相同.
(四)培养料的翻料当培养料经后发酵消毒或用农药熏蒸消毒后,要进行一次翻料,即将铺在菇床上的培养料上下翻动一次,把料抖松,同时将料中发黄绿色的生粪块及杂物等均除去,并打开门窗,进行大通风一次.
通风及抖松料的目的是为了将料在消毒发酵过程中产生的二氧化碳、乙醛、乙烯等各种有害气体彻底排除,使料内进人较多的新鲜空气,有利于接种后菌丝在料中迅速生长,同时翻匀后可使料层厚薄一致,保持15--18cm厚,这样料面平整,床面喷水时受水量也均匀,避免床面凹陷处积水.
(五)播种1.
播种前的准备菇房熏蒸消毒或经室内发酵后,打开门窗及排风筒,排除药液气味或热气,及时进行翻料.
若培养料偏湿或料内氨气过浓时,在料面喷2%~3%的甲醛溶液,随后密闭一夜,次日打开门窗通风后再翻料一次加以清除.
播种前需先测量料温,温度超过30℃,可再翻料一次降温,待培养料温度下降至28℃以下时才可播种.
播种前要对菌种质量进行检查,选用优质菌种.
优质菌种的标准是纯度高,菌丝浓密、旺盛,生命力强,粪草种的培养基里红棕色,有浓厚的蘑菇香味,不吐黄水,无杂菌虫害.
2.
播种时间目前,我国蘑菇栽培主要是利用自然气温进行生产,因此播种时间的选择十分重要.
由于蘑菇菌丝生长阶段要求较高温度,子实体发生要求较低温度,因此我国各地一般都进行秋播或深秋播,长江流域各省多数在9月上中旬温度在28℃以下时播种,10月中下旬开始采收,12月秋菇采收结束,至次年3月气温回升,又可出菇,至5月春菇结束.
珠江流域各省秋季气温较高,冬季不冷,一般在秋末播种,初冬开始采菇,冬春季连续出菇,没有间歇.
如福建在10月下旬播种,11月中下旬开始采菇,4月至5月上旬采菇结束.
华北地区一般在8月下旬播种.
3.
播种规格播种量因菌种培养料不同而有较大差异.
每瓶(750mL蘑菇菌种瓶)粪草菌种播0.
28--0.
33m2;麦粒菌种播1.
33--1.
67m2.
为了使菌种尽量全面萌发,菌丝在培养料表面应占有优势,减少杂菌污染.
一般穴播采取"小株密植"方式,行株距由l0cm见方改为8cm梅花形,深度5cm.
目前新法播种采用混播加撒播方式,即先以三分之二的菌种撒在培养料表面后,将菌种翻入料中5cm与培养料混合,再将剩下的三分之一菌种撒在料面上.
无论选用哪种方法播种,为防止杂菌污染,所用工具及操作人员的手都要严格消毒,菌种瓶表面及瓶口均用0.
1%高锰酸钾溶液消毒,近瓶口一层菌种不用.
4.
播种后的管理播种3天后,为使菌种与湿料接触,易于萌发,一般情况下关闭门窗,仅有背风地窗少量通风,潮湿天气可打开门窗通风.
3天以后,当菌丝已经萌发,并开始长出培养料时,菇房通风应逐渐加大.
如气温在28℃以上、为防止高温影响室内温度,可在中午关闭门窗,只开北面地窗,同时注意夜间通风,雨天多开门窗通风.
播种5--7天后,菌丝已经长大培养料;为了促进菌丝向料内生长,抑制杂菌发生,需加强通风,降低空气湿度.
在无风情况下;多开窗,南北地窗昼夜全部打开;有风时只开背风门窗.
在气候干燥而培养料又偏干时,可在料面覆盖一层报纸,保持料面湿润.
培养料过干时,可在报纸上喷水,增加料面湿度,使菌丝长入料内.
播种7天后要进行检查,如发现杂菌及病虫害,应及时处理.
如发现培养料过湿或料内有氨气,为了使菌丝长入料内,可在床架反面打洞,加强通风,散发水分和氨.
荷兰菇农是从合作社购买菌种和原料,进行混合播种,这可由一种小型的铺料机完成.
播种后用空调调节温度,保持20--25℃.
(六)覆土蘑菇培养料经过发菌,床而有时高低不平,覆土前要把料面抹匀拍平.
覆土对蘑菇的发育有重要的作用.
首先,覆土能改变培养料中二氧化碳的浓度,便蘑菇的菌丝从营养生长期转入到生殖生长期,形成子实体,并保持培养料的水分,有利于子实体的发育;其次,覆土层中含有许多有益的微生物如臭味假单孢杆菌等,它们的代谢产物含有多种激素,能促进蘑菇子实体的形成;第三,覆土层对子实体有支撑作用,能防止培养料温、湿度的急剧变化,保护料层中菌丝的生长发育,并有机械刺激作用,能促进结菇.
及时覆土是夺取蘑菇高产的重要措施.
由于菇房的覆土量大,且对覆土的质量要求较高,如在覆土期遇到长期下雨等不良天气,往往延误覆土,影响产量.
因此,蘑菇菌床所需要的覆土必须在覆土前及早准备,并晒干贮藏备用.
l.
覆土的选择覆土的性质往往影响到出菇的迟早与产量的高低.
澳大利亚的蘑菇农场目前多采用泥炭土作覆土材料.
泥炭苔藓是最理想的覆土材料,与土壤河泥等材料相比,泥炭苔藓的吸水量要高得多.
目前,我国蘑菇栽培上所用的覆土,根据土粒的大小,分为粗土与细土.
粗土直径2cm左右,其质地以壤土为好,要选毛细孔多、有机质含量高、团粒结构好、持水量大、且含有一定的营养成分的土壤作覆土材料,以利于蘑菇菌丝穿透泥层生长.
菇房每平方米床面约需粗土35kg.
细土直径约为0.
5cm,如黄豆大小,每平方米床面需细土20kg左右,其质地以稍带粘性的壤土为宜,因床面的泥层上经常喷水,稍带粘性的土粒喷水后不会松散,也不会造成床面板结的现象,如细土选用砂性土,床面喷水后泥粒变得松散,造成床面泥层板结,直接影响到土层的通气性,不利于菌丝的生长,也不利于子实体的形成.
2,覆土的时期与方法适宜的覆土时期是根据料层菌丝的深度来决定的,当菌丝大部分都已伸展到床底时,便是覆土的适期.
先覆粗土,隔7-10天再覆细土.
根据一般高产菇房的经验,覆粗土7天左右便应及时覆细土.
覆细土后10天左右,便能见到菌蕾,所以覆粗土后约经20天便可出菇.
覆土的厚度,如采用粗土加细土的方法,则粗土覆2.
5~3cm厚,细土覆lcm厚;如采用全部覆细土的方法,则覆土厚度在3.
3cm左右.
覆土的具体方法是:先覆粗土一层,铺满料面,以不见料为标准,并用中土(介乎粗土与细土之间的土粒)填满粗土的缝隙,以防止调水时水分渗入培养料内,造成料内菌丝萎缩,最后铺上一层薄细土.
3.
覆土的杀虫灭菌处理.
为了防止覆土中带入病虫,可采用下列处理方法.
①用10%甲醛溶液及1%的敌敌畏溶液洒在土粒上,1000kg土用以上两种农药各2--4kg,喷洒后拌匀,用塑料薄膜严密覆盖两天,利用农药挥发出的气体杀死病菌与虫卵.
②用泥土质量1%--2%的石灰拌人泥中,杀死线虫等害虫.
4.
覆土层的调水用干的粗土,覆土3天内调足粗土水分,但在杭州地区多采用先将粗土预湿,然后在2-3天内调粗土水分.
方法是将干粗土盛入竹制的土箕内,将竹土箕连同粗土浸没水中,并立即取出,等待5~10min,让水分吸入土粒中,再将土粒撒在床上,此时土粒不会粘结成团.
因此,一般覆粗土1~2天内开始调水,连续调水3天.
在用水量上掌握两头轻、中间重的原则,即第一天调水2.
5~3.
5kg/m2,第二天调水4.
5kg/m2,第三天调水2.
5~3kg/m2,3天内共调水l0—11kg/m2.
如土料干的调水量还可增加到13.
5k/m2.
喷水的方法采用轻喷勤喷、循环喷水的方法,不可一次喷水过多,防止水分流大料中,妨碍菌丝生长.
调水的具体标准是粗土已无白心,质地疏松,手能捏扁土粒,手捏粘手,此时粗土的含水量在20%左右.
(七)出菇管理蘑菇从播种到开始采收,一般需要35~40天.
长江流域各省于9月上旬播种后,从10月中下旬开始采收到12月下旬秋菇期间一般可收5批(潮),第一、二、三批出菇集中,两批菇间隔期为7天左右,第四、五批及春菇出菇不集中,产量减少.
秋菇产量占总产量的70%左右.
出菇期间的管理工作主要有水分管理、通风换干、挑根补上及追肥等.
l.
水分管理(1)床面喷水覆细土后10天左右,扒开上层细土,看到许多绿豆大小白色小菌蕾时,就要及时喷一次"重水",称为"结菇水",每天喷水1次,每次喷用1kg/m2,连续2~3天,总的用水量2.
5~3.
2kg.
喷水增加细土湿度,同时也使粗土上半部得到水分,促使菌蕾迅速形成和长大,并使粗土层的菌丝粗壮有力.
当菌蕾普遍形成并已长到黄豆大小时,需及时喷第二次"重水",称为"出菇水",方法与第一次"重水"相同,用量较第一次稍重,总的用水量2.
7~3.
6kg/m2.
再次加大细土的湿度并使粗土得到水分,促使子实体迅速长大出上,这样出菇多、均匀,转潮(批)快,除了喷"重水"期间外,其余时间喷水每天1次,气候干燥时可喷两次,每次0.
25~0.
36kg/m2.
前三批菇出菇间隔期间,一般称为"落潮",此时应减少喷水,每天喷水l次,每次喷0.
2kg/m2.
前三批菇生育期间气温较高,喷水时间最好在早晚进行.
秋菇后期即第三批采收后,蘑菇不再明显地成批生长,春菇出菇也不集中,喷水要轻喷、勤喷,减少喷水量,每天喷水0.
15~0.
45kg/m2.
喷水力求均匀,雾点要小,喷头要提高一些,并稍有倾斜,以减少对小菇的冲击.
喷水后尽量多开门窗,不喷"关门水",避免菇房闷热,使菌丝老化或者孽生杂菌.
采菇前喷水,防止手捏处菌丝发红,影响质量.
生产上欲采收春菇,在冬季停产期间,仍需加以管理,保护菌丝生长.
由于冬季气温低,蒸发量小,可适当减少喷水,一般5-7天喷水l次,每次喷水0.
5kg/m2.
要防止土面过于、过湿,以免菌丝萎缩.
春季3月上中旬气温回升后,适当增加喷水,一般每天或隔天喷l次,每次0.
15~0.
36kg/m2,以促进菌丝萌发生长.
3月下旬至4月出菇期间增加喷水量,每天喷水1~2次,每次喷水0.
36~0.
5kg/m2,4~5月份温度较高,气候干爆,适当增加喷水次数,霉天2~3次.
(2)空气湿度的调节秋菇前期温度较高,出菇多,空气相对湿度应达到90~95%.
如气候干燥,除床面适当多喷水外,需要在走道空间、墙壁和地面喷水,以增加空气相对湿度.
菇房内空气相对湿度过低,子实体生长缓慢并容易产生鳞片和"空根白心"现象.
但也不宜超过95%;否则影响菌丝生长,并容易产生杂菌、锈斑等病害.
采菇高峰过后,气温渐低,空气相对湿度可低一些,达85%~90%,空中、地面不再喷水.
春菇后期温度较高,蒸发量大,应增加菇房内相对湿度.
如气候干燥,仍需在走道空间、墙壁和地面喷水,并加强通风,降低室内温度.
也可采用喷水机来完成喷水.
2.
通风换气秋菇前期菌丝生长旺盛,出菇多,放出大量的二氧化碳,需要加强通风,保持菇房内空气新鲜;但此时期气温较高,又需保持较高的空气湿度.
因此;菇房主要在早晚或夜间通风.
春季气温尚低时,通风在中午气温较高时进行,以利提高菇房温度.
4~5月份气温上升,宜早、晚和夜间通风,以免热空气进人室内,增加菇房温度.
3.
清除老根、死菇,及时补土每次采收以后,菌床上遗留下的老根、死菇,要及时清除干净,因老根已失去吸收养分和出菇的能力,且占据位置,使下面的菌丝生长受到影响,有碍出菇.
如果时间长腐烂后,容易引起病虫危害.
同时要把采菇时带走的泥土用较湿润的细土重新补平,保持原来的厚度.
4.
追肥在出菇旺盛期需肥最大,一时供应不上时容易出现柄细长、薄皮开伞菇;发育后期营养不足时产菇减少,小菇、薄皮菇多,显著地影响蘑菇的产量和质量.
适当地分次追肥是提高产量和质量的一项措施.
常用的种类和浓度如下:(1)葡萄糖常用的葡萄糖液浓度为10-20g/L,必要时可用30g/L,也可用200g.
/L蔗糖液.
(2)胡萝卜汁先将胡萝卜切成小薄片,加水2倍,煮烂后过滤,取出原液,再稀释3倍使用.
(3)黄豆浆用黄豆1kg浸水后磨成浆汁,过滤后加清水50kg使用.
(4)化学肥料尿素用2-4g/L,硫酸铵用5g/L,磷酸二氢钾用2-3g/L,过磷酸钙用5g/L(取澄清液)的液肥.
(5)蘑菇健壮素l号比久0.
5g,硫酸镁40g,硼酸10g,硫酸锌20g,尿素l00g,维生素B140mg,加水l00kg.
可供300m2面积上喷2~3次,对菌丝复壮有效.
(6)蘑菇健壮素II号比久1g,硫酸镁50g,磷酸二氢钾100g,维生素Bl100mg,加水l00kg.
对促进子实体形成和肥大有效,用量与I号相同.
蘑菇追肥对增加产量和提高质量有一定的效果,但只能作为一项辅助措施.
蘑菇只有在配制质量好的培养料的基础上,适当追肥,才能获得更好的收成.
(八)采收当蘑菇长到符合标准大小时,应及时采收.
如果采收过晚,影响质量,同时会影响下面小菇的生长.
蘑菇旺盛期,应该采取菇多采小、温高采小、质差采小的方法,才能保证蘑菇质量.
作鲜销的蘑菇,可以采得稍大些,但也不能开伞,否则降低其商品价值.
旺产期一般每天采收两次,以保证质量.
采菇前不能喷水,否则采时手捏菇盖造成发红.
采收方法不当也会影响蘑菇的产量和质量.
菇密时,采菇要用拇指、食指、中指捏住菇盖,轻轻旋转采下,以免带动周围的小菇.
多个菇丛生在一起的球菇,采收时要用刀小心地切下大菇留小菇,不能整个搬动,否则其它小菇都会死掉.
秋菇采收第二批后,床面菇稀时,采菇可以直接将菇拔起,这样能同时带出一部分老根.
采菇时经常用湿手巾将手指上的泥土擦掉,来下的蘑菇应整齐地放人篮中,以免损伤.
蘑菇采收后,随即用小刀把菇柄下端带有泥土的部分削去,加工蘑菇菇柄长短,按收购标准要求切削.
在削菇时,动作要轻,避免机械损伤,刀要锋利,这样菇柄平整,质量好.
削菇后进行分级,将不同等级的蘑菇分别放置于垫有纱布、棉垫或薄膜的筛或篮中,上面盖上纱布,及时送到收购站交售.
B.
箱式栽培箱栽培适合于机械化的三区制周年栽培.
培养料的配方、堆制发酵工艺均与床架式栽培法相同.
栽培箱的规格要根据机械化的程度、菇房大小及便于操作进行设计,常用的有40cm*60cm*20cm和50cm*80cm*20cm两种规格.
栽培箱可用木、铝合金或硬质塑料等制作,为便于贮藏、运输和消毒灭菌,一般都制成统一规格的活动箱.
把发酵并经处理的培养料装入栽培箱,料厚15cm,播上蘑菇菌种,移人发菌培养室.
培养15--17天后,覆上消毒处理过的土粒,调水后再培养15~17天,此时蘑菇菌丝已基本发满培养料,移进出菇室.
出菇室温度控制在(14±2)℃,空气相对湿度90%~95%.
5~8天后蘑菇菌丝开始扭结出菇,采收约60天结束.
采收结束后将箱子移到室外,倒掉废料,消毒菇室,再从发菌室移进一批已经培养好菌丝的栽培箱,降温使其出菇,周而复始地连续生产.
这种箱式栽培的三区制菇房,一间发菌室配两间出菇室,还需要装空调等制冷设备,一般每年可种5期蘑菇.
C.
畦式栽培畦式栽培一般多利用冬闲田进行.
在干稻田中,整地作畦,畦宽1.
5m,高15--20cm,长则根据地形而定,在畦面上撒一层生石灰粉进行消毒.
把堆制发酵成熟的培养料铺放于畦上,料厚约l0cm,整平后稍压实即可播蘑菇菌种.
播种后用竹木材料做成框架,罩在菇畦上,覆盖黑色或深蓝色塑料薄膜.
为了保湿和遮光,薄膜上再覆盖一层用稻草、茅草、蔗叶编织成的草帘.
在栽培管理过程中,要定期掀开部分薄膜进行通风换气,并根据天气情况而定,可选在中午或下午,清晨或夜间.
换气时间的长短应根据菌丝的生长量或畦上蘑菇子实体的多少,以及当天的天气情况灵活掌握.
X草菇的栽培一、目的:掌握草菇的栽培技术二、方法和步骤(一)栽培季节当气温在25℃以上、空气相对湿度在80%以上时,即可栽培草菇.
如北京、河北可从6月下旬至8月上旬,广西、福建4~9月气温高,适合草菇的生长发育.
广东栽培草菇的季节比其它省长,如在珠江三角洲,从3月下旬开始栽培,一直到11月上旬止,其平均气温在23℃以上,因此一般从4~10月均可在自然条件下连续生产,但有春菇、夏菇、秋菇之分.
近年来,由于栽培技术的进步,可人工调节温度,即使在冬季低温季节也能生产,草菇已实现周年栽培.
(二)培养料配制适合草菇生长的培养料很多,各地可因地制宜,就地取材.
l.
培养料配方(1)废棉培养料废棉96%,石灰4%.
(2)甘蔗渣培养料甘蔗渣86%,麦敖9%,石灰3%,石膏2%(3)稻草培养料稻草81%,肥泥16%,石灰3%(4)稻草与棉籽屑培养料稻草48%,棉籽屑48%,石灰4%(5)棉籽屑培养料棉籽屑71%,干牛粪9%,稻草粉11%,麦秩7%,磷肥1%,石灰1%.
(6)棉纺屑培养料棉纺屑75%,火土灰15%,麦麸8%,石灰1%,石膏1%.
2.
培养料处理有两种培养料处理法:①塑料薄膜堆制,培养草菇的棉籽屑、稻草或废棉等需先用水浸透,浸制时间一般为6~l2h,然后捞出沥干,将辅料拌和均匀,使含水量为60%~65%.
然后建堆,堆宽1.
2m,高60~70cm,长依用料数量而定,在料推上覆盖薄膜保温.
经2~3天,待堆温升高到60℃时翻堆,翻堆后2~3天,堆温再升高到60℃时,维持l天,第二天可拆堆,准备运入菇房.
②前后发酵堆制,前发酵:将稻草切成5~l0cm的小段,浸水后加大辅料拌匀,含水量60%~70%,堆成宽lm、高lm、长度不限的发酵堆.
发酵2~3天后,翻堆检查干湿度,再堆1~2天,调好水分和pH值,然后进人栽培室,进行室内后发酵.
后发酵:完成前发酵后趁料温在40~50℃时将料搬人菇房,关闭菇房门窗,当菇床上的培养料因发酵而温度逐渐上升时,通入蒸汽或加热,将料温升到60℃保持2h,然后微微通风,逐步降温到50℃左右保持1~2天.
待床内料温降至30~35℃时,立即轻压实、拍平播种.
(三)栽培场所l.
室内栽培室内栽培需要有菇房,要求菇房能保温保湿,通气透光.
草菇房内的床架与蘑菇栽培的床架相同,通常为4~5层,床架宽1.
2m,床架间走道宽60cm.
有条件的情况下,可在菇房内安装温湿度自动调节器以及通风系统.
草菇的室内栽培能人工控制其生长发育所需的温度、湿度、通气、光照及营养等条件,避免低温、干旱、大风、暴雨等自然条件的影响,全年均可栽培,一年四季均有鲜菇供应市场,可向工业化、专业化、自动化生产的方向发展.
2.
室外栽培华南地区由于温差较小、气温较高,可在室外稻田中栽培;河北地区可采用冷床(阳畦)上盖薄膜栽培.
夏初气温低时,畦地应选择向阳的地方;夏季气温较高时,应选择较阴凉的地方.
但是室外栽培草菇除了华南地区外,只能在高温的夏秋季节进行.
由于是在室外栽培,受气候影响较大,产量不稳定.
况且室外栽培用草量多,生产成本高,有的占用耕地,其生产技术也复杂,不容易掌握.
(四)栽培方式(1)床式栽培l.
波浪式将经过发酵的培养料移到菇床上,按照菇床排列的纵向方向,做成波浪式短小的小埂菌床.
小埂高15cm,两小埂之间为5--7cm.
该方式可增加出菇面积,通风较好,菌丝生长快,出菇早,菇体整齐.
但是如果管理不好,喷水不当,小埂中部常被水渍,会影响菌丝生长和出菇.
2.
平铺式把发酵好的培养料搬人菇床,均匀铺在床架上,除中间略呈龟背式外,其余部分平整.
培养料的厚度依气温高低而有所区别,如气温30℃时,棉籽屑培养料厚l0cm,稻草培养料厚l7cm;气温升高达33C时,棉籽屑厚7cm,稻草厚l3cm;气温降至25℃时,棉籽屑厚l3cm,稻草厚20cm.
培养料在菌床上整理好后即可播种,播种方法可用穴播或撒播,接种量为4%--6%.
草菇菌种满瓶后15天以内的菌种,其生命力强,易萌发吃料,产量较高.
(2)堆式栽培一般指在大田以稻草为培养料的栽培方式.
l.
选地作畦在旱地、水田均可栽培,其土质应为疏松的砂壤土,可保湿保肥,又通气,有利于草菇生长.
如土质粘性太重或沙石太多,应添加一层砂壤土.
畦应于种菇前5~7天做成,先用杀虫药消灭蚯蚓及其它害虫.
水田应犁翻浸水4天,然后犁耙,再浸水4天,之后排水晒干.
旱或水田晒干后,即可做成畦.
一般畦宽l00~120cm,南北向,东西延长,畦高20~33cm,畦面呈龟背形,每畦相距50~60cm.
2.
备料稻草要求无霉烂,金黄色.
若用已潮湿发霉的稻草,则堆温低,发热期短,而且容易感染病虫杂菌,产量也低.
新鲜稻草含水多,发热较低,须经充分曝晒干燥后,才能使用.
早、中、晚稻草均可采用,其中以中稻草较好.
种植l公顷地草菇需500~667kg稻草.
低温季节,用草量及用种量可适当增加.
3.
浸草将稻草扎成把,每把0.
5~1kg.
2.
5~5kg捆成一捆,于堆草前一天放入水中浸10~14h,使稻草充分浸湿,早稻草浸水时间可短些.
也有人采取将稻草放入水中,边浸边踩,可使稻草充分吸水,缩短浸水时间,待稻草变软时即可使用.
浸草完毕即捞起运到栽培场备用.
4.
踩草堆(1)轧草式将湿草从中间用轧刀切成两段,齐头放在畦的两边,草头草尾在畦中间,两边对放,一把紧靠一把,用脚踩紧.
堆中间空低处填入稻草,即填心草.
一般堆4层,每层周围均比第一层缩进3cm左右,菌堆呈梯形.
播种后,菌堆顶上层盖一层薄稻草并踩紧.
(2)折尾式长稻草用此法.
将干稻草齐好,重0.
5kg蛙左右,在近草头1/3处折转扎把.
踩堆时,把已浸湿的稻草把一把紧靠一把,横放在畦上.
踩第二层时,草头的方向压在第一层草尾之上,如此一层层堆好.
(3)扭把式将稻草扭成"8"字形,依序紧密地横放在畦上,草头和草尾朝内.
两边同时进行,叠草的宽度比畦窄7--10cm.
叠完第一层后,普遍踩一次,边踩边淋水,这样菌堆易于发热.
叠第二层草时向内收缩7--10cm,叠法与第一层相同.
层层相叠,直到第四层.
菌堆做完后,还要踩一次,也要淋水,直至菌堆四边有黄水流出为止.
菌堆踩好后,用薄膜覆盖,以保温保湿,有利于草菇菌丝的生长发育.
室内栽培的,因为温湿度较稳定,3-4天后可不再覆盖.
露地栽培还须在雨季来临前用薄膜覆盖防雨.
通常踩菌堆与播种是交错进行的,菌堆第一层踩完后,在四周7-l0cm范围内播一层草菇纯种,然后踩第二层,草把刚好压住菌种.
第二、三层播种方法同第一层,在第四层草上全面播种.
5.
复踩与盖土复踩是菌堆原来踩得不紧或水分不足的辅助措施.
菌堆顶部盖土,能保温保湿,为出菇创造条件.
一般这两项措施在踩堆后第三天进行.
如果堆内稻草过干,则应在复踩时淋水以补足水分,用水量以菌堆流出黄水为度.
需淋水的草堆只适宜在建堆后第三天进行,过迟淋水引起堆温骤然降低,易损伤菌丝,影响产量.
如果草堆中稻草含水量己足,仅在菌堆顶部反复踩紧一次,然后用火烧土或较肥沃的菜园土薄盖一层.
(五)栽培管理(1)控制菌堆温度菌堆内温度经历由低到高,再由高到低的变化过程.
踩菌堆后,堆内温度逐渐升高,4~6天后达到最高温度,再过1~2天后开始缓慢下降.
一般播种后6~7天,即可出现幼菇.
菌堆内水分不足,稻草较干,易引起高温,可采用踩紧菌堆和淋水的方法.
降低堆温.
温度过高时,应掀开草被或全部撤掉草被,加强室内通风,并用竹棍在堆内打洞,散发堆温.
当温度下降到45℃左右时,再用稻草将洞塞好保温.
(2)调节水分在踩菌堆4天后要定时掀开薄膜通风换气.
若气温较高,菌床外表干燥,可直接向菌堆喷水,以后每天可以喷水1--2次,喷后盖薄膜.
如果气候特别干燥,还要在草堆覆盖物上浇水,经常保持草被有适当的湿度.
当堆上出现白色原基时,宜轻喷、少喷,以保湿为主.
随着菌蕾长大,逐渐加大喷水量.
每采完一批草菇后,应踩堆或压实一次,草堆两侧也需压实,使保温保湿良好,以利再次出菇.
(3)通风换气草菇为好气性真菌,应注意通风换气,通常每天开窗多次,以排除室内的二氧化碳,增加新鲜空气,这样有利于菌蕾的形成.
(六)采收室外种菇一般播种后6~10天即可见菌蕾,11~15天可以开始采菇.
商品草菇采收适期是菇体由基部较宽、顶部稍尖的宝塔形变为卵形,质地由硬变软,颜色由深变浅,在外菌幕未被突破之前采收,这时的菇体味道鲜美,蛋白质含量较高,质量最佳.
菌幕将破末破,菌柄还未露出的质量次之,开伞的菇质量较差.
草菇生长迅速,有时往往一夜之间全部开伞,因此,采收必须及时,最好早晚各采收一次.
室内栽培草菇6~7天可见菌蕾,10天左右收菇.
当第一潮草菇采完后,隔1~2天第二潮菇蕾便出现,约5-6天后又可采收.
每个草堆可收草菇4~5次,采收期30~40天.
室内栽培的草菇第一潮菇产量可占整个收菇期产量的70%~80%.
采收草菇的方法为:一手按住菇体周围的培养料,另一手握住菇体左右旋转,轻轻摘下,切忌用力拔起,以免牵动菌丝,弄乱草堆,影响以后出菇.
如遇密集丛的草菇,应在大部分适合采收时,一齐采摘,以免因采收个别草菇的翻动而造成大量未成熟的草菇死亡.
第三部分专题实验实验26水中细菌学检查I水中细菌总数的测定一、目的要求l.
学习水样的采取方法和水样细菌总数测定的方法.
2.
了解水源水的平板菌落计数的原则.
二、基本原理本实验应用平板菌落计数技术测定水中细菌总数.
由于水中细菌种类繁多,它们对营养和其他生长条件的要求差别很大,不可能找到一种培养基在一种条件下,使水中所有的细菌均能生长繁殖,因此,以一定的培养基平板上生长出来的菌落,计算出来的水中细菌总数仅是一种近似值.
目前一般是采用普通肉膏蛋白胨琼脂培养基.
三、器材l.
培养基肉膏蛋白胨琼脂培养基,无菌水.
2.
仪器或其他用具灭菌三角烧瓶,灭菌的带玻璃塞瓶,灭菌培养皿,灭菌吸管,灭菌试管等.
四、操作步骤l.
水样的采取(1)自来水先将自来水龙头用火焰烧灼3min灭菌,再开放水龙头使水流5min后,以灭菌三角烧瓶接取水样,以待分析.
(2)池水、河水或湖水应取距水面l0~15cm的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存.
2.
细菌总数测定(1)自来水①用灭菌吸管吸取lml水样,注入灭菌培养皿中.
共做两个平皿.
②分别倾注约15mL己溶化并冷却到45℃左右的肉膏蛋白胨琼脂培养基,并立即在桌上作平面旋摇,使水样与培养基充分混匀.
③另取一空的灭菌培养皿,倾注肉膏蛋白胨琼脂培养基15mL作空自对照.
④培养基凝固后,倒置于37℃温箱中,培养24h,进行菌落计数.
⑤两个平板的平均菌落数即为lml水样的细菌总数.
(2)池水、河水或湖水等①稀释水样取3个灭菌空试管,分别加入9ml灭菌水.
取lml水样注入第一管9ml灭菌水内、摇匀,再自第一管取1ml至下一管灭菌水内,如此稀释到第三管,稀释度分别为10-1、10-2与10-3.
稀释倍数看水样污浊程度而定,以培养后平板的菌落数在30~300个之间的稀释度最为合适,若三个稀释度的菌数均多到无法计数或少到无法计数,则需继续稀释或减小稀释倍数.
一般中等污秽水样,取10-1、10-2、10-3三个连续稀释度,污秽严重的取10-2、10-3、10-4三个连续稀释度.
②自最后三个稀释度的试管中各取lmL稀释水加入空的灭菌培养皿中,每一稀释度做两个培养皿.
③各倾注15ml已溶化并冷却至45℃左右的肉膏蛋白胨琼脂培养基,立即放在桌上摇匀.
④凝固后倒置于37℃培养箱中培养24h.
3.
菌落计数方法(1)先计算相同稀释度的平均菌落数.
若其中一个平板有较大片状菌苔生长时,则不应采用,而应以无片状菌苔生长的平板作为该稀释度的平均菌落数.
若片状菌苔的大小不到平板的一半,而其余的一半菌落分布又很均匀时,则可将此一半的菌落数乘2以代表全平板的菌落数,然后再计算该稀释度的平均菌落数.
(2)首先选择平均菌落数在30~300之间的,当只有一个稀释度的平均菌落数符合此范围时,则以该平均菌落数乘其稀释倍数即为该水样的细菌总数(见表26-1,例1).
(3)若有两个稀释度的平均菌落数均在30~300之间,则按两者菌落总数之比值来决定.
若其比值小于2,应采取两者的平均数;若大于2,则取其中较小的菌落总数(见表26-l,例2及例3).
(4)若所有稀释度的平均菌落数均大于300,则应按稀释度最高的平均菌落数乘以稀释倍数(见表26-l,例4).
(5)若所有稀释度的平均菌落数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数(见表26-l,例5).
(6)若所有稀释度的平均菌落数均不在30~300之间,则以最近300或30的平均菌落数乘以稀释倍数(见表26-1,例6).
表26—1计算菌数落总数方法举例不同稀释的平均菌落数例次10-110-210-3两个稀释度菌落数之比菌落总烽(个/ml)备注1136516420--16400或1.
6*10422760295461.
637750或3.
8*10432890271602.
227100或2.
7*1044无法计数1650513--513000或5.
1*105527115--270或2.
7*1046无法计数30512--30500或3.
1*104两位以后的数字采取四舍五入的方法去掉五、实验报告1.
结果(1)自来水平板菌落数1ml自来水中细菌总数12(2)池水、河水或湖水等稀释度10-110-210-3平板121212菌落数平均菌落数计算方法细菌总数/mL2.
思考题(1)从自来水的细菌总数结果来看,是否合乎饮用水的标准(2)你所测的水源水的污秽程度如何(3)国家对自来水的细菌总数有一标准,那么各地能否自行设计其测定条件(诸如培养温度,培养时间等)来测定水样总数呢为什么II水中大肠菌群的检测一、实验目的和内容目的:学习检测水中大肠菌群的方法,了解大肠菌群数量与水质状况的关系.
内容:1.
用滤膜法检测大肠菌群.
2.
用多管发酵法检测大肠菌群.
二、实验材料和用具复红亚硫酸钠培养基(远藤氏培养基)、乳糖蛋白胨半固体培养基、乳糖蛋白胨培养液、三倍浓乳糖蛋白胨培养液、伊红美蓝培养基(EMB培养基).
微孔滤膜(孔径0.
45m)、滤器(容量500mL)、抽气设备、镊子、发酵用试管、杜氏小管、培养皿、刻度吸管或移液管、接种环、酒精灯.
三、操作步骤(一)水样的采集1.
自来水将自来水龙头用火焰烧灼3min灭菌,再拧开水龙头流水5min,以排除管道内积存的死水,随后用已灭菌的三角瓶接取水样,以供检测.
2.
池水、河水或湖水将无菌的带玻塞的小口瓶浸入距水面10~15cm深的水层中,瓶口朝上,除去瓶塞,待水流入瓶中装满后,盖好瓶塞,取出后立即进行检测,或临时存于冰箱,但不能超过24h.
(二)滤膜法检测大肠菌群l.
用无菌镊子将一无菌滤膜置于滤器的承受器当中,将过滤杯装于滤膜承受器上,旋紧,使接口处能密封,将真空泵与滤器下部的抽气口连接(图26-1).
图26—1微孔滤膜滤器1.
滤杯;2.
滤杯和接瓶接合处(内装有滤膜);3.
接瓶;4.
抽滤系统(可接针筒);5.
硅树脂垫圈;6.
微孔滤膜(0.
45m);7.
膜承受部分2.
加水样100mL于滤杯中,启动抽真空系统,使水通过滤膜流到下部,水中的菌细胞被截留在滤膜上.
水样用量可适当增减使获得菌落适量.
3.
用无菌镊子小心将截留有细菌的滤膜取出,平移贴于复红亚硫酸钠固体培养基上(注意无菌操作,滤膜与培养基间贴紧,无气泡),37℃培养16~l8h.
挑选深红色或紫红色、带有或不带金属光泽的菌落,或淡红色、中心色较深的菌落进行涂片和革兰氏染色观察.
4.
经染色证实为革兰氏阴性无芽孢杆菌者,再接种在乳糖蛋白胨半固体培养基上,37℃培养6~8h后观察,产气者证实为大肠菌群阳性.
培养中应及时观察,时间过长则气泡可能消失.
5.
结果计算水样中总大肠菌群数/个·L-1=(滤膜生长的菌落数/过滤水样量/mL)*100(滤膜上菌落数以20~60个/片较为适宜)(三)多管发酵法检测大肠菌群1.
取5支装有3倍浓乳糖蛋白胨培养基的初发酵管,每管分别加入水样10mL.
另取5支装有乳糖蛋白胨培养基的初发酵管,每管分别加入水样lmL.
再取5支装有乳糖蛋白胨培养基的初发酵管,每管分别加入按1:10稀释的水样lmL(即相当于原水样0.
1mL),均贴好标签.
此即为15管法,接种待测水样量共计55.
5mL.
各管摇匀后在37℃恒温箱中培养24h.
若待测水样污染严重,可按上述3种梯度将水样稀释10倍(即分别接种原水样1mL、0.
lmL、0.
01mL)、甚至100倍(即分别接种原水样0.
lmL、0.
01mL、0.
001mL),以提高检测的准确度.
此时,不必用3倍浓乳糖蛋白胨培养基,全用乳糖蛋白胨培养基.
2.
取出培养后的发酵管,观察管内发酵液颜色变为黄色者记录为产酸,杜氏小管内有气泡者记录为产气.
将产酸产气和只产酸的两类发酵管分别划线接种于伊红美蓝培养基上,在37℃恒温箱中培养18~24h.
挑选深紫黑色和紫黑色带有或不带有金属光泽的菌落、或淡紫红色和中心色较深的菌落,将其一部分分别取样进行涂片和革兰氏染色观察.
3.
经镜检证实为革兰氏阴性无芽孢杆菌,则将此菌落的另一部分接种于装有倒置杜氏小管的乳糖蛋白胨培养液的复发酵管中,每管可接种同一发酵管的典型菌落1~3个,37℃培养24h若为产酸产气者表明试管内有大肠菌群菌存在,记录为阳性管.
4.
根据3个梯度(10mL、1ml、0.
1mL)每5支管中出现的阳性管教(即为数量指标),查附注的"15管发酵法水中大肠菌群5次重复测数统计表"(表26-2)的细菌最可能数,再乘以100即换算成1升水样中的总大肠菌群数.
四、注意事项认真配制不同类型培养基.
检测中应合理控制所加的水样量.
在滤膜法中每片滤膜的菌落数以20~60个为宜.
多管发酵法中水样稀释比例要适宜.
挑选菌落时认真选择大肠菌群典型菌落.
五、演示1.
具有大肠菌群的发酵管中产酸与产气特征的观察.
2.
在复红亚硫酸钠培养基和伊红美蓝培养基上大肠菌群典型菌落的色泽及特征的识别.
六、实验报告(一)实验结果记录1.
微孔滤膜法过滤水样量(mL):,37℃培养后特征菌落数:,接种乳糖培养基后的阳性管数:.
总大肠菌群数(个/L):.
2.
多管发酵法检测结果(1)根据实验数据查表26—2:表26—215管发酵法水中大肠菌群5次重复测数统计表数量指标*细菌最可能数数量指标细菌最可能数数量指标细菌最可能数数量指数细菌最可能数0000.
02031.
24001.
35138.
50010.
22100.
74011.
75205.
00020.
42110.
94022.
05217.
00100.
22121.
24032.
55229.
50110.
42200.
94101.
752312.
00120.
62211.
24112.
052415.
00200.
42221.
44122.
552517.
50210.
62301.
24202.
05308.
00300.
62311.
44212.
553111.
01000.
22401.
54223.
053214.
01010.
43000.
84302.
553317.
51020.
63011.
14313.
053420.
01030.
83021.
44324053525.
01100.
13101.
14403.
554013.
01110.
33111.
14414.
954117.
01120.
53121.
74504.
054225.
01200.
33132.
04515.
054330.
31210.
53201.
45002.
554435.
01221.
03211.
75013.
054545.
01300.
53222.
05024.
055025.
01311.
03301.
75036.
055135.
01401.
13312.
05047.
555260.
02000.
23402.
05103.
555390.
02010.
73412.
55114.
5554160.
02020.
93502.
55126.
0555180.
0*数量指标示意:如"203",表示5个10mL初发酵管中有阳性管2个;5个1mL初发酵管中有阳性管0个;5个0.
1mL初发酵管中有阳性管3个;又如"555",则表示15个初发酵管均为阳性管.
(2)多管发酵法结果填于下表中:初发酵管初发酵管数每管取样数/mL产酸产气管数复发酵管数阳性管数5105150.
1(3)多管发酵法检测结果:查表结果及总大肠菌群数(个/L)(二)试图解说明检测水样中大肠菌群的操作过程.
七、问题和思考1.
检查饮用水的中大肠菌群有何意义比较本实验中两种检测方法的优缺点.
2.
试设计一个监测某自来水厂水质卫生状况的方案.
实验27实验室环境和人体表面微生物的检查一、目的要求1.
证明实验室环境与体表存在微生物.
2.
比较来自不同场所与不同条件下细菌的数量和类型.
3.
观察不同类群微生物的菌落形态特征.
4.
体会无菌操作的重要性.
二、基本原理平板培养基含有细菌生长所需要的营养成分,当取自不同来源的样品接种于培养基上,在适宜温度下培养1~2d内每一菌体即能通过很多次细胞分裂而进行繁殖,形成一个可见的细胞群体集落,称为菌落.
每一种细菌所形成的菌落都有它自己的特点,例如菌落的大小,表面干燥或湿润、隆起或扁平、粗糙或光滑,边缘整齐或不整齐,菌落透明或半透明或不透明,颜色以及质地疏松或紧密等.
因此,可通过平板培养来检查环境中细菌的数量和类型.
三、器材l.
培养基肉膏蛋白胨琼脂平板.
2.
仪器或其他用具无菌水,灭菌棉签(装在试管内),接种环,试管架,酒精灯或煤气灯,记号笔,废物缸.
四、操作步骤每组在"实验室"和"人体"两大部分中各选择一个内容做实验,或由教师指定分配,最后结果供全班讨论.
l.
写标签任何一个实验,在动手操作前均需首先将器皿用记号笔做上记号,写上班级、姓名、日期,本次实验还要写上样品来源(如实验室空气或无菌室空气或头发等),字尽量小些,写在皿底的一边,不要写在当中,以免影响观察结果.
培养皿的记号一般写在皿底上.
如果写在皿盖上,同时观察两个以上培养皿的结果,打开皿盖时,容易混淆.
2.
实验室细菌检查(1)空气将一个肉膏蛋白胨琼脂平板放在当时做实验的实验室,移去皿盖,使琼脂培养基表面暴露在空气中;将另一肉膏蛋白胨琼脂平板放在无菌室或无人走动的其他实验室,移去皿盖.
lh后盖上两个皿盖.
(2)实验台和门的旋钮①用记号笔在皿底外面中央画一直线,再在此线中间处画一垂直线,如图27-l.
图27—1培养皿底外面画记号图形②取棉签左手拿装有棉签的试管,在火焰旁用右手的手掌边缘和小指、无名指夹持棉塞(或试管帽),将其取出(图27-2,B),将管口很快地通过煤气灯(或酒精灯)的火焰,烧灼管口;轻轻地倾斜试管,用右手的拇指和食指将棉签小心地取出(图27-2,C).
塞回棉塞(或试管帽)(27-2,D),并将空试管放在试管梁上.
图27—2灭菌棉签的取出与放入试管A.
盛灭菌棉签的灭菌试管;B.
取出管帽与烧灼管口;C.
取出棉签;D.
放回管帽;E.
棉签接种后放回试管前,拔出管帽,烧灼管口;F.
用过的棉签插入试管后,放回至试管架③弄湿棉签左手取灭菌水试管,如上法拨出棉塞(或试管帽)并烧灼管口,将棉签插入水中,再提出水面,在管壁上挤压一下以除去过多的水分,小心将棉签取出,烧灼管口,塞回棉塞(或试管帽),并将灭菌水试管放在试管梁上.
④取样将湿棉签在实验台面或门旋钮上擦拭约2cm2的范围.
⑤接种在火焰旁用左手拇指和食指或中指使平皿开启成一缝.
再将棉签伸人,在琼脂表面顶端接种,即滚动一下,立即闭合皿盖.
并按图27-2E和F,将原放棉签的空试管拨出棉塞(或试管帽),烧灼管口,插入用过的棉签,将试管放回试管架.
⑥划线另取接种环在火焰上灭菌,按图3—3方法进行划线,整个划线操作均要求无菌操作,即靠近火焰,而且动作要快.
3.
人体细菌的检查(1)手指(洗手前与洗手后)①分别在两个琼脂平板上标明洗手前与洗手后(班级、姓名.
日期).
②移去皿盖,将未洗过的手指在琼脂平板的表面,轻轻地来回划线,盖上皿盖.
③用肥皂和刷子,用力刷手,在流水中冲洗干净,干燥后,在另一琼脂平板表面来回移动,盖上皿盖.
(2)头发在揭开皿盖的琼脂平板的上方,用手将头发用力摇动数次,使细菌降落到玻脂平板表面,然后盖上皿盖.
A.
接种时,用左手将平皿开启一缝;B.
棉签伸入平板接种;C.
用己灭菌并冷却了的接种环划线;D.
第二部分划线;E.
最后部分划线(3)咳嗽将去皿盖的琼脂平板放在离口约6~8cm处,对着琼脂表面用力咳嗽,然后盖上皿盖.
(4)鼻腔①按照实验台检查法的步骤②和③,取出棉签,并将其弄湿.
②用湿棉签在鼻腔内滚动数次.
③按实验台检查法的步骤⑤和⑥,接种与划线,然后盖上皿盖.
4.
将所有的琼脂平板翻转,使皿底朝上,放37℃培养箱,培养1~2d.
五.
结果记录方法(1)菌落计数在划线的平板上,如果菌落很多而重叠,则数平板最后1/4面积内的菌落数.
不是划线的平板,也一分为四,数l/4面积的菌落数.
(2)根据菌落大小、形状、高度、干湿等特征观察不同的菌落类型.
但要注意,如果细菌数量太多,会使很多菌落生长在一起,或者限制了菌落生长而变得很小,因而外观不典型,故观察菌落的特点时,要选择分离得很开的单个菌落.
菌落特征描写方法如下:①大小大、中、小、针尖状.
可先将整个平板上的菌落粗略观察一下,再决定大、中、小的标准,或由教师指出一个大小范围.
②颜色黄色、金黄色、灰色、乳白色、红色、粉红色等.
③干湿情况干燥、湿润、粘稠.
④形态圆形、不规则等.
⑤高度扁平、隆起、凹下.
⑥透明程度透明、半透明、不透明.
⑦边缘整齐、不整齐.
五、实验报告1.
结果(1)将你自已的平板结果记录于下表中.
特征描写样品来源菌落数(近似值)菌落类型大小形态干湿高度透明度颜色边缘123415123425(2)与其他同学所做的结果进行比较样品来源菌落数(1/4平板)菌落类型数(近似值)2.
思考题(1)比较各种来源的样品,哪一种样品的平板菌落数与菌落类型最多(2)人多的实验室与无菌室(或无人走动的实验室)相比,平板上的菌落数与菌落类型有什么区别你能解释一下造成这种区别的原因吗(3)洗手前后的手指平板,菌落数有无区别(4)通过本次实验,在防止培养物的污染与防止细菌的扩散方面,你学到些什么有什么体会.
实验28微生物的诱变育种一、实验目的和内容目的:以紫外线诱变获得用于酱油生产的高产蛋白酶菌株为例,学习微生物诱变育种的基本操作方法.
内容:1.
对米曲霉(Aspergillsoryzae)出发菌株进行处理,制备孢子悬液.
2.
用紫外线进行诱变处理.
3.
用平板透明圈法进行两次初筛.
4.
用摇瓶法进行复筛及酶活性测定.
二、实验材料和用具米曲霉斜面菌种;豆饼斜面培养基、酪素培养基、蒸馏水、0.
5%酪蛋白;三角瓶(300mL、500mL)、试管、培养皿(9cm)、恒温摇床、恒温培养箱、紫外照射箱、磁力搅拌器、脱脂棉、无菌漏斗、玻璃珠、移液管、涂布器、酒精灯.
三、操作步骤(一)出发菌株的选择及菌悬液制备1.
出发菌株的选择可直接选用生产酱油的米曲霉菌株,或选用高产蛋白酶的米曲霉菌株.
2.
菌悬液制备取出发菌株转接至豆饼斜面培养基中,30℃培养3~5d活化.
然后孢子洗至装有1mL0.
lmol/LpH6.
0的无菌磷酸缓冲液的三角瓶中(内装玻璃珠,装量以大致铺满瓶底为宜),30℃振荡30min,用垫有脱脂棉的灭菌漏斗过滤,制成把子悬液,调其浓度为106~108个/mL,冷冻保藏备用.
(二)诱变处理用物理方法或化学方法,所用诱变剂种类及剂量的选择可视具体情况决定,有时还可采用复合处理,可获得更好的结果.
本实验学习用紫外线照射的诱变方法.
1.
紫外线处理打开紫外灯(30W)预热20min.
取5mL菌悬液放在无菌的培养皿(9cm)中,同时制作5份.
逐一操作,将培养皿平放在离紫外灯30cm(垂直距离)处的磁力搅拌器上,照射lmin后打开培养皿盖,开始照射,与照射处理开始的同时打开磁力搅拌器进行搅拌,即时计算时间,照射时间分别为15s、30s、lmin、2min、5min.
照射后,诱变菌液在黑暗冷冻中保存1~2h然后在红灯下稀释涂菌进行初筛.
2.
稀释菌悬液按10倍稀释至10-6,从10-5和10-6中各取出0.
lmL加入到酪素培养基平板中(每个稀释度均做3个重复),然后涂菌并静置,待菌液渗入培养基后倒置,于30℃恒温培养2~3d.
(三)优良菌株的筛选1.
初筛首先观察在菌落周围出现的透明圈大小,并测量其菌落直径与透明圈直径之比,选择其比值大且菌落直径也大的菌落40~50个,作为复筛菌株.
2.
平板复筛分别倒酪素培养基平板,在每个平皿的背面用红笔划线分区,从圆心划线至周边分成8等份,1~7份中点种初筛菌株,第8份点种原始菌株,作为对照.
培养48h后即可见生长,若出现明显的透明圈,即可按初筛方法检测,获得数株二次优良菌株,进大摇瓶复筛阶段.
3.
摇瓶复筛将初筛出的菌株,接入米曲霉复筛培养基中进行培养,其方法是,称取麦秩85g,豆饼粉(或面粉)15g,加水95~110mL(称为润水),水含量以手捏后指缝有水而不下滴为宜,于500mL三角瓶中装入15~20g(料厚为1~1.
5cm),121℃湿热灭菌30min,然后分别接入以上初筛获得的优良菌株,30℃培养,24h后摇瓶一次并均匀铺开,再培养24~48h,共培养3~5d后检测蛋白酶活性.
4.
蛋白酶的测定方法(1)取样:培养后随机称取以上摇瓶培养物1g,加蒸馏水100mL,(或200mL),40℃水浴,浸酶1h,取上清浸液测定酶活性.
另取lg培养物于105℃烘干测定含水量.
(2)酶活性测定:30℃pH7.
5条件下水解酪蛋白(底物为0.
5%酪蛋白),每分钟产酪氨酸1μg为一个酶活力单位.
计算公式为:(A样品OD680nm值-A对照OD680nm值)*K*V/t*NK:标准曲线中光吸收为"1"时的酪氨酸微克数;V:酶促反应的总体积;t:酶促反应时间(min);N:酶的稀释倍数.
5.
谷氨酸的检测此项检测也是酱油优良菌株的重要指标之一.
检测培养基:豆饼粉:麸夫=6:4,润水75%,121℃湿热灭菌30min.
谷氨酸测定:于以上培养基中加入7%盐水(W/V),40~45℃水浴,水解9d后过滤,以滤液检测谷氨酸含量(测压法).
四、注意事项1.
紫外线照射时注意保护眼睛和皮肤.
2.
诱变过程及诱变后的稀释操作均在红灯下进行,并在黑暗中培养.
五、实验报告1.
试列表说明高产蛋白酶菌株的筛选过程和结果.
2.
你认为以上的筛选方法有什么优缺点,如何改进六、问题和思考1.
试述紫外线诱变的作用机理及其在具体操作中应注意的问题.
2.
为什么在诱变前要把菌悬液打散和培养一段时间注:筛选菌株数的计算若按突变率为0.
01计算,则一次筛选可取250—300个菌落,第一次筛选后可多选几株高产株,而二级筛选为重点阶段,其最适量可参考以下计算方法:如初筛菌株数为200株,二次筛选欲选株数为2株,则二级应选(200*2)1/2,为20株,这样的数量选择,使有可能从较少的数量中获得相对较多的优良菌株.
第四部分微生物实验技能的测评微生物学实验是微生物学教学的重要组成部分,对学生实验基本技能的培养,在教学中占有重要的位置.
为了检验学生在经过微生物实验课学习后,对微生物实验基本技术和知识的掌握程度,并对学生学习效果进行评定.
测评内容包括对微生物学实验基本知识和技能的掌握,应用所学知识进行实验设计及系统地完成实验的实际工作能力.
实验44和实验45是为此而设计的两种测评方式,可选择其中的一种进行检测.
实验29基本实验技能的检测一、实验目的和内容目的:掌握微生物学的基本实验技能并进行测试.
内容:1.
复习全部基本实验操作.
2.
教师对基本实验技能进行全面辅导,并接受学生的提问.
3.
开放实验室(固定开放时间,学生可自由进入实验室,自己复习和操作).
二、实验材料和用具细菌、放线菌、酵母菌、霉菌菌种,细菌形态装片;培养基(液体、斜面、平板)、染色液;载玻片、盖玻片、接种针、接种环、酒精灯、移液管、试管、培养皿、包装纸、线绳、高压蒸汽灭菌锅、显微镜.
三、基本步骤(一)复习的主要内容1.
实验的基本操作方法(1)培养基的配制.
(2)试管、培养皿、移液管等的包扎.
(3)物品的高压蒸汽灭菌和干热灭菌.
(4)细菌制片、单染色、革兰氏染色及染色原理.
(5)铺平板、制斜面.
(6)从试管斜面菌种划线接种至平板.
(7)从试管斜面菌种转接到试管斜面.
(8)从试管斜面菌种转接至液体培养基.
2.
微生物的分离纯化(1)四大类群微生物的常用培养基及其pH范围.
(2)涂布法和混菌法的平板接种方法.
(3)穿刺接种.
(4)菌悬液的梯度稀释.
(5)划线分离纯化微生物.
(6)从土壤中分离出细菌、放线菌、酵母菌和霉菌.
3.
微生物的形态(1)油镜使用中的注意事项.
(2)辨认细菌形态、鞭毛、荚膜、细胞壁、异染颗粒、伴孢晶体、芽孢.
(3)辨认酵母的形态(液泡、内含物等)、出芽、细胞核、假菌丝.
(4)区分常见霉菌(根霉、毛霉、青霉、曲霉、木霉).
(5)细菌、放线菌、酵母菌、霉菌菌落特征的分辨.
(6)细菌大小和数量的测定.
4.
生理生化测定(1)VP反应和MR反应原理及方法.
(2)判定某种细菌是否发酵糖,能否产气、产酸的方法.
(3)如何初步鉴定一种细菌是好氧、厌氧、兼性厌氧.
(4)如何初步判定一种细菌是否运动.
(5)理化因素(如温度、pH、紫外线、抗生素等)对微生物生长的影响.
5.
免疫学测定(1)凝集反应的原理和方法.
(2)沉淀反应的原理和方法.
(3)如何用免疫学方法检测螺旋体等病原菌的存在6.
其他(1)抗生素效价的测定(原理和方法).
(2)噬菌体效价的测定(原理和方法).
(3)水体中大肠菌群的检测方法.
(4)细菌转导频率的检测方法.
(二)检测方式教师按上述测评内容和要求,事先搭配好分组出好题,到考试时由学生抽取考题3个(第1部分1题,第2部分1题,第3部分1题),在教师面前当场回答完成,教师当场评定打分.
(三)评定标准1.
熟练完成操作,正确回答原理,能迅速判断微生物形态及结构.
(优)2.
正确回答原理,操作正确,能判断微生物形态及结构.
(良)3.
基本正确地回答原理,操作正确,能判断微生物形态及结构.
(中)4.
能基本正确回答原理,操作不够熟练,但基本正确,微生物形态和结构的判断不够准确.
(及格)5.
未达到以上的最起码要求者为不及格,不及格者可通过复习要求重考.
(四)注意间题1.
要当场完成,不能换考题.
2.
要给学生准备考题的时间.
3.
学生单独操作考试,与其他学生分开.
4.
当场评分.
实验30实验设计及实施能力的测评一、实验目的和内容目的:了解学生对实验的知识内容的灵活应用能力.
内容:1.
分析实验设计.
2.
学生自行设计实验.
3.
学生独立完成自行设计的实验,并基本达到预期结果.
二、学会进行实验设计(一)实验设计的基本要求1.
写出实验目的相基本原理.
2.
写出实验的基本要求.
3.
详细写出实验的每一个步骤和注意问题.
(二)考试前的准备指导学生选定实验题目,或由老师指定题目,提供参考书目.
(三)考试方式学生在规定时间内递交实验设计.
(四)评分标准1.
具有科学性和可行性,有一定创新.
(优)2.
无科学性错误,设计不够细致,基本可行.
(良)3.
无明显科学性错误,设计有部分不够合理.
(中)4.
无明显科学性错误,设计不够合理.
(及格)5.
有明显科学性错误,设计不合理.
(不及格)三、自行设计实验独立完成的考核(一)考前准备1.
教师帮助学生修改和完善实验设计.
2.
为学生提供必要的仪器药品.
(二)考试方式在一定时间里,实验室开放,学生在规定时间内,将实验设计完成,并提交实验报告.
(三)评分标准1.
顺利完成实验,得到合理结果,实验中操作正确,熟练.
(优)2.
完成实验,得到较合理结果,实验中操作正确.
(良)3.
完成实验,得到较合理结果,实验操作基本正确.
(中)4.
完成实验,末得到合理结果,实验操作基本正确.
(及格)5.
未得到合理结果,末完成实验,实验中操作不熟练,不正确.
(不及格)(四)注意事项1.
注意实验室安全,老师要现场监督和检查.
2.
如果条件不允许单个学生完成考试实验,可分组进行.
附录:附录1实验室意外事故的处理险情紧急处理火险酒精、乙醚或汽油等着火衣服着火破伤火伤灼伤强酸、溴、氯、磷等酸性药品的灼伤强碱、氢氧化钠、金属钠、钾等碱性药品的灼伤石炭酸灼伤眼灼伤眼为碱伤眼为酸伤食入腐蚀性物质食入酸食入碱食入石炭酸或来苏水吸入菌液吸入非致病性菌液吸入致病性菌液吸入葡萄球菌、链球菌、肺炎球菌液吸入白喉菌液吸入伤寒、霍乱、痢疾、布氏等菌液立刻关闭电门、煤气,使用灭火器,沙土和湿布灭火使用灭火器或沙土或湿布覆盖,慎勿以水灭火可就地或靠墙滚转先除尽外物,用蒸馏水洗净,涂以碘酒或红汞可涂5%鞣酸、2%苦味酸或苦味酸铵茉甲酸丁酯油膏,或龙胆紫液等先以大量清水冲洗,再用5%重碳酸钠或氢氧化铵溶液擦洗以中和酸先以大量清水冲洗,再用5%硼酸溶液或醋酸冲洗以中和碱以浓酒精擦洗先以大量清水冲洗以5%硼酸溶液冲洗然后于滴入橄榄油或液体石蜡1—2滴以滋润之以5%重碳酸钠溶液冲洗,然后再滴入橄榄油或液体石蜡1—2滴以滋润之立即以大量清水漱口,并服镁乳或牛乳等,勿服催吐药立即以大量清水漱口,并服5%醋酸、食蜡、柠檬汁或油类、脂肪用40%乙醇漱口,并喝大量烧酒,再服用催吐剂使其吐出立即大量清水漱口,再以1:1000高锰酸钾溶液漱口立即以大量热水漱口,再以消毒液1:5000米他芬,3%过氧化氢或1:1000高锰酸钾溶液漱口经上法处理后,并注射1000单位的白喉抗毒素以预防经上法处理后,并注射疫菌及抗生素以预防患病附录2实验用培养基配制1.
牛肉膏蛋白胨培养基(用于细菌培养)牛肉膏3g,蛋白胨10g,NaCl5g,水1000mL,pH7.
4~7.
62.
高氏1号培养基(用于放线菌培养)可溶性淀粉20g,KNO31g,NaCl0.
5g,K2HPO4-·3H2O0.
5g,MgSO4·7H2O0.
5g,FeSO4·7H2O0.
01g,水1000mL,pH7.
4~7.
6.
配制时注意,可溶性淀粉要先用冷水调匀后再加入到以上培养基中.
3.
马丁氏(Martin)培养基(用于从土壤中分离真菌)K2HPO41g,MgSO4·7H2O0.
5g,蛋白胨5g,葡萄糖10g,1/3000孟加拉红水溶液100mL,水900mL,自然pH,121℃湿热灭菌30min.
待培养基融化后冷却55~60℃时加入链霉素(链霉素含量为30μg/mL).
4.
马铃薯培养基(PDA)(用于霉菌或酵母菌培养)马铃薯(去皮)200g,蔗糖(或葡萄糖)20g,水1000mL,配制方法如下:将马铃署去皮,切成约2cm2的小块,放入1500mL的烧杯中煮沸30min,注意用玻棒搅拌以防糊底,然后用双层纱布过滤,取其滤液加糖,再补足至1000mL,自然pH.
霉菌用蔗糖,酵母菌用葡萄糖.
5.
察氏培养基(蔗糖硝酸钠培养基)(用于霉菌培养)蔗糖30g,NaNO32g,K2HPO41g,MgSO4·7H2O0.
5g,KCl0.
5g,FeSO4·7H2O0.
1g,水1000mL,pH7.
0~7.
26.
Hayflik培养基(用于支原体培养)牛心消化液(或浸出液)1000mL,蛋白胨10g,NaCl5g,琼脂15g,pH7.
8~8.
0,分装每瓶70mL,121℃湿热灭菌15min,待冷却至80℃左右,每70mL中加入马血清20mL,25%鲜酵母浸出液10mL,15醋酸铊水溶液2.
5mL,青霉素G钾盐水溶液(20万单位以上)0.
5mL,以上混合后倾注平板.
注意:醋酸铊是极毒的药品,需特别注意安全操作.
7.
麦氏(McCLary)培养基(醋酸钠培养基)葡萄糖0.
1g,KCl0.
18g,酵母膏0.
25g,醋酸钠0.
82g,琼脂l.
5g,蒸馏水l00mL.
溶解后分装试管,1l5℃湿热灭菌15min.
8.
葡萄糖蛋白胨水培养基(用于V.
P.
反应和甲基红试验)蛋白胨0.
5g,葡萄糖0.
5g,K2HPO40.
2g,水100mL,pH7.
2,1l5℃湿热灭菌20min.
9.
蛋白胨水培养基(用于吲哚试验)蛋白胨10g,NaCl5g,水1000mL,pH7.
2~7.
4,121℃湿热灭菌20min.
10.
糖发酵培养基(用于细菌糖发酵试验)蛋白胨0.
2g,NaCl0.
5g,K2HPO40.
02g,水100mL,溴麝香草酚蓝(1%水溶液)0.
3mL,糖类lg.
分别称取蛋白胨和NaCl溶于热水中,调pH至7.
4,再加入溴麝香草酚蓝(先用少量95%乙醇溶解后,再加水配成1%水溶液),加入糖类,分装试管,装量4~5cm高,并倒放入一杜氏小管(管口向下,管内充满培养液).
115℃湿热灭菌20min.
灭菌时注意适当延长煮沸时间,尽量把冷空气排尽以使杜氏小管内不残存气泡.
常用的糖类,如葡萄糖、蔗糖、甘露糖、麦芽糖、乳糖、半乳糖等(后两种糖的用量常加大为1.
5%).
11.
RCM培养基(强化梭菌培养基)(用于厌氧菌培养)酵母膏3g,牛肉膏l0g,蛋白胨10g,可溶性淀粉lg,葡萄糖5g,半胱氨酸盐酸盐0.
5g,NaCl3g,NaAc3g,水l000mL,pH8.
5,刃天青3mg/L,l2l℃湿热灭菌30min.
12.
TYA培养基(用于厌氧菌培养)葡萄糖40g,牛肉膏2g,酵母膏2g,胰蛋白胨(bacto-typetone)6g,醋酸铵3g,KH2PO40.
5g,MgSO4·7H2O0.
2g,FeSO4·7H2O0.
01g,水1000mL,pH6.
5,121℃湿热灭菌30min.
13.
玉米醪培养基(用于厌氧菌培养)玉米粉65g,自来水1000mL,混匀,煮10min成糊状,自然pH,121℃湿热灭菌30min.
14.
中性红培养基(用于厌氧菌培养)葡萄糖40g,胰蛋白胨6g,酵母膏2g,牛肉膏2g,醋酸铵3g,KH2PO45g,中性红0.
2g,MgSO4·7H2O0.
2g,FeSO4·7H2O0.
01g,水1000ml,pH6.
2,121℃湿热灭菌30min.
15.
CaCO3明胶麦芽汁培养基(用于厌氧菌培养)麦芽汁(6波美)1000mL,水1000mL,CaCO310g,明胶10g,pH6.
8,121℃湿热灭菌30min.
16.
BCG牛乳培养基(用于乳酸发酵)(A)溶液:脱脂乳粉100g,水500mL,加入1.
6%溴甲酚绿(B.
C.
G)乙醇溶液1mL,80℃灭菌20min.
(B)溶液:酵母膏10g,水500mL,琼脂20g,pH6.
8,121℃湿热灭菌20min.
以无菌操作趁热将(A)、(B)溶液混合均匀后倒平板.
17.
乳酸菌培养基(用于乳酸发酵)牛肉膏5g,酵母膏5g,蛋白胨10g,葡萄糖10g,乳糖5g,NaCl5g,水1000mL,pH6.
8,121℃湿热灭菌20min.
18.
酒精发酵培养基(用于酒精发酵)蔗糖10g,MgSO4·7H2O0.
5g,NH4NO30.
5g,20%豆芽汁2mL,KH2PO40.
5g,水100mL,自然pH.
19.
柯索夫培养基(用于钩端螺旋体培养)优质蛋白胨0.
4g,NaCl0.
7g,KCl0.
02g,NaHCO30.
01g,CaCl0.
02g,KH2PO40.
09g,NaH2PO40.
48g,蒸馏水500mL,无菌兔血清40mL.
制法:除兔血清外的其余各成分混合,加热溶解,调pH至7.
2,121℃湿热灭菌20min,待冷却后,加入无菌兔血清,制成8%血清溶液,然后分装试管(5~10mL/管),56℃水浴灭活lh后备用.
20.
豆芽汁培养基黄豆芽500g,加水1000mL,煮沸lh,过滤后补足水分,121℃湿热灭菌后存放备用,此即为50%的豆芽汁,用于细菌培养:10%豆芽汁200mL,葡萄糖(或蔗糖)50g,水800mL,pH7.
2~7.
4.
用于霉菌或酵母菌培养:10%豆芽汁200mL,糖50g,水800mL,自然pH.
霉菌用蔗糖,酵母菌用葡萄糖.
21.
LB(Luria—Bertani)培养基(细菌培养,常在分子生物学中应用)双蒸馏水950mL,胰蛋白胨l0g,NaCll0g,酵母提取物(bacto-yeastextract)5g,用lmol/LNaOH(约lmL)调节pH值至7.
0,加双蒸馏水至总体积为1L,121℃湿热灭菌30min.
含氨苄青霉素LB培养基:待LB培养基灭菌后冷至50℃左右加入抗生素,至终浓度为80~100mg/L.
22.
复红亚硫酸钠培养基(远藤氏培养基)(用于水体中大肠菌群测定)蛋白胨10g,牛肉浸膏5g,酵母浸膏5g,琼脂20g,乳糖10g,K2HPO40.
5g,无水亚硫酸钠5g,5%碱性复红乙醇溶液20mL,蒸馏水1000mL.
制作过程:先将蛋白胨、牛肉浸膏、酵母浸膏和琼脂加入到900mL水中,加热溶解,再加入K2PO4,溶解后补充水至l000mL,调pH至7.
2~7.
4.
随后加入乳糖,混匀溶解后,于115℃湿热灭菌20min.
再称取亚硫酸钠至一无菌空试管中,用少许无菌水使其溶解,在水浴中煮沸10min后,立即滴加于20mL5%碱性复红乙醇溶液中,直至深红色转变为淡粉红色为止.
将此混合液全部加入到上述已灭菌的并仍保持融化状态的培养基中,混匀后立即倒平板,待凝固后存放冰箱备用,若颜色由淡红变为深红,则不能再用.
23.
乳糖蛋白胨半固体培养基(用于水体中大肠菌群测定)蛋白胨10g,牛肉浸膏5g,酵母膏5g,乳糖10g,琼脂5g,蒸馏水1000mL,pH7.
2~7.
4,分装试管(l0mL/管),115℃湿热灭菌20min.
24.
乳糖蛋白胨培养液(用于多管发酵法检测水体中大肠菌群)蛋白胨10g,牛肉膏3g,乳糖5g,NaCl5g,蒸馏水l000mL,1.
6%溴甲酚紫乙醇溶液lmL.
调pH至7.
2,分装试管(l0mL/管),并放入倒置杜氏小管,l15℃湿热灭菌20min.
25.
三倍浓乳糖蛋白胨培养液(用于水体中大肠菌群测定)将乳糖蛋白胨培养液中各营养成分以扩大3倍加入到l000mL水中,制法同上,分装于放有倒置杜氏小管的试管中,每管5mL,1l5℃湿热灭菌20min.
26.
伊红美蓝培养基(EMB培养基)(用于水体中大肠菌群测定和细菌转导)蛋白胨l0g,乳糖10g,K2HPO42g,琼脂25g,2%/伊红Y(曙红)水溶液20mL,0.
5%美蓝(亚甲蓝)水溶液l3mL,pH7.
4.
制作过程:先将蛋白胨、乳糖、K2HPO4和琼脂混匀,加热溶解后,调pH至7.
4,1l5℃湿热灭菌20min,然后加入已分别灭菌的伊红液和美蓝液,充分混匀,防止产生气泡.
待培养基冷却到50℃左右倒平皿.
如培养基太热会产生过多的凝集水,可在平板凝固后倒置存于冰箱备用.
在细菌转导实验中用半乳糖代替乳糖,其余成分不变.
27.
加倍肉汤培养基(用于细菌转导)牛肉膏6g,蛋白胨20g,NaCL10g,水1000mL,pH7.
4~7.
6.
28.
半固体素琼脂(用于细菌转导)琼脂1g,水100mL,121℃湿热灭菌30min.
29.
豆饼斜面培养基(用于产蛋白酶霉菌菌株筛选):豆饼100g加水5~6倍,煮出滤汁100mL,汁内加入KH2PO40.
1%,MgSO40.
05%,(NH4)2SO40.
05%,可溶性淀粉2%,pH6,琼脂2%~2.
5%.
30.
酪素培养基(用于蛋白酶菌株筛选)分别配制A液和B液.
A液:称取Na2HPO4·7H2O1.
07g.
干酪素4g,加适量蒸馏水,并加热溶解.
B液:称取KH2PO40.
36g,加水溶解.
A、B液混合后,加入酪素水解液0.
3mL,加琼脂20g,最后用蒸馏水定容至1000mL.
酪素水解液的配制:1g酪蛋白溶于碱性缓冲液中,加入1%的枯草芽孢杆菌蛋白酶25mL加水至100mL,30℃水解lh.
用于配制培养基时,其用量为1000mL培养基中加入100mL以上水解液.
31.
细菌基本培养基(用于筛选营养缺陷型)Na2HPO4·7H2O1g,MgSO4·7H2O0.
2g,葡萄糖5g,NaCl5g,K2HPO4lg,水l000mL,pH7.
0,1l5℃湿热灭菌30min.
32.
YEPD培养基(用于酵母原生质体融合)酵母粉10g,蛋白胨20g,葡萄糖20g,蒸馏水1000mL,pH6.
0,115℃湿热灭菌20min.
33.
YEPD高渗培养基(用于酵母原生质体融合)在YEPD培养基中加入0.
6mol/L的NaCL,3%琼脂.
34.
YNB基本培养基(用于酵母原生质体融合)0.
67%酵母氮碱基(YNB,不含氨基酸,Difco),2%葡萄糖,3%琼脂,pH6.
2.
另一配方为:葡萄糖10g(NH4)2SO41g,K2HPO40.
125g,KHPO40.
875g,KI0.
0001g,MgSO4·7H2O0.
5g,CaCl2·2H2O0.
lg,NaCl0.
1g,维量元素母液lmL,维生素母液lmL(母液均按常规配制),水1000mL,pH5.
8~6.
0.
35.
YNB高渗基本培养基(用于原生质体融合)在YNB基本培养基中加入0.
6mol/LNaCl.
36.
酚红半固体柱状培养基(用于检查氧与菌生长的关系)蛋白胨1g,葡萄糖10g,玉米浆10g,琼脂7g,水1000mL,pH7.
2.
在调好pH后,加入1.
6%酚红溶液数滴,至培养基变为深红色,分装于大试管中,装量约为试管高度的1/2,1l5℃灭菌20min.
细菌在此培养基中利用葡萄糖生长产酸,使酚红从红色变成黄色,在不同部位生长的细菌,可使培养基的相应部位颜色改变.
但注意培养时间太长,酸可扩散以致不能正确判断结果.
以上各种培养基均可配制成固体或半固体状态,只需改变琼脂用量即可,前者为1.
5%~2.
0%,后者为0.
3%~0.
8%.
附录3酸碱指示剂的配制(按笔画顺序排列)中文名称英文名称应加的NaOH/mL*酸性颜色碱性颜色pH范围甲基红methylred37.
0红黄4.
2~6.
3甲酚红cresolred26.
2黄红7.
2~8.
8甲酚红cresolred0.
1%乙醇(90%)红黄0.
2~1.
8间甲酚紫(酸域)meta-cresopurple26.
2红黄1.
2~2.
8间甲酚紫(碱域)meta-cresolpurple26.
2黄紫7.
4~9.
0茜素黄-Ralizarinyellow-R0.
1%水溶液黄红10.
1~12.
0氯酚红chlorophenolred23.
6黄红4.
8~6.
4溴酚蓝bromophenolblue14.
9黄蓝3.
0~4.
6溴酚红bromophenolred19.
5黄红5.
2~6.
8溴甲酚绿bromecresolgreen14.
3黄红3.
8~5.
4溴甲酚紫bromoocresolpurple18.
5黄紫5.
2~6.
8溴麝香草酚蓝bromothymolboue16.
0黄蓝6.
0~7.
6酚红Phenolred28.
2黄红6.
8~8.
4酚酞Phenolphthalein1%乙醇(90%)无色红8.
2~9.
8麝香草酚蓝(碱域)thymolblue21.
5黄蓝8.
0~9.
6麝香草酚蓝(酸域)thymolblue21.
5红黄1.
2~2.
8麝香草酚酞(百里酚酞)thymol-phthalein0.
1%乙醇(90%)无色蓝9.
3~10.
5*精确称取指示剂粉末0.
1g,移至研钵中,按上表分数次加入0.
01mol/LNaOH溶液,仔细研磨直至溶解为止,最终用蒸馏水稀释至250mL,从而配成0.
04%指示剂溶液.
但甲基红及酚红溶液应稀释至500mL,故最终浓度为0.
02%.
附录4实验用染色液及试剂的配制(一)实验用染色液的配制1.
黑色素液水溶性黑素10g,蒸馏水100mL,甲醛(福尔马林)0.
5mL.
可用作荚膜的背景染色.
2.
墨汁染色液国产绘图墨汁40mL,甘油2mL,液体石炭酸2mL.
先将墨汁用多层纱布过滤,加甘油混匀后,水浴加热,再加石炭酸搅匀,冷却后备用.
用作荚膜的背景染色.
3.
吕氏(Loeffier)美蓝染色液A液:美蓝(methyleneblue,又名甲烯蓝)0.
3g,95%乙醇30mL;B液:0.
0l%KOHl00mL.
混合A液和B液即成,用于细菌单染色,可长期保存.
根据需要可配制成稀释美蓝液,按1:10或1:100稀释均可.
4.
革兰氏染色液(1)结晶紫(crystalviolet)液:结晶紫乙醇饱和液(结晶紫2g溶于20mL95%乙醇中)20mL,1%草酸铵水溶液80mL将两液混匀置24h后过滤即成.
此液不易保存,如有沉淀出现,需重新配制.
(2)卢戈(Lugol)氏碘液:碘1g,碘化钾2g,蒸馏水300mL.
先将碘化钾溶于少量蒸馏水中,然后加入碘使之完全溶解,再加蒸馏水至300mL即成.
配成后贮于棕色瓶内备用,如变为浅黄色即不能使用.
(3)95%乙醇:用于脱色,脱色后可选用以下(4)或(5)的其中一项复染即可.
(4)稀释石炭酸复红溶液:碱性复红乙醇饱和液(碱性复红1g,95%乙醇l0mL,5%石炭酸90mL混合溶解即成碱性复红乙醇饱和液),取石炭酸复红饱和液l0mL加蒸馏水90mL即成.
(5)番红溶液:番红O(safranine,又称沙黄O)2.
5g,95%乙醇100mL,溶解后可贮存于密闭的棕色瓶中,用时取20mL与80mL蒸馏水混匀即可.
以上染液配合使用,可区分出革兰氏染色阳性(G+)或阴性(G-)细菌,G-被染成蓝紫色,G+被染成淡红色5.
鞭毛染色液A液:丹宁酸5.
0g,FeCl31.
5g,15%甲醛(福尔马林)2.
0mL,l%NaOH1.
0mL,蒸馏水l00mL;B液:AgNO32.
0g,蒸馏水100mL.
待AgNO3溶解后,取出l0mL备用,向其余的90mLAgNO3中滴加NH4OH,即可形成很厚的沉淀,继续滴加NH4OH至沉淀刚刚溶解成为澄清溶液为止,再将备用的AgNO3慢慢滴入,则溶液出现薄雾,但轻轻摇动后,薄雾状的沉淀又消失,继续滴入AgNO3,直到摇动后仍呈现轻微而稳定的薄雾状沉淀为止,如雾重,说明银盐沉淀出,不宜再用.
通常在配制当天便用,次日效果欠佳,第3天则不能使用.
6.
0.
5%沙黄(Safranine)液:2.
5%沙黄乙醇液20mL,蒸馏水80mL.
将2.
5%沙黄乙醇液作为母液保存于不透气的棕色瓶中,使用时再稀释.
7.
5%孔雀绿水溶液:孔雀绿5.
0g,蒸馏水100mL.
8.
0.
05%碱性复红:碱性复红0.
05g,95%乙醇100mL.
9.
齐氏(Ziehl)石炭酸复红液:碱性复红0.
3g溶于95%乙醇l0mL中为A液:0.
01%KOH溶液l00mL为B液.
混合A、B液即成.
10.
姬姆萨(Giemsa)染液(1)贮存液:称取姬姆萨粉0.
5g,甘油33mL,甲醇33mL.
先将姬姆萨粉研细,再逐滴加入甘油,继续研磨,最后加入甲醇,在56℃放置1~24h后即可使用.
(2)应用液(临用时配制):取1mL贮存液加19mLpH7.
4磷酸缓冲液即成.
亦可取贮存液:甲醇=1:4的比例配制成染色液.
11.
乳酸石炭酸棉蓝染色液(用于真菌固定和染色)石炭酸(结晶酚)20g,乳酸20mL,甘油40mL,棉蓝0.
05g,蒸馏水20mL.
将棉蓝溶于蒸馏水中,再加入其他成分,微加热使其溶解,冷却后用.
滴少量染液于真菌涂片上,加上盖玻片即可观察.
霉菌菌丝和孢子均可染成蓝色.
染色后的标本可用树脂封固,能长期保存.
12.
1%瑞氏(Wright's)染色液:称取瑞氏染色粉6g,放研钵内磨细,不断滴加甲醇(共600mL)并继续研磨使溶解.
经过滤后染液须贮存一年以上才可使用,保存时间愈入,则染色色泽愈佳.
13.
阿氏(Albert)异染粒染色液:A液:甲苯胺蓝(toluidineblue)0.
15g,孔雀绿0.
2g,冰醋酸lmL,95%乙醇2mL,蒸馏水100mL;B液:碘2g,碘化钾3g,蒸馏水300ml.
先用A液染色1min,倾去A液后,用B液冲去A液,并染1min.
异染粒呈黑色,其他部分为暗绿或浅绿.
(二)实验用试剂的配制l.
乳酸苯酚固定液乳酸10g,结晶苯酚10g,甘油20g,蒸馏水10mL.
2.
1.
6%溴甲酚紫溴甲酚紫1.
6g溶于100mL乙醇中,贮存于棕色瓶中保存备用.
用作培养基指示剂时,每1000mL培养基中加入lmL1.
6%溴甲酚紫即可.
3.
V.
P.
试剂CuSO41g,蒸馏水l0mL,浓氨水40mL,10%NaOH950mL.
先将CuSO4溶于蒸馏水中,然后加浓氨水,最后加入10%NaOH.
4.
0.
02%甲基红试剂甲基红0.
1g,95%乙醇760mL,蒸馏水100mL.
5.
吲哚反应试剂对二甲基氨基苯甲醛8g,95%乙醇760mL,浓HCl160mL.
6.
Alsever's血细胞保存液葡萄糖2.
05g,柠橡酸钠0.
8g,NaCl0.
42g,蒸馏水l00mL.
以上成分混匀后,微加温使其溶解后,用柠檬酸调节pH6.
1,分装于三角瓶中(30~50mL/瓶),113℃湿热灭菌15min,备用.
7.
Hank's液(l)贮存液A液:(I)NaCl80g,KCl4g,MgSO4·7H2O1g,MgCl2·6H2O1g,用双蒸馏水定容至450mL:(II)CaCl21.
4g(或CaCl2·2H2O1.
85g)用双蒸馏水定容至50mL.
将I和II液混合,加氯仿1mL即成A液.
(2)贮存液B液:Na2HPO4·12H2O1.
52g,KH2PO40.
6g,酚红0.
2g,葡萄糖10g,用双蒸馏水定容至500mL,然后加氯仿1mL,酚红应先置研钵内磨细,然后按配方顺序一一溶解.
(3)应用液:取上述贮存液的A和B液各25mL,加双蒸馏水定容至450mL,113℃湿热灭菌20min.
置4℃下保存.
使用前用无菌的3%NaHCO3调至所需pH.
注意:药品必须全部用A.
R试剂,并按配方顺序加入,用适量双蒸馏水溶解,待前一种药品完全溶解后再加入后一种药品,最后补足水到总量.
(4)10%小牛血清的Hank's液:小牛血清必须先经56℃、30min灭活后才可使用,应小瓶分装保存,长期备用.
用时按10%用量加至应用液中.
8.
0.
1mol/LCaCl2溶液双蒸馏水900mL,CaCl211g,定容至lL,可用孔径为0.
22μm的滤器过滤除菌或12l℃湿热灭菌20min.
9.
0.
05mol/LCaCl2溶液双蒸馏水900mL,CaCl25.
5g,定容至lL,可用孔径为0.
22μm的滤器过滤除菌或12l℃湿热灭菌20min.
10.
α淀粉酶活力测定试剂(1)碘原液:称取碘11g,碘化钾22g,加水溶解定容至500mL.
(2)标准稀碘液:取碘原液15mL,加碘化钾8g,定容至500mL.
(3)比色稀碘液:取碘原液2mL,加碘化钾20g,定容至500mL.
(4)2%可溶性淀粉:称取干燥可溶性淀粉2g,先以少许蒸馏水混合均匀,再徐徐倾入煮沸的蒸馏水中,继续煮沸2min,待冷却后定容至100mL(此液当天配制使用).
(5)标准糊精液:称取分析纯糊精0.
3g,用少许蒸馏水混匀后倾入400mL水中,冷却后定容至500mL,加入几滴甲苯试剂防腐,冰箱保存.
11.
pH6.
0磷酸氢二钠-柠檬酸缓冲液称取Na2HPO4·12H2O45.
23g,柠檬酸(C6H8O7·H20)8.
07g,加蒸馏水定容至1000mL.
12.
0.
lmol/L磷酸缓冲液(pH7.
0)称取Na2HPO4·12H2O35.
82g,溶于1000mL蒸馏水中,为A液:称取NaH2PO4·2H2O15.
605g,溶于l000mL蒸馏水中,为B液.
取A液61mL,B液39mL,可得到100mL0.
lmol/LpH7.
0的磷酸缓冲液.
13.
测定乳酸的试剂(l)pH9.
0缓冲液:在300mL容量瓶中加入甘氨酸11.
4g,24%NaOH2mL,加275mL蒸馏水.
(2)NAD溶液:NAD600mg溶于20mL蒸馏水中.
(3)L(+)LDH:加5mgL(+)LDH于lmL蒸馏水中.
(4)D(-)LDH:加2mgD(-)LDH于lmL蒸馏水中.
14.
Taq缓冲液(10*)Tris-HCl(pH8.
4)100mmol/L,KCl500mmol/L,MgCl215mmol/L,BSA(牛血清清蛋白)或明胶lmg/mL15.
dNTP混合液dATP50mmol/L,dCTP50mmol/L,dGTP50mmol/L,dTTP50mmol/L.
16.
1%琼脂糖琼脂糖lg,TAE100mL,100℃融化后待凉至40℃倒胶,胶厚度约0.
4~0.
6.
17.
TAETris碱4.
84mL,冰乙酸1.
l4mL,0.
5mol/LpH8.
0的EDTA-Na2·2H2O(乙二胺四乙酸钠盐)2mL18.
0.
5mol/LEDTA(pH8.
0)在800mL蒸馏水中加186.
lgEDTA,剧烈搅拌,用NaOH调pH至8.
0(约20g颗粒),定容至lL,分装后121℃湿热灭菌备用.
19.
硝酸盐还原试剂(1)格里斯氏(Griess)试剂A液:对氨基苯磺酸0.
5g,稀醋酸(10%左右)150mLB液:α萘胺0.
1g,蒸馏水20mL,稀醋酸(10%左右)150mL(2)二苯胺试剂:二苯胺0.
5g溶于l00mL浓硫酸中,用20mL蒸馏水稀释.
在培养液中滴加A、B液后溶液如变为粉红色、玫瑰红色、橙色或棕色等表示有亚硝酸盐还原,反应为阳性,如无色出现则可加1~2滴二苯胺试剂:如溶液呈蓝色则表示培养液中仍存在有硝酸盐,从而证实该菌无硝酸盐还原作用:如溶液不呈蓝色,则表示形成的亚硝酸盐已进一步还原成其他物质,故硝酸盐还原反应仍为阳性.
附录5微生物学实验中一些常用数据表(一)常用消毒剂名称浓度使用范围注意问题名称浓度使用范围注意问题升汞0.
05%~0.
1%植物组织和虫体外部消毒腐蚀金属器皿硫柳汞0.
01%~0.
1%生物制品防腐,皮肤消毒多用于抑菌甲醛(福尔马林)10mL/m3接种室消毒用于熏蒸石炭酸(苯酚)3%~5%接种室消毒(喷雾)器皿消毒杀菌力强来苏水(煤酚皂液)3%~5%接种室消毒,擦洗桌面及器械杀菌力强漂白粉2%~5%皮肤消毒腐蚀金属伤皮肤新洁尔灭0.
25%皮肤及器皿消毒对芽孢无效乙醇70%~75%皮肤消毒对芽孢无效高锰酸0.
1%皮肤及器应随用随硫磺15g/m2熏蒸,腐蚀钾皿消毒配空气消毒*金属生石灰1%~3%消毒地面及排泄物腐蚀必强*10mL/m3加热熏蒸,或迅速加入甲醛10份高锰酸钾中,使其产生黄色浓烟,立即密闭房间,熏蒸6—24h.
(二)比重糖度换算表波尔度(Baume)比重糖度(Brix)波尔度(Baume)比重糖度(Brix)11.
0071.
8241.
20043.
921.
0153.
7251.
21045.
831.
0025.
5261.
22047.
741.
0287.
2271.
23149.
651.
0369.
0281.
24151.
561.
04310.
8291.
25253.
571.
05112.
6301.
26355.
481.
05914.
5311.
27457.
391.
06716.
2321.
28659.
3101.
07418.
0331.
269761.
2111.
08219.
8341.
30963.
2121.
09121.
7351.
32165.
2131.
09923.
5361.
33367.
1141.
10725.
3371.
34468.
9151.
11627.
2381.
35670.
8161.
12529.
0391.
36872.
7171.
13430.
8401.
38074.
5181.
14332.
7411.
39276.
4191.
15234.
6421.
40478.
2201.
16136.
4431.
41780.
1211.
17138.
3441.
42982.
0221.
18040.
1451.
44283.
8231.
19042.
0461.
45585.
7(三)常用干燥剂用途常用干燥剂名称气体的干燥石灰,无水CaCl2,P2O5,浓H2SO4,KOH流体的干燥P2O5,浓H2SO4,无水CaCl2,无水K2CO3KOH,无水Na2SO4,无水MgSO4,无水CaSO4,金属钠干燥剂中的吸水P2O5,浓H2SO4,无水CaCl2,硅胶有机溶剂蒸汽干燥石蜡片酸性气体的干燥石灰,KOH,NaOH碱性气体的干燥浓H2SO4,P2O5附录6玻璃器皿及玻片洗涤法(一)玻片洗涤法细菌染色的玻片,必须清洁无油,清洗方法如下:1.
新购置的载片,先用2%盐酸浸泡数小时,冲去盐酸.
再放浓洗液中浸泡过液,用自来水冲净洗液,浸泡在蒸馏水中或擦干装盒备用.
2.
用过的载片,先用纸擦去石蜡油,再放入洗衣粉液中煮沸,稍冷后取出.
逐个用清水洗净,放浓洗液中浸泡24h,控去洗液,用自来水冲洗.
蒸馏水浸泡.
3.
用于鞭毛染色的玻片,经以上步骤清洗后,应选择表面光滑无伤痕者,浸泡在95%的乙醇中暂时存放,用时取出,用干净纱布擦去酒清,并经过火焰微热,使残余的酒精挥发,再用水滴检查,如水滴均散开,方可使用.
4.
洗净的玻片,最好及时使用,以免空气中飘浮的油污沾染,长期保存的干净玻片,用前应再次洗涤后方可使用.
5.
盖片使用前,可用洗衣粉或洗液浸泡,洗净后再用95%乙醇浸泡,擦干备用,用过的盖片也应及时洗净擦干保存.
(二)玻璃器皿洗涤法清洁的玻璃器皿是得到正确实验结果的重要条件之一,由于实验目的不同,对各种器皿的清洁程度的要求也不同.
l.
一般玻璃器皿(如锥形瓶、培养皿、试管等)可用毛刷及去污粉或肥皂洗去灰尘、油垢、无机盐类等物质,然后用自来水冲洗干净.
少数实验要求高的器皿,可先在洗液中浸泡数10min,再用自来水冲洗.
最后用蒸馏水洗2~3次.
以水在内壁能均匀分布成一薄层而不出现水珠,为油垢除尽的标准.
洗刷干净的玻璃仪器烘干备用.
2.
用过的器皿应立即洗刷,放置太久会增加洗刷的困难.
染菌的玻璃器皿,应先经121℃高压蒸汽灭菌20~30min后取出,趁热倒出容器内之培养物,再用热肥皂洗刷干净,用水冲洗.
带菌的移液管和毛细吸管,应立即放大5%的石炭酸溶液中浸泡数小时,先灭菌,然后再用水冲洗,有些实验,还需要用蒸馏水迸一步冲洗.
3.
新购置的玻璃器皿含有游离碱,一般先用2%盐酸或洗液浸泡数小时后.
再用水冲洗干净,新的载玻片和盖玻片先浸入肥皂水(或2%盐酸)内lh,再用水洗净.
以软布擦干后浸入滴有少量盐酸的95%乙醇中,保存备用.
已用过的带有活菌的载玻片或盖玻片可先浸在5%石炭酸溶液中消毒,再用水冲洗干净,擦干后,浸入95%乙醇中保存备用.
(三)洗液的配制通常用的洗液是重铬酸钾(或重铬酸钠)的硫酸溶液.
称为铬酸洗液,其成分是:重铬酸钾60g,浓硫酸460mL,水300mL.
配制方法为:重铬酸钾溶解在温水中,冷却后再徐徐加大浓硫酸(比重为l.
.
84左右.
可以用废硫酸),配制好的溶液呈红色.
并有均匀的红色小结晶,稀重铬酸钾溶液可如下配制:重铬酸钾60g,浓硫酸60mL,水1000mL.
铬酸洗液是一种强氧化剂,去污能力很强.
常用它来洗去玻璃和瓷质器皿的有饥物质,切不可用于洗涤金属器皿.
铬酸洗液加热后,去污作用更强,一般可加热到45~50℃,稀铬酸洗液可煮沸,洗液可反复使用,直到溶液呈青褐色为止.
附录7各国主要菌种保藏机构单位名称单位缩写单位名称单位缩写中国微生物菌种保藏管理委员会CCCM中国科学院微生物研究所菌种保藏中心中国科学院武汉病毒所菌种保藏中心轻工部食品发酵工业科学研究所卫生部药品生物检定所中国医学科学院皮肤病研究所中国医学科学院病毒研究所国家医药总局四川抗生素研究所华北制药厂抗生素研究所农业部兽医药品监察所世界菌种保藏联合会WFCC日本微生物菌种保藏联合会JFCC美国标准菌株保藏中心ATCC北海道大学农学部应用微生物教研室AHU美国农业部北方研究利用发展部NRRL东京大学农学部发酵教研室ATU美国农业研究服务处菌中收藏馆ARS东京大学应用微生物研究所IAM美国Upjohn公司菌种保藏部UPJOHN东京大学医学科学研究所IID加拿大Alberta大学霉菌标本室UAMH东京大学医学院细菌学教研室MTU加拿大国家科学研究委员会NRC大阪发酵研究所IFO法国典型微生物保藏中心CCTM广岛大学工业学部发酵工业系AUT捷克和斯洛伐克国家菌保会CNCTC新西兰植物病害真菌保藏部PDDCC荷兰真菌中心收藏所CBS德国科赫研究所RKI英国国立典型菌种收藏馆NCTC德国发酵红叶研究所微生微生物收藏室MIG英联邦真菌研究所CMI德国微生物研究所菌种收藏室KIM英国国立工业细菌收藏所NCIB附录8实验用缩写名称对照表Ala丙氨酸alanineGln谷氨酰胺glutamineArg精氨酸arginineGlu谷氨酸glutamicacidAsn天冬酰胺asparagineGly甘氨酸glycineAsp天冬氨酸asparticacidHis组氨酸histidineBSA牛血清清清蛋白bovineserumalbuminIle异亮氨酸isoleucineeDNA互补DNAcomplementaryDNALeu亮氨酸leucineCys半胱氨酸cysteineLDH乳酸脱氢酶lactatedehydrogenasedATP脱氧腺苷三磷酸deoxyadenosinetriphosphateLys赖氨酸lysinedCTP脱氧胞苷三磷酸deoxycytidinetriphosphateMet蛋氨酸(甲硫氨酸)methioninedGTP脱氧鸟苷三磷酸deoxyguanosinetriphosphateNAD烟酰胺腺嘌呤二核苷酸(辅酶I)dNTP脱氧核苷三磷酸deoxynucleosidetriphosphatenicotinamideadeninedinucleotidedTTP脱氧胸苷三磷酸deoxythymidinetriphosphateNADH还原型烟酰胺腺嘌呤二核苷酸(还原型辅酶I)DTT二硫苏糖醇dithiothreitolreducednicotinamideadeninedinucleotideEB(EtBr)溴化乙锭ethidiumbromidePAGE聚丙烯酰胺凝胶电泳EDTA乙二胺四乙酸ethylenediaminetetraaceticacidPolyacrylamidegelelectrophoresisEtOH乙醇ethanolPCR聚合酶链式反应polymerasechainreactionPEG聚乙二醇polyethyleneglycolTETris-EDTA缓冲液Tris-EDTAbufferPfu噬菌斑形成单位plaque-formingunitThr苏氨酸threoninePhe苯丙氨酸phenylalaninetRNA转移RNAtransferRNAPro脯氨酸prolineTrp色氨酸tryptophantRNA核蛋白体RNAribosomalRNATyr酪氨酸tyrosineSDS十二烷基磺酸钠sodiumdodecylsulfateVal颉氨酸valineSer丝氨酸serine附录9实验常用中英名词对照表EMB培养基eosinmethylenebluemedium发酵液fermentationsolutionV.
P.
试验Voges-Proskauertest四环素tetracycline三画对流免疫电泳counterimmuoelectrophoresis子囊ascus(复:asci)平板Plate子囊孢子ascospore平板划线streakplate小梗sterigma平板菌落计数法enumerationbyplatecountmethod干热灭菌hotovensterilization灭菌sterilization干燥箱dryingoven生长曲线growthcurve马丁培养基Martin'smedium甲基红(M.
R.
)试验Methylredtest马铃薯葡萄糖培养基Potatoextractglucosemedium目镜测微尺Ocularmicrometer四画石炭酸(酚)Phenol专性厌氧菌obligateanaerobe立克次氏体Rickettsia中性红neutralred节孢子arthrospore分生孢子conidium(复:conidia)六画分生孢子梗conidiophore产氨试验Productionofammoniatest分离isolation伊红美蓝培养基eosinmethylenebluemedium分辨率(清晰度)Resoivingpower(resolution)划线培养streakculture双筒显微镜biocularmicroscope厌氧细菌anaerobicbacteria孔雀绿malachitegreen厌氧培养法anaerobicculturemethod巴斯德消毒法Pasteurization吕氏美蓝液Loeffler'smethyleneblue支原体mycoplasma多粘菌素Polymyxin无性繁殖vegetativepropagation好氧细菌aerobicbacterium(复:bacteria)无菌水sterilewater异养微生物heterotrophicmicrobe无菌移液管sterilepipette异染粒metachromaticgranule无菌操作(无菌技术)aseptictechnique有性繁殖sexualreproduction比浊法turbidimetry血细胞计数板haemocytometer气生菌丝aerialhypha(复:hyphae)衣原体Chlamydia水浸法wet-mountmethod负染色negativestain牛肉膏蛋白胨培养基beefextractpeptonemedium齐氏石炭酸复红染液Ziehl'scarbolfuchsin计算室countingchamber七画五画伴孢晶体parasporalcrystal卡那霉素kanamycin免疫血清Immuneserum利夫森氏鞭毛染色Leifson'sflagellastain九画吲哚试验indoletest匍匐枝stolon局限性转导specializedtransduction厚垣孢子chalmydospore抑制剂indhibitor垣酸teichoicacid抑菌圈zoneofinhibition复染counterstain抗生素antibiotics恒温箱incubator抗生素发酵antiboticfermentation挑菌落colonyselection抗血清antiserum抗体antibody柠檬酸盐培养基citratemedium抗原antigen测微尺micrometer抗菌谱antibioticspectrum相差显微镜phasecontrastmicroscope杜氏小管Durbamtube穿刺培养stabculture来苏尔lysol细晶紫crystalviolet沉淀反应precipitationreaction耐氧细菌aerotolerantbacteria沉淀原precipinogen荚膜染色capsulestain沉淀素precipitin诱变剂mutagenicagent纯化purification诱变效应mutageniceffect芽孢spore革兰氏阳性菌Gram-positivebacteria,G+芽孢染色sporestain革兰氏阴性菌Gram-negativebacteria,G-豆芽汁葡萄糖培养基soybeansproutextractglucosemedium革兰氏染色Gramstain阿须贝无氮培养基Ashbymedium革兰氏碘液Gram'siodinesolution麦芽汁培养基maltextractmedium香柏油cedaroil八画十画乳酸石炭酸液lactophenolsolution倾注法pour-platemethod乳糖发酵lactosefermentation兼性厌氧菌faculativeanaerobe乳糖蛋白胨培养基lactosepeptonemedium原生质体protoplast单菌落singlecolony振荡培养shakeculture单筒显微镜monocularmicroscope根瘤菌nodulebacteria固氮作用nitrogenfixation氨苄青霉素ampicillin国际单位制internationalsystemofunits,SI涂抹培养smearingculture奈氏试剂Nessler'sreagent涂布器(刮刀)scraper孢子囊sporangium(复:sporangia)清毒desomfectopm孢子囊柄sporangiophore消毒剂disinfectant孢囊孢子sporangiospore真菌fungi明胶液化试验gelatinliguefactiontest胰蛋白胨bacto-tryptone杯碟法cylinder-platemethod载片slide油镜oilimmersion酒精发酵alcoholicfermentation物镜objective,objectivelens高氏1号合成培养基Gause'sNo.
1syntheticmedium细调节器fineadjustment高压蒸汽灭菌highpressuresteamsterilization肽聚糖peptidoglycan十一画苯胺黑(黑色素)nigrosin假根rhizine转导tramsduction假菌丝pseudohypha转导子transductant培养皿petridish培养基medium链霉素streptomycin培养液culturesolution十三画悬液suspension微生物发酵microbialfermentation悬滴法hangingdropmethod摇床rotatingshaker接合conjugation数值孔径numericalaperture(N.
A)接合孢子zygospore暗视野显微镜darkfieldmicroscope接种针inoculatingneedle溶菌酶lysozyme接种环inoculatingloop滤膜法membranefiltertechnique斜面slant简单染色simplestain斜面接种inoculationofanagarslant蓝细菌cyanobacteria液体接种brothtransfer酪蛋白水解培养基caseinhydrolysatemedium淀粉水解试验hydrolysisofstrarchtest十四画以上球形体sphaeroplast察氏培养基Czapek'smedium盖片coverglass碱性复红basicfuchsin硅胶silicagel碱性染料basicdye移液管Breedpipette稳定期stationaryphase脱色剂decolourisingagent聚-β-羟丁酸poly-β-hydroxybutyrate,PHB菌丝hypha(复:hyphae)酵母甘露醇培养基yeastextractmannitolmedium菌丝体mycelium(复:mycelia)酵母菌yeast菌落colony蕃红(沙黄、藏花红)safranin营养菌丝vegetativehypha佳性没食子酸pyrogallicacid十二画霉菌mould,mold媒染剂mordant凝胶扩散geldiffusion普遍性转导generaltransduction凝集反应agglutinationreaction棉塞cottonpluge凝集原agglutinogen氯霉素chloramphenicol凝集素bacteriophage琼脂扩散法agardiffusionmethod噬菌体agglutinate琼脂糖凝胶agarosegel噬菌体裂解phagelysis稀释分离法isolationbydilutionmethod噬菌斑plaque稀释液diluent(dilutedsolution)镜台测微尺stagemicrometer紫外线ultravioletrays螺旋体spirochaeta葡萄糖蛋白胨培养基glucosepeptonemedium鞭毛flagellum(复:flagella)主要参考书1、沈萍、范秀容、李广斌,微生物学实验(第三版)北京:高等教育出版社,20012、黄秀梨主编,微生物学实验指导,北京:高等教育出版社,施普林格出版社,19993、杨新美,中国食用菌栽培学,北京:农业出版社,19884、张松,食用菌学,广州;华南理工大学出版社,2000
Megalayer新加坡服务器国际带宽线路测评
前几天有关注到Megalayer云服务器提供商有打算在月底的时候新增新加坡机房,这个是继美国、中国香港、菲律宾之外的第四个机房。也有工单询问到官方,新加坡机房有包括CN2国内优化线路和国际带宽,CN2优化线路应该是和菲律宾差不多的。如果我们追求速度和稳定性的中文业务,建议还是选择CN2优化带宽的香港服务器。这里有要到Megalayer新加坡服务器国际带宽的测试服务器,E3-1230配置20M国际带...
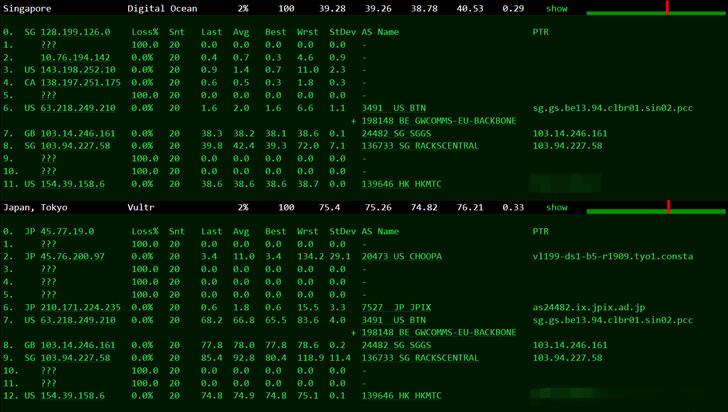
HostKvm($4.25/月),俄罗斯CN2带宽大升级,俄罗斯/香港高防限量5折优惠进行中
HostKvm是一家成立于2013年的国外VPS服务商,产品基于KVM架构,数据中心包括日本、新加坡、韩国、美国、俄罗斯、中国香港等多个地区机房,均为国内直连或优化线路,延迟较低,适合建站或者远程办公等。本月,商家旗下俄罗斯、新加坡、美国、香港等节点带宽进行了大幅度升级,俄罗斯机房国内电信/联通直连,CN2线路,150Mbps(原来30Mbps)带宽起,目前俄罗斯和香港高防节点5折骨折码继续优惠中...
星梦云-年中四川100G高防云主机月付仅60元,西南高防月付特价活动,,买到就是赚到!
官方网站:点击访问星梦云活动官网活动方案:机房CPU内存硬盘带宽IP防护流量原价活动价开通方式成都电信优化线路4vCPU4G40G+50G10Mbps1个100G不限流量210元/月 99元/月点击自助购买成都电信优化线路8vCPU8G40G+100G15Mbps1个100G不限流量370元/月 160元/月点击自助购买成都电信优化线路16vCPU16G40G+100G20Mb...

花生壳连接失败为你推荐
-
insomniac英文歌中有一句歌词是这样的:“here tonight”,谁知道这首歌曲叫什么名?特朗普取消访问丹麦特朗普当选总统后对准备出国留学的学生有什么影响8090lu.com8090lu.com怎么样了?工程有进展吗?haole10.com空人电影网改网址了?www.10yyy.cn是空人电影网么抓站工具抓鸡要什么工具?www.toutoulu.com安装好派克滤芯后要检查其是否漏气机器蜘蛛尼尔机械纪元机械蜘蛛怎么过 机械蜘蛛打法攻略解析www.aise.com怎么观看网页一些视频?汴京清谈汴京平,众争趋赀货,璋独无所取,惟载书数千卷而还什么意思蜘蛛机器人在《红色警戒2共和国之辉》中,对付“蜘蛛机器人”的最好武器是什么?