临床研究方案名称:
STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page1of41临床研究方案(版本1.
0)常规与早期开始肾脏替代治疗急性肾损伤(STARRT-AKI)的比较:一项多中心,随机,对照临床试验方案编号:GI-RM-7827方案名称:STARRT-AKI版本编号:1.
0日期:2016年12月5日加拿大研究主席SeanBagshaw,MDMScFRCPC和RonWald,MDCMMPHFRCPC澳大利亚研究主席RinaldoBellomoMBBSMDFRACPFCICM和MartinGallagherFRACPPhD中国研究主席BinDu,MDandHaiboQiu,MD加拿大重症监护研究组,多伦多圣迈克尔医院应用健康研究中心,加拿大和乔治全球健康研究院(澳大利亚)ANZICS临床研究组和澳大利亚肾脏研究网络合作项目保密文件仅限计划内使用临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page2of41目录1一般信息52研究概要83研究评估计划表104主要缩略语115背景与原理126研究目的137研究设计147.
1概述147.
2观察指标147.
2.
1主要预后147.
2.
2次要预后147.
3研究年限157.
4研究受试者157.
4.
1纳入标准157.
4.
2排除标准157.
4.
3参与时间168处置分配168.
1随机化处理分配168.
2隐蔽分组168.
3盲法169研究受试者处理179.
1试验介入179.
2RRT179.
2.
1RRT模式选择179.
2.
2RRT处方189.
2.
3RRT其他内容189.
2.
4RRT的终止1810研究程序1910.
1知情同意书(签署)1910.
2筛选和资格评估1910.
3基线评估2010.
4日常评估及随访2010.
4.
190日评估2110.
4.
2一年评估22临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page3of4110.
5退出研究2310.
6数据管理2311安全性评定2411.
1定义2411.
1.
1不良事件(AE)2411.
1.
2严重不良事件(SAE)2411.
1.
3可疑突发性的严重不良反应(SUSAR)2411.
2STARRT-AKI中值得报告的安全事件2511.
2.
1RRT可能涉及的安全事件2511.
2.
2RRT透析导管插入可能涉及的安全事件2611.
3试验干预相关的不良事件的报告程序2611.
3.
1不良事件(非严重)2711.
3.
2严重不良事件2711.
4安全监督2812统计注意事项2812.
1研究假设2812.
2样本量计算2812.
3统计分析计划2913伦理注意事项2913.
1知情同意书(的签署)2913.
2高度依赖医疗保健的患者3013.
2.
1患者知情同意书(的签署)3013.
2.
2委托决策者知情同意书(的签署)3013.
2.
3受试者或委托决策者的同意继续3014保密和记录保存3114.
1受试者保密3114.
2直接访问源文件3114.
3研究人员文档和记录保留3115质量保证程序3215.
1调查人员责任3215.
2协调中心责任3215.
3独立的伦理委员会3215.
4方案偏差的的管理3315.
5研究终止34临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page4of4115.
6审核和检查3415.
7指导委员会3515.
8数据安全和监察委员会3516金融和保险3517出版政策3618产权3619参考3720附录40附录1:研究组织结构40附录2:本地研究管理委员会41临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page5of411一般信息研究组:STARRT-AKI是国际多中心研究,包括以下机构:加拿大重症治疗研究组加拿大应用健康研究中心乔治全球健康研究中心(澳大利亚)ANZICS临床研究组澳大利亚肾脏研究中心中国危重病医学临床研究协作组研究发起方(又称研究赞助方)对"常规与早期肾脏替代治疗急性肾损伤(STARRT-AKI)比较"的全球性研究全权负责.
全球STARRT-AKI研究将由加拿大圣迈克尔医院的李嘉诚知识研究院的应用健康研究中心(亚洲人权委员会)国际协调中心(ICC)进行总控制.
亚洲人权委员会将负责开发和编程的电子病例报告表,研究手册,数据监控,具体操作文件,数据管理和分析,并向学术委员会,数据安全监测委员会,参与中心提供进度和数据报告.
乔治全球健康研究中心澳大利亚分中心(TGI)将作为区域协调中心全权负责亚太地区STARRT-AKI研究.
研究发起方(又称研究赞助方):SeanM.
Bagshaw,MDMScFRCPC加拿大阿尔伯塔大学医学和牙科学院教员危重病医学部副教授2-124EClinicalSciencesBuilding8440-112Street,Edmonton,AlbertaT6G2B7Phone:780-492-3817Fax:780-492-1500Email:bagshaw@ualberta.
caRonWald,MDCMMPHFRCPC加拿大多伦多大学圣迈克尔医院肾脏内科副教授30BondStreet,Toronto,OntarioM5B1W8Phone:416-867-3703Fax:416-867-3709Email:waldr@smh.
ca临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page6of41RegionalCoordinatingCentreInvestigators:在研究的亚太地区范围内,区域协调中心调查员是:Name:A/ProfMartinGallagherPostalAddress:乔治全球健康研究院P.
O.
BoxM201,MissendenRd,Camperdown,NSW,2050,AustraliaPh:+61280524552Fax:+61280524502Email:mgallagher@georgeinstitute.
org.
auName:ProfRinaldoBellomoPostalAddress:AustralianandNewZealandIntensiveCareResearchCentre,SchoolofPublicHealthandPreventiveMedicine,MonashUniversity,Melbourne,Victoria,AustraliaPh:+61394965992Fax:+61394963932Email:Rinaldo.
BELLOMO@austin.
org.
auName:DrAmandaWangPostalAddress:TheGeorgeInstituteforGlobalHealthP.
O.
BoxM201,MissendenRd,Camperdown,NSW,2050,AustraliaPh:+61280524573Fax:+61280524502Email:awang@georgeinstitute.
org.
au中国地区负责人姓名:杜斌教授联系地址:北京协和医院内科ICU,中国北京市东城区帅府园1号联系电话:+861069154036传真:+861069155037姓名:邱海波教授联系地址:东南大学附属中大医院重症医学科,中国江苏省南京市丁家桥87号联系电话:+862583262553传真:+862583272123临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page7of41RegionalCoordinatingCentreforChina:姓名:北京大学医学部乔治健康研究所联系地址:知春路6号锦秋国际大厦B座18层北京海淀区100088中国联系电话:+861082800577传真:+861082800177网址:www.
georgeinstitute.
org.
cn临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page8of412研究概要澳大利亚资助方&研究协助中心乔治全球健康研究院,澳大利亚(肾脏代谢中心)项目标题:常规与早期肾脏替代治疗急性肾损伤的比较(STARRT-AKI)研究分期III期临床主要目的该研究旨在明确早期启动肾脏替代治疗(RRT),相比延迟启动RRT是否改善合并严重急性肾损危重患者的肾功能(无需RRT)和90天生存率.
患者类别危重患者合并严重急性肾损伤:符合肾脏替代治疗指征经治医生可评估患者参与早期对比常规肾脏替代治疗研究的获益与危险度患者人群总入组人群是2,866名患者,在中国500-700例患者.
研究设计前瞻性多中心,开放标签随机对照临床研究研究干预措施使用随机框按中心分层,随机分配到以下俩组:早期接受肾替代治疗(符合条件后12小时内)或常规肾替代治疗.
治疗持续时间肾替代治疗持续到以下三种结局之一,死亡、放弃治疗、肾功能恢复预计入组时间预计2017年3月到2019年12月研究期限预计2017年3月到2020年12月研究观察期患者参与研究观察期是1年,总的研究期限是约2.
5–3.
5年入选标准入选在ICU接受治疗成年(>18岁),合并早期严重急性肾损伤危重患者,血清肌酐女性>100mol/L,男性≥130mol/L,而且与之前48小时内最高值相比下降不超过27mol/L并有以下情况之一:1)血清肌酐较发病前的基线水平升高>2倍;2)血清肌酐>354mol/L伴有肌酐升高>27mol/L;3)12小时以上总尿量5.
5mmol/L2.
血清碳酸氢盐重症监护室ITT意向治疗PI主要研究员PIS受试者信息表RRT肾脏替代治疗SAE严重不良事件SCr血肌酐SDM代理决策者SUSAR疑似非预期严重不良反应TMF试验主文件临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page12of415背景与原理AKI危害ICU患者中急性肾损伤(AKI)发生率高达20%(1,2).
严重AKI患者需要肾替代治疗(RRT),其死亡率和医疗费用随之明显增高(1,3).
此外,AKI存活患者的长期死亡风险也会增高(5);部分病人更需长期入住看护机构(6,7)并最终进展为慢性甚至终末期肾衰(8),其死亡率和医疗费用进一步增加.
目前尚无被证实有效减少AKI疾病负担和死亡率的治疗方法.
RRT起始时机证据急诊RRT是临床上治疗合并AKI危重病人时常用的治疗方法;但关于这些患者的RRT最佳治疗时机尚存争议.
目前一些随机临床试验着重于研究RRT起始剂量/强度(9-11),RRT模式(12,13)和RRT清除模式(14,15).
然而,针对RRT的最佳启动时间,尤其是早期启动RRT是否改善临床结果,仍缺乏明确结论,目前更需要高质量的临床证据(16,17).
高血钾症和明确尿毒症症状是公认的启动RRT的绝对指征,但当患者合并非致命性AKI时,启动RRT的最佳时机仍不明确.
在合并AKI的危重患者早期启动RRT可以更好的控制尿毒症的,酸碱平衡,电解质失衡,细胞外液潴留和全身炎症(18,19).
另一方面,早期启动RRT可能潜在地阻碍患者的肾功能自然恢复,并增加RRT风险及医疗成本.
在过去的几十年里许多研究都试图解决RRT最佳时机的问题,但目前证据主要来源于回顾性研究,观察性队列研究和小样本、低效力的前瞻性研究,尚不足以取信.
最近的一项系统评价和荟萃分析研究了合并AKI的危重患者的RRT起始时间(18),回顾1999年到2010年间发表的15项研究(2项随机试验,4项前瞻性队列研究,9项回顾性队列研究)结果显示早期启动RRT(比延迟启动RRT)显著降低死亡率(OR0.
45;95%CI,0.
28-0.
72)(图1).
然而,大部分研究总体质量不理想,并存在显著异质性(I2=78%).
因此,目前迫切需要高质量,前瞻性,随机对照试验评估早期启动RRT,与常规启动RRT相比,能否改善合并AKI的危重病人临床预后.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page13of41图1:1985年和2010年7月间发表的为比较早期与晚期启动肾脏替代治疗研究的研究死亡比的森林图,采用随机效应模型计算合并死亡比值比为0.
45(95%可信区间(CI):0.
28-0.
72).
临床意义RRT启动的最佳时机仍是尚未跨越的知识鸿沟,急需优先研究.
在没有确切指示性指标的情况下,早期启动RRT可能导致本不需要RRT肾功能就能恢复的患者置于RRT治疗的风险之中.
由于RRT的潜在风险及随之而来的不菲的医疗费用,确定RRT启动的最佳时机尤为重要(20).
本STARRT-AKI研究的目的是作为一个前瞻性,多中心,随机对照试验,以评估立即启动RRT与根据传统的适应症和临床医生的判断启动RRT相比,是否增加生存率和肾功能的恢复.
6研究目的首要目的STARRT-AKI研究比较早期与晚期肾替代治疗ICU严重急性肾损伤患者对90天全因死亡率的影响,各组治疗干预方法详见9.
1节次要目的评价90天肾功能恢复情况临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page14of417研究设计7.
1概述STARRT-AKI研究是比较不同肾脏替代治疗启动时机策略治疗急性肾损伤危重患者的多中心,随机,对照临床研究.
该研究主要终点是90天全因死亡.
总入组人群是2,866连续入组患者,其中在澳大利亚和新西兰700例患者,在中国10-15家医院500-700例患者另外1666例患者来自加拿大和其他区域,包括美国、欧洲.
患者将根据入选和排除标准进行筛选.
符合入选标准受试者将按照1:1比例随机分配,接受立即启动RRT或延迟启动RRT治疗.
对于所有的受试者,收集随机前的基线信息一直到启动RRT,重症监护病房治疗的每一天,直到随机后14天,28天,90天,1年信息以评估其生存情况及肾功能恢复情况.
此外,90天评估其生活质量和医疗费用,1年评估其生活质量.
所有这些信息将被用来进行早期启动RRT治疗严重AKI危重病人的经济评价.
7.
2观察指标7.
2.
1主要结果主要结果是随机后90天全因病死率.
7.
2.
2次要结果透析依赖(定义为随机后第90±7天接受任何形式透析治疗).
第90天的发生的死亡或透析依赖.
第90天肾功能持续下降(定义为估计肾小球滤过率,eGFR相比基线发病前的基线值下降25%).
90天主要不良肾脏结局(定义为下述任何次要结局:死亡,依赖透析或肾功能持续下降).
28天内机械通气总天数.
28天内接受血管活性治疗总天数.
28天内重症监护病房住院总天数.
90天内住院住院总天数.
ICU内死亡,28天死亡,和院内死亡.
存活者中90天EQ-5D5L指数得分(患者效用的量度).
90天的医疗健康费用1年全因死亡临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page15of41幸存者中1年需要CRT依赖幸存者中1年生活质量EQ-5D5L7.
3研究期限澳大利亚/新西兰地区STARRT-AKI研究将在入组约700名患者结束,在中国10-15家医院将入组500-700例患者,或者在数据安全监察委员会和/或研究管理委员认为合适的时候提前结束.
该研究将招募亚太地区23年内的患者,最后一次随访是在最后一次患者入组后1年.
总研究持续时间预计约为3至4年.
7.
4研究受试者研究人群为住进重症监护病房严重AKI,而且完全符合透析RRT条件的成人患者.
7.
4.
1入选标准在ICU接受治疗的成年(>18岁)患者,合并早期严重急性肾损伤.
严重急性肾损伤定义为:肾功能不全(血清肌酐女性>100mol/L,男性>130mol/L)并有以下情况之一:1)血清肌酐较发病前的基线水平升高>2倍2)血清肌酐≥354mol/L伴有肌酐升高>27mol/L;3)12小时以上总尿量5.
5mmol/L2)血清碳酸氢盐50%以上和1)血清钾≥6.
0mmol/L,或2)血清pH值≤7.
2或碳酸氢盐≤12mmol/L,或3)严重呼吸衰竭证据,包括动脉血氧分压/氧浓度≤200合并容量超负荷临床征兆,或4)严重AKI(血清肌酐>50%随机入组时肌酐值)且持续至随机后72小时以上在延迟启动RRT组,主治医师可在任何时间根据临床判断决定启动RRT.
如果该组中启动RRT患者的条件不符合上述标准,临床医生将被要求详细说明启动RRT主要原因.
然而12小时内启动RRT将被视为违反研究方案,并要求临床医生提供RRT开始的主要原因.
9.
2STARRT-AKI研究RRT实施RRT的所有其他方面将遵循这项研究所在医院的标准治疗,但RRT实施应该遵守以下一般原则:9.
2.
1RRT模式的选择该研究中可能使用三种RRT模式:间歇性血液透析(IHD),持续缓慢低效血液透析(SLED)和连续性肾脏替代治疗(CRRT).
RRT的启动后可以调整模式,但调整应该依据患者的血液动力学指标进行.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page18of419.
2.
2RRT实施模式表2:RRT模式实施指南间歇性血液透析持续缓慢低效血液透析连续性肾替代治疗每次透析最短时间(hrs)38n/a间隔最小频次/率3次/周3次/周-目标血流速(mL/min)200-400200-300100-250透析液流速(mL/min)500-800200-400-总超滤量(mL/kg/hr)≥25(无需因CRRT治疗中断增加超滤量)抗凝方案可能包括肝素,局部枸橼酸钠抗凝或无抗凝剂.
9.
2.
3RRT治疗的其他要素这项研究可以接受每个研究医院常规使用RRT机和血液透析过滤器.
CRRT的总血液超滤量和透析剂量(以透析液流量为例)合计应不少于20mL/kg/hr,技术容许且符合各医院临床实践时,血液滤过可以与IHD和SLED一起使用.
肾病和/或重症治疗医师根据患者血液动力学状态和期望的液体平衡参数来确定每次RRT液体清除速率.
重症治疗团队决定静脉输液,强心剂,升压药治疗.
RRT所需所有物资从医院常规库存提取.
研究医院将根据当地医院的政策负责管理这些设备.
9.
2.
4停止RRT一旦RRT在任一治疗组开始,RRT会继续下去直到发生下列情形之一:受试者死亡治疗策略变化(例如:采取姑息性治疗)临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page19of41发现肾脏恢复证据受试者(或他们的法定代理人)撤回知情由于肾功能恢复原因终止RRT的决定将由当地中心的治疗团队临床判断和设备的检测结果确定.
参加者以任何理由从随机的治疗组退出后,我们仍将根据意向性治疗原则继续按照研究计划安排受试者访视和分析.
10研究流程10.
1研究知情同意理想的情况下,将从患者获得知情同意.
但是,如果病人因意识障碍或其他医学原因不能给予同意,需要法定代理决策者提供知情同意.
如果是提供许可证明的合法代理人提供知情同意,则将要求可能的情况下由患者晚些时候提供自己的知情同意.
10.
2筛选和入选标准评估这项研究的研究协调员将协同治疗团队日常评估可能符合入组研究条件的ICU住院病人.
筛查患者主要使用本研究的入选和排除标准来评估.
研究小组必须确认患者符合这些标准,才能使用研究医院伦理业委会批准知情同意书(患者,法定代理人,其他)接触病人(或他们的法定代理人)获取知情同意.
治疗团队考虑入选研究之前必须着重考虑RRT的紧迫性.
如果首诊临床医生抱有患者立即启动RRT或应该延迟启动RRT的观点,以至于不能在两种方案的选择中达到均衡,则不能入组.
但如果类似患者尚未接受RRT,这个问题可以在稍晚筛选患者参与研究时重新评估.
受试者筛选表用于监查在研究中心的潜在受试者并排除选择偏倚.
各中心研究协调员每月将有希望入选的患者整理到受试者筛选表中.
该表会记录所有筛查患者不论最终入选与否.
此外,筛选表还需要记载患者被排除原因、符合入组条件但未入组研究的原因以及患者基本的人口学信息(人口学数据,一些基线实验室数据和接受RRT).
筛选记录的复印版本将被保留在研究者研究文件中.
协调中心将利用各研究医院所提供信息,每月编辑汇总筛选表.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page20of4110.
3基线评估基线数据是受试者的随机化之前的病情记录.
受试者或法定代理人(或同意继续,如适用)知情同意后,研究人员将审查病历获取如下数据:ICU入院日期基本人口学资料出生日期,性别和种族的日期受试者认可的发病地点合并危险因素病史(慢性肾脏病,高血压,糖尿病,心脏衰竭,心肌梗塞,周围血管疾病,脑血管疾病,慢性肺疾病,先前的外科手术史,先前接触放射性对比,先前接触肾毒性药物,败血症,先前的蛋白尿)RRT开始之前基线实验室评估:基本实验室指标包括钾,钠,钙,磷,尿素,葡萄糖,碳酸氢盐,白蛋白,肝功能试验,血凝指标,和全血计数分析,血气分析.
基线临床检查:尿量,生命体征,采用机械通气的情况,升压药使用和剂量,使用其他有创性治疗,疾病严重程度的评估(例如:SOFA,SAPSII,APACHE)10.
4每日评估及访视收集停留在ICU治疗的受试者所有日常数据直到随机后第14日,数据收集始于随机,终止于出现以下情形之一,以最早事件发生时为准:转出ICU受试者死亡随机后满14天受试者或法定代理人不同意收集数据每日数据收集将包括:临床观察:尿量,生命体征,采用机械通气的情况,使用和剂量升压药,使用其他有创性治疗,疾病严重程度评估(SOFA),RRT使用和属性,支持RRT手术操作的实施与性质(如:透析导管插入)实验室评估:生化,肝功能试验,动脉血气而ICU和医院住院病人每天的数据,将从医院记录来获得(包括研究医院以及患者后续转诊的医疗机构),如有需要将咨询受试者主治医师.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page21of41如果受试者是随机分组后14天内从ICU出院,每日数据表格必须在患者停留ICU的最后一天完成.
如若受试者随机分组后14天之内返回ICU,每日数据也将按照同样的要求收集,直到发生上述所列情形之一.
在随机化后28天,将收集每个病人以下数据:随机后28天内医院里需透析治疗的总天数随机后28天内医院里机械通气总天数随机后28天内医院里住院总天数此外,当病人90天随访期结束时必须完成结局数据收集(请参照第三部分研究评估计划表).
从随访后29日到90仅收集结局数据,随机90天以及365天后将停止所有数据收集(请参照第三部分研究评估计划表).
不良事件将收集14天常规数据里及任何操作相关表格里,包括与RRT实施和建立血管通路相关操作.
虽然几乎所有的不良事件将以这种方法收集,主要研究者仍然应报告上述方法收集不到但考虑与试验干预有关的不良事件.
了解更多信息,请参阅第11(安全评估).
10.
4.
190日评估任何在随机后90天以内发生主要和/或次要终点事件将如下评估(前提是受试者或法定代理人还没有撤回同意数据收集):死亡包括死亡日期和基于病历文档证明的死亡原因90天依赖RRT治疗的幸存者幸存者90天肾功能和蛋白尿状况(按照日常医疗护理收集数据)90天内总住院天数幸存者90天生活质量问卷EQ-5D5L90天的健康医疗费用要获得试验要求的数据以完成90天评估,各医院工作人员可以访问研究医院记录、治疗受试者其他设备存储的纪录,咨询主治医生和接触受试者,受试者家庭成员或他们的法定代理人.
为了方便90天的随访,在受试者离开ICU之前,将收集相关人员详细的联系信息(受试者,法律代理和/或指定看护人).
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page22of41生活质量和医疗保健成本调查(允许时间窗为随机后76120天)将通过电话联系或亲自造访,并可以通过受试者(理想状体)或他们的法定代理人/提名监护人完成.
这一评估将由研究协调员尽可能在随机盲态下进行.
存活至90天患者的肾功能和蛋白尿(允许窗口期为随机后60120天)-血清肌酐和尿蛋白数据从研究医院的现有记录中获得,或在可行的情况下从其他卫生保健机构的记录中获得.
如果无法获得第90天的肾功能和蛋白尿的结果,则可能要求患者去本地实验室进行这些测试.
肾小球滤过率(eGFR)以CKD-EPI方程来计算,并以mL/min/1.
73m2为单位来表示.
EuroQol(EQ-5D)5L问卷调查-将被用于衡量健康相关生活质量.
作为一种被广泛接受的评价病人生活质量的测量工具,EQ-5D5L可转化为质量调整生命年(QALY)以便进行经济学评估.
医疗成本-包括治疗方案本身的成本加上住院时间长短会产生任何影响,早期或延迟启动策略相关的安全事件,转出ICU后RRT的后续费用.
为了测量这些影响,我们将评估医院和ICU使用,医生的说法,和随后为试验中的所有病人门诊索赔RRT.
10.
4.
2一年评估任何在随机后1年以内发生主要和/或次要终点事件将进行如下评估(前提是受试者或法定代理人没有撤离此研究):死亡包括死亡日期和基于病历文档证明的死亡原因幸存者一年时是否依赖RRT治疗幸存者一年生活质量问卷EQ-5D5L要获得随访后1年的临床必要的数据,各医院工作人员可以查阅医院的记录,咨询主管医师,或者通过联系患者本人,家属或他们的法定代理人.
为了方便1年后的跟踪随访,在受试者离开ICU之前,我们将收集具体的联系方式(包括受试者,法定代理人和/或提名的看护者).
生活质量的调查研究(允许窗口范围随机后76120天)将通过电话或上门问卷来完成,并可以通过受试者(最好的情况下)或他们的法定代理人/提名监护人完成.
只要有可能,这一评估将由研究协调员在不知道随机分组的状况下进行.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page23of4110.
5退出研究受试者或他们的法定代理人有权力在任何时候以任何理由退出研究,研究者也有权利终止研究.
受试者以任何理由退出研究后,我们仍将根据意向性治疗原则根据研究随访计划进行随访和分析,除非受试者或他们的法定代理人已明确拒绝使用其随访资料.
如果病人或他们的法律代理人从研究退出,研究者需完成受试者研究退出表格,并将退出的原因记录在病历报告表(CRF)和原始记录中.
10.
6数据管理加拿大圣迈克尔医院(SMH)的应用健康研究中心(AHRC)将使用安全,密码保护的,基于Web的电子数据采集(EDC)的系统(Medidata公司Rave系统)管理的研究数据.
这项研究所有数据的数据库将被安置在SMH医院自有并维护的网络防火墙后,由不能被公开访问的服务器存储.
该数据库每天完全备份,写入磁盘,磁盘则将分开储存.
此外,该系统将由信息技术数据管理团队进行监控,以确保所有应用规则和标准操作流程都严格遵循.
该EDC系统将允许研究人员来管理他们的病人,处理数据清理,纠正病人数据.
因此,在数据收集过程的每个步骤中,电子系统将被用于创建,修改,维护和检索该研究的临床数据.
电子审查留痕模块将保存每条记录的初始录入及其修改记录,修改原因,修改时间和登录日期,修改者用户名.
在这项研究中,源文件工作表(SDWS)将提供给研究人员,以促进数据收集.
在抄录到EDC系统前,研究人员将研究方案要求的原始文件的数据记录到SDWS上面.
如果源文件工作表被用作收集数据的主要方式(该数据单元被新创建的,而不是从其它数据来源转化),那么它会被认为是源文档,并且必须与其他根据ICHGCP原则的源文档一起保存.
受试者将通过在EDC系统的唯一识别码来识别.
数据记录在EDC系统信息应该准确地反映受试者的源记录,如果数据可及的话,应该尽早在系统中完成数据记录.
这个过程的目的是通过数据提交过程中向研究者及时反馈以提高临床研究的质量,同时以更及时的方式提高收集安全的信息能力.
将使用至少两种方法验证数据的准确性和可靠性:临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page24of411)全面的验证核查程序将集中验证数据,自动生成差异并由研究者解决.
必要时也可以出现手动计算差异.
2)研究监察员在EDC系统审查和验证研究数据和使用中央非现场和现场监查的方法实现其他功能角色.
数据监察的方法将在独立的功能计划里说明.
在整个研究过程中,数据将根据这些计划进行审查.
此外,将提供一个全面的EDC系统访问和输入数据指南.
这些计划旨在协助现场工作人员,以确保高品质的数据收集和数据录入.
11安全评估两个治疗组患者均将在ICU中做好透析治疗准备.
立即启动RRT组将在随机分组后尽快接受透析治疗.
延迟启动RRT组将进行观察后延迟启动RRT,但最终它们将被接受相同的治疗(血液透析),虽然需要基于临床判断后有非常明确指证才启动.
因为该研究将比较两个常见的标准治疗,所以受试者接受较常规治疗更高风险的可能性较低.
11.
1定义11.
1.
1不良事件(AE)一个AE或不良事件是指接受临床医疗产品的患者或临床研究受试者发生任何不可预知的医学事件,该事件不一定和研究治疗措施存在因果关系.
因此,一个AE可以是与研究干预时间上相关的任何不利或无法预料的症兆(包括异常的实验室发现),症状或疾病.
11.
1.
2严重不良事件(SAE)满足以下条件的至少一个不良事件:是致命的(死亡结果)可能危及生命需要住院或延长住院时间导致严重残疾或工作能力丧失11.
1.
3可疑不可预知的严重不良反应(SUSAR)SUSAR是一种严重不良反应,其性质和严重程度不能用研究方案相关的文件解释(例如,IEC批准的研究方案,知情同意书,或经批准的产品信息)或无法根据受试者的潜在疾病和治疗来预测.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page25of41因为STARRT-AKI研究干预措施是不同时机启动临床应用成熟的透析治疗,所以SUSARs是不太可能发生.
此外,在研究干预存在异质性时,SUSAR的定义可能是存在疑惑,因此建议各中心研究者发现任何可疑SUSAR后立即和协调中心讨论(24小时内).
11.
2STARRT-AKI研究安全事件上报观察期:安全时间将从病人随机开始到随机后90天的时间内收集,例外请清楚注明.
报告内容:a)与试验干预有关事件(直到随机后14天)不良事件和严重不良事件并不是在日常数据收集、手术相关结局记录表中,而是各中心研究者认为至少是'可能'与RRT开启的不同时间有关时才填写.
认为与研究干预相关的严重不良事件要求使用AE/SAE表格收集,并快速向协调中心报告(发现事件发生后24小时内).
注意.
在90天的随访期间发生的所有死亡人数将由首席研究者审查并与临床医生合作确定死亡是否与研究干预相关.
b)研究结果相关事件(直到随机后90天)任何构成该研究的主要或次要终点的事件将在研究结局表格单独收集;这些事件一般不必须向协调中心快速报告,除非研究者认为事件与试验干预有关(即,各中心研究者认为事件有可能与立即或延迟RRT有关).
c)RRT并发症相关事件(直到随机后14天)我们还将收集与RRT的治疗相关或血管通路相关的主要不良事件数据,但这些事件不一定向协调中心报告,这些事件将通过在ICU和相关操作有关表格进行常规数据收集.
有关RRT并发症相关的安全事件在下面(11.
2.
1和11.
2.
2)部分进行概述.
CRF完成指引将提供CRF和EDC系统的安全事件记录与收集综合指南.
11.
2.
1RRT可能有关的安全事件这将包括以下临床结果,定义如下:临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page26of41RRT相关低血压:定义为血压下降需要下列治疗之一:在透析过程中需要升压药或者透析过程中需要增加升压药的剂量或者由于低血压需要提前终止透析治疗严重低磷血症:定义为血磷20g/L或者是输血超过2袋红细胞;4.
出血需要有创性干预(例如再次手术)过敏反应:定义为由于RRT设备所引起的临床可疑性过敏反应11.
2.
2RRT需要的透析导管植入可能有关的安全事件这将包括以下临床结果(在14天内记录),定义如下:透析中心静脉导管植入部位出血:定义为插管引起的出血需要输血>1单位的红细胞以及、或者需要在12小时内进行手术干预或修复透析中心静脉导管相关血液感染:定义为2组血培养(一个从透析管抽血一个从其他部位抽血)证实血路感染,同时没有其他可发现的感染源超声确诊的CVC引起的血栓:定义为在CVC置入的静脉处或者静脉系统所证实的阻塞性或非阻塞性血栓;或者进一步进展为肺栓塞气胸(对于在颈内静脉或锁骨下静脉置管):定义为在CVC置管后经胸片证实的胸腔内的气体;或者需要进一步插入胸腔导管治疗血胸(对于在颈内静脉或锁骨下静脉置管):定义为在CVC置管后胸腔内出血;或者需要进一步插入胸腔导管治疗气体栓塞CVC置入时意外穿到动脉其他透析中心静脉导管相关的安全事件11.
3研究干预相关的不良事件报告程序(请见以下流程图)临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page27of41研究者将按照当地伦理委员会的报告要求提交报告的不良事件相关的IEC.
协调中心将为研究者及相关工作人员提供24小时紧急医疗救治咨询.
联系号码将被分发到所有参与调查人员在一个单独的文件.
11.
3.
1不良事件(非严重)观察期内发生的可报告的非严重不良事件将记录不良事件表上,并在原始记录文件记载,上报协调中心.
11.
3.
2严重不良事件对于严重不良事件,采用以下报告程序:悉知事件24小时内使用的电子病例报告表详细报告SAE.
研究者优选通过电话通知研究监察员.
初始报告必须尽可能完整,包括当前疾病的细节和严重不良事件,该事件与研究干预之间的因果关系的判断.
形式并传真(或扫描和电子邮件)所有检查的复印件,并在检查上记录检查日期.
应注意确认保密病人身份.
在原始记录文件记录在案任何SAE是致命的或危及生命,应于7日内随访.
随访严重不良事件的结局,直到临床痊愈完成,实验室结果已恢复到基线水平,或者直到疾病发展变稳定.
这可能意味着患者已经离开了临床研究而需要继续随访,以及协调中心要求后研究者做额外的调研.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page28of4111.
4安全监督安全事件将整个研究由数据安全监测委员会(DSMB)进行监控.
生物统计学家会按照DSMB设定一个时间表,产生AE和SAE的表格并提交所有AE和SAE的摘要给DSMB.
数据安全监督委员会在既定的间隔时间监察主要终点,并根据有效性和安全性建议研究者是否中止研究.
DSMB摘要报告将提供给相应的独立的伦理委员会.
12统计相关事项本研究将招募近3.
5-4年来2866例个体,随机分为两组,并评估每个个体在随机化90天后的主要预后.
12.
1研究假设该研究将检验两个主要假设1)与延迟采用RRT的方法比较,立即开始RRT提高90天生存率.
2)与延迟采用RRT的方法比较,即时开始RRT改善肾恢复(定义为90天不依赖RRT).
12.
2样本量计算本研究的样本量计算,仅根据主要预后和研究的干预措施对这一结果的影响力为主,对事件发生率、影响的大小和性能,采用保守值.
在标准化部署中,预期90临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page29of41天死亡率为40%.
由于纳入标准根据更严重的急性肾损伤的患者队列做了细微调整(即KDIGO阶段3AKI患者占主导地位),我们预计招收死亡风险更大的队列,这比在加拿大的试点研究指出的37%略高.
死亡率也与芬兰和澳大利亚/新西兰当代报道的需RRT-AKI患者队列在90天死亡率具有可比性(10,22).
由于对即时RRT所提供的估计减少风险没有明确的指导,我们选择相对风险减少15%(绝对风险降低6%)作为专家推荐,成为一种效应尺度最低限度的影响干预的重要性和可能性(23).
I类误差0.
05,鉴别力0.
90,每个部分的样本量要求1359例患者(共2718).
为考虑到中期分析,所需的样本量增加至2780.
考虑到交互因素和3%脱落的结合比率(从试点阶段算),我们将总样本量定为2866例.
12.
3统计分析计划先验统计分析计划(SAP)将在完成研究录入前加以设计和出版.
主要预后分析将以意向性治疗的原则为基础.
当2550和75%计划的录入者完成90天的随访,基于所述主要预后效果的中期分析将完成.
鉴于提前终止假阳性结果风险的好处,对于主要预后(90天死亡率),统计学差异通过奥布莱恩-弗莱明区间建立的小P值进行描述.
分析的其余细节将在SAP中加以概述.
13伦理注意事项本研究将按照GCP的ICH指南和当地实施的监管要求所规定的原则进行.
13.
1知情同意中华人民共和国卫生和计划生育委员会制定的《涉及人体的医学技术研究管理办法(征求意见稿)》指出,如未履行知情同意程序,应当暂停或终止研究项目.
从高度依赖医疗处理的患者例如ICU患者中获取书面知情同意书是有困难的.
因为重症监护患者往往由于昏迷、镇静、插管或者病的过于严重而不能理解临床试验参与的信息.
对于像重症监护室这种高度依赖医疗处理的患者,同意书及同意书签署相关程序的准备必须遵循相关的当地法律和规定.
必须呈交获取知情同意的书面程序并在使用前经伦理委员会批准.
研究中获取同意的标准是在意识清醒、无理解障碍的患者中获取的书面形式知情同意书较纳入研究更为重要.
然而,预计大多数符合STARRT-AKI研究要求的患者会因疾病严重或镇静剂治疗被认为无法给出参与这项研究的知情同意书.
本研究中获取同意的一系列方法已根据国家声明第4.
4章的规定建立.
国家声明通过4.
4.
14为此类患者在4.
4.
9部分加以指导.
按照国家声明,只要有可能,参与研究的同意书应该在项目相关活动开展前从患者代表处征求意见.
当研究前无法获取知情同意书时,必须遵循以下处理原则:临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page30of4113.
2高度依赖医疗保健的患者13.
2.
1受试者知情同意书的获取:对有意识、无理解障碍的患者,尽可能进行研究相关处理前给予知情同意书,研究者或研究协调员将口头向病人解释研究内容,同时患者将有机会阅读受试者信息表.
在他们疑问被解答后,如果他们愿意参加这项研究,将被要求签署知情同意书.
重症监护医师在照顾危重患者、评估他们的患者在了解自己的病情和同意治疗干预方面的能力具有丰富经验.
一旦适用,不属于研究团队的治疗医生将就潜在的受试者是否有权同意进行研究加以评估.
如果患者被认为是合格并同意参加,他们将给予已签名并注明日期的知情同意书的复印件,受试者信息表,以及达成知情同意过程中讨论的其他文件.
13.
2.
2委托决策者知情同意书的获取:若潜在的受试者缺乏给予知情同意的能力,同意书应该从受试者的监护人或由法律授权的个人或组织获取.
患者参加医学研究的同意书(以及他们可能被描述术语)的标准在澳大利亚各州和领地及新西兰之间有变化.
根据本研究目的,所谓"委托决策者(SDM)"是指法律允许为患者给予同意书的个人.
从SDM获得同意书的程序必须事前获取当地独立伦理委员会的批准.
13.
2.
3由受试者或委托决策者同意继续:当患者或SDM考虑纳入研究并签署同意书不可能或不可行时,当提供的程序符合独立的伦理委员会和适用法律的规定和要求时,患者可在未经事先同意的情况可能纳入研究.
应尽快通知SDM患者已参加研究并告知他们可随时撤回他们的同意书或者继续参与.
若他们选择退出研究,如使用收集到那个时候研究相关的数据和预后数据则需获得他们许可.
如果患者在获得同意前死亡且无法联系到SDM,知情同意弃权书必须符合当地独立的伦理委员会的要求,且依从地方性法规.
当患者康复到可以充分理解该研究释义时,需尽快从患者处获得将继续研究程序的知情同意并提供退出研究的机会.
若患者选择从研究程序中退出,如继续使用他们的研究相关数据以及使用预后数据需征得患者许可.
科研人员和潜在的或实际的受试者及其亲属之间的所有交流需考虑到重大疾病带来的压力或情绪因素,确保潜在受试者及家属在医务人员提供治疗中决策的自由不受影响.
当研究人员同时也是提供治疗的医务人员时,应当考虑是否需要一个独立的工作人员来接触潜在的受试者或其他委托人并征求同意.
书面知情同意书应由患者、或者SDM和进行知情同意讨论的个人进行姓名签署并亲自注明日期.
签名并注明日期的书面知情同意书的副本将提供给患者和/或SDM.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page31of4114保密和记录保存14.
1受试者保密研究者和试验工作人员必须保护受试者的身份,他们的身份得到未经授权的第三方保护,并防止这些文件的意外或过早破坏.
所有文件将安全存储,并只能由试验工作人员和授权人员访问.
这项研究符合该地区研究工作的司法管辖区患者的隐私和数据保护法.
研究者应当保存受试者入选显示的代码,姓名和地址.
研究者应严格保存受试者的书面知情同意书.
当对研究者或者患者的资料进行归档或处理数据时,协调中心应采取一切适当措施,防止未经授权的第三方访问这些数据.
14.
2源文件的直接获取这项研究可以由独立的伦理委员会、国际卫生乔治研究机构有资格的代表按照法律要求的机构审核.
因此,在研究过程中和研究完成之后,为了监查和审核本研究,所有的研究中心必须可以获得医疗记录或者其他的源文件,例如ICU图表和其他研究相关文件.
保护受试者的身份信息,并且在医疗记录中保存患者的保密性信息.
受试者的保密信息会一直保存,除非法规要求披露.
14.
3研究中文件和记录的保存研究者必须保持准确的记录完整的研究文件,以及随后验证研究的数据.
这些文件应分为两个单独的类别(1)研究者的研究文件,(2)受试对象的源文件.
研究者的研究文件包含研究方案或者修订版,评估计划,独立的伦理委员会或者机构审查委员会和政府的批件,知情同意书模板,治疗记录,工作人员履历,以及其他适当的文件或者信函.
研究者必须保存这些文件至研究结束或研究中止后至少15年.
根据当地法规,过了保留时段后,这些文件或单据才可以销毁.
如果研究者希望将这项研究的记录分配给另一方组织或将它们转移到其他位置,必须提前通知协调中心.
如果研究者不能保证研究中心的部分或所有文件的归档要求,研究者和协调中心之间就必须协商安置这些文件在中心外的密封保存,以便在监管审核的时候可以密闭返回到研究者手中.
当需要保留对象的源文件时,应在中心外存放相应的副本.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page32of4115质量保证程序15.
1调查人员责任研究者需要遵循临床试验质量管理规范的ICH指南和合适的法规要求,同意按照本临床研究方案进行研究.
研究者需确保研究方案要求的所有的研究过程都与协调中心提供的研究过程一致.
研究者应当确保所有的研究人员有足够资质可以协助研究,研究者还需要通知研究助理研究方案的具体内容、方案的任何修订、治疗措施和他们试验相关的职责和功能.
研究者应有一个研究员下属人员和其他有资质人员的清单,并委托这些人员承担与试验相关的重要的职责.
研究者必须同意提供可靠的数据、根据协议准确清晰的提供研究方案要求的所有资料信息.
研究者需允许协调中心的代表可以直接访问源文件.
15.
2协调中心责任协调中心负责采取一切合理措施确保临床方案的正常进行,并负责向主要研究者和研究人员提供适当的培训.
每个参与中心启动研究之前,协调中心会向主要研究者和研究人员提供培训.
培训内容包括研究方案和研究过程的各个方面,并且包括EDC系统的使用和研究材料的培训.
所有的研究材料会在培训前或培训课程中提供.
在研究过程中,研究监查员与研究中心联系(采用现场监查或者非现场监查的方法),审查研究进展、研究方案中研究者和患者的依从性情况和任何紧急问题.
研究监查员的主要职责是帮助研究者和协调中心在这项研究的各个方面都保持在一个较高的水平,包括伦理、科学性、技术性和研究的管理质量.
研究者和研究人员提供所有适当的文件协助协调中心,并且可以与协调中心合作,以确保数据的答疑问题可以及时得到解决.
15.
3独立的伦理委员会这项研究开始之前,研究方案、知情同意书和任何提议的宣传材料以及其他相应的文件都应提交给适当的独立伦理委员会书面批准.
如果法律要求,由各个省/州的监护法庭(或同等的机构)的审查也可以进行.
在研究过程中,研究方案的任何修订或完善都应该由主要研究者通知独立伦理委员临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page33of41会,并且在实施新方案之前,必须得到独立伦理委员会的批准,除非方案的改变是以消除对患者的即时危害,这种情况也应尽早通知独立伦理委员会.
每一个主要研究者负责通知独立伦理委员会可能会影响患者的安全或影响临床试验继续进行的事件,特别是在安全性方面改变的任何事件.
根据他们的指南,主要研究者负责向独立伦理委员会提供项目进度报告、不良事件报告以及其他必要的材料.
每个参与医院的主要研究者有责任保持所有信件和与当地的独立伦理委员会适用文件的最新记录.
15.
4方案偏离管理方案偏离是指预料之外或无意的偏离目前批准的研究方案或知情同意文件.
方案偏离可能是方案运行中的遗漏、添加或者更改.
尽管大多数临床研究都是精心策划的,但是在研究实施过程中出现的很多问题会导致方案偏离.
大多数这些实例是技术偏差,不会损害研究患者或显著影响研究结果的完整性.
无论是什么原因,它对检测相似类型的重复偏离尤为重要,因为它们可能预示着需要做出改变(例如:方案修正、再培训和/或者提高沟通).
下表介绍了STARRT-AKI研究的方案偏离和采取的措施.
临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page34of41问题是否属于方案偏离采取措施纳入了不符合入选/排除标准的患者是患者仍保留在本研究中,除非研究者从安全方面考在研究数据库的表格18上输入错误:回顾性修订资格虑此患者不适合继续在本研究中患者随机分配到立即RRT组,但是直到很久以后才开始RRT(反之亦然)是按照临床适当的方法继续治疗,根据意向性治疗分析在研究的延迟进程臂中的患者在确认资格后14小时开始透析,但不满足方案中所述的开始透析的标准没有RRT可以根据临床判断由主治医生决定在任何时间在RRT组的延迟方法中开始.
如果在该组患者中开始RRT的标准不符合方案中概述的临床标准,将要求临床医生指明这样做的主要原因.
然而,除非RRT的起始在12小时内的资格,它不会被视为违反协议,但临床医生将被要求提供RRT开始的主要原因.
方案偏离必须记录在方案偏离表中并及时报告研究管理委员会(通过研究监查)和独立伦理委员会(如适用).
该报告应总结所事件和所采取的措施.
研究管理委员会可能会根据事件的严重性和影响的初步评估,进行一个全面的现场审核.
15.
5研究终止该研究必须在完成中心所有患者的治疗和评估后结束.
此外,这项研究可能会随时根据研究指导委员会、研究者要求或者按法律规定,适当及时通知有关各方结束.
提前结束因前尽可能充分相互协商.
研究终止需上报独立伦理委员会,协调中心或研究者应提供用于终止或暂停研究的原因.
15.
6审核和检查临床研究方案名称:STARRT-AKI中国协议版本1,日期为2016年12月05日,CHN方案编号:GI-RM-7827乔治全球健康研究院版权-机密Page35of41研究者同意允许审核员或督查员(如适用)可以直接访问他/她的研究记录,理解这些人员是受专业保密的约束,因此不会透露任何个人身份或个人医疗信息.
研究者将尽一切努力来帮助他们进行审核和督查.
通知研究者有计划内督查或审核时,需要告知协调中心,并要求协调中心参加督查,必要时赞助方也参加本次督查.
研究者应该立即与协调中心(及赞助方)沟通审核或者督查出现的任何结果和信息.
研究者应采取协调中心(和赞助方)要求的适当措施,纠正审核或督查过程中发现的所有问题.
15.
7指导委员会指导委员会负责研究的运作、参与中心的执行情况和收集数据的质量.
该委员会还将监督对方案的遵守情况.
执行委员会制定发表文章计划,并监督本研究的所有数据的公布和文章的发表.
本研究数据展示或者发表之前,必须获得指导委员会的许可.
指导委员会每个季度以网络研讨会、电话会议或亲临的方式开一次研讨会.
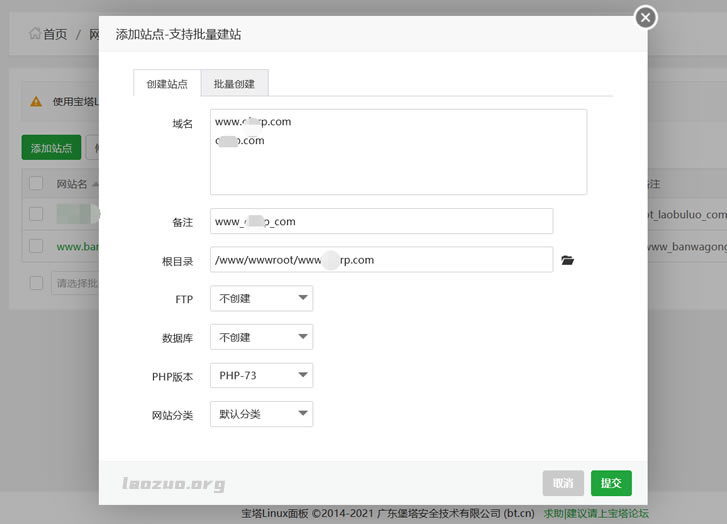
阿里云服务器绑定域名的几个流程整理
今天遇到一个网友,他之前一直在用阿里云虚拟主机,我们知道虚拟主机绑定域名是直接在面板上绑定的。这里由于他的网站项目流量比较大,虚拟主机是不够的,而且我看他虚拟主机已经有升级过。这里要说的是,用过阿里云虚拟主机的朋友可能会比较一下价格,实际上虚拟主机价格比云服务器还贵。所以,基于成本和性能的考虑,建议他选择云服务器。毕竟他的备案都接入在阿里云。这里在选择阿里云服务器后,他就蒙圈不知道如何绑定域名。这...
Megalayer促销:美国圣何塞CN2线路VPS月付48元起/香港VPS月付59元起/香港E3独服月付499元起
Megalayer是新晋崛起的国外服务器商,成立于2019年,一直都处于稳定发展的状态,机房目前有美国机房,香港机房,菲律宾机房。其中圣何塞包括CN2或者国际线路,Megalayer商家提供了一些VPS特价套餐,譬如15M带宽CN2线路主机最低每月48元起,基于KVM架构,支持windows或者Linux操作系统。。Megalayer技术团队行业经验丰富,分别来自于蓝汛、IBM等知名企业。Mega...

Gcorelabs:美国GPU服务器,8路RTX2080Ti;2*Silver-4214/256G内存/1T SSD,1815欧/月
gcorelabs怎么样?gcorelabs是创建于2011年的俄罗斯一家IDC服务商,Gcorelabs提供优质的托管服务和VPS主机服务,Gcorelabs有一支强大的技术队伍,对主机的性能和稳定性要求非常高。Gcorelabs在 2017年收购了SkyparkCDN并提供全球CDN服务,目标是进入全球前五的网络服务商。G-Core Labs总部位于卢森堡,在莫斯科,明斯克和彼尔姆设有办事处。...
-
马云卸任软银董事马云已经卸任了阿里巴巴,那么他接下来的身份是什么?滚筒洗衣机和波轮洗衣机哪个好全自动洗衣机滚筒的和波轮的有什么区别,各有什么好处?天气预报哪个好用哪个最准确最准天气预报软件排行是怎样的?燃气热水器和电热水器哪个好电热水器和燃气热水器的优缺点,那个更实用?少儿英语哪个好少儿英语哪套教材好哪里好呢?宝来和朗逸哪个好大众朗逸和宝来,哪个好点?宝来和朗逸哪个好朗逸和宝来买哪个好等额本息等额本金哪个好等额本息与等额本金哪个划算?电陶炉和电磁炉哪个好电陶炉和电磁炉哪个好看书软件哪个好什么读书app好用