萍乡市人民医院国家药物临床试验机构(GCP)
工作流程及有关规定机构办网址:https://www.
pxsrmyy.
cn/Item/1022.
aspx,联系电话:0799-6881723萍乡市人民医院GCP信息系统网址:https://pxsrmyy.
wetrial.
com/伦理网址:https://www.
pxsrmyy.
cn/Item/993.
aspx,联系电话:0799-6881737地址:江西省萍乡市武功山中大道8号萍乡市人民医院核磁共振室2楼药物临床试验机构办公室机构办电子邮箱:pxsrmyygcp@163.
com伦理委员会电子邮箱:pxsrmyyec@qq.
com备注:下列文中均可在网站中下载.
一、立项流程申办者或CRO持国家药监部门临床研究批件或CDE受理通知书(受理通知书应载明:自受理缴费之日起60日内,未收到药审中心否定或质疑意见)、研究方案向机构办公室提出申请,主要研究者填写药物临床试验项目立项评估表(1),签字后交机构办公室,机构办将根据专业资格和已承担的临床试验情况进行评估审核,由机构办主任批复.
(2-3个工作日,联系人王丽、彭庆海)二、形式审查流程通过立项评估后,按照药物临床试验形式审查文件清单(2)/医疗器械临床试验形式审查文件清单(3)向机构办公室提交材料进行形式审查(通过https://pxsrmyy.
wetrial.
com/系统提交电子资料,形式审查通过后打印纸质材料提交机构办).
(2-3个工作日,联系人王丽、彭庆海)【特殊规定:CRO需在委托书上签字盖章(申办方委托CRO)】三、伦理审查流程1、形式审查通过后,凭形式审查综合意见表与伦理委员会(联系人童向霞,13807999321)接洽,联系伦理资料递交及上会事宜并支付伦理费用(伦理委员会对项目进行审查前交纳).
萍乡市人民医院国家临床试验机构财务管理流程说明(4).
开户名:萍乡市人民医院开户行:中国工商银行股份有限公司萍乡安源支行账号:1504200119000237619-000000002(备注:1、汇款请注明项目名称、某某版次的伦理审查费,例如:阿莫西林胶囊项目伦理审查费(方案编号:20170512),注明后财务方能开具发票;2、因后期可能的调整,实时财务信息以机构办公室告知为准)2、伦理流程及资料要求:具体见https://www.
pxsrmyy.
cn/Item/993.
aspx,开会频率和大概时间:一月一次,每月的第三周的星期三下午.
上会文件递交截止时间:开会前一星期.
3、伦理收费标准1)初始会审:5000元/项(税后),实付5338.
50元/项(税点:6.
77%).
临床试验项目复审、严重不良事件审查、违背方案审查、定期/年度跟踪审查、研究完成审查、暂停/终止研究审查:免收伦理审查费.
2)临床试验项目修正案(会议审查):1000元/项(税后),实付1067.
7元(税点:6.
77%).
3)临床试验项目修正案(快速审查):500元/项(税后),实付533.
85元(税点:6.
77%).
4)加急审查:加收2000元/项(税后),实付2135.
40元(税点:6.
77%).
5)院外科研课题、新技术项目的初始审查费:1000元/项(税后),实付1067.
7元.
院内科研课题、新技术项目:免收伦理审查费6)发票形式:增值税普票/专票(如需开具增值税专票,请提供一般纳税人证明.
)付款成功后,请付款方在3个工作日内将汇款证明扫描或拍照后发送至机构办公室邮箱和伦理邮箱.
超过一星期将予以相应处罚.
收到付款凭证1周可开具发票.
四、合同签订规定及流程经伦理委员会讨论通过获得批件后,申办者或CRO起草合同书,交主要研究者初步审核→经机构办公室、医院法务等部门审阅修改,双方磋商后定稿(审核过程留修订痕迹).
合同定稿后由主要研究者签字(一式五份),交机构办公室,经主管院领导签字,盖医院公章.
(合同平均磋商时间30天,合同签署时间4-5天,具体依实际进度而定;建议递交伦理资料时同步开始准备合同,加快进度;联系人肖律).
1)合同签约方名称:萍乡市人民医院开户名:萍乡市人民医院开户银行:中国工商银行股份有限公司萍乡安源支行开户城市:萍乡市银行账号:1504200119000237619-000000002(备注:1、汇款请注明项目名称、第几笔款、方案编号,例如:阿莫西林胶囊项目第一笔款(方案编号:20170512)2、因后期可能的调整,实时财务信息以机构办公室告知为准)付款成功后,请付款方在3个工作日内将汇款证明扫描或拍照后发送至机构办公室邮箱(pxsrmyygcp@163.
com),超过一星期将予以相应处罚.
2)合同盖医院章,账号与章及签约方一致3)管理费收取比例:管理费=研究者费*30%4)机构办管理药品:收费标准:400元/月/保存条件5)税费:医院打款,均需支付额外的税费,6.
77%增值税普票/专票(如需开具增值税专票,请提供一般纳税人证明.
6)合同是否接受申办方模板:如果合作方是国企,采用医院模板;如果是外企,接收合作方模板7)合同特殊规定:1)一旦发生与实验相关的受试者损害,研究者应立即通知申办方,申办方委托专人(律师或其工作人员)全权处理索赔或赔偿或诉讼事宜,研究机构或研究者同意给予申办方相关协助.
申办方根据需要及时支付费用,保证受试者能够获得免费并及时的治疗.
2)若发生医疗纠纷,申办方若超过24小时未作出响应,研究机构有权与受试者达成补偿协议.
3)申办者应对参加临床试验的受试者提供保险,对于发生与试验相关的损害或死亡的受试者承担治疗的费用及相应的经济补偿.
申办者应向研究者提供法律上与经济上的担保,但由医疗事故所致者除外.
4)合同中需注明生物样本不允许申办方及CRO擅自运输到国外检测,除非国家政府有关部门批准(人遗办).
五、项目启动会合同签订后,机构办进行项目启动前质控,确认文件、设备、药物已准备妥当,申办者、CRO、专业科室、机构办商定启动会时间,组织召开项目启动会.
1)根据江西省食品药品督管理局规定,试验项目启动前需填写《药物临床试验项目基本情况登记表》(见第6页),提交登记表中列出的相关材料,扫描后发机构办邮箱,同时以机构名义邮寄省食品监督管理局登记备案.
地址:江西省南昌市北京东路1566号江西省食品药品监督管理局药化注册处邮编:3300292)是否需要收款到账才可启动/入组:否六、临床试验过程申办者、CRO公司定期对项目进行监查、稽查,对发现的问题及时督促研究者完善,按照合同及时支付相关费用.
机构办公室将定期对项目进行质控.
七、结题审核及资料归档CRA按照GCP的要求对资料进行整理,督促研究者完善试验相关文件的记录,做好资料、试验药物的回收工作,支付项目尾款.
结题报告经主要研究者、机构办主任审核签字,盖机构办公室公章,然后按照机构要求进行资料归档,并保存在药物临床试验机构办档案室.
萍乡市人民医院国家药物临床试验机构项目关闭中心的流程与归档目录(5).
(2-3日,联系人王丽、彭庆海)联系人:林小小(机构办主任)13707990185陈杰(项目洽谈)13576438671肖律(项目洽谈,协议)13979926356王丽(立项、形式审查、财务)13755507010杨文(质量管理)13879977617林艳梅(药物管理)13979934468彭庆海(档案管理)13607992289童向霞(伦理秘书)13807999321其他有关规定1、机构办工作流程:具体见https://www.
pxsrmyy.
cn/Item/1022.
aspx是否接受无CFDA批件前立项:不接受是否接受无组长单位批件前立项:不接受2、立项递交材料2.
1具体要求:官网https://www.
pxsrmyy.
cn/Item/1022.
aspx下载药物临床试验文件形式审查清单.
2.
2递交以后多久可以收到回复:2-3天2.
3是否可以同步递交伦理:否,必须通过机构的文件形式审查后才能递交伦理.
2.
4是否需要保管费:收取,试验资料归档免费保管5年,5年后收费标准3000元/年.
3、HIS溯源3.
1HISaccess:CRA是否有独立账号查HIS:无,用机构办人员的账号查询HIS、LIS3.
2是否可以打印病例出来签字进行监察:不允许3.
3门诊系统查阅要求:用机构办人员的账号查询HIS、LIS4、SMO4.
1SMO:CRC合作方是否有要求:立项时须告知机构办,并获得机构办的同意4.
2形式及内容是否有要求:可不签署协议,但需要申办方委托SMO的委托书.
4.
3一个CRC最多允许承接两个处于入组期的项目5、HGRAO遗传办6.
1HGRAO遗传办申请是否认可组长单位伦理批件:否6.
2承诺书申请流程:院长签字盖医院章,最少一星期6.
3贵院组织机构代码证号:统一社会信用代码12360300491330417P6、仪器6.
1以下仪器设备贵院是否都有:-20度和-70度冰箱,15-25度恒温箱(保存药品)、药品温度计、离心机、打印传真一体机、文件柜(保存试验文件)、身高体重仪、12导联ECG医院有身高体重仪、12导联ECG;药物储存设备和温度计、打印机、文件柜等需由申办方提供;检验科有离心机,是否额外提供以申办方和科室讨论决定.
6.
2以上仪器设备是否都有年检或校准(后期实地选点需要收集校准证书):有6.
3如果冰箱、恒温箱、温度计由申办者/CRO提供,申办者/CRO需同时提供校准证书.
7、试验的某些检测项目如血常规、血生化、尿常规、血妊娠、尿液药物筛查按方案要求都在中心实验室检测,是否可以接受:可以接受8、医疗废弃物如针管等的销毁贵院是否有标准操作流程(SOP):有9、先提交其他材料预审,等上会之前再递交国家局批件:不可以10、是否接受新政,先递交伦理审核,再申请国家局批件:不接受11、是否有其它伦理特殊要求:具体见https://www.
pxsrmyy.
cn/Item/993.
aspx12、是否接受招募广告(paper,网络等形式):接受13、监察员去医院选点时伦理可否先盖付费申请书章印(方便直接打款加快研究进程):可以登记编号:药物临床试验项目基本情况登记表试验名称CFDA药物临床试验批件号(SFDA)试验药物名称剂型规格试验药物分类中药、天然药物化学药物生物制品放射性药物进口药物其它临床试验分期I期(耐受性试验)I期(药代动力学试验)II期III期IV期生物等效性试验其他多中心临床试验是否是否为组长单位是其他否试验方案编号病例总数申办单位联系人姓名及电话合同研究组织联系人姓名及电话试验预期时间主要研究者基本情况姓名科室职称联系方式是否组织(参加)过药物临床试验临床试验单位情况研究分工单位名称承担的病例数是否具备药物临床试验资质主要研究者姓名及职称组长单位参加单位需提交的材料目录1药物临床试验批件复印件2申请人与临床试验机构签署的临床试验协议或合同复印件3伦理委员会审批意见复印件4试验方案封面以及摘要(需盖机构章)我声明备案表中填写的内容及提交的材料真实有效、有据可查,符合相关法规、规范的要求,对其承担相应的责任.
机构办主任签字(需盖机构章):日期:年月日备注:1.
登记编号由省局统一编号2.
临床试验单位情况一栏中若本中心为组长单位,则"参加单位"需填写该项目所有参加单位信息,机构可自行添加行数;若本中心为参加单位,只需填写组长单位信息和本中心作为"参加单位"的信息.
3.
本表一式三份,省局存档一份,临床试验机构存档一份,省药品审评中心存档一份.
- 萍乡市人民医院国家药物临床试验机构(GCP)相关文档
- 2019年全省"高职扩招培养高素质农民"推荐学员计划分配表
- "江西省2015年第一批政府和社会资本合作(PPP)推介项目表"
- 地震萍乡网址
- 萍乡市萍乡网址
- 考生萍乡网址
- 2020年度卫生专业技术人员公开招聘递补进入面试名单
易速互联月付299元,美国独立服务器促销,加州地区,BGP直连线路,10G防御
易速互联怎么样?易速互联是国人老牌主机商家,至今已经成立9年,商家销售虚拟主机、VPS及独立服务器,目前商家针对美国加州萨克拉门托RH数据中心进行促销,线路采用BGP直连线路,自带10G防御,美国加州地区,100M带宽不限流量,月付299元起,有需要美国不限流量独立服务器的朋友可以看看。点击进入:易速互联官方网站美国独立服务器优惠套餐:RH数据中心位于美国加州、配置丰富性价比高、10G DDOS免...
ZJI-全场八折优惠,香港服务器 600元起,还有日本/美国/韩国服务器
ZJI怎么样?ZJI是一家成立于2011年的商家,原名维翔主机,主要从事独立服务器产品销售,目前主打中国香港、日本、美国独立服务器产品,是一个稳定、靠谱的老牌商家。详情如下:月付/年付优惠码:zji??下物理服务器/VDS/虚拟主机空间订单八折终身优惠(长期有效)一、ZJI官网点击直达香港葵湾特惠B型 CPU:E5-2650L核心:6核12线程内存:16GB硬盘:480GB SSD带宽:5Mbps...

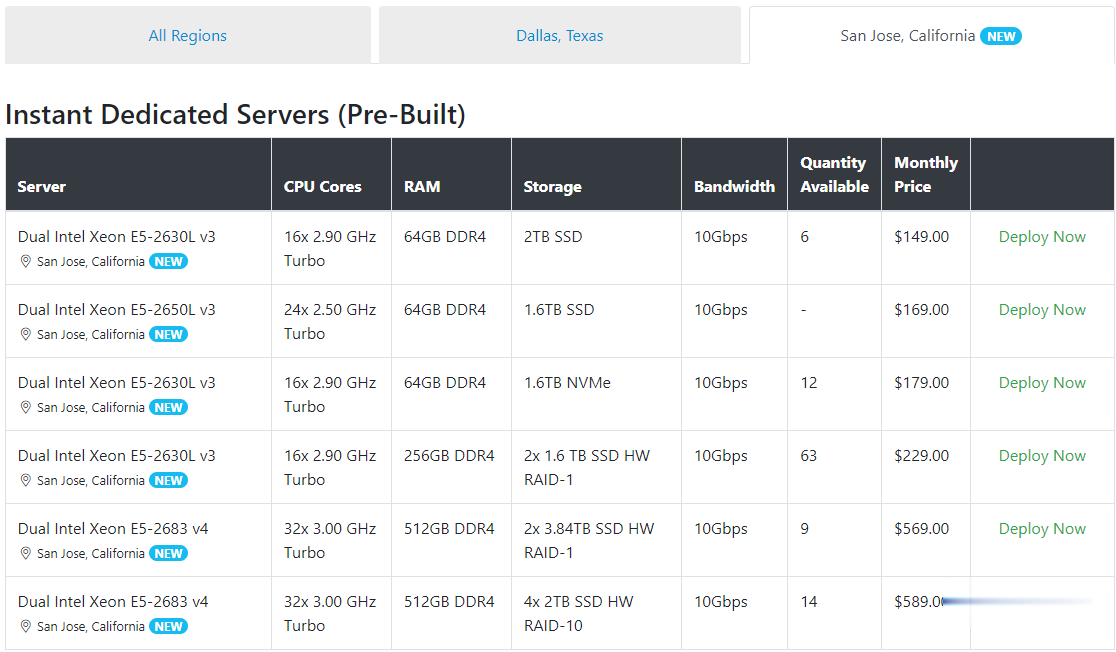
Spinservers美国圣何塞服务器$111/月流量10TB
Spinservers是Majestic Hosting Solutions,LLC旗下站点,主营美国独立服务器租用和Hybrid Dedicated等,数据中心位于美国德克萨斯州达拉斯和加利福尼亚圣何塞机房。TheServerStore.com,自 1994 年以来,它是一家成熟的企业 IT 设备供应商,专门从事二手服务器和工作站业务,在德克萨斯州拥有 40,000 平方英尺的仓库,库存中始终有...
-
拂晓雅阁推荐一些好玩的贴图论坛百度手写百度手写怎么不见了手机区号有的手机号中间的号码是地区区号,那是什么卡淘宝店推广如何推广淘宝店淘宝店推广给淘宝店铺推广有什么好处?怎么点亮qq空间图标怎样点亮qq空间的图标奇虎论坛360有论坛中心?idc前线永恒之塔内侧 删档吗 ?ios系统ios系统有哪些版本?分词技术怎么在SEO中学会运用关键词分词技术